利用纤维素酶降解琼脂糖的条件优化
2017-08-09李庆旺蔡坤淇MIAOSong张龙涛郑宝东福建农林大学食品科学学院福建福州350002中爱国际合作食品物质学与结构设计研究中心福建福州350002替格斯食品研究中心爱尔兰科克市999014
李庆旺,熊 瑶,蔡坤淇,MIAO Song,3,张龙涛,*,郑宝东(1.福建农林大学食品科学学院,福建福州 350002; 2.中爱国际合作食品物质学与结构设计研究中心,福建福州 350002; 3.替格斯食品研究中心,爱尔兰科克市 999014)
利用纤维素酶降解琼脂糖的条件优化
李庆旺1,2,熊 瑶1,2,蔡坤淇1,2,MIAO Song1,2,3,张龙涛1,2,*,郑宝东1,2
(1.福建农林大学食品科学学院,福建福州 350002; 2.中爱国际合作食品物质学与结构设计研究中心,福建福州 350002; 3.替格斯食品研究中心,爱尔兰科克市 999014)
本文以还原糖生成量为指标,研究纤维素酶降解琼脂糖的条件。在单因素实验的基础上,通过Box-Behnken实验设计和响应面分析对琼脂糖酶解条件进行优化,确定4个因子(纤维素酶含量、酶解温度、pH和酶解时间)的适宜水平,建立纤维素酶含量、酶解温度、pH和酶解时间与酶解率之间的回归模型,并对酶解产物进行初步鉴定。最优酶解条件:底物含量0.2%、纤维素酶含量1909.3 U/mL、酶解温度50.0 ℃、pH4.9、酶解时间24.2 h,该条件下琼脂糖的酶解率为29.58%±0.26%。薄层色谱(TLC)鉴定结果表明酶解主要产物为聚合度2~6的琼胶低聚糖。
琼脂糖,响应面法,酶解条件,薄层色谱
琼脂糖又称琼胶糖或琼胶素,是从琼胶中提纯出来的不含或少含硫酸酯(盐)的非离子型多糖,是一种不带电荷的中性基本结构[1-2],为琼胶的主要组成成分,其基本结构是1,3连结的β-D-半乳糖和1,4连结的3,6-内醚-L-半乳糖交替连接起来的长链。琼胶寡糖(AOS)是指琼胶多糖经水解后聚合度(DP)为2~10的低聚糖,是由琼二糖的重复单位连接而成[3]。由于具有较强的抗癌、抗氧化、抗炎、抗龋齿及抗淀粉老化等功能活性,在食品、医药、化妆品等方面可见较多的应用研究[4-7]。
目前,琼胶低聚糖的主要制备方法为化学法[8-10]和酶法[11-13]。化学法制备琼胶低聚糖存在条件难控制、产物不均一、分离纯化过程繁琐和回收难等问题。琼胶低聚糖的酶法制备反应条件温和,产物较为单一,近年来得到较多研究者的关注。琼胶酶是目前用于专一性降解琼脂糖的酶种[14-16],然而用微生物分泌生产制备的琼胶酶制剂分离困难、产量有限,尚未能在琼胶低聚糖的产业化制备中获得应用[17-19]。本课题组在前期研究筛选获得商业纤维素酶制剂,可降解琼脂糖获得琼胶低聚糖,工艺简单,成本低廉,具有一定的产业化前景。本文对纤维素酶降解琼脂糖的酶解条件进行优化,并对酶解产物进行初步鉴定。
1 材料与方法
1.1 材料与仪器
琼脂糖(agarose) 美国amresco公司;纤维素酶 美国amresco公司,来源于里氏木霉Trichodermareesei,酶活力:≥400 U/mg;新琼二糖标准品(NA2)、新琼四糖标准品(NA4)、新琼六糖标准品(NA6) 美国Sigma-Aldrich公司;高效硅胶层析板(G60 F25420 cm×20 cm) 德国Merck公司;其他化学试剂 均为分析纯,国药集团上海化学试剂有限公司。
T6系列紫外可见分光光度计 北京普析通用有限责任公司;DSHZ-300A水浴恒温振荡器 苏州培英实验设备有限公司;Allegra X-30R型台式高速冷冻离心机 美国贝克曼库尔特有限公司;PL202-S100型精密分析天平 上海Mettler Toledo仪器有限公司;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;101-0型电热鼓风干燥箱 上海阳光实验仪器有限公司。
1.2 实验方法
1.2.1 琼胶低聚糖的制备 称取不同质量的琼脂糖粉末,溶解到0.05 mol/L醋酸盐缓冲溶液中,分别加入不同量的纤维素酶,在不同温度下,酶解一定时间。反应结束后,调节pH至中性,沸水浴加热10 min灭酶,10000×g离心15 min后取上清,DNS法测定还原糖含量。
1.2.2 琼脂糖酶法水解单因素实验 采用1.2.1方法酶解琼脂糖,进行单因素实验,考察不同因素对琼脂糖酶解率的影响。酶解条件为:
固定反应条件为:纤维素酶含量2000 U/mL、酶解温度50 ℃、pH5.0、酶解时间24 h,考察不同底物含量(0.2、0.4、0.6、0.8和1.0%(w/v))对酶解率的影响;
固定反应条件为:底物含量0.2%、酶解温度50 ℃、pH5.0和酶解时间24 h,考察不同纤维素酶含量(400、800、1200、1600、2000和2400 U/mL)对酶解率的影响;
固定反应条件为:底物含量0.2%、纤维素酶含量2000 U/mL、pH5.0和酶解时间24 h,考察不同酶解温度(30、40、50、60和70 ℃)对酶解率的影响;
固定反应条件为:底物含量0.2%、纤维素酶含量2000 U/mL、酶解温度50 ℃和酶解时间24 h,考察不同pH(3.0、4.0、5.0、6.0和7.0)对酶解率的影响;
固定反应条件为底物含量0.2%、纤维素酶含量2000 U/mL、pH5.0和酶解温度50 ℃,考察不同酶解时间(2、6、12、18、24和30 h)对酶解率的影响。
1.2.3 响应面法优化琼脂糖酶法水解的影响因素 以琼脂糖的酶解率作为响应值,在单因素实验的基础上,筛选出对琼脂糖的酶解率影响显著的因素进行因素水平设计,利用Design-Expert软件进行Box-Behnken Design响应面设计[20-21],以确定最优酶解工艺,并进行验证实验。实验因素水平设计和编码见表1。

表1 Box-Behnken实验因素水平表Table 1 Factors and levels table of Box-Behnken experiment
1.2.4 还原糖含量测定 参照文献并作修改[22],准确称取干燥至恒重的半乳糖100 mg,去离子水溶解后,定容至100 mL,即为1.0 mg/mL半乳糖溶液。取6支25 mL比色管,分别移取0.1、0.2、0.3、0.4和0.5 mL半乳糖溶液到比色管中,并用去离子水补足至1 mL,至半乳糖溶液终浓度为0.1、0.2、0.3、0.4和0.5 mg/mL,再分别加入2 mL DNS试剂,混合均匀,在沸水中加热5 min,取出后立即用冷水冷却到室温,再向每管加入5 mL去离子水,至总体积为10 mL,混匀后,在540 nm处测定OD值。以等量去离子水代替半乳糖溶液为对照。以半乳糖含量作为横坐标,吸光度作为纵坐标绘制标准曲线。对照半乳糖含量标准曲线,根据对照组和实验组在OD540下吸光值的差值,计算酶解后产生的还原糖含量。
1.2.5 琼脂糖酶解率的计算 酶解率(%)=酶解反应中还原糖的含量(mg/mL)/底物含量(mg/mL)×100。
1.2.6 酶解产物的TLC薄层色谱分析 参照文献并作修改[23]。将薄层层析硅胶板于100 ℃活化1 h,冷却,将上清液用毛细管点样于薄层板上,然后放入展开室的展开剂(正丁醇∶冰醋酸∶水=2∶1∶1)中,等溶剂上升至硅胶板顶端边缘时,取出薄层板晾干。均匀地喷涂显色剂(10%浓硫酸、0.2%间苯二酚溶于无水乙醇),用电吹风冷风缓慢吹干薄层板,置于105 ℃烘箱中,显色10 min。以NA2、NA4和NA6作为标准对照。
1.3 数据处理
2 结果与分析
2.1 半乳糖标准曲线
由图1可知,半乳糖标准曲线的方程为y=2.203x-0.1557,R2=0.9974。半乳糖质量浓度在0.1~0.5 mg/mL范围内线性关系良好。

图1 D-半乳糖含量标准曲线Fig.1 The standard curve of concentration of D-galactose
2.2 单因素实验结果分析
2.2.1 底物含量对酶解率的影响 由图2可知,随着琼脂糖含量的增加,琼脂糖的酶解率逐渐降低,且琼脂糖添加量过多时,会形成部分凝胶,影响酶解效率。因此选择0.2%琼脂糖含量,此时琼脂糖酶解率为28.24%。

图2 底物含量对酶解率的影响Fig.2 Effects of substrate content on enzymatic hydrolysis yield
2.2.2 纤维素酶含量对酶解率的影响 由图3所知,在纤维素酶含量为400~2400 U/mL之间,随着纤维素酶含量的增加,琼脂糖的酶解率也随之迅速增加,在纤维素酶含量为2000 U/mL时,酶解率达到最大,为28.21%。此后随着纤维素酶含量的增加,酶解率反而下降,可能是由于此时还原糖的溶出已达到饱和,使酶解率稍有下降。考虑到经济因素,初步选择纤维素酶含量为2000 U/mL。
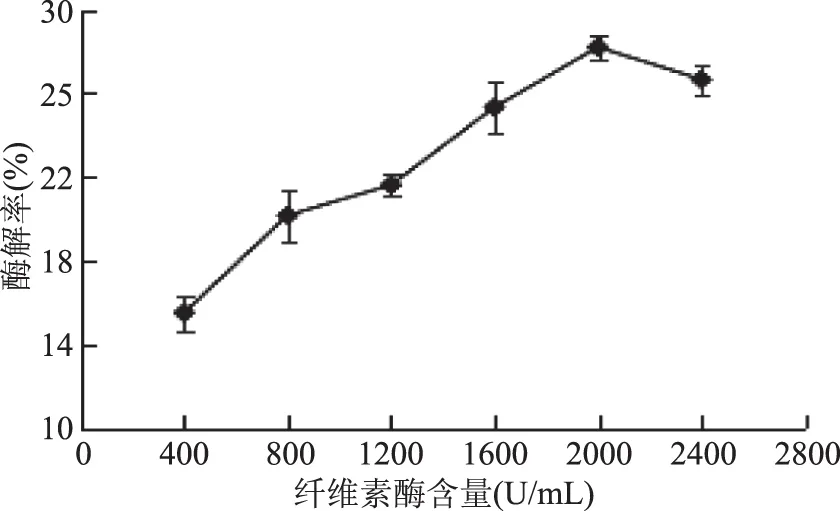
图3 纤维素酶含量对酶解率的影响Fig.3 Effect of cellulase content on enzymatic hydrolysis yield
2.2.3 酶解温度对琼脂糖酶解率的影响 由图4所知,在温度为30~50 ℃之间,随着温度的升高,琼脂糖的酶解率也随之增加;在50 ℃之后,随着温度的逐渐升高,酶解率逐渐降低,可能是因为,温度的升高,超出了纤维素酶耐受的温度范围,使酶逐渐失活,导致酶解率下降。因此,在温度为50 ℃时,酶解率最高为28.02%。

图4 酶解温度对酶解率的影响Fig.4 Effect of enzymatic hydrolysis temperature on enzymatic hydrolysis yield
2.2.4 pH对琼脂糖酶解率的影响 由图5所知,在pH3.0~5.0之间,随着pH的升高,琼脂糖的酶解率也随之增加;在pH5.0之后,随着pH的逐渐升高,酶解率逐渐降低,可能是因为,pH的升高,超出了纤维素酶最适的pH范围,抑制了纤维素酶酶活,导致酶解率下降。因此,在pH5.0时,酶解率最高为28.42%。

图5 pH对酶解产率的影响Fig.5 Effect of pH on enzymatic hydrolysis yield
2.2.5 酶解时间对琼脂糖酶解率的影响 由图6可知,在酶解时间为2~24 h之间,随着酶解时间延长,琼脂糖的酶解率也随之迅速增加,在酶解时间为24 h时,酶解率达到最大为28.21%。此后随着纤维素酶含量的增加,酶解率反而下降,考虑到酶解时间越长,对酶活会产生抑制作用,初步选择酶解时间为24 h。

图6 酶解时间对酶解率的影响Fig.6 Effect of enzymatic hydrolysis time on enzymatic hydrolysis yield

表2 Box-Behnken实验设计和结果Table 2 Design and results of Box-Behnken experiment

表3 Box-Behnken的实验方差分析Table 3 Variance analysis of Box-Behnken experiment
注:“*”表示差异显著(p≤0.05);“**”表示差异极显著(p≤0.01);“***”,表明差异高度显著(p≤0.001)。
2.3 Box-Behnken实验设计和结果分析
采用Design-Expert 8.0.6软件的Box-Behnken Design的响应曲面实验设计原理,根据上述单因素实验的结果,选取对琼脂糖的酶解率有显著影响的4个因素,进行响应面设计。以4个主要因素纤维素酶含量(A)、酶解温度(B)、pH(C)和酶解时间(D)为自变量(X),以3次实验所得的琼脂糖酶解率为响应值(Y),每个因素设置3个水平,进行响应面优化实验。根据响应面实验结果,考察这4个显著性因素之间存在的交互作用并确定酶解率最优时各因素取值。Box-Behnken的实验设计和结果见表2。
根据Design-Expert 8.0.6软件的响应面统计方法对表2的实验数据进行拟合,得到琼脂糖酶解率(Y)关于自变量(X)纤维素酶含量(A)、酶解温度(B)、pH(C)和酶解时间(D)的二次多元回归方程:
Y=29.31-0.62A+0.14B-0.16C-0.074D+0.17AB+0.18AC-0.21AD-0.048BC-0.26BD-0.34CD-0.73A2-0.47B2-0.53C2-0.76D2
回归方程的方差分析见表3。
由表3可知,模型的F值为97.76,p<0.0001,模型拟合度较好;且失拟项影响不显著(p=0.6786>0.05),表明该模型具有统计学意义,有很好的稳定性,回归模型和实测值拟合度较好,能对琼脂糖的酶解率进行分析及预测。该模型的复相关系数R2=0.9899,校正相关系数R2=0.9797,表明该模型可解释97.97%的实验结果。标准差系数(CV)为0.35%,说明模型能较好地反映各因素和酶解率之间的实测值,实验具有很高的可靠性。
由回归方程各变量的系数显著性检验可得出,各自变量对琼脂糖酶解率的影响依次为纤维素酶含量(A)>pH(C)>酶解温度(B)>酶解时间(D),同时A、C和D与酶解率呈负相关关系,B与酶解率呈正相关关系。模型自变量的一次项A和C影响高度显著(p<0.0001),B影响极显著(p<0.01),D影响显著(p<0.05);自变量的交互项AD、BD、CD影响高度显著(p<0.0001),AB、AC影响极显著(p<0.01),说明各因素间的交互作用显著,BC影响不显著(p>0.05),说明两者之间无交互作用。二次项A2、B2、C2、D2的影响均为高度显著。
2.4 响应面分析
为了观察某两个因素及其交互作用同时对酶解率的影响,保持其他因素条件不变,得到某两个因素及其交互作用对酶解率影响的一元二次方程,从而得到响应曲面图,确定因素的最佳水平范围。分别固定自变量纤维素酶含量(A)、酶解温度(B)、pH(C)和酶解时间(D)在原点,利用Design-Expert 8.0.6软件,绘制出其他两个变量的响应曲面图,结果如图7~图12所示。
由图7可知,响应曲面的坡度相对很陡峭,表明酶解率对纤维素酶含量和酶解温度的改变比较敏感。当固定纤维素酶含量时,酶解率呈先缓慢增加后缓慢减小的趋势;当固定酶解温度时,酶解率呈先缓慢增加而后快速降低的趋势。由图8可知,响应曲面的坡度相对很陡峭,表明纤维素酶含量和pH之间有较强的交互作用。当固定纤维素酶含量时,酶解率呈先平稳增加后缓慢减小的趋势;当固定pH时,酶解率呈先缓慢增加而后快速降低的趋势。由图9可知,响应曲面的坡度相对较为平缓,当固定某一因素时,酶解率均呈先缓慢增加后缓慢减小的趋势。由图10可知,曲面投影呈圆形,两因子的交互不显著。由图11可知,响应曲面的坡度相对较为陡峭,表明酶解温度和酶解时间之间有很好的交互作用。当酶解温度不变时,酶解率呈先缓慢增加而后逐渐降低的趋势;当酶解时间不变时,酶解率呈缓慢增加后趋于平稳的趋势。由图12可知,响应曲面的坡度相对较为陡峭,表明响应值(酶解率)对pH和酶解时间的改变较为敏感。当固定某一因素时,酶解率均呈先缓慢增加后缓慢减小的趋势。

图7 纤维素酶含量和酶解温度对酶解率的影响Fig.7 Effect of cellulase content and enzymatic hydrolysis temperature on enzymatic hydrolysis yield

图8 纤维素酶含量和pH对酶解率的影响Fig.8 Effect of cellulase content and pH on enzymatic hydrolysis yield
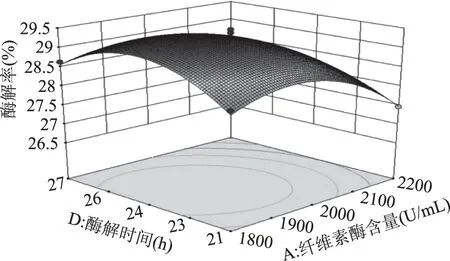
图9 纤维素酶含量和酶解时间对酶解率的影响Fig.9 Effect of cellulase content and enzymatic hydrolysis time on enzymatic hydrolysis yield
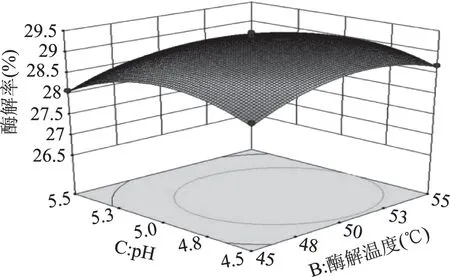
图10 酶解温度和pH对酶解率的影响Fig.10 Effect of enzymatic hydrolysis temperature and pH on enzymatic hydrolysis yield

图11 酶解温度和酶解时间对酶解率的影响Fig.11 Effect of enzymatic hydrolysis temperature and enzymatic hydrolysis time on enzymatic hydrolysis yield

图12 pH和酶解时间对酶解率的影响Fig.12 Effect of pH and enzymatic hydrolysis time on enzymatic hydrolysis yield
2.5 回归模型的验证实验
进一步通过软件Design-Expert 8.0.6分析预测,酶解率达到最高时,纤维素酶含量为1909.3 U/mL、酶解温度为50.0 ℃、pH为4.9和酶解时间为24.2 h,此时酶解率为29.47%。为了验证模型的可靠程度,根据软件预测的最佳酶解条件进行3次平行酶解实验,实验结果显示琼脂糖的酶解率为29.58%±0.26%,与预测值接近,表明真实值和预测值具有较高的拟合度,验证了模型的可靠性。
2.6 酶解产物的TLC薄层色谱分析
TLC分析酶解产物的结果如图13所示。与标准品对比,纤维素酶酶解主要产物为聚合度2~6的琼胶低聚糖,以及少量聚合度6以上的琼胶低聚糖。

图13 酶解产物的TLC分析Fig.13 TLC analysis of agarose degradation
3 结论
通过单因素实验和响应面实验对琼脂糖酶解条件的优化,确定了琼脂糖酶解的适宜条件:底物含量0.2%、纤维素酶含量1909.3 U/mL、酶解温度50.0 ℃、pH4.9和酶解时间为24.2 h。在上述条件下进行验证实验,得到的酶解率为29.58%±0.26%,主要产物为聚合度2~6的琼胶低聚糖。
[1]Seo Y B,P J,Huh I Y,et al. Agarose hydrolysis by two-stage enzymatic process and bioethanol production from the hydrolysate[J]. Process Biochemistry,2016,51(6):759-764.
[2]Shin M H,Lee D Y,Wohlgemuth G,et al. Global metabolite profiling of agarose degradation bySaccharophagusdegradans2-40[J]. New Biotechnology,2010,27(2):156-168.
[3]刘美英,梅建凤,易喻,等. 琼胶寡糖生物活性的研究进展[J]. 药物生物技术,2008,15(6):493-496.
[4]Enoki T,Tominaga T,Takashima F,et al. Anti-tumor-promoting activities of agaro-oligosaccharides on two-stage mouse skin carcinogenesis[J]. Biological & Pharmaceutical Bulletin,2012,35(7):1145-1149.
[5]Bhattarai Y,Kashyap P C. Agaro-oligosaccharides:a new frontier in the fight against colon cancer?[J]. American Journal of Physiology Gastrointestinal and Liver Physiology,2016,310(6):G335-G343.
[6]Higashimura Y,Naito Y,Takagi T,et al. Preventive effect of agaro-oligosaccharides on non-steroidal anti-inflammatory drug-induced small intestinal injury in mice[J]. Journal of Gastroenterology & Hepatology,2014,29(2):310-317.
[7]Higashimura Y,Naito Y,Takagi T,et al. Protective effect of agaro-oligosaccharides on gut dysbiosis and colon tumorigenesis in high-fat diet-fed mice[J]. American Journal of Physiology Gastrointestinal & Liver Physiology,2016,310(6):G367-G375.
[8]刘刚. 琼胶寡糖的制备及生物活性研究[D]. 上海:上海海洋大学,2010.
[9]赵永强. 龙须菜琼胶糖的制备及其副产物的研究[D]. 上海:广东海洋大学,2010.
[10]许艳婷,王秀娟,苏小玲,等. 液相色谱-电喷雾-四级杆-飞行时间质谱法分析琼胶寡糖[J]. 分析化学,2011,39(12):1798-1804.
[11]Kang O L,Ghani M,Hassan O,et al. Novel agaro-oligosaccharide production through enzymatic hydrolysis:Physicochemical properties and antioxidant activities[J]. Food Hydrocolloids,2014,42:304-308.
[12]Yun E J,Lee S,Kim J H,et al. Enzymatic production of 3,6-anhydro-L-galactose from agarose and its purification andinvitroskin whitening and anti-inflammatory activities[J]. Applied Microbiology and Biotechnology,2013,97(7):2961-2970.
[13]Heetaek K,Yun E J,Wang D M,et al. High temperature and low acid pretreatment and agarase treatment of agarose for the production of sugar and ethanol from red seaweed biomass[J]. Bioresource Technology,2013,136(12):582-587.
[14]Hsu P H,Wei C H,Lu W J,et al. Extracellular production of a novel endo-β-agarase AgaA from Pseudomonas vesicularis MA103 that cleaves agarose into neoagarotetraose and neoagarohexaose[J]. International Journal of Molecular Sciences,2015,16(3):5590-5603.
[15]Ramos K R M,Valdehuesa K N G,Cabulong R B,et al. Overexpression and secretion of AgaA7 fromPseudoalteromonashodoensissp. nov in Bacillus subtilis for the depolymerization of agarose[J]. Enzyme & Microbial Technology,2016,90:19-25.
[16]Koti B A,Shinde M,Lalitha J. Repeated batch production of agar-oligosaccharides from agarose by an amberlite IRA-900 immobilized agarase system[J]. Biotechnology & Bioprocess Engineering,2012,18(2):333-341.
[17]Chi W J,Park J S,Kang D K,et al. Production and characterization of a novel thermostable extracellular agarase from Pseudoalteromonas hodoensis newly isolated from the West Sea of South Korea[J]. Applied Biochemistry and Biotechnology,2014,173(7):1703-1716.
[18]Zeng C,Zhang L,Song M,et al. Preliminary characterization of a novelβ-agarase from Thalassospira profundimonas[J]. Springer Plus,2016,5(1):1086.
[19]Li G,Sun M,Wu J,et al. Identification and biochemical characterization of a novel endo-typeβ-agarase AgaW from Cohnella sp. strain LGH[J]. Applied Microbiology &Biotechnology,2015,99(23):1-11.
[20]沙玉杰,杨平平,何培青,等. 响应面法优化嗜热菌Bacillus sp.BⅡ-5产琼胶酶的发酵培养基条件[J]. 中国酿造,2013,32(5):31-35.
[21]杨贤庆,刘刚,戚勃,等. 响应曲面法优化琼胶的酸水解条件[J]. 食品科学,2010,31(20):173-177.
[22]曾诚. 产琼胶酶菌株的筛选及其酶学性质[D].福州:福建农林大学,2016.
[23]肖琼,肖安风,姚德恒,等. 琼胶酶水解工艺条件的优化及产物分析[J]. 中国食品学报,2015,15(12):99-106.
Optimization of enzymolysis conditions for degradation of agarose by cellulase
LI Qing-wang1,2,XIONG Yao1,2,CAI Kun-qi1,2,MIAO Song1,2,3,ZHANG Long-tao1,2,*,ZHENG Bao-dong1,2
(1.College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China; 2.China-Ireland International Cooperation Laboratory of Foods Material Science and Structural Design,Fuzhou 350002,China; 3.Teagasc Food Research Centre,Moorepark,Fermoy,Co. Cork 999014,Ireland)
In this paper,the conditions of cellulose enzymatic degradation of agarose were studied with the yield of reducing sugar as the index. Following single factor experiment,the enzymatic hydrolysis conditions of agarose were optimized by four factors(cellulase content,enzymolysis temperature,pH and enzymolysis time)Box-Behnken experiment design and response surface methodology(RSM),and a regression model was established for predicting the enzymatic hydrolysis yield at different levels of cellulase content,enzymolysis temperature,pH and enzymatic hydrolysis time. In addition,the enzymatic hydrolysate products were preliminary identified. The optimum enzymolysis parameter,including,the substrate content was 0.2%,the cellulase content was 1909.3 U/mL,the enzymolysis temperature was 50.0 ℃,the pH was 4.9,and the enzymolysis time was 24.2 h. Under these conditions,the enzymolysis rate of agarose reached 29.58%±0.26%. The results of thin layer chromatography(TLC)showed that the main products were agar oligosaccharides with polymerization degree of 2~6.
agarose;response surface methodology;enzymatic hydrolysis conditions;thin layer chromatography(TLC)
2017-02-28
李庆旺(1988-),男,硕士研究生,研究方向:农产品加工技术,E-mail:1165326411@qq.com。
*通讯作者:张龙涛(1979-),男,博士,副教授,研究方向:食品材料与结构设计,E-mail:zlongtao@hotmail.com。
TS201.7
B
1002-0306(2017)14-0156-07
10.13386/j.issn1002-0306.2017.14.031
