拟康宁木霉T-51几丁质酶活性及内切几丁质酶基因克隆与分析
2017-08-09尤佳琪李国庆
尤佳琪, 李国庆
(华中农业大学作物病害监测和安全控制湖北省重点实验室, 武汉 430070)
拟康宁木霉T-51几丁质酶活性及内切几丁质酶基因克隆与分析
尤佳琪, 李国庆*
(华中农业大学作物病害监测和安全控制湖北省重点实验室, 武汉 430070)
木霉是一类重要的生防真菌,木霉产生的几丁质酶在其生物防治的重寄生过程中起着重要作用。拟康宁木霉TrichodermakoningiopsisT-51是一株对番茄灰霉病有生防潜力的木霉菌株,本文测定了T-51菌株产生几丁质酶的活性,结果表明T-51在PDB中液体培养以及与灰霉病菌在PDA上对峙培养时产生的几丁质酶活性显著受到灰霉病菌的诱导。采用RACE技术首次克隆了拟康宁木霉T-51中一个几丁质酶基因Tkchit42,全长为1 817 bp,包含4个外显子和3个内含子。预测该基因有一个1 275 bp的开放阅读框,编码424个氨基酸,预测的蛋白总分子量为46.378 kDa,预测的等电点(pI)为5.16,与T.koningii中42 kDa内切几丁质酶的氨基酸序列相似性达到99%。
几丁质酶; 拟康宁木霉; 基因克隆; 序列分析
果蔬灰霉病是我国保护地果蔬生产中最主要的病害之一[1],在保护地果蔬生产中造成巨大的产量损失。灰霉病菌对化学农药极易产生抗药性[2],而且化学农药所引起的农药残留和环境污染等问题也受到人们的重视,因此,生物防治作为一种可替代的灰霉病防治措施,逐渐得到了植物保护研究者的关注。
木霉是一类具有广谱生防效果的生防真菌,对包括灰霉病在内的许多植物真菌病害都有生防作用。木霉对植物真菌病害的生防机制是多样的,包括对病原菌营养竞争、重寄生、抗生作用以及通过诱导植物抗性防治病害[3-4]。木霉的重寄生作用过程中,分泌真菌细胞壁水解酶是极其重要的[5]。几丁质是仅次于纤维素的自然界中第二大有机的可再生资源,也是真菌细胞壁骨架的主要成分[6],分泌几丁质酶能够帮助木霉降解寄主真菌的细胞壁,帮助木霉寄生寄主真菌。几丁质酶家族十分庞大,可分为内切几丁质酶、外切几丁质酶、β-N-乙酰氨基葡糖苷酶和壳二糖酶等[7],这些酶共同作用将几丁质逐步降解为单糖。许多研究表明,木霉产生的几丁质酶活性受到病原菌细胞壁的诱导[8],在重寄生过程中几丁质酶基因的表达也有显著的上调[9]。拟康宁木霉T-51是本实验室分离筛选得到的生防木霉菌株,前期的研究结果表明T-51对灰霉病菌有很强的重寄生能力,并且可以有效抑制灰霉病菌在植物残体上产孢,还有产生抗真菌物质、促进植物生长、诱导植物抗性等作用,对番茄灰霉病表现出很好的生防潜力[10]。然而,目前世界上对于拟康宁木霉生物防治的研究极少,对拟康宁木霉生物防治的分子机制暂无报道。
1 材料与方法
1.1 菌株来源
拟康宁木霉Trichodermakoningiopsis菌株T-51由本实验室分离自湖北省武汉市油菜田土壤中。
灰葡萄孢Botrytiscinerea菌株RoseBC-3由本实验室分离自月季灰霉病残体上。
1.2 主要试剂
TRIzol®Reagent (InvitrogenTM, USA)、pMD18-T、rTaqDNA聚合酶、dNTP混合物、 5′-Full RACE试剂盒和3′-Full RACE 试剂盒等均购于TaKaRa公司(中国大连);DNA凝胶回收试剂盒购于Axygen Scientific;粉状几丁质购于Sigma公司,并且根据任莉[11]的方法制成胶态几丁质。1% DMAB(对二甲氨基苯甲醛):10 g DMAB溶于100 mL含有12%浓盐酸的冰醋酸溶液中,待完全溶解后置于4℃下贮存备用,使用时用冰醋酸稀释10倍。
1.3 粗酶液的制备
1.3.1 液体培养
灰霉病菌菌株RoseBC-3菌丝块接种在铺有玻璃纸的PDA平板上生长,菌落长满后,将菌丝刮下,加液氮研磨成粉,按1%(W/V)比例加入PDB培养基中,在80℃水浴锅中水浴4 h后,用双层滤纸过滤,121℃蒸汽灭菌,即为Bc-PDB。取3 mL Bc-PDB或PDB在20 mL的玻璃摇菌瓶中,每瓶加入一个直径5 mm的木霉T-51生长2 d的新鲜菌丝块,在25℃摇床中150 r/min摇培3 d。取摇培上清液为粗酶液。
1.3.2 对峙培养
将灰霉病菌菌株RoseBC-3和拟康宁木霉菌株T-51的菌丝块分别接种在PDA平板的两端,两个菌丝块相距7 cm,或者在PDA平板上单独接种灰霉或单独接种木霉。将接种后的PDA平板放在20℃下培养7 d,互作区域的粗酶液浸提方法参考任莉[11],将对峙培养的平板中灰霉病菌和木霉菌落重叠区域(即为木霉与灰霉病菌的互作区,简称为T+B)或单独灰霉病菌(B only)或单独木霉(T only)菌落下的PDA培养基切下,捣碎,按照2∶1(W/V)的比例在ddH2O中浸提过夜,然后取上清液作为粗酶液。
1.4 几丁质酶活力测定
几丁质酶的测定方法参考任莉[11],吸取0.5 mL 粗酶液或PDB(空白对照)于5 mL的离心管中,加入0.5 mL胶态几丁质。将离心管置于37℃水浴中反应4 h。然后以8 000 r/min的速度离心5 min终止酶促反应。吸取0.5 mL上清液于一支洁净离心管中,加入0.1 mL浓度为0.8 mol/L 四硼酸钾溶液(pH 9.1)。摇匀后,沸水浴中反应3 min,迅速用冰水冷却至室温。再加入3 mL 制备好的1%对二甲氨基苯甲醛(DMAB)试剂,并在37℃下保温20 min,自来水中冷却至室温。测定各反应体系在585 nm下的吸光值。以N-乙酰氨基葡萄糖做标准曲线,在上述酶促反应体系中,定义1 mL酶液每小时释放出1 μmol的N-乙酰氨基葡萄糖定义为一个酶活力单位(U),计算各粗酶液中的几丁质酶活力。
1.5 核酸提取
将生长旺盛的拟康宁木霉T-51菌丝接种到铺有玻璃纸的固体PDA平板上,置于20℃下培养3 d后收集菌丝。分别使用CTAB法和TRIzol法提取菌丝总DNA和总RNA[12]。
1.6 PCR扩增
本研究所使用的引物序列见表1,其中P1-F/R引物参考伊洪伟[13]克隆长枝木霉中几丁质酶基因的PCR引物,其余引物是本研究中设计,由北京奥科鼎盛生物科技有限公司合成。
首先以拟康宁木霉T-51的基因组DNA为模板,用P1F和P1R引物(表1)进行扩增,PCR扩增体系(50 μL):DNA (1 μg/μL) 1 μL,10 × PCR buffer 5 μL,dNTP mix (2.5 mmol/L each) 1 μL, P1-F (20 μmol/L) 1 μL, P1-R (20 μmol/L) 1 μL,rTaqDNA polymerase 0.5 μL,ddH2O 40.5 μL。PCR反应程序为:94℃ 预变性30 s; 94℃ 30 s, 55℃ 30 s, 72℃ 2 min(35个循环);72℃ 10 min,16℃ 5 min。基因末端序列的克隆使用5′ RACE和 3′ RACE的方法,根据已经测序获得的序列设计了引物Tk-5′-GSP Outer、Tk-5′-GSP Inner、Tk-3′-GSP Inner及Tk-3′-GSP Outer(表1),根据试剂盒说明书进行扩增。
表1 本文使用的PCR扩增引物序列
Table 1 The sequences of PCR primers used in this study

引物名称Primername引物序列(5'-3')Sequence(5'-3')P1-FATGTTGGGTTTCCTCGGAAAATCCP1-RCTAGTTGAGACCGCTTCGGATGTTTk-5'-GSPOuterCTGGGTGTCATCGGAAGGGTACTTk-5'-GSPInnerAGCCACCGATAGAAAGCATAACCTk-3'-GSPInnerACGGTATCTGGGACTACAAGGTk-3'-GSPOuterTGGGAGTACCCTTCCGATGA
1.7 扩增产物的纯化、连接、转化及测序
扩增后的产物用1%琼脂糖凝胶电泳检测,切下目的片段,使用DNA 凝胶回收试剂盒进行纯化,然后连接pMD18-T载体,转化大肠杆菌DH5α,筛选阳性转化子测序。测序由北京奥科鼎盛生物科技有限公司完成。
1.8 序列分析
核酸序列在NCBI(http:∥www.ncbi.nlm.nih.gov/blast)上进行同源性检索,使用DNAMAN软件对序列进行拼接,并将核苷酸序列翻译为氨基酸,使用BioEdit分析软件对基因的核苷酸序列进行碱基成分和氨基酸组成分析。使用NCBI的ORF Finder分析序列的保守结构域。使用SignalP工具(http:∥www.cbs.dtu.dk/services/SignalP)中预测氨基酸序列的信号肽,通过TargetP工具(http:∥www.cbs.dtu.dk/services/TargetP/)进行蛋白亚细胞定位的预测,用SWISS-MODEL工具(http:∥www.swissmodel.expasy.org/) 预测蛋白的三维模型。使用MEGA软件(NJ法, 重复运算1 000次)构建与同源基因序列的系统发育树。
2 结果与分析
2.1 几丁质酶活性
T-51在Bc-PDB和PDB中的几丁质酶活性测定结果如图1,T-51在Bc-PDB中培养产生的几丁质酶活性(12.85±4.85 U/mL)显著高于(P<0.05)在PDB中培养产生的几丁质酶活性(9.36±0.61 U/mL)。T-51和灰霉病菌对峙培养过程中的几丁质酶活性测定结果如图2,在T-51与RoseBC-3的互作区域(T+B)中的几丁质酶活性(32.67±10.27 U/mL)显著高于(P<0.05)单独培养木霉(T only)(11.71±1.72 U/mL)或者单独培养灰霉病菌(B only)(9.99±1.68 U/mL)所产生的几丁质酶活性。这表明灰霉病菌会诱导拟康宁木霉T-51产生几丁质酶,特别是在T-51重寄生灰霉病菌菌落的过程中,几丁质酶活性显著上升,这表明几丁质酶可能在木霉的重寄生过程中起着重要的作用。
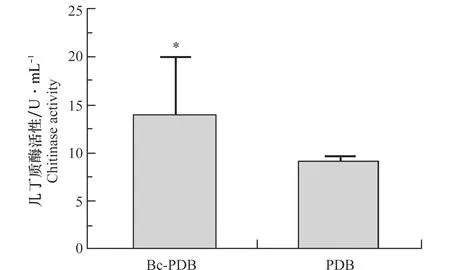
图1 拟康宁木霉T-51在Bc-PDB与PDB中产生的几丁质酶活性Fig.1 Chitinase activity of Trichoderma koningiopsis T-51 in Bc-PDB and PDB
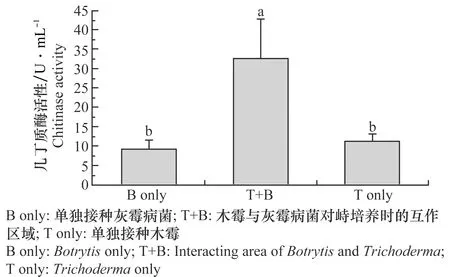
图2 拟康宁木霉T-51与灰霉病菌对峙培养时产生的几丁质酶活性Fig.2 Chitinase activity in dual culture of Trichoderma koningiopsis T-51 and Botrytis on PDA
2.2 拟康宁木霉T-51几丁质酶基因的克隆及序列分析
通过P1-F/R引物的扩增两株拟康宁木霉T-51的基因组DNA得到1 400 bp左右的条带,如图3a。该目的条带测序结果得到1 470 bp的序列。这段序列经过NCBI中比对,发现与许多木霉属其他种的内切几丁质酶基因有很高的同源性,其中与其近缘种康宁木霉T.koningii中编码42 kDa内切几丁质酶基因的核苷酸序列同源性达到97%,因此将这个基因命名为Tkchit42。然后根据这段序列设计了特异性引物进行末端序列的克隆。通过对cDNA的巢式PCR分别扩增5′端(图3b)和3′端(图3c),均得到约600 bp的条带。测序后的序列使用DNAMAN软件进行拼接得到了该基因的全长序列。Tkchit42基因序列在GenBank中的登录号为KU140672。

图3 Tkchit42基因的PCR及RACE扩增电泳图Fig.3 Amplification of Tkchit42 by using PCR and RACE
序列分析的结果表明,该基因全长共1 817 bp(不含polyA),其中5′端非编码区有135 bp,3′端非编码区有212 bp。包含4个外显子和3个内含子,内含子大小分别为57、70、68 bp。外显子组成一个长1 275 bp的开放阅读框,起始密码子为ATG,终止密码子为TAA(图4),Tkchit42基因全长碱基组成:G+C=49.26%,A+T=50.74%。

图4 Tkchit42基因全长结构示意图Fig.4 Structure of Tkchit42 gene
2.3Tkchit42基因编码的氨基酸序列分析
Tkchit42基因编码424个氨基酸(图5),其中丝氨酸含量最高(10.82%),半胱氨酸含量最低(0.24%)。预测的蛋白总分子量为46.378 kDa,预测的等电点(pI)为5.16。氨基酸序列在NCBI上预测到内切几丁质酶的保守结构域,属于GH18-几丁质酶超家族,有几丁质酶的活性位点。根据SignalP 4.0预测,在氨基酸序列前端存在信号肽,最可能的剪切位点是在27~28位:VAA-KD。使用Target P预测蛋白亚细胞器定位,预测结果表明该蛋白最有可能定位在胞外,是分泌蛋白。使用SWISS-MODEL在线预测了Tkchit42编码的蛋白三维结构的丝带模型,如图6。
2.4 同源性及分子进化分析
将Tkchit42编码的氨基酸在NCBI数据库中比对发现,其序列与多种木霉属真菌中42 kDa内切几丁质酶或几丁质酶基因的氨基酸序列相似性都达到85%以上,其中与T.koningii相似性达到99%(表2)。利用MEGA软件建立Tkchit42编码的氨基酸序列及其他木霉中的同源氨基酸序列的系统进化树,如图7。
3 结论与讨论
几丁质酶在木霉与寄主真菌互作的过程中十分重要,其中的β-N-乙酰氨基葡糖苷酶NAG1在木霉识别寄主真菌的过程中起到关键作用[14]。木霉与寄主真菌还未接触的时候,木霉通过分泌少量的β-N-乙酰氨基葡糖苷酶来识别寄主真菌,当识别反应成功后,便在短时间内大量分泌几丁质酶来降解寄主真菌的细胞壁[15-16],降解寄主细胞壁后产生的小分子产物反馈给木霉后又能激活包括几丁质酶基因在内的重寄生相关基因的表达上调,进一步分泌更多的细胞壁水解酶类,最终导致寄主真菌细胞壁裂解,细胞死亡[17]。已有研究表明木霉的几丁质酶等细胞壁水解酶类的活性受到寄主真菌细胞壁的诱导[8],例如哈茨木霉产生的几丁质酶受到灰霉病菌细胞壁的诱导[18]。本文的研究结果表明拟康宁木霉T-51在PDB摇培中产生几丁质酶的活性受到灰霉病菌的诱导,在拟康宁木霉T-51对灰霉病菌对峙培养时的互作区几丁质酶活性也显著升高,这意味着几丁质酶在T-51在对灰霉病菌的生物防治过程中可能起着重要作用。本实验室前期的研究表明,拟康宁木霉T-51对番茄灰霉病有着很好的生防潜力,并且对多种其他植物病原真菌菌落有重寄生能力。因此有必要对拟康宁木霉中生防相关的分子机制进行深入的研究。
本研究首次克隆了拟康宁木霉中的一个几丁质酶基因Tkchit42。在木霉中存在多种几丁质酶,在重寄生的过程中起着不同的作用,这些几丁质酶在木霉不同的种之间都存在差异。目前报道木霉中的内切几丁质酶的分子量主要为33、37 kDa以及42 kDa等[19],同源性分析表明Tkchit42的序列与编码42 kDa的内切几丁质酶基因的序列较为相近,根据本研究克隆的几丁质酶基因Tkchit42核酸序列预测其编码蛋白的分子量为46 kDa。胡仕凤等[15]通过比对分析17种木霉的42 kDa几丁质酶具有信号肽,序列为其N端的22个氨基酸残基,序列通常为“MLGFLGKSVALLAALQATLTSA”,本研究中Tkchit42编码的前22个氨基酸序列与之相同,而且Tkchit42也预测到了信号肽。

图5 Tkchit42基因预测的开放阅读框序列及氨基酸序列Fig.5 Predicted ORF and amino acid sequence of Tkchit42
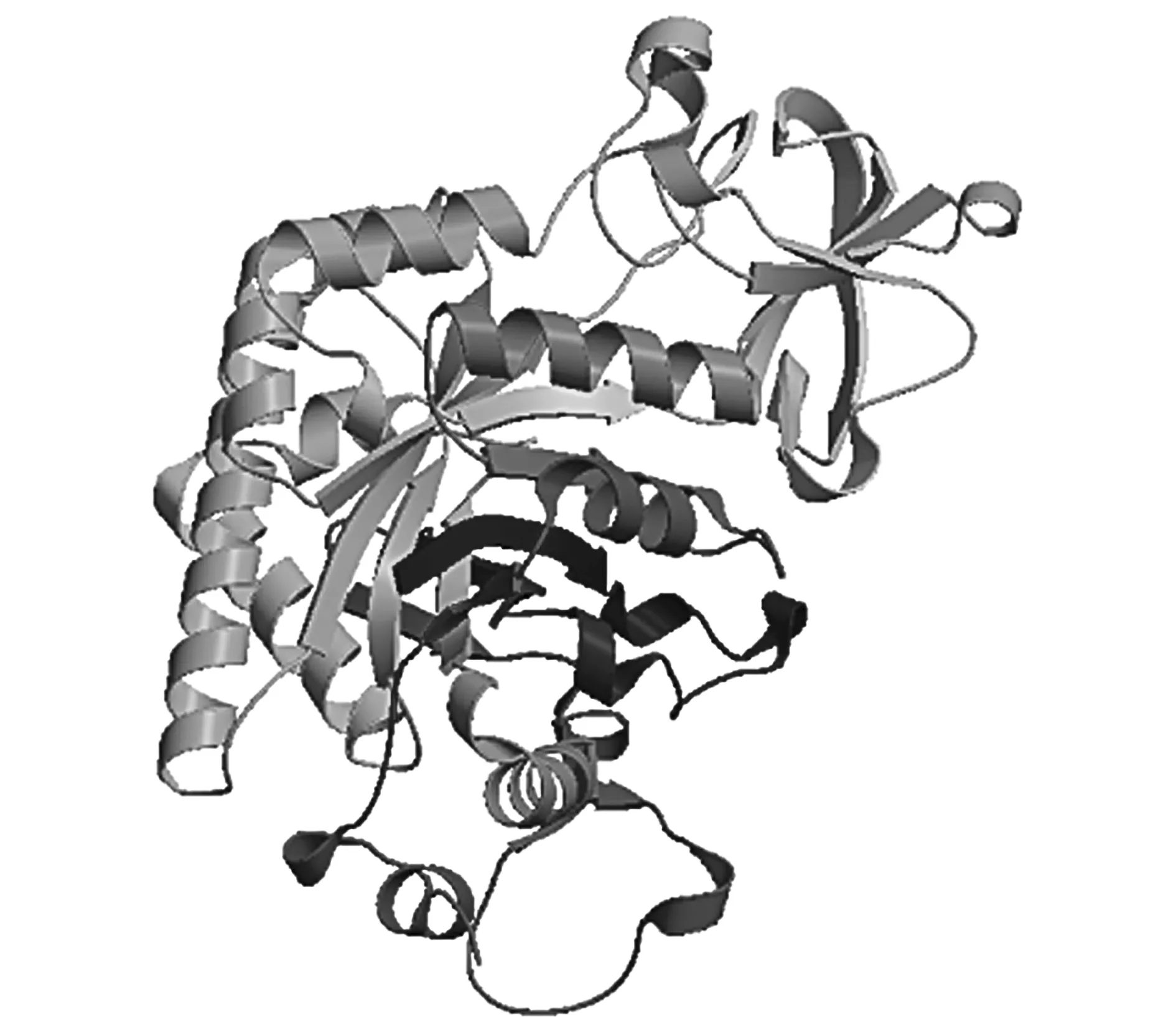
图6 Tkchit42编码蛋白的三级结构丝带模型的预测Fig.6 The 3D structure prediction of the protein encoded by Tkchit42
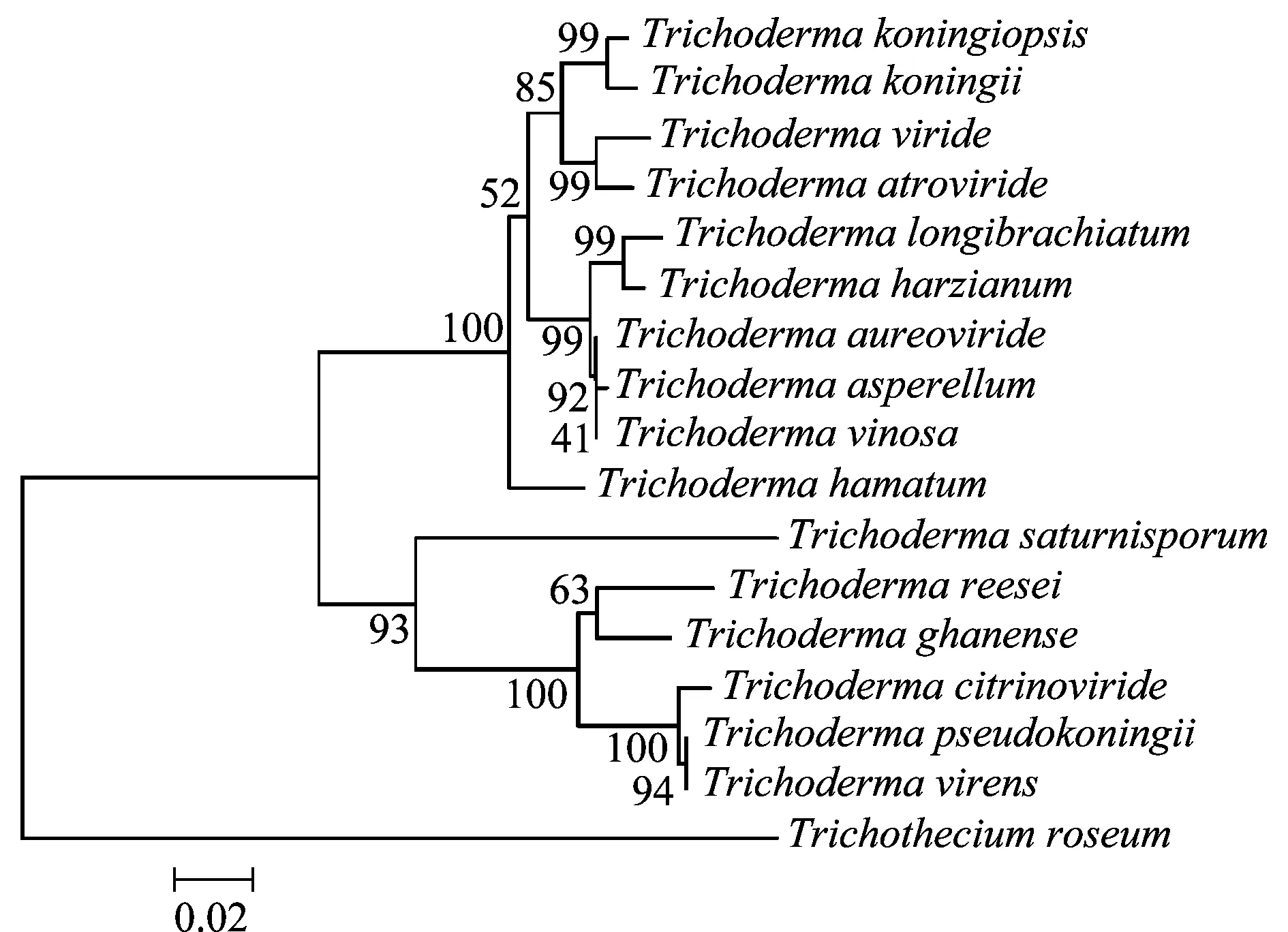
图7 基于Tkchit42推导的氨基酸序列与其他木霉几丁质酶氨基酸序列的系统进化树Fig.7 Phylogenetic tree of the predicted amino acid sequences of Tkchit42

GenBank登录号GenBankaccessionnumber基因编码产物Encodedproduct物种名Species氨基酸序列相似性/%Identityofaminoacidsequencegi|6630936|gb|AAF19612.1|42kDa内切几丁质酶康宁木霉Trichodermakoningii99gi|226596953|gb|ACO72604.1|几丁质酶深绿木霉T.atroviride97gi|6630948|gb|AAF19618.1|42kDa内切几丁质酶绿色木霉T.viride96gi|56967602|gb|AAW31950.1|42kDa内切几丁质酶黄绿木霉T.aureoviride96gi|297573457|gb|ADI46579.1|CHI42几丁质酶棘胞木霉T.asperellum95gi|6630962|gb|AAF19625.1|42kDa内切几丁质酶酒色木霉T.vinosum95gi|88191681|gb|ABD42921.1|内切几丁质酶长枝木霉T.longibrachiatum94gi|74049056|gb|AAZ95174.1|内切几丁质酶哈茨木霉T.harzianum94gi|2738109|gb|AAC60385.1|内切几丁质酶钩状木霉T.hamatum94gi|294992331|gb|ADF57309.1|几丁质酶chi18-5加纳木霉T.ghanense85gi|13516885|dbj|BAB40594.1|内切几丁质酶假康宁木霉T.pseudokoningii85gi|13516873|dbj|BAB40588.1|内切几丁质酶e-G2绿木霉T.virens85gi|294992333|gb|ADF57310.1|几丁质酶chi18-5橘绿木霉T.citrinoviride84gi|589112229|ref|XP_006968137.1|几丁质酶里氏木霉T.reesei83gi|284451278|gb|ADB89220.1|42kDa内切几丁质酶土星孢木霉T.saturnisporum81gi|317134350|gb|ADV02751.1|几丁质酶粉红单端孢霉Trichotheciumroseum71
几丁质酶有着广泛的应用前景。几丁质被几丁质酶降解后的产物(几丁寡糖、壳聚糖和N-乙酰氨基葡萄糖)具有抗菌及抗肿瘤等活性[20]。木霉中的几丁质酶基因转入水稻[21]、烟草[8]、苹果[8]、棉花[22]等植物,能够诱导植物对一些病原真菌产生抗性。哈茨木霉产生的几丁质酶粗提物能够抑制灰霉病菌菌丝生长和孢子萌发,并且抑制番茄灰霉病的发生[23]。本研究结果表明拟康宁木霉T-51产生的几丁质酶可能在生防过程中起着重要的作用,因此将来有必要对拟康宁木霉T-51的几丁质酶等生防相关的酶类进行更深入的研究,探究其在灰霉病防治中的作用。
[1] Dean R, Kan J A L V, Pretorius Z A, et al. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(4):414-430.
[2] Williamson B, Tudzynski B, Tudzynski P, et al.Botrytiscinerea: the cause of grey mould disease [J]. Molecular Plant Pathology, 2007, 8(5): 561-580.
[3] Harman G E.Overview of mechanisms and uses ofTrichodermaspp.[J].Phytopathology, 2006, 96(2): 190-194.
[4] Benitez T, Rincon A M, Limon M C, et al. Biocontrol mechanisms ofTrichodermastrains [J]. International Microbiology, 2004, 7(4): 249-260.
[5] 叶小波, 曾千春, 蒋细良. 木霉菌重寄生过程中的酶学研究进展[J]. 中国生物防治学报, 2009, 25(3):276-280.
[6] Li Duochuan.Review of fungal chitinases[J]. Mycopathologia, 2006, 161(6): 345-360.
[7] Gokul B, Lee J H, Song K B, et al. Characterization and applications of chitinases fromTrichodermaharzianum-A review [J]. Bioprocess & Biosystems Engineering, 2000, 23(6):691-694.
[8] 徐同, 柳良好. 木霉几丁质酶及其对植物病原真菌的拮抗作用[J]. 植物病理学报, 2002, 32(2):97-102.
[9] Steindorff A S, Ramada M H S, Coelho A S G, et al. Identification of mycoparasitism-related genes against the phytopathogenSclerotiniasclerotiorum, through transcriptome and expression profile analysis inTrichodermaharzianum[J]. BMC Genomics, 2014, 15(1):1-14.
[10]You Jiaqi, Zhang Jing, Wu Mingde, et al. Multiple criteria-based screening ofTrichodermaisolates for biological control ofBotrytiscinereaon tomato [J]. Biological Control, 2016, 101: 31-38.
[11]任莉. 重寄生真菌盾壳霉降解草酸毒素及其引起的生防效应研究[D]. 武汉:华中农业大学,2008.
[12]曾丽梅. 盾壳霉草酸脱羧酶基因的克隆、功能验证及生防作用研究[D]. 武汉:华中农业大学,2013.
[13]伊洪伟. 长枝木霉菌几丁质酶基因克隆和抑菌活性物质结构鉴定[D]. 哈尔滨:东北林业大学,2012.
[14]Gruber S, Seidl-Seiboth V.Self versus non-self: fungal cell wall degradation inTrichoderma[J]. Microbiology, 2012, 158(1):26-34.
[15]Haran S, Schickler H, Oppenheim A, et al. Differential expression ofTrichodermaharzianumchitinases during mycoparasitism [J]. Phytopathology, 1996, 86(9):980-985.
[16]Inbar J, Chet I. The role of recognition in the induction of specific chitinases during mycoparasitism byTrichodermaharzianum[J]. Microbiology, 1995,141(11):2823-2829.
[17]Vinale F, Sivasithamparam K, Ghisalberti E L, et al.Trichoderma-plant-pathogen interactions [J]. Soil Biology and Biochemistry, 2008,40(1):1-10.
[18]赵亚玲, 惠有为, 赵健, 等. 低温木霉对灰霉的拮抗作用[J]. 应用化工, 2010, 39(9):1303-1305.
[19]胡仕凤, 高必达, 陈捷. 木霉几丁质酶及其基因的研究进展[J]. 中国生物防治, 2008, 24(4):369-375.
[20]陈少波, 吴根福. 几丁质酶研究进展[J]. 科技通报, 2004, 20(3):258-262.
[21]柳良好, 徐同. 哈茨木霉几丁质酶诱导及其对水稻纹枯病菌的拮抗作用[J]. 植物病理学报, 2003, 33(4):359-363.
[22]李莉. 转木霉几丁质酶基因棉花的抗病性检测及鉴定[D]. 乌鲁木齐:新疆农业大学, 2005.
[23]杨春林, 席亚东, 谢华蓉, 等. 哈茨木霉Th-30几丁质酶的生产条件及对灰霉病菌的拮抗作用[J]. 植物保护学报, 2009, 36(4):295-300.
(责任编辑:田 喆)
Chitinase activity and endo-chitinase gene cloning and sequence analysis ofTrichodermakoningiopsisT-51
You Jiaqi, Li Guoqing
(KeyLaboratoryofCropDiseaseMonitoring&SafetyControlofHubeiProvince,HuazhongAgriculturalUniversity,Wuhan430070,China)
TrichodermakoningiopsisT-51 is a potential biological control agent againstBotrytiscinerea. In this study, chitinase activity of T-51 was significantly induced byB.cinereain both liquid PDB medium and the interacting area withB.cinereacolony on PDA medium. An endo-chitinase geneTkchit42 was cloned fromT.koningiopsisT-51. The full length ofTkchit42 was 1 817 bp, encoding an endo-chitinase protein containing 424 amino acid residues. The predicted protein molecular weight was 46.378 kDa. TheTkchit42 amino acid sequence BLAST showed 99% similarity with that of a 42 kDa endo-chitinase ofT.koningii. For our knowledge, this is the first report of chitinase gene cloned fromT.koningiopsis.
chitinase;Trichodermakoningiopsis; gene cloning; sequence analysis

研究报告ResearchReports
2016-08-17
2016-12-19
公益性行业(农业)科研专项(201303025)
S 476
A
10.3969/j.issn.0529-1542.2017.04.004
* 通信作者 E-mail: guoqingli@mail.hzau.edu.cn
