解答化学选择题的十种技法
2017-08-08四川卢敬萱
四川 卢敬萱
解答化学选择题的十种技法
四川 卢敬萱
高考化学选择题7道,4个选项,涉及28个知识点,考查知识范围广是选择题特点之一。设置4个选项的情境较为发散,可以从不同视角检测思维的敏捷、严密、整体、创造四种品质。作为标准化考试的固定题型,选择题是客观性试题中最灵活的一种,与之相匹配的解题方法需要灵活多变,以提高解题速度和准确度。
技法一:概念法
化学概念是化学理性分析的活动产物,涉及概念辨析的选择题,应从分析概念入手,精确掌握其关键性词语,不被替代性干扰词语所迷惑。
例1:合成导电高分子材料PPV的反应:
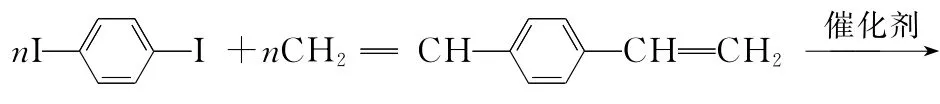
A.合成PPV的反应为加聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度
技法二:代入法
此法主要适用于题干提供信息量少的试题。
例2:纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
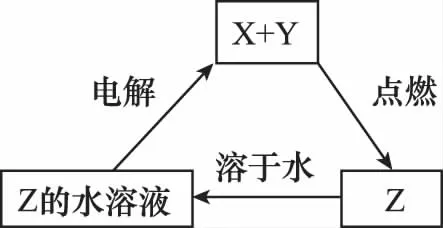
A.X可能是金属铜B.Y不可能是氢气
C.Z可能是氯化钠D.Z可能是三氧化硫
技法三:叠加法
此法应用在由若干个已知热化学方程式,确定未知热化学方程式的试题中。比较所求热化学方程式,调整物质的化学计量数和左右位置,通过类似数学方程的叠加消元处理得到结果。
例3:黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)N2(g)+3CO2(g) ΔH=xkJ·mol-1
已知:碳的燃烧热ΔH1=akJ·mol-1S(s)+2K(s)
2K(s)+N2(g)+3O2(g)ΔH3=c kJ·mol-1则x为( )
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
【解析】对照所求热化学方程式,缺少与C有关的热化学方程式,可依据碳的燃烧热ΔH1=akJ·mol-1,写出热化学方程式ΔH1=akJ·mol-1
①,调整化学计量数与所求热化学方程式相同,①×3,S(s)的位置和化学计量数相同无需调整,S(s)+K2S(s) ΔH2=b kJ·mol-1②,KNO3(s)只需调整位置,产物和反应物互换位置,焓变数值不变符号相反,c kJ·mol-1③,①×3+②+③=ΔH,3ΔH1+ΔH2-ΔH3=x解得x=3a+b-c。答案(A)。
技法四:守恒法
此法应用于有关原子、离子、电子求算问题。
(1)原子守恒
例4:某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C14H18O5B.C14H16O4
C.C16H22O5D.C16H20O5
(2)电荷守恒
例5:25℃时,在10mL浓度均为0.1mol/L NaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时c(OH-)>c(Na+)=c(NH3·H2O)
B.加入10mL盐酸时c(NH+4)+c(H+)=c(OH-)
C.加入盐酸至溶液pH=7时c(Cl-)=c(Na+)
D.加入20mL盐酸时c(Cl-)=c(NH+4)+c(Na+)
【解析】A选项,NaOH和NH3·H2O混合溶液中,NaOH完全电离,NH3·H2O部分电离,c(OH-)>0.1mol/L,c(Na+)=0.1mol/L,c(NH3·H2O)<0.1mol/L,c(OH-)>c(Na+)>c(NH3·H2O),A错误;B选项,任何溶液均为电中性,即阳离子所带正电荷总数等于阴离子所带负电荷总数,表示方法离子浓度乘以离子带电荷数,c(NH+4)+c(H+)+c(Na+)=c(OH-)+c(Cl-),由于等体积等浓度混合c(Na+)=c(Cl-),即c(NH+4)+c(H+)=c(OH-),B正确;C选项,加入盐酸至pH=7时,溶液呈中性,即c(H+)=c(OH-),那么c(NH+4)+c(Na+)=c(Cl-),即c(Cl-)>c(Na+),C错误;D选项,加入20mL盐酸时,此时溶液恰好为氯化钠与氯化铵的混合溶液,溶液呈酸性,因c(H+)>c(OH-),c(NH+4)+c(Na+)<c(Cl-),D错误。答案(B)。
(3)得失电子相等
例6:某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)下列说法正确的是( )
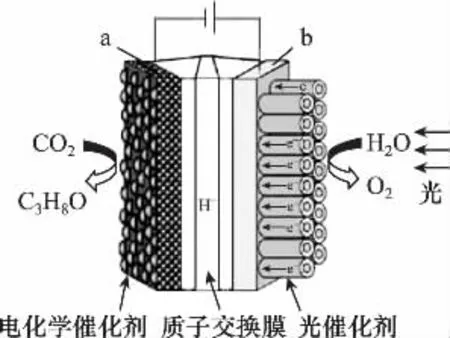
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1mol O2,有44g CO2被还原
D.a电极的反应为3CO2+18H+-18e-5H2O
(4)能量守恒
例7:甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:CO(g)+OH(g)ΔH1,则ΔH1
已知反应①中的相关的化学键键能数据如下:
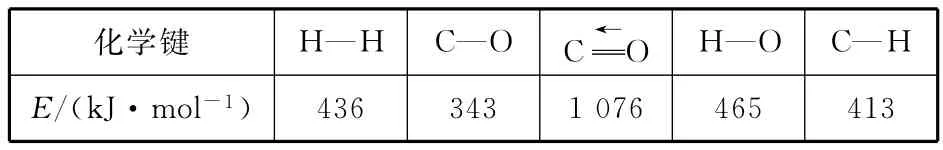
化学键H—H C—O C←O H—O C—H 436 343 1 076 465 413 E/(kJ·mol-1)
A.-832kJ·mol-1B.-489kJ·mol-1
C.-367kJ·mol-1D.-99kJ·mol-1
【解析】化学反应过程既遵循质量守恒又遵循能量守恒,能量守恒表达式:反应物总键能=生成物总键能+反应热,CO键能1 076kJ·mol-1、H2键能436kJ·mol-1、CH3OH中有3个C—H1个C—O1个H—O,ΔH1=1 076kJ·mol-1+436kJ·mol-1×2-(413×3+343+465)kJ·mol-1=-99kJ·mol-1。答案(D)。
技法五:公式法
公式是化学概念的数学表达方式,不能生搬硬套,做到外化于形,内化于心。
例8:一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
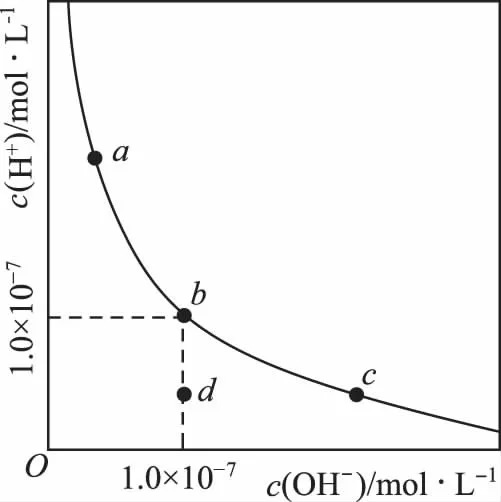
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
【解析】溶液中水的离子积公式Kw=c(H+)·c(OH-),内在的本质是Kw只与温度有关,与电解质无关,H+和OH-的浓度是指溶液中水和电解质电离出来的总和。A选项升高温度,Kw增大,c(H+)和c(OH-)都增大,c点向上同时向右运动,离开abc所在的等温线,A错误;B选项,b点c(H+)=c(OH-)=1.0×10-7,Kw=1.0×10-7×1.0×10-7=1.0×10-14,B错误;C选项温度不变,加入FeCl3为强酸弱碱盐,Fe3+结合水电离出的OH-,促进水的电离平衡右移,H+浓度增大,OH-浓度减小,abc三点对应的平衡常数不变,(由b到a),符合图象变化趋势,C正确;D选项温度不变,c点不可能离开等温线,D错误。答案(C)。
技法六:淘汰法
应用在4个选项难易、熟悉程度不同,容易熟悉的选项优先分析,缩小选择范围。
例9:一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+平衡时,体系中气体体积分数与温度的关系如下图所示:
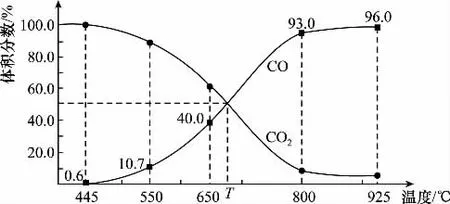
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
【解析】A、C选项不涉及计算只需定性分析,A选项充入惰性气体,为保持恒压体积增大,v正、v逆均减小,平衡向右移动,A错误;C选项图中信息T℃平衡时CO2和CO体积分数相等,T℃恒温恒压充入等体积的CO2和CO,化学平衡不移动,C错误;B选项,规范三行式计算,
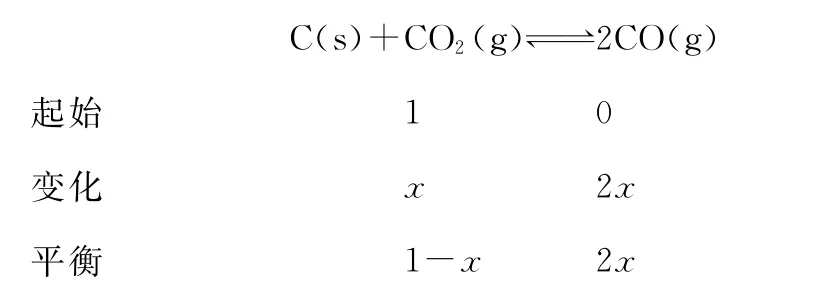
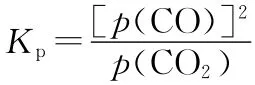
技法七:寻隐法
对反应、结构、图象进行细致分析,挖掘知识本身、题干和选项中不易察觉的知识和信息,突破思维定式解决问题。
例10:下列说法正确的是( )
A.密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2 NA
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
【解析】A选项,NO和O2反应方程式为2NO2,根据方程式知,2mol NO与1mol O2恰好完全反应生成2mol NO2,隐性知识NO2和N2O4之间存在2NO2转化,产物分子数小于2 NA,A错误;B选项,核U与中子发生裂变反应,净产生的中子数为10-1=9,U发生裂变反应净产生的中子n)数为9 NA,B正确;C选项中六碳环不是苯环,只有—COOH与NaOH反应,1mol分枝酸最多可与2mol NaOH发生中和反应,C错误;D选项容易思维定式,一般混有少量氯化钠的硝酸钾,制得硝酸钾的饱和溶液,采取降温结晶的方法。而本题氯化钠中混有少量的硝酸钾,氯化钠是大量的,制得的饱和溶液中硝酸钾量较少,不能采取降温结晶的方法,采取蒸发结晶方法,D错误。答案(B)。
技法八:推理法
推理法按照思维的起点分为顺推和逆推。顺推是从题目给定的条件出发,运用所学过的基本概念和基本理论,通过逻辑推理找出正确答案;逆推是从题干的结论出发,一步步推到起始已知条件或潜在的已知条件,将最终找出的条件与选项对照而得出答案。
例11:氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,25℃时氯气-氯水体系中存在以下平衡关系Ka=?其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
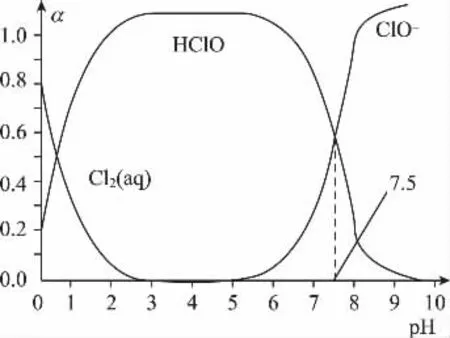
下列表述正确的是( )
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
【解析】C、D选项不涉及化学计算优先分析,C选项比较不同pH的杀菌效果,杀菌靠的是HClO,由图象可知,pH=6.5时c(HClO)比pH=7.5时要大,HClO浓度越大,杀菌效果好,pH=7.5时杀菌效果比pH=6.5时差,C正确;D选项比较夏季与冬季的杀菌效果,考虑温度的差异,夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,D错误;A选项所求的是气态氯气与水反应的热化学方程式,已知方程中Cl2(aq)需转化成Cl2(g),生成物中是ClO-不是HClO,解决Ka=?是首要问题,根据表达式及图象可知pH=7.5c(HClO)=c(ClO-)Ka=10-7.5;三式叠加得K=10-1.2×10-3.4×10-7.5=10-12.1,A错误;B选项,体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),即c(Cl-)+c(ClO-)=c(H+)-c(OH-),所求式子c(HClO)代替c(Cl-),问题转化为比较c(HClO)、c(Cl-)大小问题,在氯水中HCl完全电离、HClO部分电离,所以c(HClO)<c(Cl-)c(HClO)+c(ClO-)<c(H+)-c(OH-),B错误。答案(C)。
技法九:类比法
此法是利用知识间相似性,把题目中的已知条件或所求问题转换成自己熟悉的、易理解的、易判断的形式分析求解的一种方法。
例12:在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是()

c(mol·L-1)v(mmol·L-1·min-1)0.600 0.500 0.400 0.300 T/K 318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16 1.80 1.44 1.08
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
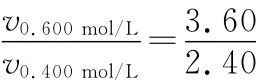
技法十:综合法
多种推理方法并用使问题快速解决。
例13:40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示。
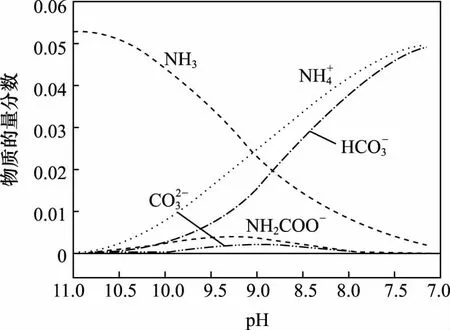
下列说法不正确的是( )
A.在pH=9.0时,c(NH+4)>c(HCO-3)>c(NH2COO-)>c(CO2-3)
B.不同pH的溶液中存在关系:c(NH+4)+c(H+)=2c(CO2-3)+c(HCO-3+c(NH2COO-)+c(OH-)
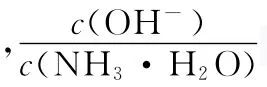
D.在溶液中pH不断降低的过程中,有含NH2COO-的中间产物生成

(作者单位:四川大学华西药学院)
