CRISPR/Cas9敲除pyk2基因对人脑胶质瘤细胞增殖、迁移及侵袭能力的影响
2017-08-07汪超甲胡钧涛胡胜利张宇强成于思雷尚国
汪超甲, 王 辉, 胡钧涛, 胡胜利, 张宇强, 成于思, 雷尚国
1.十堰市太和医院(湖北医药学院附属医院)神经外科, 湖北 十堰 442000; 2.十堰市郧西县人民医院神经外科, 湖北 十堰 442600
CRISPR/Cas9敲除pyk2基因对人脑胶质瘤细胞增殖、迁移及侵袭能力的影响
汪超甲1, 王 辉1, 胡钧涛1, 胡胜利1, 张宇强1, 成于思1, 雷尚国2*
1.十堰市太和医院(湖北医药学院附属医院)神经外科, 湖北 十堰 442000; 2.十堰市郧西县人民医院神经外科, 湖北 十堰 442600
为了探讨富含脯氨酸的酪氨酸激酶(proline rich tyrosine kinase2,Pyk2)对人脑胶质瘤U251细胞增殖及侵袭能力的影响,设计了2对以pyk2为靶基因的sgRNA片段,以px335质粒为载体,构建CRISPR/Cas9重组质粒,转染至人脑胶质瘤U251细胞中,同时设置野生型U251细胞作为对照组。通过酶切鉴定及Western blot分析筛选阳性单克隆细胞,并测序揭示突变位点。筛选出的阳性单克隆细胞作为实验组,经RTCA法比较后,发现实验组细胞的增殖能力较对照组明显下降,且具有统计学意义(P<0.05);Transwell小室法及划痕实验的结果均证实,较对照组,实验组细胞的体外侵袭及迁移能力受到明显的抑制,差异显著(P<0.05)。作为验证侵袭能力的代表,基质金属蛋白酶9(matrix metalloprotein 9,MMP9)在Western blot实验中表达量较对照组也明显下降。通过上述方法成功得到目的基因敲除的稳定细胞株,并证实敲除pyk2基因能明显的抑制人脑胶质瘤细胞的增殖、迁移及侵袭能力。
CRISPR/Cas9;pyk2基因;人脑胶质瘤细胞;增殖、迁移及侵袭能力
脑胶质瘤是颅内最常见的原发性恶性肿瘤。目前,手术仍是首选的治疗方案,对于高级别的脑胶质瘤来说,术后进行放疗、化疗等辅助治疗将有助于控制肿瘤的复发和转移。但由于其自身呈侵袭性生长、恶性程度高等生物学特点,很难达到彻底治愈。手术治疗并不能彻底切除整个肿瘤组织,放疗、化疗受限于其耐受性和耐药性,也达不到理想的效果。随着对肿瘤发生发展研究的深入,研究者们发现,肿瘤的发生和发展是多个基因在多方面共同作用的结果。若能彻底研究清楚对脑胶质瘤发生和发展起决定性作用或者影响较大的基因发挥作用的机制,则有望从基因水平为彻底治疗脑胶质瘤提供一条新的途径。
含脯氨酸的酪氨酸激酶(Pyk2)被研究证实在人脑胶质瘤细胞中高表达,且与该病预后密切相关,但具体机制尚不清楚。MMP9属于锌依赖性内肽酶家族,其主要功能是降解细胞外基质,维持细胞外基质的动态平衡。研究表明,其与肿瘤的侵袭性密切相关,常被用来代表侵袭能力的评价指标,故本实验希望通过检测MMP9表达水平的变化,进一步证实目的基因在肿瘤侵袭能力方面的影响。前期本课题组利用RNA干扰技术成功沉默脑胶质瘤细胞中C-Met基因并揭示了其在脑胶质瘤发生、发展中的作用机制[1],但由于其操作复杂、成本高,且干扰效果有限,而CRISPR/Cas9技术操作简单、设计简单、成本低,可使目的基因彻底得到敲除或者是点突变、插入,能更真实的反应该基因的作用机制。故本研究利用CRISPR/Cas9技术敲除脑胶质瘤细胞中的pyk2基因,以期探讨其在细胞增殖、迁移及侵袭方面的影响。
1 材料与方法
1.1 材料
px335/Cas9质粒由武汉大学药学院研究所馈赠;U251细胞由十堰市太和医院生命科学研究所提供;胎牛血清购自美国Gibco公司;Transwell BD购自美国Biosciences公司;Lipofectamine 3000转染试剂盒购自美国Invitrogen公司;Pyk2抗体购自英国Abcam公司;PMSF及RIPR裂解液购自上海碧云天公司;PVDF膜购自美国Millipore公司;BbsⅠ酶购自美国Thermo公司;T7EⅠ酶购自北京唯尚立德公司;其他试剂均为分析纯。
1.2pyk2敲除载体的构建
选取pyk2基因外显子1序列,以NGG为PAM序列(protospacer-adjacent motif,PAM)设计2对sgRNA引物,分别命名为sgRNA 1.1/1.2,sgRNA 2.1/2.2(表1),退火体系:sgRNA正链引物、sgRNA反链引物各5 μL。退火程序:37℃ 30 min;95℃ 5 min;0.1℃/s逐渐降温直至25℃。退火成双链后,BbsⅠ酶线性化px335/cas9质粒,并与退火产物连接,连接体系(10 μL):sgRNA退火产物5.0 μL,线性化质粒1.0 μL,T4连接酶1.0 μL,T4 buffer 1.0 μL,ddH2O 2.0 μL。而后转化大肠杆菌DH5α感受态细胞,挑菌测序,分析所得质粒。
1.3 细胞培养及转染
将DMEM+10%胎牛血清培养基加入复苏的脑胶质瘤U251细胞中,5% CO2,37℃,孵箱内培养,备用。当细胞达到70%~90%融合时,利用阳离子脂质体Lipofectamine 2000将构建好的成对的质粒(如引物sgRNA2.1、sgRNA2.2退火产物对应的质粒2.1、2.2)转染至细胞中,继续培养,并将各组对应的细胞分别命名为P1、P2。
1.4 酶切鉴定及测序
提取细胞总DNA,利用pyk2引物(表1),扩增体系(10 μL):上游引物 0.5 μL,下游引物0.5 μL,MIX 5.0 μL,模板1.0 μL,ddH2O 3.0 μL。PCR扩增程序: 95℃ 5 min;95℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。扩增产物pyk2经T7EⅠ酶切,琼脂糖凝胶电泳鉴定,并用BandScan 5.0分析胶片灰度值计算切割效率,效率值用切割后片段的总灰度值/所有条带灰度值之和。将有效率组的细胞分单克隆继续扩大培养,随后再次酶切鉴定。将PCR产物与T载体连接,随后转化大肠杆菌DH5α感受态细胞,挑菌测序,揭示目的序列的突变位点。
1.5 Western blot法检测细胞中Pyk2及MMP9蛋白表达水平
收集转染至U251脑胶质瘤细胞的阳性单克隆细胞,用蛋白裂解液裂解细胞,提取总蛋白后,酶标液测定蛋白浓度,取50 μg总蛋白上样,8% PAGE胶电泳,转PVDF膜,用5%脱脂奶粉的TBST封闭液封闭2 h,加1∶300一抗(兔抗人Pyk2抗体),孵育过夜,加二抗(山羊抗兔抗体)1∶1 000,AP显色,β-actin作为内参,BandScan5.0分析胶片灰度值,蛋白的表达水平以相对表达量即Pyk2/β-actin、MMP9/β-actin的比率计算,并绘图比较各组之间的差异。
1.6 RTCA法比较细胞增殖能力的变化
计数后调整细胞浓度为1×104个/mL,将细胞悬液接种于16孔RTCA板中,每孔接入300 μL,37℃培养120 h。各组设置8个复孔,记录生长曲线及数据,将24 h、48 h、72 h的数据经统计学分析绘制柱形图。

表1 sgRNA及PCR引物序列
1.7 Transwell小室法检测细胞的体外侵袭能力
收集计数细胞,用MEM无血清培养基稀释细胞至2×104个/mL,备用。10% FBS MEM培养基预先加入24孔板中,并将Transwell小室置入24孔板中,上室加入200 μL的细胞悬液,下室加入500 μL含10% FBS的培养基,置培养箱培养,24 h后取出小室,用10 mmol/L磷酸盐缓冲液(PBS)清洗2遍,棉签擦拭上室中的细胞, 95%乙醇固定1 h,0.2%结晶紫染色30 min,10 mmol/L PBS再次清洗,显微镜选取5个视野,计数细胞。
1.8 划痕实验验证细胞的迁移能力
计数并种植细胞,待细胞融合度接近70%,用枪头平行划线,10 mmol/L PBS清洗细胞后,继续培养,选取5个观察点显微镜记录48 h划痕之间细胞数,该实验重复3次,并求平均值进行统计学分析。
2 结果与分析
2.1 靶基因pyk2敲除载体的构建及鉴定
将构建好的重组质粒2.1、2.2与空质粒经BbsⅠ酶切后,琼脂糖凝胶电泳鉴定(图1),重组质粒2.1、2.2可以切出8 000 bp左右的条带,与空质粒一致。并将重组质粒2.1、2.2测序后的序列与pyk2目的序列进行比对,经DNA Star软件分析,结果显示目标序列已完全正确的插入载体中,至此,目的基因pyk2的敲除载体构建成功。

图1 重组质粒酶切鉴定的琼脂糖电泳Fig.1 Agarose gel electrophoresis of recombinant plasmids.注:M:DNA Marker; 2.1、2.2、px335分别为重组质粒2.1、2.2和px335环形质粒的酶切产物。
2.2 酶切鉴定敲除效率及测序
提取实验组细胞的总DNA,PCR产物用T7EⅠ酶切鉴定,PCR扩增长度为569 bp,如图2所示:与对照组相比,P1组无切割效率,而P2组则有约40%的切割效率。挑取P2组细胞扩大培养,获得6个单克隆细胞,分别命名为1~6,经T7EⅠ酶切鉴定后,琼脂糖凝胶电泳,并用BandScan 5.0分析条带的灰度值,将酶切下的条带的灰度值/所有条带的灰度值之和作为有效率,如图3所示:2、4号单克隆细胞有效率,其效率值分别约为30%、40%。PCR产物连接T载体后测序,结果显示1号有点突变,而2号和4号单克隆分别缺失13 bp、51 bp,确定为有意义的突变,得到阳性单克隆细胞,备用进行后续实验。
2.3 蛋白表达水平的检测

图2 转染后细胞酶切鉴定的琼脂糖电泳Fig.2 Agarose gel electrophoresis of enzyme digestion after transfection.注:M:DNA Marker;uwt、uP1、uP2代表没有加入T7EⅠ酶组;而wt、P1、P2代表加入T7EⅠ酶组。
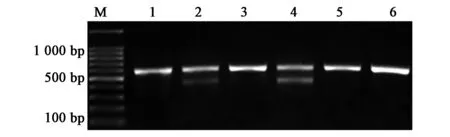
图3 单克隆细胞PCR酶切鉴定琼脂糖电泳Fig.3 Identification of PCR of monoclonal cells by agarose gel electrophoresis.注:M:DNA Marker;1~6分别对应1~6号单克隆细胞。
经Western blot检测分析各组细胞中Pyk2及MMP9蛋白的表达量的差异,可见实验组1、2、3(分别与阳性单克隆细胞1、2、4号对应)Pyk2表达量几乎为零(图4),进一步证实目的基因pyk2被成功敲除;图5显示MMP9的表达量较对照组明显降低。柱状图更好的反应了各组之间的差异(图6、7),经独立样本t检验统计学分析,差异具有统计学意义(P<0.01)。

图4 各组细胞Pyk2表达量的差异图Fig.4 The difference of Pyk2 expression in different groups.注:wt:对照组;1、2、3分别对应阳性单克隆细胞1、2、4号。

图5 各组细胞MMP9表达量的差异图Fig.5 The difference of MMP9 expression in different groups.注:wt:对照组;1、2、3分别对应阳性单克隆细胞1、2、4号。

图6 各组细胞Pyk2表达量的差异图Fig.6 The difference of Pyk2 expression in different groups.注:wt:对照组;1、2、3分别对应阳性单克隆细胞1,2,4号。**表示与对照组相比差异极显著(P<0.01)。

图7 各组细胞MMP9表达量的差异图Fig.7 The difference of MMP9 expression in different groups.注:wt:对照组;1、2、3分别对应阳性单克隆细胞1,2,4号。**表示与对照组相比差异极显著(P<0.01)。
2.4 RTCA检测细胞增殖能力的变化
如图8所示,经RTCA检测发现,敲除目的基因pyk2后,细胞的增殖能力(阳性单克隆细胞1、2、4号的平均值)明显下降,经单样本t检验,差异有统计学意义(P<0.05)。
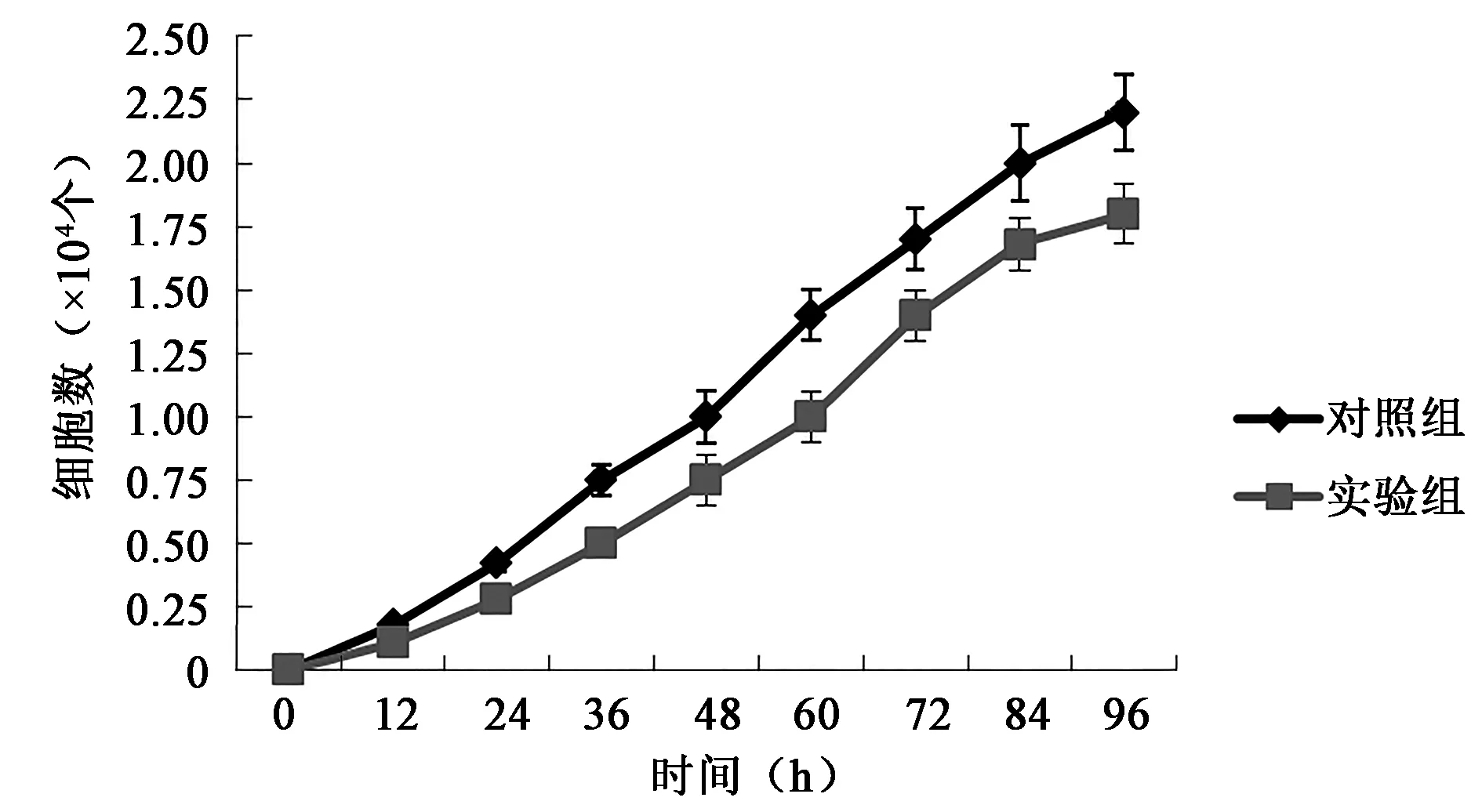
图8 细胞生长曲线比较Fig.8 Comparison of cell growth curve.
2.5 Transwell小室法检测细胞的体外侵袭能力的变化
如图9(彩图见图版三)和图10所示,实验组200×情况下穿膜细胞数(阳性单克隆细胞1、2、4号的平均值)约为11.530±2.21个,而空白对照组则为30.86±4.53,经SPSS 17.0进行统计学分析,两组之间差异有统计学意义(P<0.01)。
2.6 划痕实验检测细胞的体外迁移能力的变化
划痕实验显示:实验组200×下观察到48 h划痕间细胞数(阳性单克隆细胞1、2、4号的平均值)为16.35±2.51个,而对照组为25.12±3.43个。较对照组明显减少,经分析差异有统计学意义(P<0.05)(图11、12)。

图9 小室法检测细胞的侵袭能力Fig.9 Transwell method was used to detect the invasion ability of the cells.注:A:对照组细胞的侵袭能力;B:实验组(阳性单克隆2号)细胞后侵袭能力,200×。(彩图见图版三)

图10 小室法检测各组穿膜细胞数比较Fig.10 Comparison of the cells number in each group by the chamber method.注:**表示与对照组相比差异极显著(P<0.01)。
3 讨论
脑胶质瘤的治疗一直是神经外科及肿瘤科面临的难题。因其侵袭性强、易复发、恶性程度高,目前的各种治疗手段虽有一定的疗效,但均不能达到理想的效果。胶质母细胞瘤患者的平均生存期尚不足一年[2]。癌基因的激活或者是抑癌基因的失活被认为是肿瘤发生、发展的基础,脑胶质瘤也不例外,是多基因、多因素共同作用的结果[3]。因此,从基因水平探讨其治疗措施是非常必要的。

图11 划痕实验48 h各组细胞数比较Fig.11 Comparison of the cells number in each group for 48 hours by Scratch test.注:*表示与对照组相比差异显著(P<0.05)。
Pyk2是一种胞质非受体蛋白酪氨酸激酶,属于黏附斑复合物家族的一员,分子量约为115.7 kDa, 有4个主要的结构域,分布较为局限[4]。研究报道Pyk2在神经胶质瘤细胞系中高表达,且参与脑胶质瘤的发生、发展的过程,可能对调节细胞的增殖能力发挥着重要作用[5]。本研究利用CRISPR/Cas9表达载体,成功并高效的敲除了pyk2基因,通过 Western blot试验及T7EⅠ酶切共同验证了其敲除效率。RTCA实验揭示敲除该基因后细胞的增殖能力明显下降。Transwell实验及划痕实验提示细胞的迁移及侵袭能力得到显著抑制,MMP9蛋白表达量的下降也进一步证实细胞的侵袭能力的下降。上述的试验表明,pyk2基因在脑胶质瘤中高表达,且进一步证实其参与了细胞的增殖、迁移及侵袭过程的调节。

图12 划痕实验比较细胞的迁移能力Fig.12 Comparison of the migration ability of the cells.注:A、C:对照组0 h、48 h时细胞的迁移能力;B、D:实验组(阳性单克隆2号)0 h、48 h时细胞的迁移能力。
Pyk2之所以在调节脑胶质瘤细胞的增殖、迁移及侵袭方面发挥着重要作用,具体的机制可能与以下因素有关:通过激活P13/AKT信号通路中的GSK3在转录和翻译水平间接抑制抗凋亡蛋白MCL1的降解[6];Pyk2可随着自由的、催化过的钙离子浓度的升高而激活,可被自身磷酸化而激活,也可通过对SRC及Fyn等信号分子的招募,激活一系列信号通路[7];同时也可作为细胞骨架的绑定蛋白而参与信号的传导、细胞骨架的识别,进而参与整合素的激活和信号的整合[8];通过整合素及生长因子受体介导信号传导调节细胞粘附、转移、生长、扩增及分化[9];调节肌动蛋白的偶联,在细胞骨架的构建中发挥重要作用[10];Pyk2酪氨酸激酶的平衡对细胞骨架的构建及细胞自噬起重要作用[11]。
CRISPR/Cas9基因敲除技术作为一种高效的新型的基因编辑技术,较传统的TALEN、RNAi等具有效率高、操作简单等特点,在本实验中也得到验证[12]。但为了提高效率,严格按照设计原则设计sgRNA是非常重要的。本研究通过对目的基因pyk2进行敲除,揭示了其在脑胶质瘤细胞增殖、迁移、侵袭等方面的作用,但肿瘤的发生、发展是由多方面的综合因素引起的,要应用于临床尚有局限性。若期望在未来彻底治愈脑胶质瘤,尚需科研工作者在基础和临床方面付出更大的努力。
[1] 汪超甲,王 辉,胡钧涛,等. RNAi沉默c-Met基因对人脑胶质瘤U251细胞增殖及侵袭能力的影响[J].中国临床神经外科杂志,2015,20(5):290-292.
[2] Ohka F, Natsume A, Wakabayashi T. Current trends in targeted therapies for glioblastoma multiforme[J]. Neurol. Res. Int., 2012, 88(25): 878425.
[3] Xu D S, Yang C, Proescholdt M,etal.. Neuronatin in a subset of glioblastoma multiforme tumor progenitor cells is associated with increased cell proliferation and shorter patient survival[J]. PLoS ONE, 2012, 7(5): e37811.
[4] Chatzizacharias N A, Kouraklis G P, Theocharis S E. Focal adhesion kinase: A promising target for anticancer therapy[J]. Expert Opin. Ther. Tar.,2007,11(10): 1315 -1328.
[5] Kathy W K, Lin K B L, Dang-Lawson M,etal.. Small molecule inhibitors of the Pyk2 and FAK kinases modulate chemoattractant-induced migration, adhesion and Akt activation in follicular and marginal zone B cells[J]. Cell. Immunol.,2012,275(1):47-54.
[6] Jiang X H, Jacamo R, Zhukova E,etal.. RNA interference reveals a differential role of FAK and Pyk2 in cell migration, leading edge formation and increase in focal adhesions induced by LPA in intestinal epithelial cells[J]. J. Cell. Physiol., 2006,207(3):816-828.
[7] Loftus J C, Yang Z B, Kloss J,etal.. A novel interaction between Pyk2 and MAP4K4 is integrated with glioma cell migration[J]. J. Sig. Transd., 2013,8(15): 956580.
[8] Zhao J H, Zheng C H, Guan J L. Pyk2 and FAK differentially regulate progression of the cell cycle[J]. J. Cell Sci., 2000, 113(17):3063-3072.
[9] Yoon H, Choi Y L, Song J Y,etal.. Targeted inhibition of FAK, PYK2 and BCL-XL synergistically enhances apoptosis in ovarian clear cell carcinoma cell lines[J]. PLoS ONE, 2014,9(2): e88587.
[10] Gutenberg A, Bruck W, Buchfelder M,etal.. Expression of tyrosine kinases FAK and Pyk2 in 331 human astrocytomas[J]. Acta Neuropathol., 2004,108(4): 224-230.
[11] Du Q S, Ren X R, Xie Y,etal.. Inhibition of PYK2-induced actin cytoskeleton reorganization, PYK2 autophosphorylation and focal adhesion targeting by FAK[J]. J. Cell Sci.,2001, 114(16):2977-2987.
[12] Shen B, Zhang W S, Zhang J,etal.. Efficient genome modification by CRISPR-Cas9 nickase with minimal off-target effects[J]. Nat. Methods, 2014,11(4):399-402.
Effects ofpyk2 Knockout on the Proliferation, Migration and Invasion of Human Glioma Cell Line by CRISPR/Cas9
WANG Chaojia1, WANG Hui1, HU Juntao1, HU Shengli1, ZHANG Yuqiang1, CHENG Yusi1, LEI Shangguo2*
1.DepartmentofNeurosurgery,ShiyanTaiheHospital(AffliatedHospitalofHubeiMedicineCollege),HubeiShiyan442000,China; 2.DepartmentofNeurosurgery,YunxiPeople’sHospital,HubeiShiyan442600,China
Two pairs of CRISPR/Cas9 recombinant plasmids which targetspyk2 genes were constructed to investigate the effects of Pyk2 (proline rich tyrosine kinase 2) on the proliferation and invasion of human glioma cell line U251. The plasmids were transfected into human glioma U251 cells after they were identificatied, and the wild type U251 cells were set as the control group. Positive monoclonal cells were selected by enzyme digestion and Western blot analysis, then the mutation sites were revealed by sequencing. Compared with the control group, the proliferation ability of the experimental group (the positive monoclonal cells) was decreased by the RTCA method (P<0.05). The invasion and migration ability of the cells in experimental group were significantly inhibited by Transwell chamber method and Scratch test, and the differences were statistically significant (P<0.05). The matrix metalloproteinase 9 (MMP9), which was used to verify the invasion ability, was significantly decreased in the experimental group than in the control group by Western blot method. Through the above methods, we successfully obtained the stable cell lines with target gene knockout, and confirmed that knockout ofpyk2 gene could significantly inhibit the proliferation, migration and invasion of human glioma cells.
CRISPR/Cas9;pyk2 genes; human glioma cells; proliferation, migration and invasion
2017-02-22; 接受日期:2017-03-31
湖北省自然基金项目(2013CFB225);湖北医药学院中青年创新团队项目(2014CXZ03);湖北医药学院附属太和医院博士启动基金项目(2014QD02);十堰市科技局指导性项目(15Y26)资助。
汪超甲,主治医师,研究方向为脑胶质瘤的临床及基础研究。E-mail:vernon502@163.com。*通信作者:雷尚国,副主任医师,研究方向为脑胶质瘤的临床及基础研究。E-mail:404090832@qq.com
10.19586/j.2095-2341.2017.0010
