台湾乳白蚁β-葡萄糖苷酶基因的克隆与分析1)
2017-08-07候亚会严善春吴文静刘小琳李志强
候亚会 严善春 吴文静 刘小琳 李志强
(东北林业大学,哈尔滨,150040) (广东省动物保护与资源利用重点实验室(广东省生物资源应用研究所))
台湾乳白蚁β-葡萄糖苷酶基因的克隆与分析1)
候亚会 严善春 吴文静 刘小琳 李志强
(东北林业大学,哈尔滨,150040) (广东省动物保护与资源利用重点实验室(广东省生物资源应用研究所))
为了进一步挖掘与利用台湾乳白蚁(CoptotermesformosanusShiraki)的纤维素酶基因,利用RT-PCR技术,构建了台湾乳白蚁cDNA文库,针对β-葡萄糖苷酶(BG)保守区域设计简并引物,得到一个1 966 bp的潜在的编码β-葡萄糖苷酶的新基因(CfBG-Ib),其开放阅读框1 692 bp,编码563个氨基酸的产物,并进行了原核表达。预测成熟的蛋白分子质量为64.02 ku,在Bt蛋白的胁迫下,检测发现CfBG-Ib与同类基因CfGlu1B和CfBG-Ia的表达响应模式相似,3个基因均在Cry1Ac胁迫下显著上调,可能是Cry1Ac的潜在靶标之一。
台湾乳白蚁;β-葡萄糖苷酶;纤维素酶;基因克隆;Bt蛋白
CoptotermesformosanusShiraki;β-glucosidase; Cellulase gene; Gene cloning; Bt protein
木食性昆虫能通过纤维素酶高效降解纤维素类物质,满足自身生长发育的需要[1-2],如食木白蚁、天牛幼虫、木蜂幼虫及鳞翅目幼虫等。其中,白蚁是消化纤维素最有效的昆虫类群,被认为是地球上最小的高效生物反应器[3],其降解效率可达74%~99%[4-5],而且每年消化的纤维素类物质总量巨大。白蚁高效利用纤维素的肠道生境条件和丰富的纤维素酶及其基因,为生物质能的开发提供了可借鉴的生物模型,对于纤维素的生物能源转化利用与环保型白蚁药剂作用靶标的研究均具有重要意义[6]。
纤维素分解为葡萄糖主要需要三类纤维素酶,包括外切葡聚糖酶、内切葡聚糖酶(EG)和β-葡萄糖苷酶(BG)[7]。目前普遍认为纤维素酶通过这3种酶的协同作用完成降解,首先是内切葡聚糖酶在纤维素的非结晶区作用,产生无定形纤维素和可溶性的纤维寡糖,形成新的末端,然后再由外切葡聚糖酶作用于非还原端,每次水解一个纤维二糖分子,最后再由β-葡萄糖苷酶将纤维二糖分子彻底水解为葡萄糖[8]。β-葡萄糖苷酶是白蚁重要的内源性纤维素酶,主要由白蚁的唾液腺和中肠分泌产生。
台湾乳白蚁(CoptotermesformosanusShiraki)属鼻白蚁科,在我国广泛分布,是我国重要的林业有害生物。白蚁纤维素酶基因对于白蚁的消化代谢至关重要,台湾乳白蚁纤维素酶基因资源丰富[9],已公布的仅8个EG酶全长基因、5个BG酶全长基因,查找白蚁体内全部纤维素酶基因,有助于了解白蚁的纤维素消化体系,为进一步防控和利用白蚁奠定基础。Bt蛋白是被广泛应用的微生物杀虫剂,对白蚁也具有毒杀作用[10],但是尚不清楚是否会影响纤维素酶的表达,从而影响纤维素的代谢过程,促进白蚁的死亡。
本研究拟通过构建台湾乳白蚁cDNA文库,利用β-葡萄糖苷酶基因的保守区域,筛选新的β-葡萄糖苷酶基因,并对新基因进行序列分析和遗传进化分析,同时检测Bt蛋白处理下新基因和已知基因的表达情况,有利于探究白蚁消化系统对药剂的响应,寻找新的药物潜在干扰靶标。
1 材料与方法
1.1 材料
台湾乳白蚁野外群体采自广东省广州市生物岛,实验室内置于人工气候箱饲养,温度为27 ℃,相对湿度为75%,喂食松木板,直至试验取用。
1.2 台湾乳白蚁cDNA文库的构建
选取健康的台湾乳白蚁工蚁10头,按照TaKaRa MiniBEST Universal RNA Extraction Kit(TaKaRa公司)试剂盒使用说明进行白蚁总RNA的提取,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa公司)合成cDNA文库。
1.3 新β-葡萄糖苷酶基因的筛选
1.3.1 简并引物设计
选取已被报道的台湾乳白蚁、格斯特乳白蚁(Coptotermesgestroi)、美洲散白蚁(Reticulitermesflavipes)、高山象白蚁(Nasutitermestakasagoensis)、黄翅大白蚁(Macrotermesbarneyi)、Macrotermescarbonarius、恒春新白蚁(Neotermeskoshunensis)和黑翅土白蚁(Odontotermesformosanus)等编码β-葡糖苷酶的10条同源基因的序列(GQ911585,KC891004,HM152540,AB508959,JQ292845,AB508957,KC533771,AB073638,JN565079,GU591172),采用CODEHOP(Consensus Degenerate Hybrid Oligonuleotide Primers,http://blocks.fhcrc.org/codehop.html)在线软件设计简并引物(表1),筛选台湾乳白蚁新的β-葡糖苷酶基因。

表1 研究所用的引物
1.3.2 中间片段的筛选
(1)以构建的工蚁cDNA文库为模板,进行PCR扩增。反应体系为,cDNA 2 μL,PremixTaq25 μL,上下游简并引物各2 μL,加dH2O至50 μL;反应程序为,94 ℃预热1 min,然后94 ℃ 30 s,50/55/60 ℃ 30 s,72 ℃ 30 s,循环30次,最后72 ℃延伸10 min。(2)取5 μL PCR扩增产物进行1.0%琼脂糖凝胶电泳检测。(3)使用E.Z.N.A.TMGel Extraction Kit(Omega公司)回收目的DNA片段。(4)使用pMDTM18-T Vector Cloning Kit(Takara公司)将DNA片段与载体进行连接。(5)将连接物转化到大肠杆菌DH5α感受态细胞进行培养,挑选阳性菌落,摇菌,进行PCR鉴定,反应程序同上。(6)使用Plasmid Mini Kit I(Omega公司)对鉴定呈阳性的菌液提取质粒,质粒送华大基因进行测序。(7)将测序得到的结果提交至NCBI进行比对分析,筛选与已知序列存在显著性差异的序列进行后续试验。
1.3.3 基因全长序列的克隆
为了获取白蚁纤维素酶cDNA的全长序列,应用SMARTer®RACE cDNA Amplification Kit(Clontech公司)构建cDNA全长文库。根据简并引物扩增获得的中间片段序列,设计5′-RACE和3′-RACE的基因特异引物(表1)。用上述合成的cDNA作为RACE(Rapid amplification of cDNA ends)PCR的模板,按照SMARTer®RACE 5′/3′Kit(Clontech公司)使用说明进行PCR扩增。按1.3.2中的方法对PCR产物进行回收、连接、转化、产物验证以及测序。
1.3.4 生物信息学分析
应用DNAstar软件将测序结果拼接得到台湾乳白蚁BG基因cDNA全长序列,并分析DNA序列的开放阅读框和预测氨基酸序列。利用ANTHEPROT软件分析编码蛋白的蛋白质相对分子质量、理论等电点等参数。利用SingalP4.1(http://www.cbs.dtu.dk/services/SignalP/)在线软件预测信号肽序列,用NetOGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)分析N-连接糖基化位点,用Phyre 2(http://www.sbg.bio.ic.ac.uk/servers/phyre2)预测蛋白质立体模型。从BLAST核酸数据库中选取22条来自其他白蚁的β-葡糖苷酶。利用MEGA6分析上述22条β-葡糖苷酶核酸序列和本研究新发现的β-葡糖苷酶核酸序列,构建系统发育树。
1.4β-葡糖苷酶基因的原核表达
根据克隆得到的β-葡糖苷酶基因的cDNA,选取基因的开放阅读框作为原核表达的片段,设计特异性引物(表1)。按1.3.2中的方法对原核表达目的片段进行PCR扩增、切胶回收、连接、转化以及测序分析,将测序正确的目的片段和pET-32a(+)空载体进行双酶切反应,筛选阳性重组质粒转化至大肠杆菌表达型菌株Rosetta 2(DE3)感受态细胞中,并筛选阳性单克隆,对重组蛋白进行IPTG诱导表达,采用细菌蛋白抽提试剂盒提取细菌总蛋白,进行10% SDS-PAGE电泳。
1.5 Bt蛋白处理下台湾乳白蚁β-葡萄糖苷酶基因的表达差异
取直径为150 mm的玻璃培养皿,放入台湾乳白蚁工蚁120头,并加入10头兵蚁维持品级的稳定,置于温度27 ℃,相对湿度75%的人工气候箱中饥饿培养24 h。取直径为90 mm的滤纸,分别用1 mL的丙酮和0.1 mg·L-1的吡虫啉溶液、Bt蛋白Cry1Ab溶液和Bt蛋白Cry1Ac溶液浸湿,室温下放置一天,使丙酮充分挥发。取直径为90 mm的玻璃培养皿,每组放入丙酮充分挥发后的滤纸、饥饿处理后的工蚁50头、兵蚁5头处理1天,重复3次。收集试验组和对照组的工蚁,提取总RNA进行荧光定量PCR检测,按照PrimeScriptTMRT reagent Kit with gDNA Eraser和SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒说明书进行,采用2-ΔΔCt的方法进行目的基因的相对表达量分析[11]。用于荧光定量PCR检测的特异性引物和内参引物如表1。
2 结果与分析
2.1 台湾乳白蚁BG基因的克隆与序列分析
简并引物获得的扩增片段与已克隆得到的台湾乳白蚁β-葡糖苷酶基因(CfGluA,CfGluB,CfGluC,CfGluD,CfBG-Ia)进行核酸序列比对,有2个克隆分别与GluA和CfBG-Ia序列相同,有一个长为817 bp的克隆片段与所有已知序列均存在显著性差异,但有共同的保守区域。根据中间片段,3′-RACE和5′-RACE PCR扩增拼接后得到该片段的完整cDNA,全长1 966 bp,5′非编码区为114 bp,开放阅读框长度为1 692 bp,编码563个氨基酸,在N端前26个氨基酸为信号肽序列,3′非编码区为160 bp,含有poly(A)尾(图1)。

斜体表示5′和3′末端非编码区;下划线表示信号肽序列;*号表示翻译终止密码子;黑色实心三角形表示N-糖基化位点;方框表示底物结合位点和催化位点。
图1 基因CfBG-Ib的cDNA全长序列和编码的氨基酸序列
预测成熟蛋白的蛋白质分子质量为64.02 ku,等电点为6.41,含有5个N-糖基化位点。在GenBank数据库中比对蛋白质序列,结果显示,该编码蛋白质含有糖基水解酶家族1(GHF1)结构域,序列与Nasutitermestakasagoensis的β-葡糖苷酶(BAI50024)一致性最高,为58%,与Reticulitermesflavipes(ADK12988)、Periplanetaamericana(AIA09348)、Zootermopsisnevadensis(KDR17469)、Coptotermesformosanus(ADB23476)、Coptotermesgestroi(AGS32242)等等翅目或蜚蠊目昆虫的β-葡糖苷酶一致性比例均在55%以上。故确认克隆的cDNA序列为台湾乳白蚁β-葡糖苷酶基因,命名编码的蛋白为CfBG-Ib(GenBank登录号KY228991)。
根据蛋白序列,结合其他已知物种的β-葡糖苷酶三维结构,推测CfBG-Ib三维结构(模板覆盖84%的氨基酸,可信度大于90%)。三维结构图(图2)显示,CfBG-Ib具有糖基水解酶家族1的典型结构,8个(β/α)结构围成的桶状结构,2个催化活性中心:亲核中心Glu244和酸碱催化中心Glu453,2个顺式肽键:Ala259-Pro260和Trp495-Ser496。
从GenBank数据库中收集了来自等翅目10个物种22条β-葡糖苷酶核酸序列,结合本研究的β-葡糖苷酶序列,采用ML法构建系统进化树。进化
树结果与Shimada和Maekawa研究结果[12]一致,β-葡糖苷酶分成3个进化枝,CfBG-Ib与CfBG-Ia、CfGlu1B同属于具有纤维素消化功能的进化枝1,但相互距离较远,CfBG-Ib可能更早分出(图3)。此外,进化枝2的β-葡糖苷酶可能参与信息素交流过程[12],进化枝3的β-葡糖苷酶可能与性别相关[13-15]。
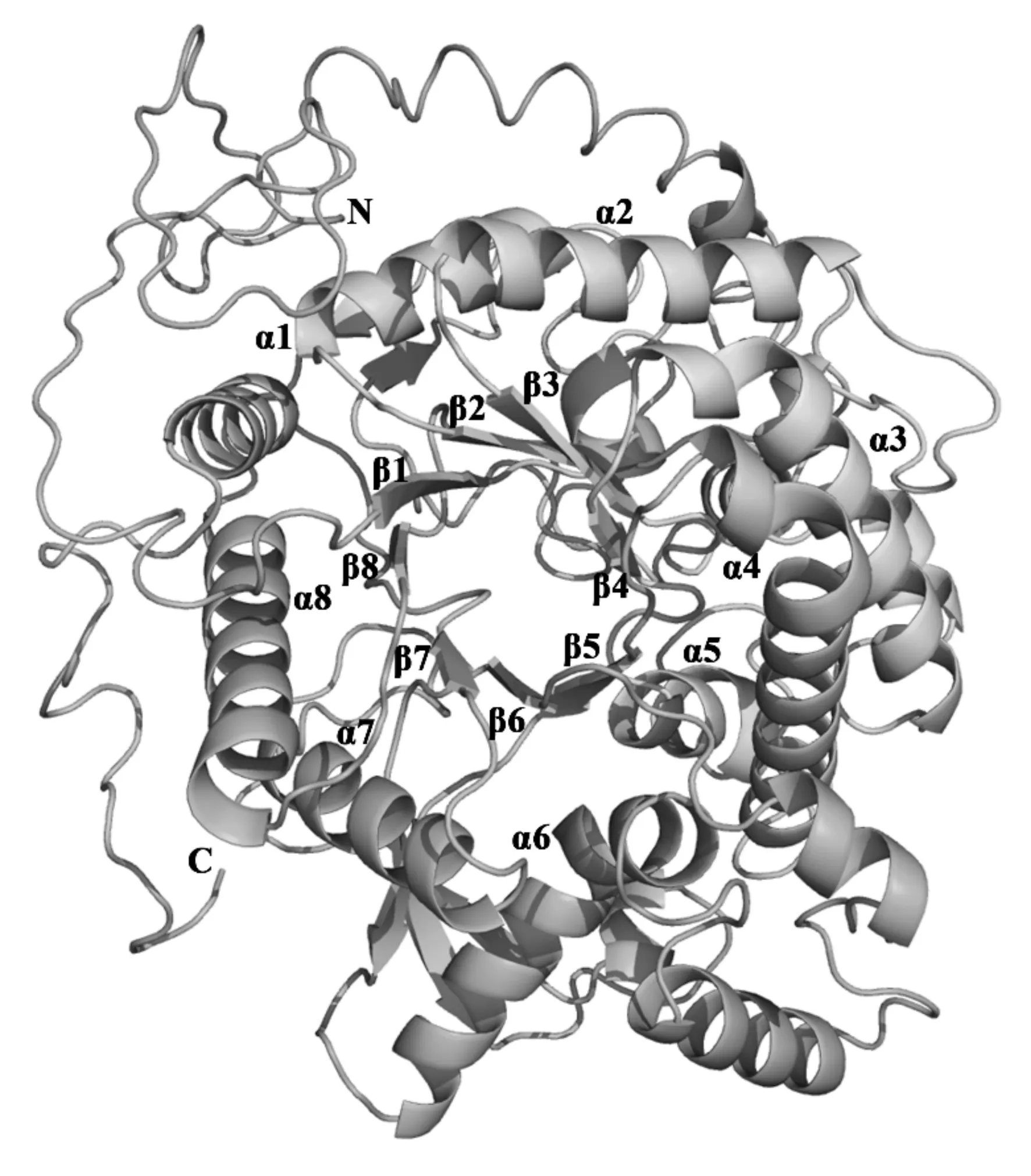
图2 CfBG-Ib的三维结构
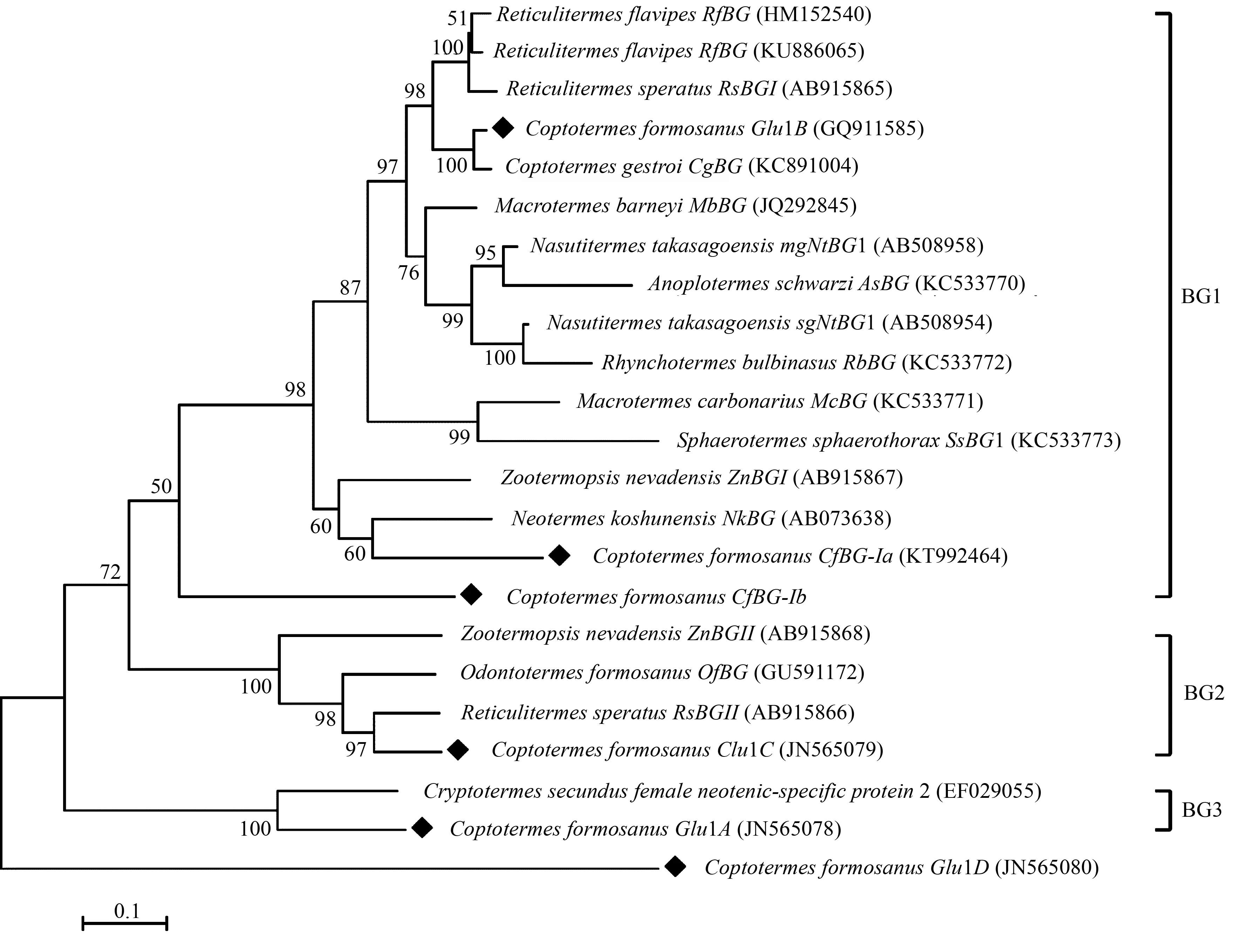
数字表示bootstrap验证1 000次该树枝可信度的比例;黑色方形表示台湾乳白蚁已知的β-葡萄糖苷酶全长序列。
2.2 重组蛋白的表达
PCR扩增后,回收目的片段CfBGIb,将CfBGIb和pET-32a空载体分别进行双酶切反应,然后将带黏性末端目的基因片段CfBGIb和带黏性末端的pET-32a载体进行连接转化,成功构建出重组原核表达载体CfBGIb-pET32a。
将CfBGIb-pET32a转化至大肠杆菌表达型菌株Rosetta 2(DE3)感受态细胞中,摇菌培养后加入1 mmol IPTG诱导,成功实现CfBG-Ib基因的表达。SDS-PAGE电泳检测发现(图4),转化诱导的CfBGIb-pET32a细菌细胞总蛋白显示出一条明显的条带,相对分子质量约80 ku,而未诱导的细菌细胞总蛋白无该条带。该条带可能为含有CfBGIb蛋白的融合蛋白,因为预测的CfBGIb编码蛋白的分子质量为64.02 ku,pET-32a质粒上带有分子质量约为18 ku的Trx-tag、S-tag和His-tag三个融合表达标签,所以重组表达后的融合蛋白大小可能为82 ku。
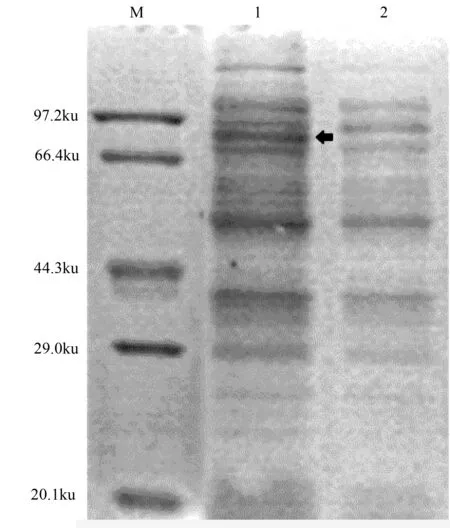
1.诱导的pET-32a-CfBG-Ib的原核表达;2.未诱导的pET-32a-CfBG-Ib的原核表达;箭头指向的是CfBG-Ib重组蛋白。
图4 CfBG-Ib重组蛋白的原核表达
2.3 Bt蛋白处理下台湾乳白蚁β-葡萄糖苷酶基因表达
选择了Bt蛋白中常见的晶体蛋白Cry1Ab和Cry1Ac进行胁迫处理,以不加药物的处理组为阴性对照,因为吡虫啉是目前白蚁防治药物中的重要成分之一,故以吡虫啉的处理组为阳性对照。检测处理1天的正常工蚁进行基因表达的检测。结果显示,药剂胁迫处理下,属于同一进化枝的具有纤维素消化功能的CfGlu1B、CfBG-Ia和CfBG-Ib的相对表达量变化相似,但对不同药物的响应不同(表2)。3个基因在Bt蛋白Cry1Ab处理下,表达量与阴性和阳性对照组相比差异不显著,而在Bt蛋白Cry1Ac处理下,均显著上调。推测Cry1Ac可能会直接影响台湾乳白蚁的消化代谢过程,纤维素酶可能是其潜在靶标之一,故表达受到显著影响。此外,三个基因表达模式相似,均有纤维素消化功能,在白蚁体内可能共同参与了纤维素的消化过程,提高消化纤维素的效率,为白蚁提供更多的能量。
表2 药剂处理24 h后台湾乳白蚁β-葡萄糖苷酶基因的表达量
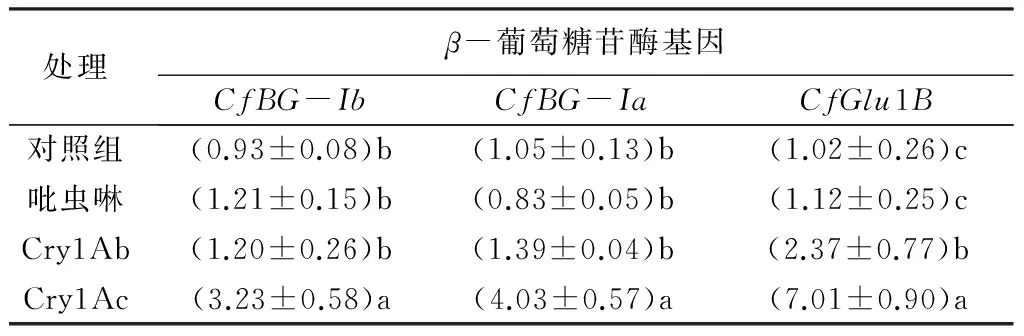
处理β-葡萄糖苷酶基因CfBG-IbCfBG-IaCfGlu1B对照组(0.93±0.08)b(1.05±0.13)b(1.02±0.26)c吡虫啉(1.21±0.15)b(0.83±0.05)b(1.12±0.25)cCry1Ab(1.20±0.26)b(1.39±0.04)b(2.37±0.77)bCry1Ac(3.23±0.58)a(4.03±0.57)a(7.01±0.90)a
注:表中数据为平均值±标准误。数据后同列不同字母表示各基因不同处理间的基因表达量差异显著(P<0.05)。
3 结论
利用RT-PCR方法、序列分析方法、荧光定量表达分析方法等,成功从台湾乳白蚁中筛选出一个新的β-葡萄糖苷酶基因CfBG-Ib,并对新基因的序列、进化地位、胁迫下的表达情况进行了分析,丰富了对白蚁纤维素消化酶体系的认识。本研究的结果主要有:(1)CfBG-Ib基因全长1 966 bp,编码563个氨基酸,具有糖基水解酶家族1的保守结构域,GenBank登录号KY228991;(2)CfBG-Ib在系统进化树上与已知的CfGlu1B和CfBG-Ia同属于进化枝1,推测CfBG-Ib也具有纤维素消化功能,但CfBG-Ib可能更为原始;(3)CfBG-Ib、CfGlu1B和CfBG-Ia在Bt蛋白处理下的基因表达模式相似,其中,在Bt蛋白Cry1Ac处理下显著上调,可能是Cry1Ac的潜在靶标之一。
[1] WATANABE H, TOKUDA G. Animal cellulases[J]. Cell Mol Life Sci,2001,58(9):1167-1178.
[2] WATANABE H, TOKUDA G. Cellulolytic systems in insects[J]. Annu Rev Entomol,2010,55(1):609-632.
[3] OHKUMA M. Termite symbiotic systems: efficient bio-recycling of lignocellulose[J]. Appl Microbiol Biotechnol,2003,61(1):1-9.
[4] PRINS R A, KREULEN D A. Comparative aspects of plant cell wall digestion in insects[J]. Animal Feed Science and Technology,1991,32(1):101-118.
[5] BREZNAK J A. Role of microorganisms in the digestion of lignocellulose by termites[J]. Annual Review of Entomology,1994,39(1):453-487.
[6] ZHANG D, LAX A R, BLAND J M, et al. Characterization of a new endogenous endo-β-1,4-glucanase of Formosan subterranean termite (Coptotermesformosanus)[J]. Insect Biochem Mol Biol,2011,41(4):211-218.
[7] 孙建中,陈春润.昆虫与生物质能源利用:一个新的交叉学科前沿[J].昆虫知识,2010,47(6):1033-1042.
[8] LO N, TOKUDA G, WATANABE H. Evolution and function of endogenous termite cellulases[M]//BIGNELL D E, ROISIN Y, LO N. Biology of termites a modern synthesis. Dordrecht: Springer Netherlands,2010:51-67.
[9] 刘小琳,李志强,张丹丹.白蚁内源性纤维素酶基因资源研究进展[J].生物技术通报,2015(12):25-33.
[10] SINGHA D, SINGHA B, DUTTA B K. In vitro pathogenicity ofBacillusthuringiensisagainst tea termites[J]. Journal of Biological Control,2010,24(3):279-281.
[11] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[12] SHIMADA K, MAEKAWA K. Gene expression and molecular phylogenetic analyses of beta-glucosidase in the termiteReticulitermessperatus(Isoptera: Rhinotermitidae)[J]. J Insect Physiol,2014,65(1):63-69.
[13] KORB J, WEIL T, HOFFMANN K, et al. A gene necessary for reproductive suppression in termites[J]. Science,2009,324:758.DOI:10.1126/science.1170660.
[14] WEIL T, REHLI M, KORB J. Molecular basis for the reproductive division of labour in a lower termite[J]. BMC Genomics,2007,8(1):198.DOI:10.1186/1471-2164-8-198.
[15] ZHANG D, LAX A R, HENRISSAT B, et al. Carbohydrate-active enzymes revealed inCoptotermesformosanus(Isoptera: Rhinotermitidae) transcriptome[J]. Insect Molecular Biology,2012,21(2):235-245.
1)国家自然科学基金项目(31172163);广东省自然科学基金项目(2015A030310429);广州市科技计划项目(201510010036)。
候亚会,男,1990年9月生,东北林业大学林学院,硕士研究生。E-mail:873523206@qq.com。
严善春,东北林业大学林学院,教授。E-mail:yanshanchun@126.com。李志强,广东省动物保护与资源利用重点实验室(广东省生物资源应用研究所),研究员。E-mail:lizq@giabr.gd.cn。
2016年11月23日。
S763.33;Q969.29
责任编辑:程 红。
Gene Cloning and Characterization of aβ-glucosidase Gene fromCoptotermesformosanusShiraki//Hou Yahui, Yan Shanchun(Northeast Forestry University, Harbin 150040, P. R. China); Wu Wenjing, Liu Xiaolin, Li Zhiqiang(Guangdong Key Laboratory of Animal Conservation and Resource Utilization, Guangdong Public Laboratory of Wild Animal Conservation and Utilization, Guangdong Institute of Applied Biological Resources)//Journal of Northeast Forestry University,2017,45(3):96-101.
In order to exploit and utilize cellulose genes ofCoptotermesformosanusShiraki, the cDNA library ofC.formosanuswas constructed by RT-PCR. Based on conserved domains ofβ-1,4-D-glucosidase (BG), degenerate primers were designed to screen for new genes. A novelβ-1,4-D-glucosidase gene was obtained with the full-length of 1 966 bp and an open reading frame of 1 692 bp. The 563-residue mature BG was with a calculated molecular masses of 64.02 kDa, and contained a glycosyl hydrolase family 1 domain. By phylogenetic analysis, the novel BG belongs toβ-glucosidase cluster 1, encoding digestive enzymes, and designated CfBG-Ib. The recombinantβ-glucosidaseCfBG-Ibwas expressed heterologously. Under the stress of Bt protein, the expression pattern ofCfBG-Ibwas similar to those ofCfGlu1BandCfBG-Ia. Three genes were significantly up-regulated in response to Cry1Ac stress, which may be one of the potential targets of Cry1Ac.
