低氧对小鼠腹腔巨噬细胞吞噬能力及氧依赖杀伤功能的影响*
2017-08-07高世兰张晓娜胡方杰李积东蒲小燕
高世兰,张晓娜,胡方杰,李积东,蒲小燕,永 胜
(青海大学医学院,西宁 810001)
低氧对小鼠腹腔巨噬细胞吞噬能力及氧依赖杀伤功能的影响*
高世兰,张晓娜,胡方杰,李积东,蒲小燕,永 胜§
(青海大学医学院,西宁 810001)
目的 探讨低氧对小鼠腹腔巨噬细胞(Mφ)吞噬杀伤能力,IL-6、TNF-α分泌功能的影响。方法 ①用流式细胞仪检测小鼠腹腔Mφ对FITC标记金黄色葡萄球菌的吞噬能力;②用双乙酰基二氯荧光素(DCFH-DA)荧光探针法检测Mφ呼吸爆发功能;③用ELISA试剂盒检测小鼠Mφ培养上清中的NO浓度;④用ELISA试剂盒检测小鼠腹腔Mφ培养上清中的IL-6、TNF-α浓度。结果 低氧暴露30 d后,模拟海拔5000 m实验组小鼠与常氧对照组(海拔400m)相比,小鼠腹腔Mφ吞噬能力、呼吸爆发能力及NO释放量显著降低(P<0.05),细胞培养上清中的IL-6、TNF-α的浓度明显升高(P<0.05)。结论 模拟海拔5000 m低氧暴露30 d后,Mφ的吞噬能力和氧依赖杀伤功能降低,Mφ分泌IL-6、TNF-α的水平升高。说明低氧在一定程度上降低Mφ抗原清除能力并引发炎性反应。
低氧 Mφ 吞噬能力呼吸爆发 NO IL-6 TNF-α
急进高原时,机体免疫功能发生改变,表现为T细胞的重新分布,免疫球蛋白、淋巴细胞增殖及细胞因子分泌水平变化[1-2]。研究发现,模拟海拔8000 m,低氧暴露下的小鼠脾T淋巴细胞增值能力降低,脾CD3+、CD4+、CD8+细胞数减少;大鼠外周血CD4+、CD8+T淋巴细胞活化水平均下降,而B淋巴细胞增殖功能未见明显变化[3]。在低氧环境中培养的T淋巴细胞的成熟延缓,细胞因子的分泌发生改变[4-5]。有关低氧环境对机体免疫损伤的研究是医学热点难点之一,因此有关低氧损伤的免疫机制及其防治措施的研究越来越受到关注。目前有关低氧对机体免疫系统的研究多侧重于淋巴细胞,但对Mφ功能改变的报道甚少。Mφ是参与固有免疫应答的重要细胞,具有吞噬杀伤、抗原提呈、肿瘤抑制、生物活性物质分泌等多种功能[6]。本研究模拟海拔5000 m环境,观察低氧暴露下的小鼠Mφ功能改变,探讨低氧条件对机体固有免疫细胞-Mφ吞噬杀伤以及分泌细胞因子功能的影响,为低氧对固有免疫的影响提供实验依据。
1 材料与方法
1.1动物
健康雄性BALB/c小鼠,4~6周龄,购买于西安交大医学院,合格证号:SCXK(陕2007-001)。
1.2 仪器与试剂
1.2.1 仪器
无菌操作台(ZHJH-C2019C,上海智城分析仪器制造有限公司);CO2培养箱(Thermo Scientific Forma,美国);小型台式离心机(Eppendorf 5148R,德国);酶联免疫检测仪(BIO-RAD xMark,美国);恒温摇床(ZD-85,精达仪器制造厂) ;低压氧舱(DYC-3000,贵州航空风雷军械有限责任公司);流式细胞仪(BD FACS Calibur,美国)。
1.2.2 试剂
脂多糖(LPS,Sigma公司);RPMI-1640(索莱宝公司,北京);PBS 缓冲液(北京索莱宝公司);IL-6、TNF-a、NOELISA试剂盒(TSZ,美国);异硫氰酸荧光素(FITC,ebioscienc美国);双乙酰基二氯荧光素(DCFH-DA,Sigma公司);N-甲酞-甲硫氨酞-亮氨酞苯丙氨酸(fMLP,Sigma公司);豆蔻酰佛波醇乙酷(PMA,Sigma公司)。
1.3 试验方法
1.3.1 低氧动物模型建立
小鼠常规分笼喂养,自由饮水进食,适应性喂养1 w后分两组。低氧实验组小鼠饲养于青海大学医学院高原医学中心低压氧舱(模拟海拔5000m),常氧对照组小鼠饲养于西安交大医学院常规动物室(海拔400m),两组小鼠在18 ℃~22 ℃室温条件下分笼喂养30 d。
1.3.2 Mφ吞噬能力检测
1.3.2.1 小鼠腹腔Mφ制备:参照文献方法[7],分离获取腹腔Mφ(细胞浓度调整至1×106个/mL)。
1.3.2.2 FITC标记细菌的制备:参照文献方法[8](细胞浓度调整至1×106个/mL)。
1.3.2.3 吞噬能力检测:参照文献方法[8],细胞用流式细胞仪检测,用 FITC标记细胞的阳性细胞百分率表示Mφ吞噬率,阳性细胞平均荧光强度(x-Mean)代表Mφ吞噬能力(吞噬指数)[9],每个样本均检测10000个细胞。
1.3.3 Mφ呼吸爆发检测
1.3.3.1 探针DCFH-DA装载:参照文献方法[8](细胞浓度调整至1×106个/mL)。
1.3.3.2 呼吸爆发能力检测:参照文献方法[8],用FL1直方图阳性细胞平均荧光强度(x-Mean)表示ROS水平(图1)[10]。
1.3.4 小鼠Mφ培养上清中的NO水平检测
将1×106个/mL Mφ细胞悬液接种于96孔细胞培养板(100μL/孔),每孔加入100 μL LPS (5、10、20、40μg/mL,设未刺激对照组),于37 ℃、5%CO2培养箱中培养48 h后,用NO检测试剂盒检测细胞培养上清。检测严格按试剂盒说明书进行。
1.3.5 小鼠Mφ培养上清中IL-6、TNF-α的释放水平检测
将1×106个/mL Mφ细胞悬液接种于96孔细胞培养板(100μL/孔),每孔加入100 μL LPS(终浓度为10μg/mL)于37 ℃、5%CO2培养箱中培养48 h后,用IL-6、TNF-α试剂盒检测细胞培养上清。检测严格按试剂盒说明书进行。
1.4 统计学方法
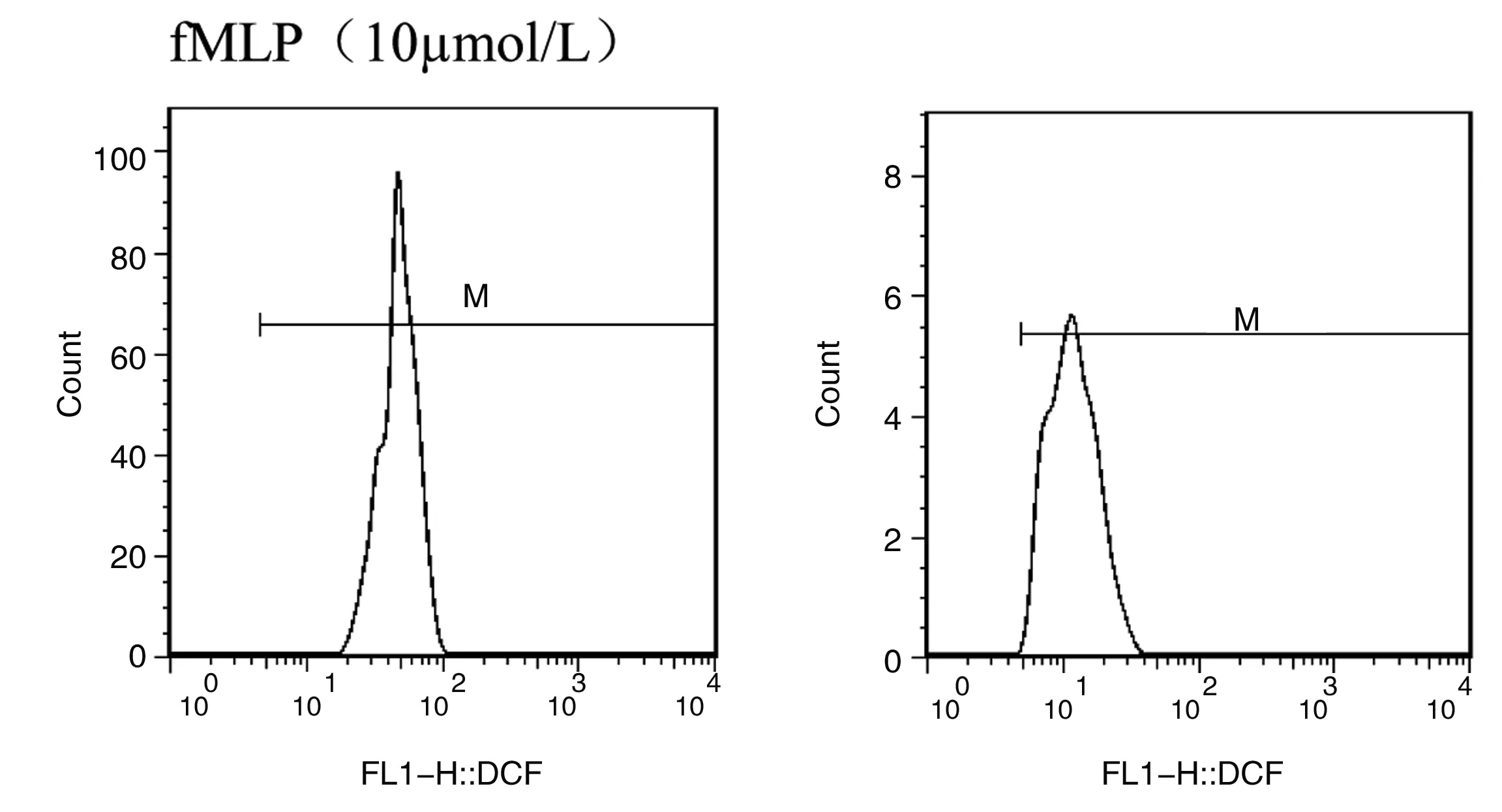
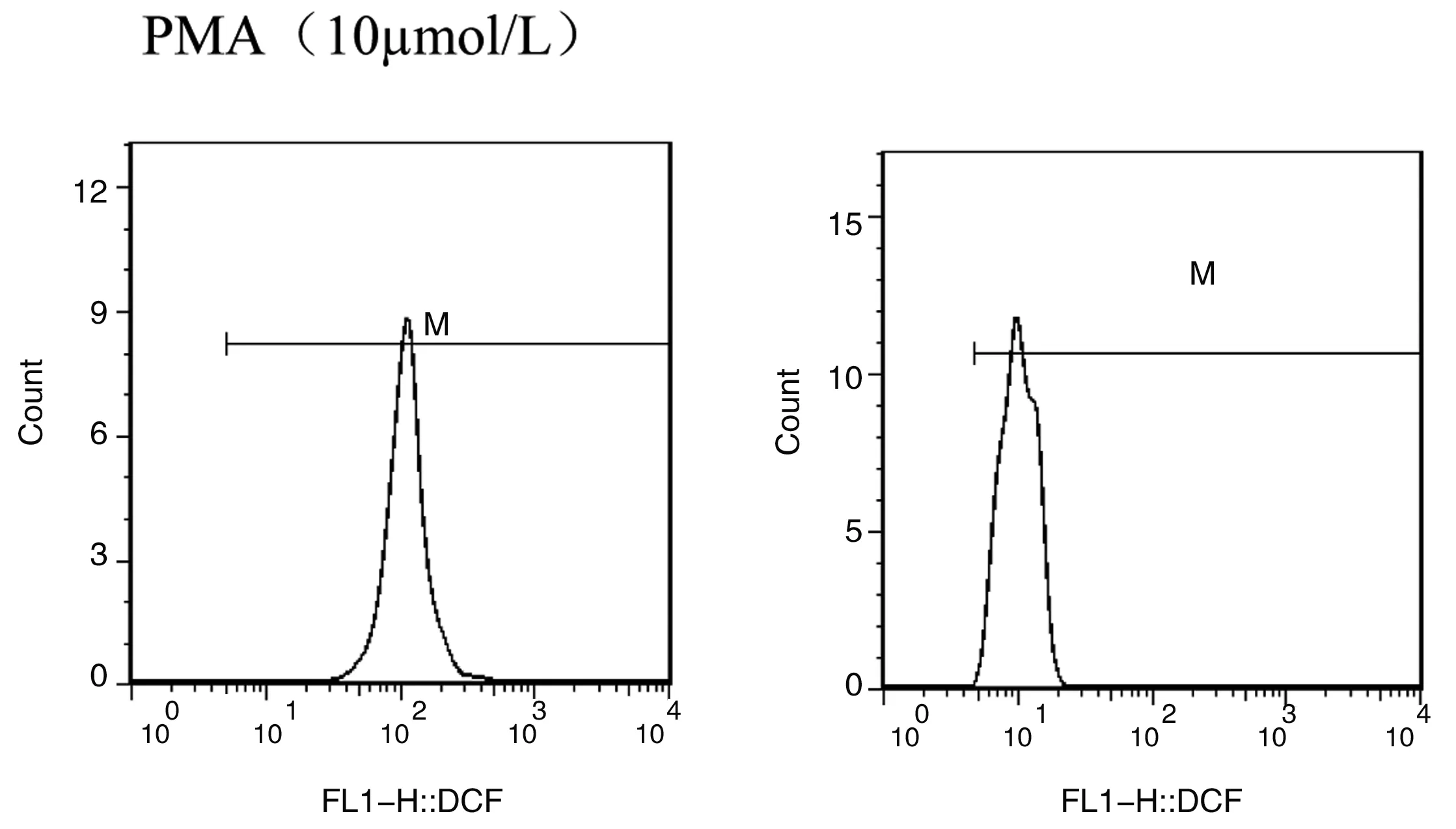
常氧组 低氧组
Figure 1 Influence of hypoxia on peritoneal macrophages respiratory burst in mice
2 结果
2.1 低氧对Mφ吞噬能力的影响
低氧(模拟海拔5000m)下暴露小鼠30 d后,与常氧对照组相比,低氧组小鼠腹腔Mφ的吞噬率以及吞噬指数显著降低(P<0.01),说明低氧暴露致使小鼠Mφ吞噬抗原异物功能降低。数据详见表1。

Table 1 Influence of hypoxia on peritoneal macrophages phagocytosis in ±s)
2.2 低氧对Mφ呼吸爆发功能的影响
低氧(模拟海拔5000m)下暴露小鼠30 d后,与常氧对照组相比,低氧实验组小鼠腹腔Mφ呼吸爆发水平显著降低(P<0.01),说明低氧暴露使小鼠腹腔Mφ氧依赖杀伤功能降低。组内比较,刺激物fMLP、PMA浓度为0.1~10 μmo1/L时与未加刺激物比较,小鼠腹腔Mφ呼吸爆发水平显著升高(P<0.01);刺激物fMLP、PMA浓度为1~10 μmo1/L时与0.1 μmo1/L比较,小鼠腹腔Mφ呼吸爆发水平显著升高(P<0.01);刺激物fMLP、PMA浓度为10 μmo1/L时与1 μmo1/L比较,小鼠腹腔Mφ呼吸爆发水平显著升高(P<0.01)。说明随着刺激物浓度的增加,小鼠腹腔Mφ呼吸爆发水平也随之升高。数据详见表2、3。

Table 2 Influence of hypoxia on peritoneal macrophages respiratory burst in ±s)
*:compared with 0 μmo1/L groupP<0.01;#,compared with 0.1 μmo1/L groupP<0.01;△,compared with 1 μmo1/L groupP<0.01.
Table 3 Influence of hypoxia on peritoneal macrophages respiratory burst in ±s)
*:compared with 0 μmo1/L groupP<0.01;#,compared with 0.1 μmo1/L groupP<0.01;△,compared with 1 μmo1/L groupP<0.01.
2.3 低氧对LPS诱导的小鼠腹腔MφNO产生的影响
低氧(模拟海拔5000m)下暴露小鼠30 d后,与常氧对照组相比,低氧实验组小鼠腹腔Mφ培养上清中NO的浓度显著降低(P<0.01),说明低氧暴露使小鼠腹腔Mφ氧依赖杀伤功能降低。组内比较,刺激物LPS浓度为(5~40)μg/mL时与未加刺激物比较,小鼠腹腔Mφ培养上清中NO的浓度显著增加(P<0.01);刺激物LPS浓度为(10~40)μg/mL时与5 μg/mL比较,小鼠腹腔Mφ培养上清中NO的浓度显著增加(P<0.01);刺激物LPS浓度为(20~40)μg/mL时与10 μg/mL比较,小鼠腹腔Mφ培养上清中NO的浓度显著增加(P<0.01);刺激物LPS浓度为40 μg/mL时与20 μg/mL比较,小鼠腹腔Mφ培养上清中NO的浓度显著增加(P<0.01)。说明随着刺激物浓度的增加,小鼠腹腔Mφ培养上清中NO的浓度也随之增加。数据详见表4。
*:compared with 0 μg/mL groupP<0.01;#,compared with 5 μg/mL groupP<0.01;△,compared with 10 μg/mL groupP<0.01;□,compared with 20 μg/mL groupP<0.01.
2.4 低氧对Mφ分泌IL-6、TNF-α的影响
低氧(模拟海拔5000m)下暴露小鼠30 d后,与常氧对照组相比,低氧实验组小鼠腹腔Mφ培养上清中IL-6、TNF-α的浓度显著上升(P<0.01)。说明模拟海拔5000 m低氧暴露可使小鼠Mφ分泌细胞因子的能力发生改变。组内比较,刺激物LPS浓度为10 μg/mL时与未加刺激物比较,小鼠腹腔Mφ培养上清中IL-6、TNF-α的浓度显著增加(P<0.01)。数据详见表5。
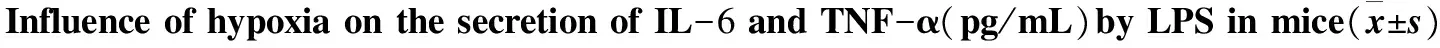
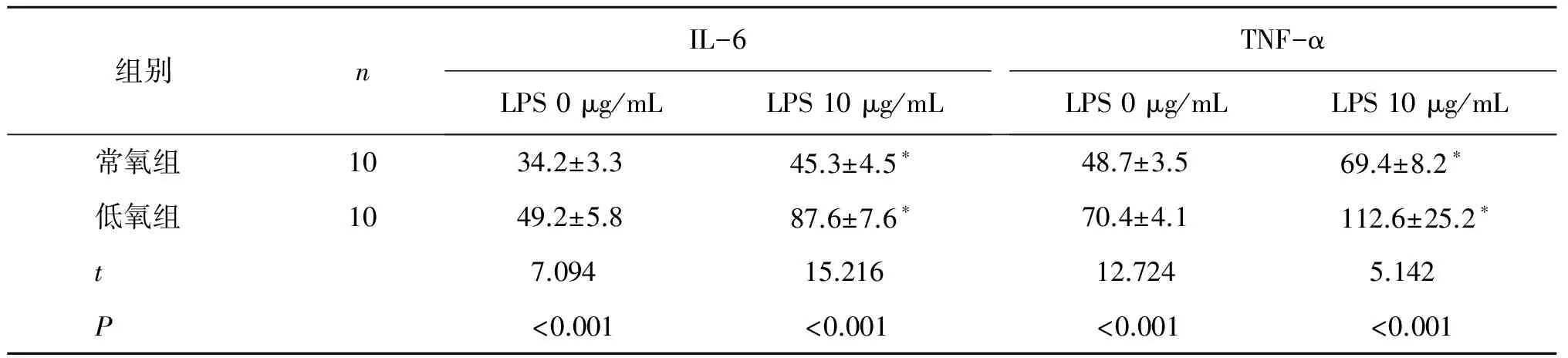
组别nIL-6LPS0μg/mLLPS10μg/mLTNF-αLPS0μg/mLLPS10μg/mL常氧组1034.2±3.345.3±4.5∗48.7±3.569.4±8.2∗低氧组1049.2±5.887.6±7.6∗70.4±4.1112.6±25.2∗t7.09415.21612.724 5.142P<0.001<0.001<0.001 <0.001
*:compared with 0 μg/mL groupP<0.01.
3 讨论
研究表明,低氧应激造成免疫功能稳态的破坏,出现免疫抑制、机体易感性增加[1,11-12]。据文献报道,高原肺水肿患者外周血中白细胞和中性粒细胞明显增高,并且血浆肿瘤坏死因-α(TNF-α)、IL-6、内皮素-1(ET-1)、CRP含量亦显著增高[13-14]。重症急性高原病患者的肿瘤坏死因子-α(TNF-α)、IL-1、IL-2、IL-6、IL-8含量均明显高于高原健康人群[15]。以上研究说明低氧可导致机体的防御功能受损。固有免疫系统是机体防御病原体侵袭的第一道防线,固有免疫细胞能吞噬、分解生物大分子,杀灭病原体。Mφ是固有免疫应答中重要的细胞成分,具有吞噬杀伤病原体、提呈抗原、分泌细胞因子及抑制肿瘤等多种功能,构成了机体非特异防御的主要基础[16]。Mφ通过其表面抗原识别受体(如Fc受体)识别抗原异物并促进其吞噬[17],吞入细胞内的抗原异物通过 “呼吸爆发”产生大量活性氧(ROS,reactive oxygen species)这类高活性的杀菌物质清除[18],另外活化的Mφ所产生的诱导型NO合成酶(iNOS)可催化L-精氨酸与氧分子反应产生一氧化氮(nitric oxide,NO),NO与过氧化氢(H2O2)或过氧化物酶结合产生过亚硝酸盐基,杀伤清除细菌。有研究表明,高原低氧可使人外周血中性粒细胞NADPH活性降低,从而影响其免疫功能[19]。据文献报道,低氧抑制MφNADPH 氧化酶的活性[20]。另外,低氧导致Mφ的吞噬能力降低[21-22],清除金黄色葡萄球菌的功能受到抑制[23]。Mφ分泌IL-6、TNF-α等多种细胞因子,参与炎症的发生和发展[24]。低氧可引起高原人群血清中IL-6、TNF-α的上升[25]。研究表明,肺动脉高压大鼠模型中,低压低氧致使大鼠血清中TNF-α、IL-6分泌增加[26]。据报道,活化的Mφ可分泌IL-6、TNF-α促炎症因子而引起广泛的组织损伤、多器官炎性反应[6,27]。研究发现TNF-α具有活化Mφ、增强Mφ杀伤功能、提高中性粒细胞吞噬能力及增强NK细胞的细胞毒作用[16]。本实验在低氧暴露下,用fMLP、PMA作为刺激剂,观察Mφ吞噬杀伤功能变化;用LPS作为Mφ的刺激剂,观察Mφ分泌炎性因子IL-6、TNF-α以及NO的情况,结果发现模拟海拔5000 m高原低氧暴露30 d后,小鼠腹腔Mφ吞噬能力及氧依赖杀伤功能明显低于常氧对照组,而分泌IL-6、TNF-α水平显著高于对照组。相同浓度刺激物LPS作用下,NO的分泌水平随着刺激浓度的增加而增加。
本研究显示,模拟海拔5000 m低氧暴露可导致小鼠腹腔Mφ吞噬杀伤功能降低、分泌细胞因子能力增加,使清除抗原能力降低,引发炎性反应,抑制Mφ免疫功能。
[1]FACCO M,Zilli C,Siviero M,et al.Modulation of Immune Response by the Acute and Chonic Exposure to HinghAltitude[J].Med.Sci.Sports Exerc.2005,37(5):768-74.
[2]Shephard RJ.Immune changes induced by exercise in an adverse environment[J].Can J Physiol Pharmacol,1998,76(5):539-46.
[3]田云梅.高原低氧免疫损伤及其干预措施的研究[D].中国人民解放军军事医学科学院,2009.
[4]Caldwell CC,Kojima H,LukashevD,etal.Differential effects of physiologically relevant hypoxic conditions on T lymphocyte development and effector functions[J].J Immunol,2001,167(11):6140-49.
[5]黄庆愿,张国斌,曹利飞,等.急性低氧和腺苷对大鼠脾脏T淋巴细胞增殖的影响[J].中国应用生理学杂志,2004,03:7-10.
[6]张翠萍,谢印芝,陈鹏,等.低氧对巨噬细胞分泌TNF-α和IL-6的影响及其机制[J].中国应用生理学杂志,2005,21(3):281-4.
[7]程安玮,金征宇,万发春.甘草多糖对小鼠腹腔巨噬细胞NO、iNOS及iNOS mRNA表达的影响[J].食品科学,2009,21:351-4.
[8]永胜,蒲小燕,高翔,等.慢性高原红细胞增多症患者中性粒细胞吞噬能力及呼吸爆发功能[J].青海医学院学报,2012,33(4):224-9.
[9]金齐力,姜丽娜,姚春艳,等.流式细胞术检测单核巨噬细胞吞噬荧光素结核分枝杆菌的方法学探讨[J].蚌埠医学院学报,2008,33(5):505-8.
[10]ImrichA,KobzikL.Flowcytometric analysis of macrophage oxidative metabolism using[J].Methods Mol Biol,1998,91:97-108.
[11]KolA,Zarember,HarryL,et al.HIF-1α:a master regulator of innate host defenses[J].J ClinInvest,2005,115(7):1702-4.
[12]StaatsR,BalkowS,SorichterS,et al.Change in perforin-positive peripheral blood lymphocyte(PBL)subpopulations following exercise[J].ClinExp Immunol,2000,120(3):434-9.
[13]帅鹏,陈浩,陈露.急性高原肺水肿血浆TNF-α、IL-6、ET-1的变化及临床意义[J].西藏科技,2004,132(4):40-41+45.
[14]牟信兵,汤红亚,洪青元,等.急性高原病患者血清和支气管肺泡灌洗液炎性反应物的改变[J].中国应用生理学杂志,2003,19(4):327.
[15]周其全,刘福玉,高钰琪,等.白细胞与白细胞介素增高在急性高原病并发多器官功能障碍中的作用及临床意义[J].中国危重病急救医学,2007,19(10):588-9.
[16]荣岳光.苜草素对小鼠巨噬细胞NO、IL-6、TNF-α分泌的影响及其机理研究[D].中国农业科学院,2007.
[17]于一,郭艳茹,岳旭,等.巨噬细胞的FC受体及其与吞噬功能的关系[J].细胞生物学杂志,1991,13(3):110-114.
[18]SAWYERDW,DONOVITZ G R,MA NDELL G L,et al.Polymorphonuclearneutrophils:an effective antimicrobial force[ J].Rev Infect,1989,11:1532-44.
[19]永胜,双杰,芦殿香,等.高原红细胞增多症患者中性粒细胞[Ca~2+]i及NADPH氧化酶活性变化[J].山东医药,2013,35:5-8.
[20]AlbinaJE,Henry WL Jr,MastrofrancescoB,et al.Macrophage activation by culture in an anoxic environment[J].J Immunol,1995,155(9):4391-6.
[21]Leeper-Woodford SK,MillsJW.Phagocytosis and ATP levels in alveolar macrophages during acute hypoxia[J].Am J Respir Cell Mol Biol,1992,6(3):326-34.
[22]LindertKA,Caldwell-KenkelJC,NukinaS,et al.Activation of Kupffer cells on reperfusion following hypoxia:particle phagocyte-sis in a low-flow,reflow model[J].Am J Physiol,1992,262(21):345-50.
[23]J nssonK,HuntTK,MathesSJ.Oxygen as an isolated variable influences resistance to infection[J].Ann Surg,1988,208(6 ):783-7.
[24]许国根,陈雯,张万光,等.全身炎症反应综合征患者致炎因子与抗炎因子的变化及相关性研究[J].中国急救医学,2002,22(6):320-1.
[25]崔建华,张西洲,何富文,等.健康青年进驻高原血清TNF-α和IL-6的变化[J].西北国防医学杂志,1999,120(3):197-8.
[26]孟宁.间歇性低压低氧对大鼠肺动脉高压预防作用的免疫调节机制[D].河北医科大学,2015.
[27]Marino M W,DunnA,GrailD,etal.Characterization of tumor necrosis facror-deficient mice[J].ProcNatlAcadSci USA,1997,94(15):8093-8.
Effects of Plateau Hypoxia on Phagocytosis and Oxygen-dependent Catalyticactivity of Peritoneal Macrophages in Mice
GAO Shi-lan,ZHANG Xiao-na,HU Fang-jie,LI Ji-dong,PU Xiao-yan,YONG Sheng§
(Qinghai University Medical College,Xining,810001,China)
Objective To explore the influences of hypoxia on the phagocytosis and cytolyticactivity as well as secretion variation of Interleukin-6(IL-6)and Tumor Necrosis Factor-α(TNF-α)of peritoneal macrophages in mice.Methods (1)Using flow cytometry to detect the phagocytosis and cytolyticactivity of peritoneal macrophages to staphylococcus aureus marked with fluorescein isothiocyanate(FITC).(2)The respiratory burst level of the cultured macrophage in mice was detected with 2′,7′-dichlorodihydrofluorescein diacetate(DCFH-DA)fluorescent probe method.(3)The concentration of nitric oxide(NO)of the cultured macrophage supernatant in mice was determined with ELISA kits.(4)The concentration of IL-6 and TNF-α of the cultured macrophage supernatant in mice was also measured with ELISA kits.Results Compared with the normoxic control group(400m),the hypoxia group(5000m)exposed under simulated altitude of 5000 m for 30 days,all of the phagocytosis,respiratory burst level and NO release decreased(P<0.05),while the concentration of IL-6 and TNF-α in the Mφ supernatant of the hypoxia group were significantly increased(P<0.05).Conclusion After exposed to hypoxia at simulated altitude of 5000 m for 30 days,the phagocytosis and cytolyticactivity of mice are suppressed and the cytokines secretion level of IL-6 and TNF-α in Mφ are increased.It suggests that plateau hypoxia can suppress the antigen clear functions of Mφ and induce inflammatory reactions in mice.
Hypoxia Macrophages Phagocytosis Respiratory burst IL-6 TNF-α
﹡:国家自然科学基金项目(81060249);青海省应用基础研究计划项目(2014-ZJ-715,2015-ZJ-741);§:通信作者,博士,副教授,E-mail:yongsheng@qhu.edu.cn 高世兰(1992~),女,藏族,青海籍,免疫学在读硕士研究生
R392
A
10.13452/j.cnki.jqmc.2017.02.008
2016-11-09
