蓝靛果多酚冻干粉稳定性及其总抗氧化能力研究
2017-07-31宫彦龙朱速松
雷 月,宫彦龙,朱速松,李 斌
(1.贵州省水稻研究所,贵州贵阳 550006;2.沈阳农业大学食品学院,辽宁沈阳 110866)
蓝靛果多酚冻干粉稳定性及其总抗氧化能力研究
雷 月1,2,宫彦龙1,朱速松1,李 斌2,*
(1.贵州省水稻研究所,贵州贵阳 550006;2.沈阳农业大学食品学院,辽宁沈阳 110866)
对采自长白山的蓝靛果忍冬冻果经提取、纯化,并制成蓝靛果多酚冻干粉,研究pH、光照、温度、氧化剂H2O2、还原剂Na2SO3、防腐剂苯甲酸钠和葡萄糖、蔗糖、D-果糖对蓝靛果多酚冻干粉稳定性的影响,并通过总抗氧化能力(Total Antioxidant Capacity,T-AOC)测试,进一步分析了蓝靛果多酚冻干粉在不同条件下的抗氧化活性。结果表明:蓝靛果多酚在pH为2和3、低温避光条件下保存效果较好,蓝靛果多酚耐还原能力比耐氧化能力强,防腐剂苯甲酸钠对蓝靛果多酚稳定性无显著影响(p>0.05),糖的加入有助于多酚保存率的提高,使其稳定性增强;通过总抗氧化能力(T-AOC)测试发现,在pH为2、3时,蓝靛果多酚的总抗氧化能力明显高于其他受试pH范围(p<0.05),温度、光照对蓝靛果多酚抗氧化活性的影响存在显著性差异(p<0.05),添加氧化剂H2O2会降低多酚的抗氧化活性,添加不同质量浓度的糖类对蓝靛果多酚抗氧化活性的影响显著(p<0.05)。
蓝靛果,多酚,稳定性,总抗氧化能力
蓝靛果忍冬(LoniceraCaeruleaL.)简称蓝靛果,俗称黑瞎子果、羊奶子等,是一种皮薄多汁、色素含量较高且营养丰富的新兴野生浆果资源,具有较强的环境适应能力[1-3]。蓝靛果果实为紫黑色长椭圆形,其味道类似于越蔓橘、蓝莓,呈酸甜味且含有种类多样的矿物质、微量元素及维生素等营养物质,其中维生素C含量约为苹果的十倍以上,其碳水化合物中以葡萄糖的含量最高,故又称之为“第三代水果”[4-7]。蓝靛果所含生物活性成分的种类和含量均较丰富,特别是多酚组分作为一种潜在新颖、安全无毒的物质备受广大科研工作者的关注,已有相关研究报道多酚类物质具有多种生物学特性,包括抗氧化活性[8-10],抗菌作用[11-12]、抗炎作用[13-14]、预防癌症[15-16]以及预防缺血性心脏病[17]等生理功效。
多酚物质性质不稳定,除受其自身结构的影响外,还受pH、光照、温度等多种理化因素的影响,特别是经提取纯化后获得的多酚物质极易发生降解而改变其性质,导致稳定性更难控制,限制了其在生产和深加工过程中的普遍应用。因此,如何控制和提高多酚的稳定性,使其得到合理的开发利用并应用于更多的生产领域是当前的研究重点。近几年,国内外对浆果中花色苷稳定性的研究已有一定的报道,例如,Augustine[18]等人和Daniela F[19]等人分别对葡萄皮和野生蓝莓中的花色苷稳定性进行了相关研究,刘敬华[2]和张冬雪[20]等人考察了蓝靛果花色苷的稳定性和抗氧化性,均发现花色苷在低温避光条件下稳定性较好,同时还探讨了金属离子、食品添加剂等因素影响花色苷保存效果的趋势变化。对于浆果中多酚稳定性方面的研究,当前主要涉及的有荔枝多酚[21]、苹果多酚及其果皮和果肉多酚[22-24]等稳定性研究的相关报道,但是对蓝靛果多酚稳定性和总抗氧化能力的研究尚未见报道。本实验对采自长白山的蓝靛果忍冬冻果经提取、纯化,并通过真空冷冻干燥后制成蓝靛果多酚冻干粉,系统地考察了pH、光照、温度等因素对提纯后的蓝靛果多酚稳定性的影响,并在此影响因素条件下研究蓝靛果多酚的总抗氧化能力,旨在为蓝靛果在食品领域中更好的生产应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
蓝靛果忍冬 采自吉林省长白山,将已成熟且无机械损伤的蓝靛果果实经清洗沥水后,于沈阳农业大学食品实验室-80 ℃超低温冰箱冻藏。
福林-酚试剂、没食子酸标准品、XAD-7型大孔树脂 美国Sigma公司;无水乙醇、95%乙醇、盐酸、氢氧化钠、无水碳酸钠、柠檬酸、磷酸氢二钠、过氧化氢、亚硫酸钠、苯甲酸钠、葡萄糖、蔗糖、D-果糖 国药集团化学试剂有限公司;总抗氧化能力(Total Antioxidant Capacity,T-AOC)试剂盒 南京建成生物工程研究所。
JYL-C012九阳榨汁机 九阳股份有限责任公司;电子分析天平、PHS-3C型pH计 北京赛多利斯科学仪器有限公司;SB 25-12 DTN超声波清洗机(超声波功率500 W) 宁波新芝生物科技股份有限公司;HWS24型电热恒温水浴锅 常州国华电器有限公司;真空泵 巩义市予华仪器有限责任公司;旋转蒸发仪、层析柱(1.8 cm×30 cm) 上海亚荣生化仪器厂;HL-2恒流泵 上海沪西分析仪器厂有限公司;FD5-3P型真空冷冻干燥机 西盟公司;UV-1600型紫外可见分光光度仪 北京瑞利分析仪器公司;BCD-186KB型冰箱 青岛海尔电器有限公司。
1.2 实验方法
1.2.1 蓝靛果多酚提取液的制备 参考李斌[25]等人的方法制备蓝靛果多酚粗提液,并将制得的蓝靛果多酚粗提液置于-20 ℃保存,备用。
1.2.2 蓝靛果多酚冻干粉的制备 参考李斌[26]等人的方法制备蓝靛果多酚冻干粉,避光备用。
1.2.3 蓝靛果多酚含量的测定 蓝靛果多酚含量的测定采用福林-酚法,具体操作参考李斌[25]等人的方法。
式(1)
式中:X-样品中多酚的含量(mg/g);C-根据标准曲线方程计算出待测液中多酚的质量浓度(mg/mL);V-待测液体积(mL);N-稀释倍数;m-样品质量(g)。
1.2.4 蓝靛果多酚稳定性的研究
1.2.4.1 pH对蓝靛果多酚稳定性的影响 配制pH为2、3、4、5、6、7、8的柠檬酸-磷酸氢二钠缓冲溶液,准确称量蓝靛果多酚冻干粉配成一定浓度的蓝靛果多酚溶液,并精确量取7份体积均为10 mL蓝靛果多酚溶液,分别用上述配制好的相应pH缓冲溶液定容到50 mL,将不同pH的多酚缓冲溶液于室温暗处放置5 h,每隔1 h取样测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析pH对蓝靛果多酚稳定性的影响。
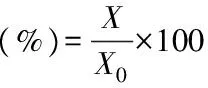
式(2)
式中:X为处理后多酚含量(mg/g);X0为处理前多酚含量(mg/g)。
1.2.4.2 温度对蓝靛果多酚稳定性的影响 准确称取蓝靛果多酚冻干粉配成一定浓度的蓝靛果多酚溶液,并精确量取8份体积均为10 mL蓝靛果多酚溶液,用缓冲溶液(pH3)定容至50 mL,分别置于0 ℃(冰水浴)、4 ℃(冰箱冷藏)以及25、30、50、70、90、100 ℃(恒温水浴)条件下,避光处理5 h,且同一温度下每隔1 h取样于室温状态下测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析温度对蓝靛果多酚稳定性的影响。
1.2.4.3 光照对蓝靛果多酚稳定性的影响 准确称取蓝靛果多酚冻干粉配成一定浓度的蓝靛果多酚溶液,并精确量取4份体积均为10 mL蓝靛果多酚溶液,用缓冲溶液(pH3)定容至50 mL,将待测液在室温下分别在室内避光、室内自然光、室外自然光、紫外光灯条件下处理5 h,且同一光照条件下每隔1 h取样测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析光照条件对蓝靛果多酚稳定性的影响。
1.2.4.4 氧化剂对蓝靛果多酚稳定性的影响 选用H2O2作为氧化剂,准确称取蓝靛果多酚冻干粉配制成一定质量浓度的蓝靛果多酚溶液,并精确量取5份体积均为10 mL蓝靛果多酚溶液,依次加入质量浓度分别为0、0.5%、1%、1.5%、2%的H2O2溶液,用缓冲溶液(pH3)定容至50 mL,将待测液于室温避光处放置5 h,且同一H2O2质量浓度下每隔1 h取样测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析氧化剂H2O2对蓝靛果多酚稳定性的影响。
1.2.4.5 还原剂对蓝靛果多酚稳定性的影响 选用Na2SO3作为还原剂,准确称取蓝靛果多酚冻干粉配制成一定质量浓度的蓝靛果多酚溶液,并精确量取5份体积均为10 mL蓝靛果多酚溶液,依次加入质量浓度分别为0、0.05%、0.1%、0.15%、0.2%的Na2SO3溶液,用缓冲溶液(pH3)定容至50 mL,将待测液于室温避光处放置5 h,且同一Na2SO3质量浓度下每隔1 h取样测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析还原剂Na2SO3对蓝靛果多酚稳定性的影响。
1.2.4.6 食品防腐剂对蓝靛果多酚稳定性的影响 选用苯甲酸钠(食品级)作为防腐剂,准确称取蓝靛果多酚冻干粉配制成一定质量浓度的蓝靛果多酚溶液,并精确量取5份体积均为10 mL蓝靛果多酚溶液,依次加入质量浓度分别为0、0.01%、0.05%、0.1%、0.15%的苯甲酸钠溶液,用缓冲溶液(pH3)定容至50 mL,将待测液于室温避光处放置5 h,且同一苯甲酸钠质量浓度下每隔1 h取样测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析防腐剂苯甲酸钠对蓝靛果多酚稳定性的影响。
1.2.4.7 糖类对蓝靛果多酚稳定性的影响 准确称取蓝靛果多酚冻干粉配成一定浓度的蓝靛果多酚溶液,并精确量取15份体积均为10 mL蓝靛果多酚溶液,分3组,分别加入不同质量浓度的葡萄糖、蔗糖、D-果糖溶液,其质量浓度依次设定为0、10%、20%、30%、40%、50%,用缓冲溶液(pH为3)定容至50 mL,将待测液于室温避光处放置5 h,且同一种糖质量浓度下每隔1 h取样测定蓝靛果多酚含量,计算其多酚保存率,设3次重复,取其平均值,比较分析糖类对蓝靛果多酚稳定性的影响。
1.2.5 蓝靛果多酚总抗氧化能力(T-AOC)测定 采用T-AOC试剂盒测定。按照试剂盒上的操作方法进行测定,将试剂1、试剂2和试剂3按照1∶2∶0.5的比例配制成混合试剂;取两支试管分别标记为空白管和测定管,先向测定管中加入样液1.0 mL,再分别向两支试管中加入3.5 mL配好的混合试剂,充分混合均匀,37 ℃水浴30 min,接着分别向两支试管中加入试剂4各0.1 mL,向空白管中加入样液1.0 mL,最后混匀,放置10 min,在520 nm波长,1 cm光径下,用去离子水调零并采用紫外分光光度计测吸光度值。T-AOC单位为U,按如下公式计算:
式(3)
式中:Ac为测定管吸光度值;A0为空白管吸光度值;V总为反应液总体积mL;V为取样量mL;n为样品测试前稀释倍数。
1.3 数据处理与统计分析
通过Excel 2003整理实验数据,并应用统计分析软件SPSS 17.0对数据进行单因素方差分析、多重比较分析,结果以平均数±标准差(n=3)表示,显著性水平为p<0.05,极显著水平为p<0.01。
2 结果与分析
2.1 蓝靛果多酚稳定性的研究
2.1.1 pH对蓝靛果多酚稳定性的影响 由图1可知,不同pH对蓝靛果多酚稳定性影响有显著性差异(p<0.05)。随着pH的增大和各pH处理时间的延长,蓝靛果多酚保存率逐渐降低,即多酚稳定性逐渐减弱。总体而言,当pH为2、3时,蓝靛果多酚的保存率明显高于其他受试pH条件(p<0.05),且随处理时间的延长,多酚保存率的变化不显著(p>0.05),稳定性较好,5 h后其保存率仍然高达87%以上。相对于pH2、3而言,当pH在4~8之间,随着处理时间的延长,蓝靛果多酚保存率呈急剧降低的趋势,且在pH8处理5 h后,多酚保存率降至54.61%。这可能是因为蓝靛果多酚结构中含有大量的酚羟基,在酸性条件下其结构较为稳定,而在碱性环境中易与碱发生作用,形成不稳定的醌式碱形结构,稳定性变差[27]。因此,蓝靛果多酚应在pH为2、3的条件下保存较佳。
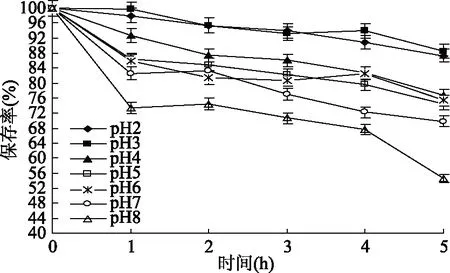
图1 pH对蓝靛果多酚稳定性的影响Fig.1 Effect of pH value on the stability of polyphenols
2.1.2 温度对蓝靛果多酚稳定性的影响 由图2可知,随着温度的逐渐升高和各温度处理时间的延长,蓝靛果多酚的保存率呈下降趋势,多酚稳定性减弱。当温度在70~100 ℃范围时,随着热处理时间的延长,蓝靛果多酚保存率的下降趋势较0~50 ℃范围的显著(p<0.05),这可能是因为高温长时处理会使蓝靛果多酚的结构受到破坏并发生降解反应,故其保存率降低[28],而当受试温度在0~4 ℃范围时,随着处理时间的延长,蓝靛果多酚的保存率无显著变化(p>0.05),5 h后其保存率仍高达90%以上,这是因为低温条件可抑制酚氧化酶的活性,从而降低了蓝靛果多酚的氧化、缩合及降解速率,故其保存率相对较高,稳定性较好[29]。由统计分析结果表明:温度对蓝靛果多酚稳定性的影响显著(p<0.05)。
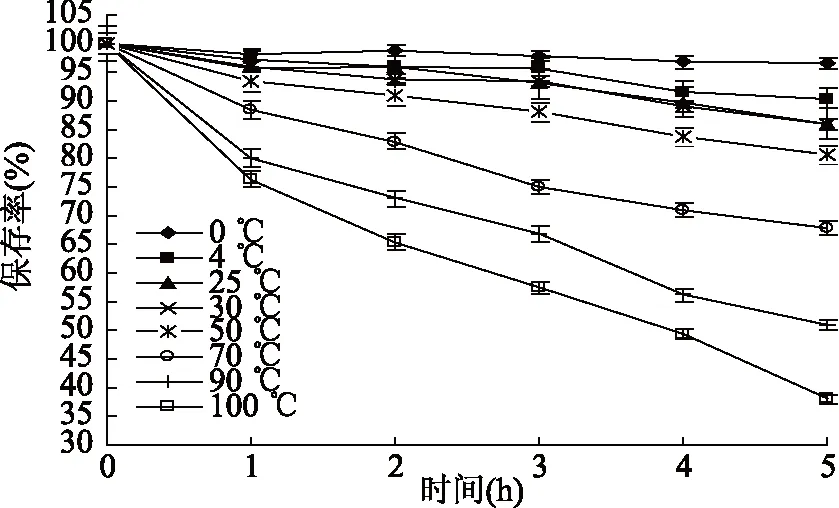
图2 温度对蓝靛果多酚稳定性的影响Fig.2 Effect of temperature on the stability of polyphenols
2.1.3 光照对蓝靛果多酚稳定的影响 由图3可知,在避光和室内自然光条件下,蓝靛果多酚的保存率随处理时间的延长而逐渐降低,5 h后其多酚保存率分别为92.84%和85.28%,稳定性相对较好,而在室外自然光和紫外光条件下,随着处理时间的延长,蓝靛果多酚的保存率呈急剧下降的趋势,5 h后其多酚保存率分别降至62.75%和46.15%,这可能是因为蓝靛果多酚的光敏感性较强,在室外自然光和紫外光条件下会使多酚的降解速率加快,稳定性变差[30]。统计分析结果表明:不同光照条件对蓝靛果多酚稳定性有显著性影响(p<0.05),故蓝靛果多酚应在避光条件下保存。
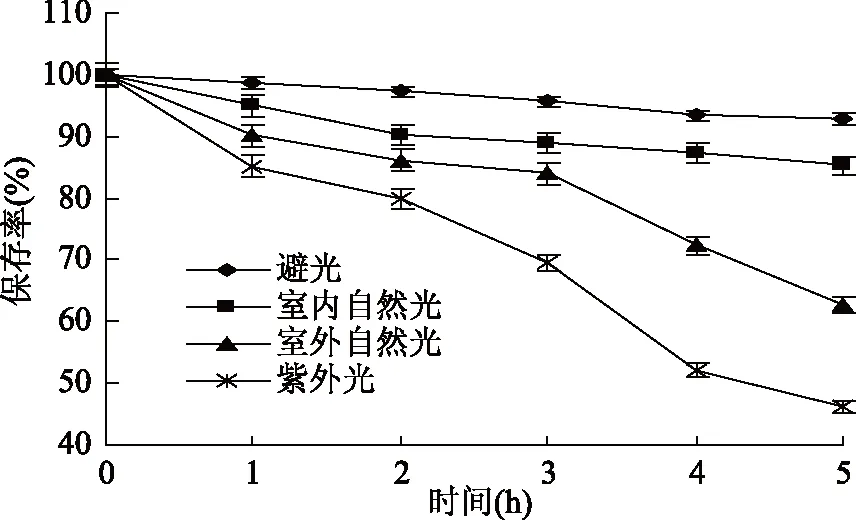
图3 光照对蓝靛果多酚稳定性的影响Fig.3 Effect of light on the stability of polyphenols
2.1.4 氧化剂H2O2对蓝靛果多酚稳定性的影响 由图4可知,与对照组相比,加入H2O2后蓝靛果多酚的保存率均明显降低。当H2O2质量浓度为0.5%时,处理5 h后蓝靛果多酚保存率降至80.03%,而当H2O2质量浓度增加到2.0%时,处理5 h后蓝靛果多酚保存率降至33.76%,多酚稳定性较差,说明氧化剂H2O2对蓝靛果多酚具有强烈的破坏作用,即蓝靛果多酚耐氧化性较差。高凝轩等[31]的研究结果也表明,相同添加量的氧化剂H2O2随着处理时间的延长,多酚保留率显著降低。统计分析结果表明:不同质量浓度的氧化剂H2O2对蓝靛果多酚稳定性有显著性影响(p<0.05),因此,蓝靛果多酚应尽量避免与氧化剂H2O2接触。
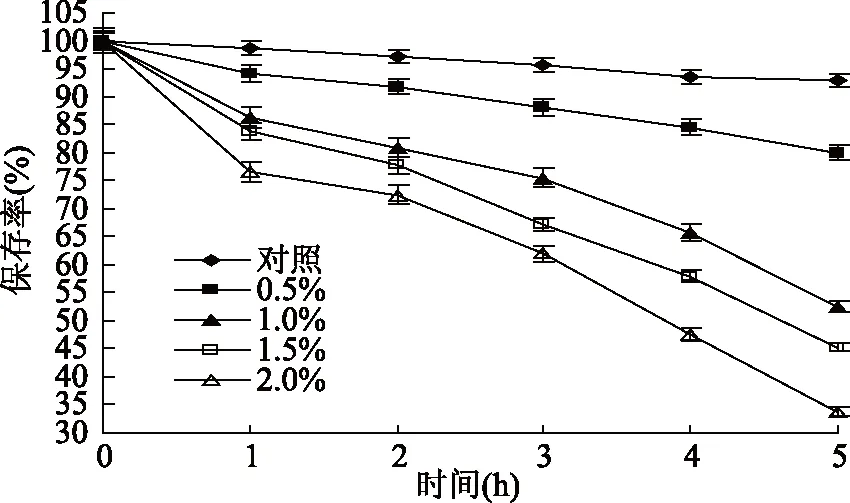
图4 氧化剂H2O2对蓝靛果多酚稳定性的影响Fig.4 Effect of H2O2 on the stability of polyphenols
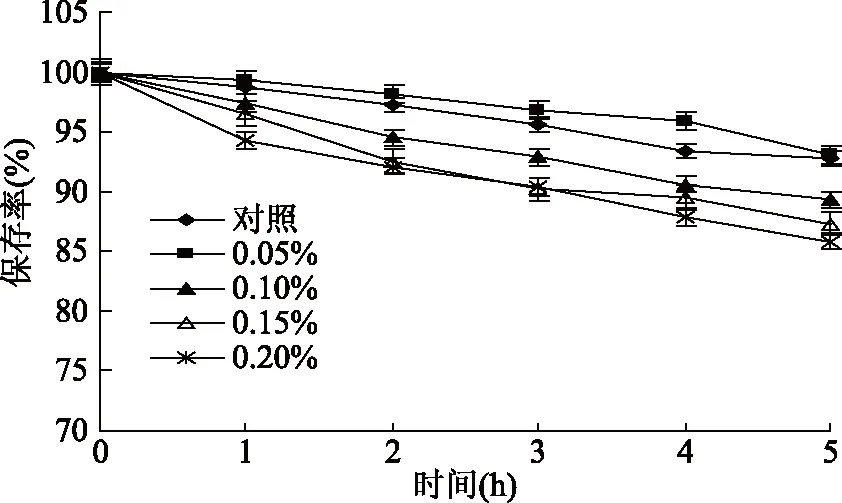
图5 还原剂Na2SO3对蓝靛果多酚稳定性的影响Fig.5 Effect of Na2SO3 on the stability of polyphenols
2.1.5 还原剂Na2SO3对蓝靛果多酚稳定性的影响 由图5可知,随着Na2SO3质量浓度的增大和各浓度处理时间的延长,蓝靛果多酚的保存率呈下降趋势,多酚稳定性逐渐减弱,当Na2SO3质量浓度增加到0.20%时,处理5 h后蓝靛果多酚的保存率仍达85%以上,多酚稳定性未受太大影响,说明蓝靛果多酚具有较好的耐还原能力。统计分析结果表明不同质量浓度的还原剂Na2SO3对蓝靛果多酚稳定性无显著性影响(p>0.05)。
2.1.6 防腐剂苯甲酸钠对蓝靛果多酚稳定性的影响 由图6可知,总体而言,随着处理时间的延长,防腐剂苯甲酸钠处理组和对照组的蓝靛果多酚保存率均呈下降趋势,然而随着苯甲酸钠质量浓度的增大,蓝靛果多酚的保存率逐渐升高,多酚稳定性增强,且在同一处理时间内,苯甲酸钠处理组的蓝靛果多酚保存率均显著高于对照组的(p<0.05),说明添加适量的苯甲酸钠有助于蓝靛果多酚稳定性的增强,这可能是因为苯甲酸钠具有抑制微生物活性的作用,故而降低了微生物对多酚的利用率,使其稳定性增强[31]。
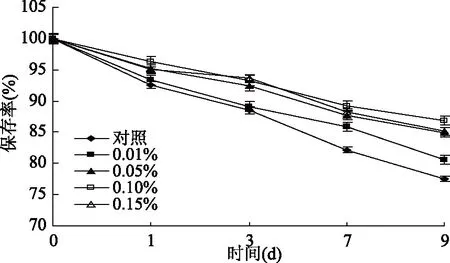
图6 防腐剂苯甲酸钠对蓝靛果多酚稳定性的影响Fig.6 Effect of sodium benzoate on the stability of polyphenols
2.1.7 糖类对蓝靛果多酚稳定性的影响 由图7可知,随着处理时间的延长,糖类处理组及其对照组的蓝靛果多酚保存率呈先升高后降低的趋势,同时,随着葡萄糖、蔗糖、D-果糖质量浓度的不断增大,蓝靛果多酚保存率也逐渐升高,且同一处理时间内,糖类处理组的多酚保存率基本均高于对照组的(p<0.05),说明葡萄糖、蔗糖、D-果糖的加入对蓝靛果多酚的稳定性均具有增强作用,当葡萄糖、蔗糖、D-果糖的质量浓度分别达到40%和50%时,处理5 h后,其多酚保存率分别为98.67%、95.17%、100.78%和100.16%、96.30%、103.27%,显著高于对照组的92.84%(p<0.05),出现这种现象可能是因为高浓度的糖使蓝靛果多酚中花色苷类物质的水分活度降低,进而减慢了多酚的降解速率[31-32]。该结果与雷月等[33]探讨添加一定量的葡萄糖、蔗糖等对蓝靛果花色苷的稳定性均具有增强作用的结论相符。

图7 糖类对蓝靛果多酚稳定性的影响Fig.7 Effect of carbohydrate on the stability of polyphenols
2.2 蓝靛果多酚总抗氧化能力(T-AOC)的测定
2.2.1 pH对蓝靛果多酚抗氧化活性的影响 由图8可知,当pH为2和3时,蓝靛果多酚总抗氧化能力显著高于其他受试pH范围(p<0.05),这可能是因为当pH为2、3时,蓝靛果多酚的化学结构较稳定,保存率显著高于其他受试pH范围,故抗氧化活性也相对增强,而随着pH的继续增大,蓝靛果多酚保存率急剧降低,因此多酚的总抗氧化能力也呈下降趋势,当pH增大至8时,蓝靛果多酚在碱性条件下易形成结构不稳定的化合物,保存率降低,故其抗氧化活性也明显减弱。统计分析结果表明:pH对蓝靛果多酚抗氧化活性有显著性影响(p<0.05)。
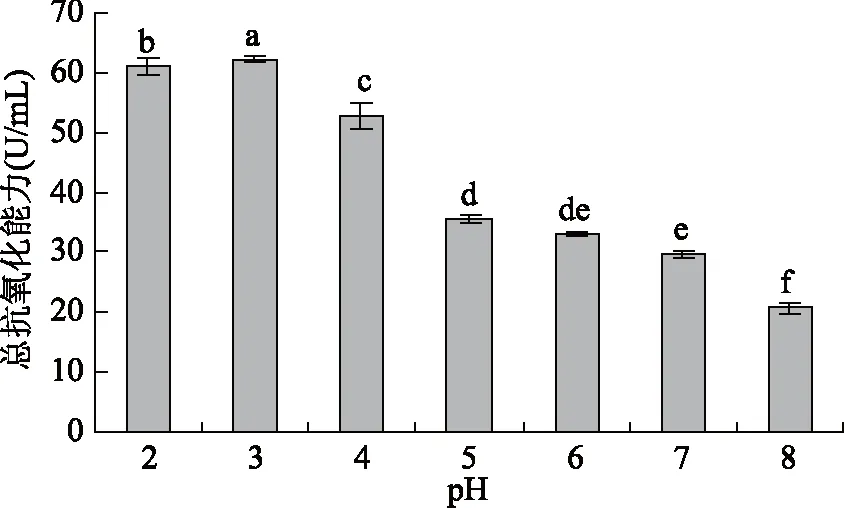
图8 pH对蓝靛果多酚抗氧化活性的影响Fig.8 Effect of pH on antioxidant activity of polyphenols注:不同小写字母表示差异显著(p<0.05),图9~图12同。
2.2.2 温度对蓝靛果多酚抗氧化活性的影响 由图9可知,总体而言,蓝靛果多酚的总抗氧化能力随着温度的升高而逐渐降低,当温度为0、4 ℃时,在同一处理时间内,蓝靛果多酚保存率明显高于其他受试温度范围,稳定性相对较好,测得的多酚总抗氧化能力也均在65 U/mL以上,抗氧化活性明显强于其他受试温度范围(p<0.05),而继续升温到70 ℃时,多酚的保存率明显降低,其总抗氧化能力也仅为39.84 U/mL,抗氧化活性减弱。统计分析结果表明:温度对蓝靛果多酚抗氧化活性有显著性影响(p<0.05)。
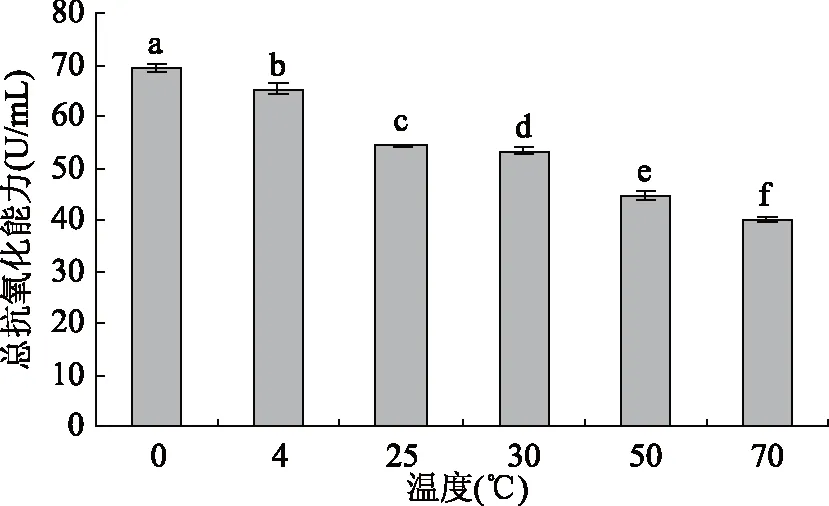
图9 温度对蓝靛果多酚抗氧化活性的影响Fig.9 Effect of temperature on antioxidant activity of polyphenols
2.2.3 光照对蓝靛果多酚抗氧化活性的影响 由图10可知,在避光条件下,蓝靛果多酚的总抗氧化能力为58.84 U/mL,显著高于其他光照条件下的总抗氧化能力(p<0.05);而紫外光条件下,蓝靛果多酚的抗氧化活性最差;并且在室内自然光和室外自然光条件下,蓝靛果多酚的总抗氧化能力间存在显著性的差异(p<0.05)。这是因为不同的光照条件对蓝靛果多酚的稳定性有显著影响,造成多酚保存率的变化,进而影响了蓝靛果多酚的抗氧化活性。统计分析结果表明:4种不同的光照条件对蓝靛果多酚抗氧化活性有显著性影响(p<0.05)。
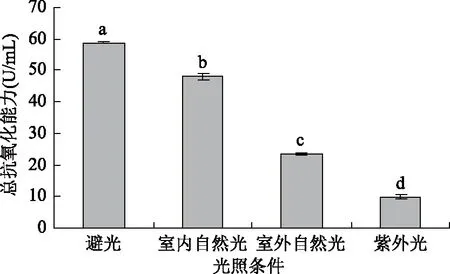
图10 光照对蓝靛果多酚抗氧化活性的影响Fig.10 Effect of light on antioxidant activity of polyphenols
2.2.4 氧化剂H2O2对蓝靛果多酚抗氧化活性的影响 由图11可知,与对照组相比,加入H2O2后,随着其质量浓度的逐渐增大,蓝靛果多酚的总抗氧化能力呈急剧下降的趋势,当H2O2的质量浓度为0时,蓝靛果多酚的总抗氧化能力为54.53 U/mL,而当其质量浓度达到2%时,多酚的总抗氧化能力仅为6.307 U/mL,这是因为氧化剂H2O2可直接亲核进攻多酚中花色苷类物质的C2位使花色苷开环生成查耳酮,查耳酮降解生成不同的酯类物质及衍生物,这些氧化产物会进一步降解成小分子物质或相互作用发生聚合反应,进而导致花色苷的降解[34-35]。因此,在同一处理时间内,随着H2O2质量浓度的增大,蓝靛果多酚的保存率逐渐降低,稳定性变差,从而导致其抗氧化活性减弱,同时也说明氧化剂H2O2的加入会使蓝靛果多酚受损,降低其耐氧化能力。统计分析结果表明:不同质量浓度的氧化剂H2O2对蓝靛果多酚抗氧化活性有显著性影响(p<0.05)。
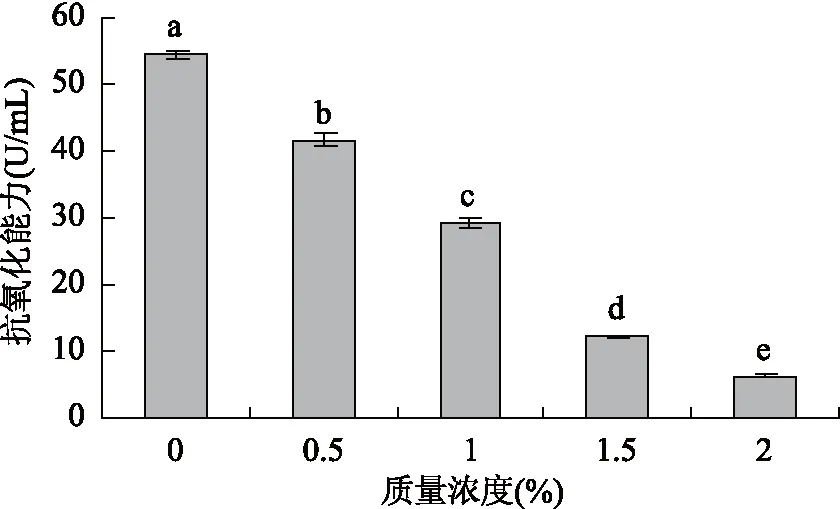
图11 氧化剂H2O2对蓝靛果多酚抗氧化活性的影响Fig.11 Effect of H2O2 on antioxidant activity of polyphenols
2.2.5 糖类对蓝靛果多酚抗氧化活性的影响 由图12可知,随着葡萄糖、蔗糖和D-果糖质量浓度的逐渐增大,蓝靛果多酚的总抗氧化能力也呈上升趋势,且基本均高于对照组的总抗氧化能力,不同质量浓度的葡萄糖、蔗糖、D-果糖均对蓝靛果多酚抗氧化活性有显著性影响(p<0.05),当糖浓度为10%时,经葡萄糖、蔗糖、D-果糖处理后蓝靛果多酚的总抗氧化能力间存在显著性差异(p<0.05),当葡萄糖、蔗糖和D-果糖的质量浓度在20%~50%范围内时,同一质量浓度的3种糖对蓝靛果多酚抗氧化活性的影响无明显差异(p>0.05)。
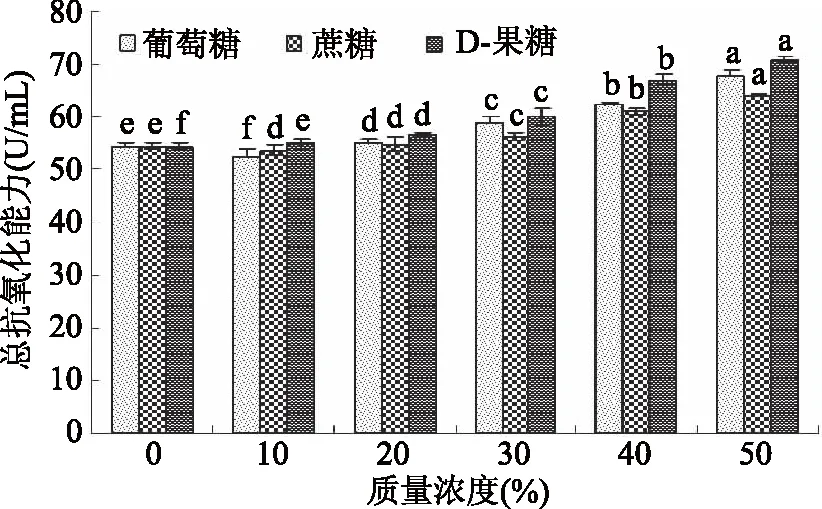
图12 糖类对蓝靛果多酚抗氧化活性的影响Fig.12 Effect of carbohydrate on antioxidant activity of polyphenols
3 结论
通过考察pH、光照、温度等因素对蓝靛果多酚稳定性的影响,发现蓝靛果多酚在pH为2和3条件下处理5 h后,其多酚保存率仍高达87%以上,稳定性较好,在低温避光条件下保存蓝靛果多酚稳定性最好,蓝靛果多酚具有较好的耐还原能力,但其耐氧化能力较差,防腐剂苯甲酸钠对蓝靛果多酚稳定性无显著影响(p>0.05),葡萄糖、蔗糖、D-果糖的加入对蓝靛果多酚的稳定性具有增强作用,且随着糖浓度的增大,蓝靛果多酚的保存率也趋于上升的趋势。
通过总抗氧化能力(T-AOC)测定实验,结果表明:在pH为2、3时,蓝靛果多酚总抗氧化能力显著高于其他受试pH范围(p<0.05),温度、光照对蓝靛果多酚抗氧化活性有显著影响(p<0.05),添加氧化剂H2O2会降低蓝靛果多酚的总抗氧化能力,加入不同质量浓度的葡萄糖、蔗糖、D-果糖均对蓝靛果多酚的抗氧化活性有显著性影响(p<0.05),而当糖质量浓度在20%~50%范围内时,同一质量浓度的3种糖对蓝靛果多酚抗氧化活性的影响无显著差异(p>0.05)。
[1]吕闻明.蓝靛果忍冬酚类物质提取及抗氧化性研究[D].长春:吉林大学,2012.
[2]刘敬华,王振宇.精制及高纯度蓝靛果花色苷的抗氧化性及稳定性研究[J].食品工业科技,2013,34(19):87-92.
[3]Sun Feng,Huo Junwei,QIN Dong. Establishment and optimization of SRAP amlification system inLoniceraCaeruleaL[J]. Journal of Northeast Agricultural University(English Edition),2011,18(4):26-31.
[4]Jin X H,Ohgami K,Shiratori K,et al. Effects of blue honeysuckle(LoniceracaeruleaL.)extract on lipopolysaccharide-induced inflammationinvitroandinvivo[J]. Experimental Eye Research,2006,82(5):860-867.
[5]刘德江,申健,田立娟,等.野生与栽培蓝靛果果实提取物的体外抗氧化活性[J].经济林研究,2013,31(3):103-106.
[6]张敏,刘刚,张雁南,等.响应面法优化蓝靛果花色苷提取工艺研究[J].北方园艺,2014(23):113-116.
[7]向延菊,王大伟.蓝靛果忍冬的研究现状及其发展前[J].塔里木农垦大学学报,2004,16(4):26-29.
[8]Kahkonen M P,Hopia A I,Heinonen M. Berry phenolics and their antioxidant activity[J]. Journal of Agricultural and Food Chemistry,2001,49(8):4076-4082.
[9]Gruia MI,Oprea,et al. The antioxidant response induced byLoniceracaerulaeaberry extracts in animals bearing experimental solid tumors[J]. Molecules,2008(13):1195-1206.
[10]Kim J H,Hong J Y,Shin S R,et al. Comparison of antioxidant activity in wild plant(Adenophoratriphylla)leaves and roots as a potential source of functional foods[J]. International Journal of Food Sciences and Nutrition,2009(60):150-161.
[11]R Puupponen-Pimiä,L Nohynek,C Meier,et al. Antimicrobial properties of phenolic compounds from berries[J]. Journal of Applied Microbiology,2001,90(4):494-507.
[12]Zhu X,Zhang H,Lo R,et al. Phenolic compounds from the leaf extract of artichoke(CynarascolymusL.)and their antimicrobial activities[J]. Journal of Agricultural and Food Chemistry,2004(52):7272-7278.
[13]Park S,Hahm KB,Oh TY,et al. Preventive effect of the flavonoid,wogonin,against ethanol-induced gastric mucosal damage in rats[J]. Dig Dis Sci,2004(49):384-394.
[14]Fawole O A,Ndhlala A R,Amoo S O,et al. Anti-inflammatory and phytochemical properties of twelve medicinal plants used for treating gastro-intestinal ailments in South Africa[J]. Journal of Ethnopharmacology,2009,123(2):237-43.
[15]Liang C,Xin X,Rong L,et al. Isolation of cyanidin 3-glucoside from blue honeysuckle fruits by high-speed counter-current chromatography[J]. Food Chemistry,2014,152(2):386-390.
[16]Chen L,Xin X,Yuan Q,et al. Phytochemical properties and antioxidant capacities of various colored berries[J].Journal of the Science of Food and Agriculture,2014,94(2):180-188.
[17]Fukumoto L R,Mazza G. Assessing antioxidant and prooxidant activities of phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2000,48(8):3597-3604.
[18]Augustine S,Kudachikar V B,Vanajakshi V,et al. Effect of combined preservation techniques on the stability and microbial quality and retention of anthocyanins in grape pomace stored at low temperature[J]. Journal of Food Science and Technology,2013,50(2):332-338.
[19]Daniela F,Cristian D B,Paolo S,et al. Effect of Time and storage temperature on anthocyanin decay and antioxidant activity in wild blueberry(Vacciniumangustifolium)powder[J]. Journal of Agricultural and Food Chemistry,2013,61(12):2999-3005.
[20]张冬雪.蓝靛果色素提取条件对比,稳定性及应用研究[D].北京:中国农业科学院,2012.
[21]冯卫华,于立梅,秦艳,等.荔枝多酚的抗氧化性动力学及稳定性[J].食品科学,2011,32(15):5-9.
[22]袁歆贻.pH与光照对苹果多酚稳定性的影响[J].现代农业科技,2014(19):297-304.
[23]赵玉,任亚梅,张爽,等.苹果果皮和果肉多酚稳定性研究[J].中国食品学报,2014,14(2):93-101.
[24]赵玉,任亚梅,李莹,等.添加剂对苹果果皮和果肉多酚稳定性的影响[J].中国食品学报,2015,15(3):120-127.
[25]李斌,雷月,孟宪军,等. 响应面实验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J]. 食品科学,2015,36(22):33-39.
[26]李斌,雷月,智红涛,等. 一种纯化蓝靛果忍冬中多酚的方法:中国,CN 105616477 A[P]. 2016.06.01.
[27]楠极,栗丽萍. 番石榴叶多酚提取液稳定性的研究[J]. 食品研究与开发,2016,37(8):32-35.
[28]王卫国,林强,张仟伟. 葡萄皮花色苷的生理活性及稳定性研究进展[J]. 中国酿造,2016,35(9):5-10.
[29]李伟,张应团. 火棘多酚类物质的体外抗氧化作用[J]. 食品工业科技,2008(9):121-123.
[30]毛迪锐,姜贵全,孙继伟,等. 文冠果壳总黄酮分离纯化及稳定性研究[J]. 食品与机械,2016,32(1):140-143.
[31]高凝轩,李斌,杜珊珊,等. 黑果腺肋花楸多酚稳定性的研究[J]. 食品科学,2016,37(23):20-24.
[32]樊金玲,朱文学,巩卫东,等. 蔗糖含量对牡丹花色苷热稳定性性和降解动力学的影响[J]. 食品科学,2010,31(13):74-78.
[33]雷月,黎盛,智红涛,等. 粗制及精制蓝靛果花色苷的稳定性及抗氧化性研究[J]. 食品工业科技,2016,37(2):113-124.
[34]周坦洋,罗芙蓉,白彬. 葡萄籽原花青素生物药理活性的研究进展[J]. 哈尔滨医科大学学报,2012,46(1):94-96.
[35]Lopes L B,Vande H,Li H T,et al. Topical delivery of lycopene using microemulsions:enhanced skin penetration and tissue antioxidant activity[J]. Journal of Pharmaceutical Sciences,2010,99(3):1346-1357.
Study on stability and total antioxidant capacity ofpolyphenols fromLoniceraCaeruleaL.
LEI Yue1,2,GONG Yan-long1,ZHU Su-song1,LI Bin2,*
(1.Guizhou Rice Research Institute,Guiyang 550006,China;2.College of Food Science,Shenyang Agricultural University,Shenyang 110866,China)
In this study,the polyphenols fromLoniceraCaeruleaL was obtained through the extraction,purification and vacuum freeze drying,and the effect of pH,light,temperature,H2O2,Na2SO3,sodium benzoate and glucose,sucrose,Dfructose on the stability of polyphenols were investigated. Through determining the total antioxidant capacity(T-AOC),the antioxidant activity of polyphenols fromLoniceraCaeruleaL. in different conditions was analyzed. The results showed that the polyphenols fromLoniceraCaeruleaL. had better preservation when the pH was 2 and 3,at low temperature and in dark,the resistance to reduction of polyphenols was stronger than ability of resistance to oxidation,sodium benzoate had no obvious impact on the stability of polyphenols fromLoniceraCaeruleaL.(p>0.05),carbohydrate increased the stability of polyphenols. In addition,through determination of the total antioxidant capacity,it was found that the total antioxidant capacity of polyphenols was obviously higher than that of other subjects pH range when the pH was 2 and 3(p<0.05),the temperature and light had obvious impact on the antioxidant activity of polyphenols fromLoniceraCaeruleaL.(p<0.05),H2O2reduced the antioxidant activity of polyphenols,the carbohydrate at different concentrations had obvious effects on the antioxidant activity of polyphenols(p<0.05).
LoniceraCaeruleaL.;polyphenols;stability;total antioxidant capacity
2016-12-27
雷月(1988-),女,硕士,研究实习员,研究方向:食品深加工,E-mail:leiyue0917@163.com。
*通讯作者:李斌(1979-),男,博士,副教授,研究方向:浆果深加工及功能性成分研究,E-mail:libinsyau@163.com。
国家自然科学基金资助(31671863);辽宁省高等学校优秀人才支持计划资助(2014108);沈阳农业大学天柱山英才计划项目资助(2014);贵州省优秀青年科技人才培养对象专项资金资助(黔科合人字[2011]19号);贵州省科技计划资助(黔科合重大专项字[2013]6023号);贵州省科研机构服务企业行动计划资助(黔科合服企[2014]4005);贵州省科技合作计划资助(黔科合LH字[2015]7074号);贵州省现代水稻产业技术体系资助(GZCYTX2016-06)。
TS255.1
A
1002-0306(2017)13-0078-07
10.13386/j.issn1002-0306.2017.13.015
