Exchange模型的DCE-MRI定量研究评价肝硬化的价值
2017-07-31程敬亮河南中医药大学第一附属医院磁共振科河南郑州450000郑州大学第一附属医院磁共振科河南郑州450052
张 岚,郑 妍,邢 威,程敬亮(.河南中医药大学第一附属医院磁共振科,河南 郑州 450000;2.郑州大学第一附属医院磁共振科,河南 郑州 450052)
Exchange模型的DCE-MRI定量研究评价肝硬化的价值
张 岚1,郑 妍1,邢 威1,程敬亮2*
(1.河南中医药大学第一附属医院磁共振科,河南 郑州 450000;2.郑州大学第一附属医院磁共振科,河南 郑州 450052)
目的 探讨Exchange模型的动态对比增强磁共振(DCE-MRI)定量研究评价肝硬化的价值。方法 符合纳入标准和排除标准的肝硬化代偿期和失代偿期患者各15例,正常对照组15名,均行肝脏DCE-MRI扫描,采用Exchange模型计算出各组定量参数,包括对比剂容积转运常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积分数(Ve)、血浆容积分数(Vp)、肝动脉灌注指数(HPI)、血容量(BV)、血流量(BF)、对比剂平均通过时间(MTT)。3组定量参数的比较采用单因素方差分析,组间两两比较采用LSD-t检验。绘制ROC曲线判断Ktrans、Ve、HPI、MTT对肝硬化的诊断效能。 结果 正常对照组、代偿期肝硬化组和失代偿期肝硬化组的Ktrans分别为(0.85±0.34)min-1、(0.67±0.36)min-1、(0.39±0.18)min-1,Ve分别为0.47±0.42、0.34±0.13、0.16±0.06,HPI分别为0.35±0.09、0.57±0.17、0.76±0.20,MTT分别为(17.38±15.38)s、(34.26±11.37)s、(57.33±16.73)s,BF值分别为(97.22±36.29)ml/(min·100 g)、(69.30±35.22)ml/(min·100 g)、(24.64±28.24)ml/(min·100 g),差异均有统计学意义(P<0.05),且HPI和MTT的组间两两比较差异有统计学意义(P<0.05)。Kep、Vp、BV在3组间比较差异无统计学意义(P>0.05)。Ktrans 和Ve判断失代偿期肝硬化的曲线下面积(AUC)为0.86、0.92,敏感度为90%、90%,特异度为80%、80%;HPI和MTT判断代偿期肝硬化的AUC为0.79、0.76,敏感度为85%、85%,特异度为75%、75%;HPI和MTT判断失代偿期肝硬化的AUC为0.91、0.88,敏感度为95%、90%,特异度为80%、80%。结论 Exchange模型的DCE-MRI定量研究获得多个定量参数,可反映肝硬化的血流动力学改变及血管微环境变化,评价肝硬化的严重程度。
肝硬化;磁共振成像;血流动力学;Exchange模型
肝硬化起病隐匿,进展缓慢,晚期常合并多种并发症,死亡率高。临床上对肝硬化的诊断和分期主要依靠实验室和影像学综合评判。因此,迫切需要一种精准无创、适合长期随访的影像学方法。研究[1]表明,肝硬化的血流动力学改变早于形态学改变,因此检测肝硬化的血流变化将有助于病情分期、早期诊断和治疗。近年,CT灌注成像已用于肝纤维化、肝硬化的诊断和分期,但肝脏具有独特的双重血供,病理状态下肝动、静脉及门静脉系统间的血流动力学变化错综复杂,使得准确测量其血管灌注成为难点[2]。动态对比增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)基于血流动力学模型分析,模拟出血管内外对比剂的分布情况,通过双输入-双室模型获得定量参数,准确而客观地反映肝脏血流灌注状态和微血管环境,对发现仅有血流动力学改变的病变早期阶段及监测病变的进展程度具有重要意义[3]。本研究旨在探讨Exchange模型的DCE-MRI定量研究评估肝硬化的可行性,建立用于评价肝硬化的定量指标。
1 资料与方法
1.1一般资料 收集2015年8月—2016年12月于河南中医药大学第一附属医院消化内科收治的肝硬化住院患者。纳入标准:①经临床、生化、影像学检查及肝脏穿刺活检病理证实为肝硬化;②均为肝炎患者;③无肝、脾良恶性占位;④门静脉及腹主动脉无血栓、斑块等;⑤无酒精、精神类药物成瘾史。排除标准:中重度脂肪肝,既往脾脏切除史,肾功能不全,患有严重心、脑、肺、血液系统疾病。经筛选共30例肝硬化患者被纳入本研究,并采用Child-Pugh分级标准[4]对肝硬化患者进行评分(表1),A级为代偿期肝硬化组,B级和C级为失代偿期肝硬化组。代偿期肝硬化组15例,男9例、女6例,年龄35~73岁,平均(48.9±3.7)岁;失代偿期肝硬化组15例,男10例、女5例,年龄40~69岁,平均(55.7±4.6)岁。同时选取15名健康志愿者为正常对照组,男8名、女7名,年龄32~60岁,平均(47.4±5.8)岁。本研究获得本院伦理委员会批准,所有入组者均签署知情同意书。
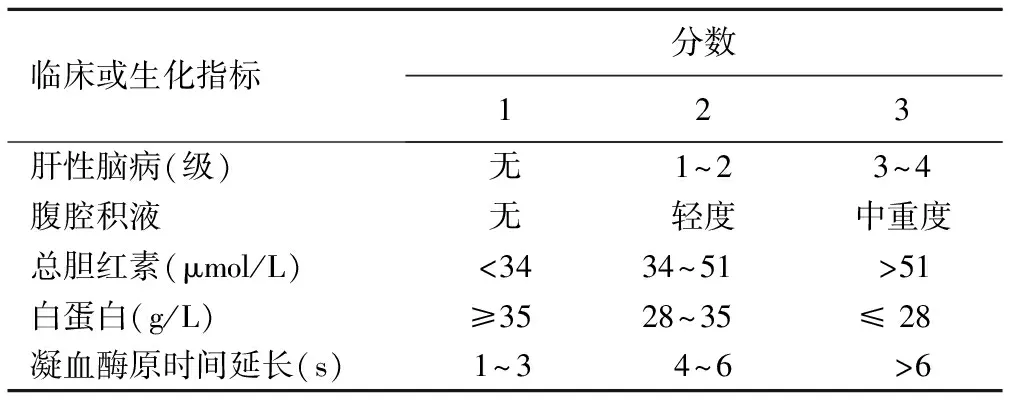
表1 肝硬化患者Child-Pugh分级标准
注:Child-Pugh A级≤6分,Child-Pugh B级 7~9分,Child-Pugh C级≥10分。
1.2仪器与方法 采用Philips Ingenia 3.0T MR扫描仪,腹部8通道线圈。扫描序列:轴位T1WI,TR 10 ms,TE 2.3 ms,层厚5 mm,层间距0.5 mm,FOV 400 mm×352 mm,矩阵160×160,NEX 1次,翻转角10°;轴位T2WI,TR 880 ms,TE 80 ms,层厚5 mm,层间距0.5 mm,FOV 400 mm×352 mm,矩阵160×160,NEX 1次,翻转角10°;3D-THRIVE序列,TR 3.8 ms,TE 1.8 ms,层厚4 mm,层间距0.4 mm,FOV 400 mm×400 mm,矩阵160×160,翻转角10°。前两期动态扫描后经肘正中静脉以4 ml/s的流速团注对比剂钆双胺,剂量0.2 mmol/kg体质量,注射对比剂后以相同速率以20 ml生理盐水冲洗,连续扫描50期,每期采集30层,每期采集时间6 s。
1.3图像分析 将原始数据导入Omni Kinetics软件分析。首先进行三维非刚性运动校正和配准[5](图1A),然后拟合肝动脉和门静脉血管输入函数(vascular input function,VIF)。肝动脉ROI由腹主动脉代替,门静脉取主干层面,腹主动脉和门静脉内的对比剂时间-浓度曲线作为肝脏双血供VIF曲线。选择Exchange模型计算各组定量参数值,获取各参数功能性伪彩图(图1B~1F)。手动勾画ROI,分别在门静脉及门静脉上、下方层面内的肝左叶、右叶选取4~6个ROI,大小约30 mm2,避开大血管且不能达到肝脏边缘,每个ROI重复测量3次取平均值。定量参数包括:对比剂容积转运常数(volume transfer constant of the contrast agent, Ktrans)、速率常数(reverse reflux rate constant, Kep)、细胞外血管外间隙(extracellular extravascular space, EES)、容积分数(volume fraction of EES, Ve)、血浆容积分数(volume fraction of plasma,Vp)、肝动脉灌注指数(hepatic perfusion index,HPI)、血容量(blood volume, BV)、血流量(blood flow, BF)、对比剂平均通过时间(mean transit time, MTT)。
1.4统计学分析 采用SPSS 21.0统计分析软件。计量资料以±s表示。3组参数值比较采用ANOVA分析,组间两两比较采用LSD-t检验。采用ROC曲线判断Ktrans、Ve、HPI、MTT诊断肝硬化的曲线下面积(area under the curve, AUC)及敏感度、特异度。P<0.05为差异有统计学意义。
2 结果
正常对照组、代偿期肝硬化组和失代偿期肝硬化组Ktrans、Ve依次呈下降趋势,且失代偿期肝硬化组Ktrans与代偿期肝硬化组、正常对照组差异有统计学意义(t=2.52,4.14,P<0.05),失代偿期肝硬化组Ve与正常对照组差异有统计学意义(t=3.31,P<0.05),与代偿期肝硬化组差异无统计学意义(t=1.92,P>0.05)。正常对照组、代偿期肝硬化组和失代偿期肝硬化组HPI和MTT逐渐升高,且3组间两两比较差异均有统计学意义(P均<0.05);BF呈下降趋势,且失代偿期肝硬化组BF较代偿期肝硬化组和正常对照组降低(t=3.66,5.94,P<0.05)。3组间的Kep、Vp、BV差异均无统计学意义(P均>0.05),见表2。Ktrans、Ve、HPI、MTT对代偿期肝硬化和失代偿期肝硬化的诊断效能见表3,图2、3。
表2 正常对照组、代偿期肝硬化组和失代偿期肝硬化组定量参数比较(±s)

表2 正常对照组、代偿期肝硬化组和失代偿期肝硬化组定量参数比较(±s)
组别Ktrans(min-1)Kep(min-1)VeVp代偿期肝硬化组(n=15)0.67±0.364.15±2.640.34±0.130.10±0.71失代偿期肝硬化组(n=15)0.39±0.18∗#3.50±1.170.16±0.06∗0.09±0.85正常对照组(n=15)0.85±0.345.57±2.740.47±0.420.12±0.92F值8.713.185.540.92P值0.00070.05170.00730.995组别HPIMTT(s)BF[ml/(min·100g)]BV(ml/100g)代偿期肝硬化组(n=15)0.57±0.17∗34.26±11.37∗69.30±35.2214.27±2.83失代偿期肝硬化组(n=15)0.76±0.20∗#57.33±16.73∗#24.64±28.24∗#12.68±3.81正常对照组(n=15)0.35±0.0917.38±15.3897.22±36.2915.66±3.20F值24.628.0317.983.05P值<0.0001<0.0001<0.00010.0578
注:*:与正常对照组比较,P<0.05;#:与代偿期肝硬化组比较,P<0.05。

表3 Ktrans、Ve、HPI、MTT对代偿期肝硬化和失代偿期肝硬化的诊断效能
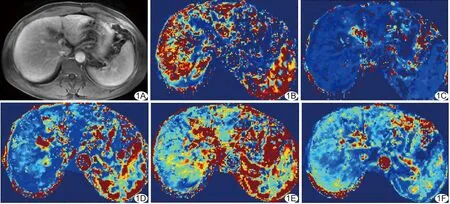
图1 患者女,45岁,乙型肝炎病史15年 A.肝脏DCE-MRI原始T1WI增强图像; B~F.分别为肝脏DCE-MRI功能性参数 Ktrans、Ve、HPI、MTT、BF的伪彩图

图2 Ktrans和Ve诊断失代偿期肝硬化的ROC曲线 以Ktrans=0.41 min-1、Ve=0.28诊断失代偿期肝硬化的AUC分别为0.86、0.925,敏感度分别为90%、90%,特异度分别为80%、80% 图3 HPI和MTT诊断失代偿期肝硬化的ROC曲线 以HPI=0.69、MTT=52.80 s诊断失代偿期肝硬化的AUC分别为0.915、0.88,敏感度分别为95%、90%,特异度分别为80%、80%
3 讨论
DCE-MRI定量研究是基于对比剂进入血管引起组织T1弛豫时间缩短,记录组织信号强度的变化,跟踪对比剂随时间扩散到周围组织的情况,通过血流动力学模型获取肝脏血流灌注和血管渗透性等方面的定量数值,从功能学角度了解肝脏的生理功能和病理变化[6]。由于肝脏为肝动脉和门静脉双重供血,作为一个双血供器官必须拟合双血供VIF获取肝脏血流动力学变化的信息,才能真实地反映肝脏的病理生理状态。本研究采用的Exchange模型为双输入-双室模型,双输入即肝脏为肝动脉和门静脉双重供血;双室是把肝脏分成2个室,即肝血窦和血管外细胞外间隙。Exchange模型同时得到肝脏的渗透参数和灌注参数,全面地评估肝脏的微循环状态,定量而客观地反映肝脏的血流灌注和病理生理改变,从而更适用于肝脏疾病的评估[7]。
Ktrans指对比剂从血管内扩散到血管周围间隙的速度常数,反映组织内微血管的通透性[8]。Ve是EES对比剂的容积分数,反映EES的大小。随着肝硬化进展,肝窦毛细血管化加重,钆对比剂从肝血窦自由交换至EES的速率下降,Ktrans降低。因此,利用Ktrans能敏感地检测到微血管的通透性。肝硬化失代偿期时Ve显著降低,考虑此期大量的肝硬化再生结节形成及肝小叶结构被破坏,导致肝脏正常结构改变,可能使EES减小,引起Ve下降。Ktrans和Ve对失代偿期肝硬化的诊断效能较高,提示其可用来监测肝硬化的进展程度。
本研究肝硬化代偿期和失代偿期HPI明显升高,且各组间HPI增加均有统计学意义。考虑由于肝细胞坏死,纤维组织增生和再生结节形成,门静脉回流受阻,动静脉间形成广泛交通支,肝动脉血流量在肝脏总循环血流中比例增大。许尚文等[9]认为HPI可作为慢性肝病患者临床随访的一个观察指标。本研究结果也显示HPI在肝硬化代偿期和失代偿期的诊断效能较高,尤其判断失代偿期肝硬化。因此,尽管HPI是一个相对值,但对肝硬化分期诊断有较大价值。MTT指对比剂经动脉流入到静脉流出所需时间的平均值[10]。由于纤维索条和再生结节的双重作用,门静脉和肝静脉分支狭窄、闭塞,导致对比剂流入至流出时间延长,MTT增加,与Chen等[11]的CT灌注研究结果相一致。Patel等[12]对14例肝硬化患者DCE-MRI研究发现,MTT判断肝硬化的敏感度为100%,特异度为83%。本研究中MTT判断代偿期和失代偿期肝硬化的敏感度为85%和90%,对判断肝硬化具有较高的临床应用价值。本研究中代偿期肝硬化BF降低不明显,至失代偿期时降低显著,说明代偿期门静脉灌注量虽然降低,但全肝循环血流量还能维持正常生理机能,这可能与肝脏血管独特的代偿机制及肝脏“自身调节”机制有关[13]。但随着肝内血管阻力逐步升高,逐步转变为以肝动脉供血为主,但肝动脉供血的代偿性增加并不能完全弥补门静脉血流量的持续下降,最终结果是反映肝脏总血流的灌注指标BF降低。
本研究的局限性,①样本量较小,今后需扩大样本量深入研究;②对原始图像的三维非刚性运动校正目前尚无统一的标准[14];③Exchange 模型对时间分辨率要求较高,可能过度拟合参数。
综上所述,基于Exchange模型的DCE-MRI定量研究获取多个参数,能反映肝硬化的血流动力学改变及血管微环境变化,可对肝硬化进行整体量化评估。
[1] Stankovic Z, Csatari Z, Deibert P, et al. Normal and altered three-dimensional portal venous hemodynamics in patients with liver cirrhosis. Radiology, 2012,262(3):862-873.
[2] 吴国华,殷允娟,侯海燕,等.256层CT全肝灌注评估肝硬化段性功能储备.中国医学计算机成像杂志,2015,21(3):246-250.
[3] Shimon A, Claudia C, Guido J, et al. DCE-MRI of the liver: Effect of linear and non-linear conversions on hepatic perfusion quantification and reproducibility. J Magn Reson Imaging, 2014,40(1):90-98.
[4] Child CG, Turcotte JG. Surgery and portal hypertension.Major Probl Clin Surg, 1964,1:1-85.
[5] Wang HS, Cao YE. Correction of arterial input function in dynamic contrast-enhanced MRI of the liver. J Magn Reson Imaging, 2012,36(2):411-421.
[6] 黎美玲,陆健,曹鹏.动态对比增强MRI在肝脏中的应用与研究进展.中国医学影像技术,2017,33(1):149-152.
[7] 章俞,赵振华,赵丽,等.Extended Tofts 和 Exchange 模型的动态对比增强MRI参数鉴别诊断肝细胞癌和肝转移瘤的价值.中华放射学杂志,2015,49(9):656-660.
[8] Li ZM, Sun JH, Chen LM, et al. Assessment of liver fibrosis using pharmacokinetic parameters of dynamic contrast-enhanced magnetic resonance imaging. J Magn Reson Imaging, 2016,44(1):98-104.
[9] 许尚文,陈自谦,夏加林,等.3.0 T 磁共振动态增强扫描对乙肝肝纤维化的评估.功能与分子医学影像学:电子版,2015,4(4):778-784.
[10] 周瑞臣,李伟,李健,等.颅脑CT灌注参数定量分析的准确性. 中国介入影像与治疗学,2016,13(8):477-480.
[11] Chen ML, Zeng QY, Huo JW, et al. Assessment of the hepatic microvascular changes in liver cirrhosis by perfusion computed tomography. World J Gastroenterol, 2009,15(28):3532-3537.
[12] Patel J, Sigmund EE, Rusinek H, et al. Diagnosis of cirrhosis with intravoxel incoherent motion diffusion MRI and dynamic contrast-enhanced MRI alone and in combination:Preliminary experience. J Magn Reson Imaging, 2010,31(3):589-600.
[13] Bultman E, Brodsky E, Debra K, et al. Quantitative hepatic perfusion modeling using DCE-MRI with sequential breath-Holds.J Magn Reson Imaging, 2014,39(4):853-865.
[14] 赵丽,赵振华,章俞,等.3D非刚性运动校正在肝肿瘤动态增强MRI中的应用.中国医学影像学杂志,2016,24(11):820-824.
Value of DCE-MRI quantification study with exchange model in evaluation of liver cirrhosis
ZHANGLan1,ZHENGYan1,XINGWei1,CHENGJingliang2*
(1.DepartmentofMRI,theFirstAffiliatedHospitalofHenanUniversityofTCM,Zhengzhou450000,China; 2.DepartmentofMRI,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
Objective To investigate the value of dynamic contrast-enhanced MRI (DCE-MRI) quantitation study with exchange model in evaluation of liver cirrhosis. Methods A total of 30 patients with liver cirrhosis confirmed to included and excluded criteria were divided into compensatory cirrhosis group (n=15) and decompensatory cirrhosis group (n=15). And 15 healthy volunteers were served as a control group. All subjects were performed liver DCE-MRI and quantitative parameters of three groups were obtained by exchange model, including volume transfer constant of the contrast agent (Ktrans), reverse reflux rate constant (Kep), volume fraction of EES (Ve), volume fraction of plasma (Vp), arterial perfusion index (HPI), blood volume (BV), blood flow(BF) and mean transit time (MTT). The parameters of three groups were compared byANOVAanalysis andLSDtest for every two groups. The diagnostic efficacy of Ktrans, Ve, HPI, MTT for liver cirrhosis were analyzed by ROC. Results Ktrans, Ve, HPI, MTT and BF values in the control group, compensatory cirrhosis group and decompensatory cirrhosis group were (0.85±0.34) min-1, (0.67±0.36) min-1, (0.39±0.18)min-1; 0.47±0.42, 0.34±0.13, 0.16±0.06; 0.35±0.09, 0.57±0.17, 0.76±0.20; (17.38±15.38)s, (34.26±11.37)s, (57.33±16.73)s; (97.22±36.29)ml/(min·100 g), (69.30±35.22)ml/(min·100 g), (24.64±28.24) ml/(min·100 g), respectively, and showing significant differences among three groups, and significant with HPI and MTT for every two groups (P<0.05). There were no significant differences for Kep, Vp and BV among three groups (P>0.05). According to ROC of Ktrans and Ve for decompensatory liver cirrhosis, AUC were 0.86, 0.92, the sensitivity were 90%, 90% and the specificity were 80%, 80%. According to ROC of HPI and MTT for compensatory liver cirrhosis, AUC were 0.79, 0.76, the sensitivity were 85%, 85% and the specificity were 75%, 75%. According to ROC of HPI and MTT for decompensatory liver cirrhosis, AUC were 0.91, 0.88, the sensitivity were 95%, 90% and the specificity were 80%, 80%. Conclusion DCE-MRI quantitative study with exchange model can obtain multiple parameters, reflect hemodynamic changes and vascular microenvironment and evaluate severity of liver cirrhosis.
Liver cirrhosis; Magnetic resonance imaging; Hemodynamics; Exchange model
河南省科技攻关项目(162102310104)。
张岚(1977—),女,河南郑州人,硕士,副主任医师。研究方向:腹部影像学。E-mail: 13837187787@163.com
程敬亮,郑州大学第一附属医院磁共振科,450052。E-mail: cjr.chjl@vip.163.com
2017-02-05
2017-05-21
10.13929/j.1003-3289.201702007
R575.2; R445.2
A
1003-3289(2017)07-1019-05
