一株海洋红酵母的鉴定及营养成分分析
2017-07-24章霞徐志进柳敏海李伟业李凌刚叶剑英傅荣兵
章霞,徐志进,柳敏海,李伟业,李凌刚,叶剑英,傅荣兵
(浙江省舟山市水产研究所,浙江舟山316000)
一株海洋红酵母的鉴定及营养成分分析
章霞,徐志进,柳敏海,李伟业,李凌刚,叶剑英,傅荣兵
(浙江省舟山市水产研究所,浙江舟山316000)
为探究海洋红酵母Rhodotorula benthica作为水产蛋白源饵料的可能性,采用生理生化分析和分子鉴定的方法,对该酵母进行了属性鉴定、培养性能初探和一般营养成分测定等研究。结果表明:此菌株的菌落形态、生殖方式和生理生化特性等指标鉴定结果均符合红酵母属性;利用真菌ITS基因引物对酵母菌总DNA进行扩增,测序获得598 bp目的片段,经NCBI GenBank比对,此酵母菌的ITS序列与斯鲁菲亚红酵母Rhodotorula slooffiae序列一致性为99%~100%,故将该菌株鉴定为斯鲁菲亚红酵母;对此海洋红酵母进行液体培养基扩培,获得其生长曲线在48 h时达生长峰值,生物量为2.25×108cfu/mL,类胡萝卜素含量为83.6 μg/g。研究表明,此株海洋红酵母含有丰富的维生素、不饱和脂肪酸、蛋白质等营养物质,在水产养殖产业中具有较好的应用前景。
海洋红酵母;营养成分;生理生化;类胡萝卜素
海洋红酵母Rhodotorula benthica属于真菌,主要分布于不同海域和沿岸的各种基物上,具有较强的抗逆性和较好的耐盐性[1]。海洋红酵母富含氨基酸、肝糖、多肽、不饱和脂肪酸、动物幼体生长激素和类胡萝卜素等有益成分[2-4],且具有生物培养周期短、发酵条件简单、产量高等特点,在医药、食品、化工等各个领域均得到了广泛的关注[5-6]。
近年来,众多学者对红酵母在水产养殖中的应用进行了广泛研究。薛德林等[7]研究表明,海洋胶红酵母Rhodotorula benthica对提高海参幼体的成活率和变态率有显著成效;郝佳等[8]研究表明,海洋红酵母微生态制剂有助于提高刺参的生长和存活率;徐琴等[9]研究表明,黏红酵母Rhodotorula glutinis具有净化中国对虾育苗水环境的作用;王宇光等[10]研究表明,在适合的菌体浓度下,海洋胶红酵母与鱼虾等养殖可无害共生:海洋红酵母在水产养殖中的应用具有巨大的潜力。据报道,水产养殖过程中应用的海洋红酵母菌种主要是胶红酵母、黏红酵母、小红酵母、深红酵母等,其中后3种也是中国长江中红酵母菌的优势种[5]。其他潜在优势菌种仍在探索中,例如Nagahama等[11-12]从太平洋西北部各海域分离、鉴定并获得了红酵母菌40株,为今后海洋红酵母的相关研究提供了参考依据;周与良等[13]对中国黄、渤海沿岸的海洋红酵母进行了资源研究和种类鉴定;李明等[14]从刺参的体表、肠道、呼吸树上分离获得了海洋红酵母:目前在海洋红酵母菌种的发掘鉴定方面仍需深入研究。本研究中,通过微生物生理生化分析、分子学鉴定等方法,对一株从辽宁省丹东獐岛海域(黄海海域)海水样品中分离获得的海洋红酵母进行鉴定并对其基础培养条件和营养性能进行初探,旨在为其在水产养殖中的开发利用提供参考。
1 材料与方法
1.1 材料
试验用海洋红酵母菌种由辽东学院提供,于YPD斜面保存。
斜面保存培养基:葡萄糖2.0%、蛋白胨1.0%、酵母浸粉0.5%、琼脂2.0%、海水100 mL,自然海水pH。
液体活化培养基:葡萄糖2.0%、蛋白胨1.0%、酵母浸粉0.5%、海水100 mL,自然海水pH。
1.2 方法
1.2.1 菌种的活化与鉴定 将冰箱中保存的菌种接种在平板培养基上活化,温度为30℃,时间为24 h。
(1)菌种的生理生化鉴定。参照《微生物学实验手册》和《酵母菌的特征与鉴定手册》中对海洋红酵母进行糖发酵、碳源同化和氮源同化等生理生化试验方法。
(2)菌种的分子鉴定。从YPD固体培养基上无菌获得菌体,进行菌体DNA提取,并采用真菌ITS基因引物对酵母菌总DNA进行扩增,引物序列ITS1F:CTTGGTCATTTAGAGGAAGTAA,ITS4A:CG-CCGTTACTGGGGCAATCCCTG。反应体系(共50 μL)包含10×Buffer(含MgCl2)5.0 μL,200 mmol/μL dNTPs 1 μL,10 μmol/L双向引物各2 μL,50 U/μL Taq酶0.1 μL,100 ng/μL DNA模板2 μL,用灭菌超纯水补足至50 μL。PCR反应程序:94℃下预变性5 min;94℃下循环变性30 s, 55℃下退火复性1 min,72℃下延伸40 s,共进行40个循环;最后在72℃下再延伸10 min,于4℃下保存[15]。PCR扩增产物的初步鉴定采用10 g/L琼脂糖凝胶电泳分离,由生工生物工程(上海)股份有限公司完成PCR产物测序工作,获得的序列与NCBI GenBank中酵母菌序列进行同源性比对,鉴定菌种。
1.2.2 海洋红酵母摇床扩培及生长曲线 从平板上接2环到装液量为80 mL/500 mL的三角锥形瓶中(30℃、160 r/min),24 h形成种子培养基,再将种子培养基以6%的接种量接种到装液量为80 mL/500 mL的锥形瓶中,其他培养条件不变,培养48 h。用血球板方法计数[16]。
采用分光光度计测定OD值,以时间为横坐标,酵母培养液的OD值为纵坐标绘制生长曲线。
1.2.3 菌种收集 采用液体活化培养基发酵菌种48 h后以4000 r/min离心10 min。弃上清,收集菌体,用于后期干物质、氨基酸和脂肪酸等的测定。
1.2.4 类胡萝卜素的提取和测定 采用丙酮萃取方法。菌种培养48 h后,收集菌体置于恒温烘箱(40℃)中烘干至恒重,取1 g干酵母,按比例加入一定量的盐酸(3 mol/mL),室温振荡40 min,沸水浴加热4 min后,迅速冷却,以4000 r/min离心10 min,弃上清,将沉淀用水洗后再离心,重复以上步骤1次,得细胞碎片。随即在细胞碎片中加入50 mL丙酮,室温振荡30 min,以4000 r/min离心10 min,取上清液。重复浸提2次,直到沉淀没有颜色,此时所得上清液即为类胡萝卜素提取液。
色素含量(μg/g干质量)=ODmax×D×V/0.16W。其中:OD为475 nm波光处的吸光度;D为测定试样时的稀释倍数;V为丙酮的用量(mL);W为酵母菌干质量(g);0.16为胡萝卜素的摩尔消光系数[17]。
1.2.5 基础营养成分及氨基酸含量的测定 分别采用凯氏定氮法(GB/T6432—94)、索氏抽提法(GB/T6433—94)、550℃燃烧后称量残余物的方法(GB/T6438—92)、550℃烘干至恒重的方法测定粗蛋白质、粗脂肪、灰分和水分含量。按GB/ T18246—2000的方法,样品经水解后,利用A300型氨基酸全自动分析仪进行分析。
1.2.6 脂肪酸含量的测定
(1)提取。将样品放入50 mL离心管中,用玻璃棒将菌丝绞碎,加入5 mL超纯水搅拌溶解,再加入40 mL混合溶剂(乙醇∶乙醚∶石油醚= 2∶1∶1),用力摇5 min,再以3500 r/min离心5 min,吸取上清液;第二次加入10 mL混合溶剂(石油醚∶乙醚=1∶1),再以3500 r/min离心5 min,吸取上清液;在45℃的水浴锅吹氮气,直至吹干。
(2)甲酯化。加2 mL正己烷到烧杯中,将油脂溶解,倒入5 mL带盖玻璃管中,加入0.5 mL KOH-甲醇溶液(4 mol/L),振荡1 min,静置直至上层清液清澈,吸取上清液,上机。
(3)色谱条件。安捷伦气相色谱仪7820,色谱柱为DB-23(30 m×0.25 m×0.25 μm),检测器为FID,进样口温度为300℃,检测器温度为250℃,进样量为1 μL。初始温度为50℃,以10.0℃/min升温至180℃,保持5 min;再以5.0℃/min升温至230℃,保持2 min,分流比为20∶1。脂肪酸的定量分析采用面积归一法计算而得。
1.3 数据处理
试验所得数据使用Excel 2003软件进行处理,数据结果用平均值±标准差表示。
2 结果与分析
2.1 菌种的生化鉴定
将菌种活化、分离、纯化培养48 h后,菌落在平板上显粉红色圆形,表面光滑、隆起、湿润、不透明、边缘整齐,易挑起,直径为3~5 mm(图1)。酵母细胞呈椭圆形,直径为5 μm左右,出芽生殖(图2)。

图1 海洋红酵母数码照片Fig.1 Digital photo of yeast Rhodotorula benthica
图2 海洋红酵母显微照片(200×)Fig.2 Micrograph of yeast Rhodotorula benthica(200×)
酵母菌生理生化特性鉴定指标有碳源发酵测试、碳源同化、肌醇同化测试等[18]。此菌株对葡萄糖、乳糖、海藻糖、蔗糖、甘露糖、半乳糖和麦芽糖均不发酵,能同化硝酸钾、亚硝酸钠、麦芽糖、蔗糖、甘露糖、海藻糖、木糖,不能同化葡萄糖、鼠李糖、乳糖、淀粉、蜜二糖和肌醇,尿素分解呈阳性,脲酶试验呈阴性,部分结果见表1。该菌株的形态学和各项生理生化检测结果符合红酵母Rhodotorula特征,初步确定该菌株为海洋红酵母。
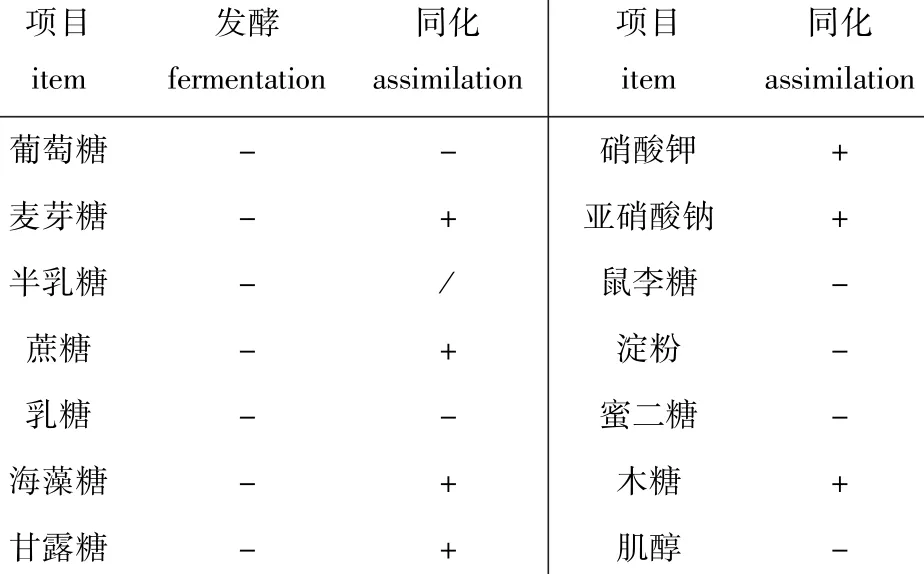
表1 海洋红酵母的生理特征Tab.1 Physiological properties of the yeast strain of Rhodotorula benthica
2.2 菌种的分子鉴定
2.2.1 菌种片段克隆鉴定 利用真菌ITS基因引物对酵母菌总DNA进行扩增,测序获得598 bp目的片段,并在NCBI网站上进行序列比对,结果表明,该酵母菌的ITS序列与斯鲁菲亚红酵母Rhodotorula slooffiae序列一致性为99%~100%。据此将该菌株鉴定为斯鲁菲亚红酵母。
2.2.2 5种海洋红酵母的核苷酸相似性 利用该斯鲁菲亚红酵母与其他4种海洋红酵母——黏红酵母Rhodotorula glutinis、牧草酵母Rhodotorula graminis、小红酵母Rhodotorula minuta、胶红酵母Rhodotorula mucilaginosa的ITS基因片段进行核苷酸序列进行比较,分析其相似性,并运用Neighbor-Joining方法构建此5种海洋红酵母基于ITS基因序列的系统进化树。从表2和图3可以看出,该斯鲁菲亚红酵母的ITS基因序列与小红酵母的核苷酸相似性最高,进化树也与小红酵母聚于一支,可见这两种海洋红酵母遗传距离较近。
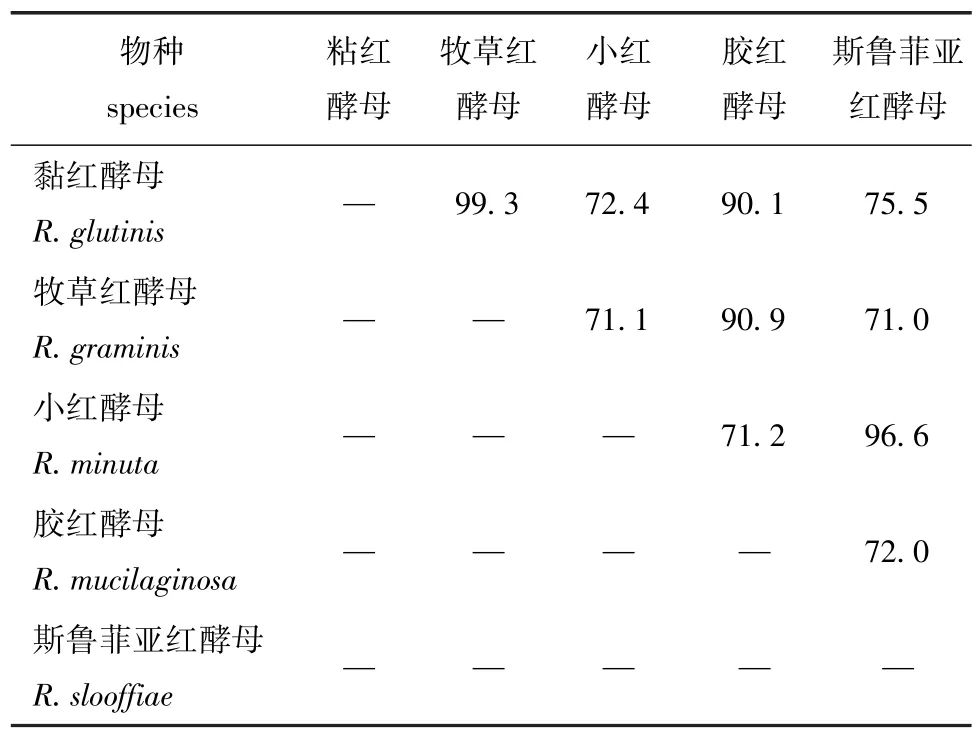
表2 斯鲁菲亚红酵母与其他4种海洋红酵母ITS基因核苷酸相似性Tab.2 Similarity of the nucleotide sequence for ITS genes among yeasts Rhodotorula slooffiae and the other 4 species of Rhodotorula sp.%
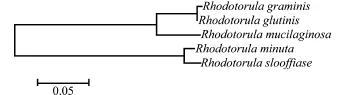
图3 基于ITS核苷酸序列构建的5个物种的系统进化树Fig.3 Phyogenetic tree of 5 species in Rhodotorula sp. based on ITS nucleotide sequence
2.3 生长曲线及类胡萝卜素含量
将活化的菌种接种到液体培养基中,以160 r/min在30℃下恒温培养,每3 h摇匀菌悬液,用分光光度计于600 nm波长处测定OD值,用蒸馏水做空白对照,记录数值。海洋红酵母在液体培养基中的生长曲线见图4。在13 h内,菌体处于生长潜伏期,13~48 h为指数增生期,48 h之后为生长停滞期(图4)。48 h为菌体的生长峰值,此时的菌体密度为2.25×108cfu/mL,类胡萝卜素含量为83.6 μg/g。
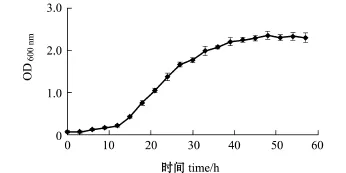
图4 斯鲁菲亚红酵母的生长曲线Fig.4 Growth curve of yeast Rhodotorula slooffiae
2.4 海洋红酵母的一般营养成分
菌体扩培48 h后,收集菌体,此株海洋红酵母菌体的粗蛋白质含量(质量分数,下同)为干质量的48.70%,粗脂肪含量为23.35%,粗灰分含量为15.27%。
2.5 斯鲁菲亚红酵母的氨基酸组成
从表3可知,该株红酵母含有常见的16种氨基酸,其中10种为必需氨基酸。氨基酸含量总计为261.9 mg/g(干质量),其中非必需氨基酸为148.1 mg/g(干质量),占总氨基酸含量的56.55%,必需氨基酸为113.8 mg/g(干质量),占总氨基酸含量的43.45%。非必需氨基酸中以谷氨酸含量最高(41.2 mg/g),占总氨基酸含量的15.73%;必需氨基酸中蛋氨酸含量最低(3.8 mg/g)。
2.6 斯鲁菲亚红酵母的脂肪酸组成
从该株斯鲁菲亚红酵母中共检出17种脂肪酸,脂肪酸含量为200.9 mg/g(干质量),脂肪酸各组分所占的比例见表4。该红酵母中饱和脂肪酸(SFA)总量占脂肪酸总量的31.92%,其中以棕榈酸含量最高(19.77%)。不饱和脂肪酸(UFA)总量占脂肪酸总量的68.08%,其中5种单不饱和酸(MUFA)总量占脂肪酸总量的37.76%,其中以顺式油酸含量最高(34.71%);4种多不饱和脂肪酸(PUFA)总量占脂肪酸总量的30.32%,其中以顺式亚油酸含量最高(25.24%)。
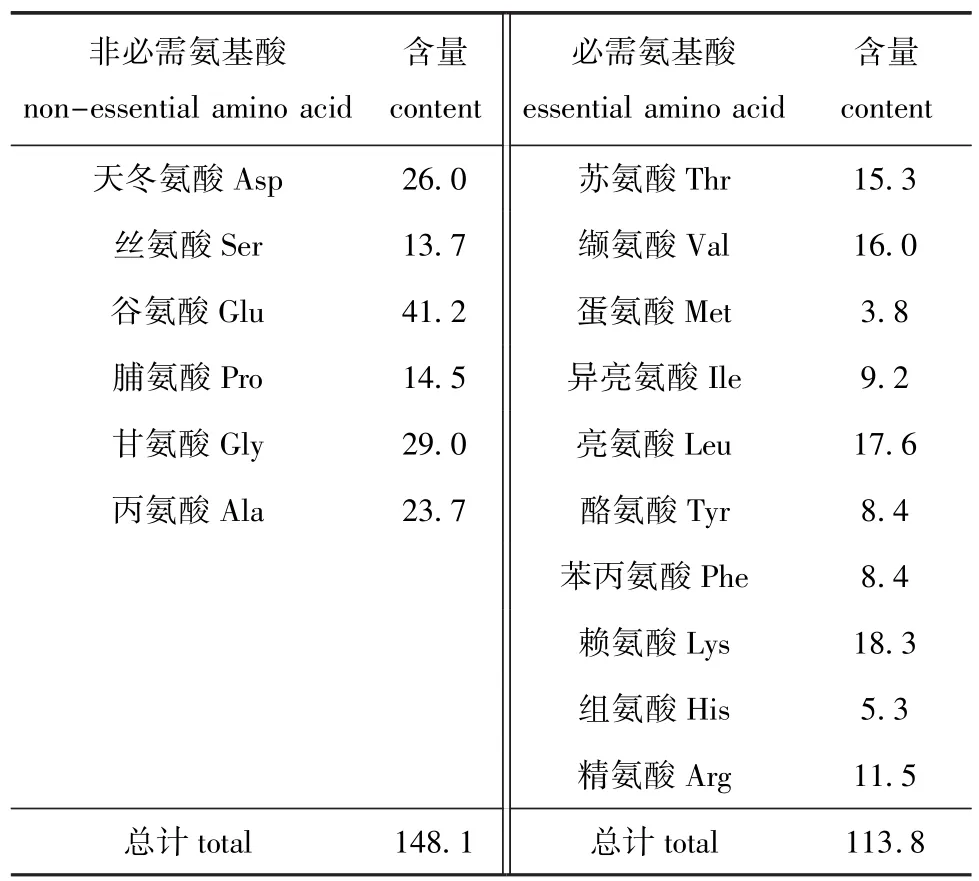
表3 斯鲁菲亚红酵母的氨基酸组成及含量Tab.3 Amino acid composition and content of the yeast Rhodotorula slooffiaemg/g
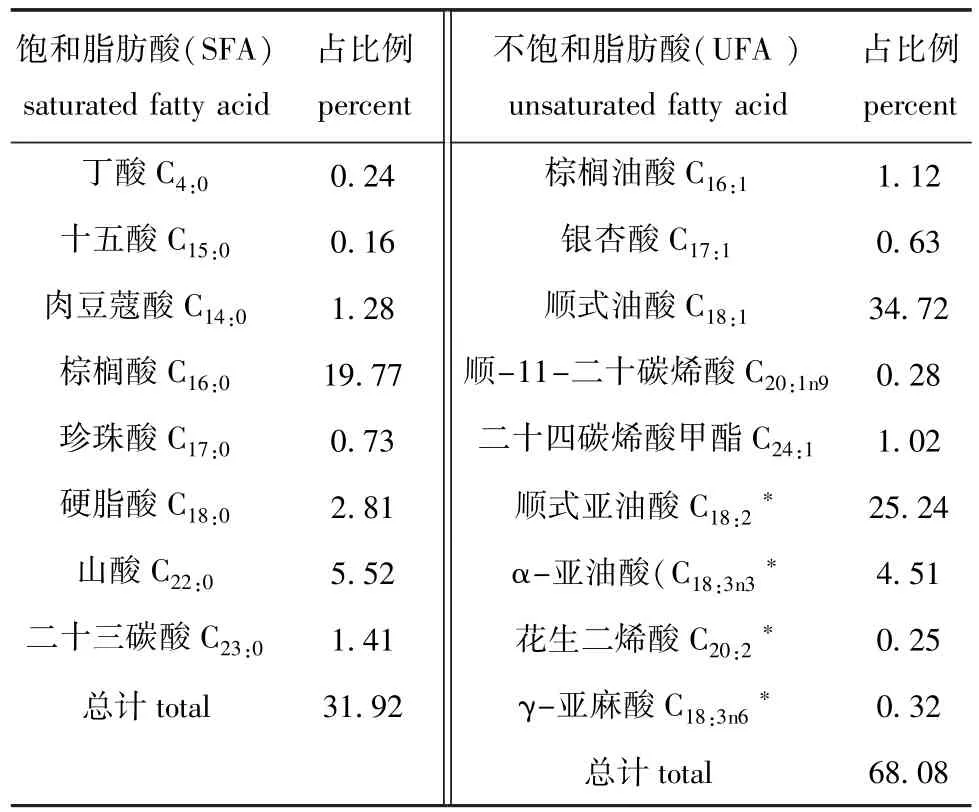
表4 斯鲁菲亚红酵母的脂肪酸组成及其比例Tab.4 Fatty acid composition and percent in the yeast Rhodotorula slooffiae%
3 讨论
目前,有关海洋红酵母的营养性能研究报道较多,杨世平等[19]对海洋红酵母的基础营养成分、脂肪酸和氨基酸进行了研究和分析,发现其蛋白质、总糖、必需氨基酸含量较高,具备了作为水产饵料生物的重要条件。李娟等[20]对于黄海近海获得的1株酵母菌进行了营养成分分析,结果与杨世平等[19]的研究结果相似。Yang等[21]研究表明,海洋红酵母具有增强凡纳滨对虾抗氧化能力及促进对虾生长等作用。研究表明,海洋红酵母有望成为水产养殖的新型饵料和微生态制剂。
本试验中,也对获得的斯鲁菲亚红酵母进行了营养性能测定,表明其粗蛋白质占干质量的48.70%,说明此株红酵母中蛋白质含量较高,可满足水产养殖动物饵料蛋白质含量30%~56%的需求,粗灰分占干质量的15.27%,说明其矿物质含量较高。而对此株红酵母脂肪酸的测定结果显示,其富含脂肪酸最多的是顺式油酸(C18:1),其次是顺式亚油酸(C18:2)、棕榈酸(C16:0),缺少多不饱和脂肪酸中的二十碳五烯酸(C22:5,EPA)、二十二碳六烯酸(C22:6,DHA)、α-亚麻酸(C18:3),这与高玲美[22]、蔡诗庆等[23]、杨世平等[19]、李娟等[20]的研究结果类似,均缺乏不饱和脂肪酸DHA和EPA[24],因此,在其作为水产饵料的使用中,需添加富含这两种多不饱和脂肪酸的藻类、鱼油或者其他物质,以弥补此缺陷[15]。
目前,水产饲料用鱼粉、鱼油等动物性原料昂贵,大部分采用了植物蛋白替代,而植物蛋白中缺乏蛋氨酸和赖氨酸等,造成大多商品饲料中缺乏鱼类限制性氨基酸——赖氨酸、蛋氨酸、精氨酸和苯丙氨酸等。而海洋红酵母富含此类氨基酸,大有可能作为单细胞动物蛋白源提供鱼类所需的限制性氨基酸。已有研究表明,对鱼类具有诱食活性的主要是L-型氨基酸,包括甘氨酸、L-丙氨酸、精氨酸、赖氨酸和由氨基酸合成的谷胱甘肽(GSH)等,而红酵母中精氨酸、丙氨酸、甘氨酸等含量丰富,拌饲投喂可能具有诱食鱼类的作用。
另有研究表明,在斑马鱼的肠道中分离获得了斯鲁菲亚红酵母[25],可见此种酵母可能对鱼类的生长无害。在饵料中添加类胡萝卜素具有抗氧化、防癌、增色,以及增强免疫力和抗应激的功能[26-30],而此红酵母经YPD培养基培养48 h后,达到生长峰值为2.25×108cfu/mL,类胡萝卜素含量为83.6 μg/g,可见其生长速度较快,类胡萝卜素含量较高,这为其作为水生动物饵料添加剂提供了必备条件。但相较于其他研究中海洋红酵母所产的类胡萝卜素,含量还有待提升,目前也有众多的方法可达到此目的,例如通过调节碳源浓度、氮源浓度,添加无机盐(MgCl2、KH2PO4)和花生油、番茄汁、维生素B1等外源性物质,以及获得变异菌种和调节培养条件(分批补料、温度、pH)等,皆可增加海洋红酵母的生长量和类胡萝卜素产量[31-38]。由此可知,此红酵母能否成为鱼类良好的饵料添加剂或者微生态制剂需要进一步验证。
综上所述,海洋红酵母是海洋环境中的腐生菌,营养需求粗放,生长周期短且能产生类胡萝卜素。菌体本身含有丰富的蛋白质、糖类、维生素等,除能提取色素外,还可以将全细胞作为色素单细胞蛋白,用于饵料、饲料添加剂和微生态活菌制剂,具有巨大的商业应用潜力。
[1] Hagler A N,Ahearn D G.Ecology of aquatic yeasts[M].Rose A H,Harrison J S.The Yeasts.London,UK:Academic Press,1987:181-205.
[2] Bon J A,Leathers T D,Jayaswal R K.Isolation of Astaxanthin-overproducing Mutants of Phaffia rhodozyma[J].Biotechnology Letters,1997,19(2):109-112.
[3] 王岁楼.食品生物技术[M].北京:中国海洋出版社,1998.
[4] Misawa N,Shimada H.Metabolic engineering for the production of carotenoids in non-carotenogenic bacteria and yeasts[J].Journal of Biotechnology,1998,59(3):169-181.
[5] 刘秀莲,王宇光.海洋红酵母的研究进展[J].生物技术通讯, 2008,19(2):293-295.
[6] 刘秀莲.海洋红酵母表达载体的构建及其转化体系的研究[D].海口:海南大学,2008.
[7] 薛德林,胡江春,王国安,等.海洋胶红酵母、光合细菌、生化黄腐酸在海参育苗和养成中的应用效果[J].腐植酸,2009(4):19-24.
[8] 郝佳,吴英茜,刘晗奇,等.几种微生态制剂对刺参幼参生长、存活和消化酶活性的影响[J].大连海洋大学学报,2015,30 (3):248-252.
[9] 徐琴,李健,刘淇,等.4种微生态制剂对对虾育苗水体主要水质指标的影响[J].海洋科学,2009,33(3):10-15.
[10] 王宇光,雷禄旺,刘秀莲,等.海南海域海洋红酵母的分离鉴定和应用性能评价[J].中国农学通报,2009,25(22):324-328.
[11] Nagahama T,Hamamoto M,Nakase T,et al.Distribution and identification of red yeasts in deep-sea environments around the northwest Pacific Ocean[J].Antonie van Leeuwenhoek,2001,80 (2):101-110.
[12] Nagahama T,Hamamoto M,Nakase T,et al.Rhodotorula benthica sp.Nov.and Rhodotorula calyptogenae sp.Nov.,novel yeast species from animals collected from the deep-sea floor,and Rhodotorula lysiniphila sp.Nov.,which is related phylogenetically[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(3):897-903.
[13] 周与良,黄铁石,但汉斌,等.中国海红酵母属(Rhodotorula Harrison)的种类[J].南开大学学报:自然科学,1999,32(4):115-116.
[14] 李明,马悦欣,刘志明,等.刺参机体酵母菌组成及其拮抗活性的研究[J].大连海洋大学学报,2012,27(5):436-440.
[15] 徐志进,章霞,柳敏海,等.利用Cytb和16S rRNA序列研究多鳞四指马鲅和四指马鲅的种群遗传结构[J].大连海洋大学学报,2015,30(3):266-270.
[16] 周德庆.微生物学实验教程[M].2版.北京:高等教育出版社,2006.
[17] 周鲜娇.不同培养条件对海洋红酵母类胡萝卜素累积的影响[J].安徽农业科学,2011,39(15):8845-8847.
[18] Barnett J A,Payne R W,Yarrow D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991.
[19] 杨世平,吴灶和,简纪常.一株海洋红酵母(Rhodosporidium paludigenum)的营养组分分析[J].饲料工业,2011,32(10):52-54.
[20] 李娟,刘丹梅,孙书伟,等.1株高蛋白海洋酵母菌的鉴定及营养成分分析[J].江苏农业科学,2014,42(1):269-270,296.
[21] Yang Shiping,Wu Zaohe,Jian Jichang,et al.Effect of marine red yeast Rhodosporidium paludigenum on growth and antioxidant competence of Litopenaeus vannamei[J].Aquaculture,2010,309 (1-4):62-65.
[22] 高玲美.高蛋白海洋酵母的初步研究[D].青岛:中国海洋大学,2007.
[23] 蔡诗庆,胡超群,任春华.三株海洋酵母的生化营养成分分析[J].热带海洋学报,2009,28(2):62-65.
[24] Brown M R,Barrett S M,Volkman J K,et al.Biochemical composition of new yeasts and bacteria evaluated as food for bivalve aquaculture[J].Aquaculture,1996,143(3-4):341-360.
[25] 胡秀彩,戚冰洁,顾丹,等.斑马鱼肠道中一株红酵母(Rhodotorula)的分离与鉴定[J].生物技术,2011,21(4):55-58.
[26] Berera R,van Stokkum I H M,Kennis J T M,et al.The light-harvesting function of carotenoids in the cyanobacterial stress-inducible IsiA complex[J].Chemical Physics,2010,373(1-2):65-70.
[27] Bhagavathy S,Sumathi P.Evaluation of antigenotoxic effects of carotenoids from green algae Chlorococcum humicola using human lymphocytes[J].Asian Pacific Journal of Tropical Biomedicine, 2012,2(2):109-117.
[28] Chew B P,Park J S,Wong M W,et al.A comparison of the anticancer activities of dietary beta-carotene,canthaxanthin and astaxanthin in mice in vivo[J].Anticancer Research,1999,19 (3A):1849-1853.
[29] 张娟娟,李小勤,冷向军,等.虾青素在虹鳟体内的沉积与降解研究[J].水产学报,2012,36(12):1872-1879.
[30] 夏冬梅,杨铿,李卓佳,等.海洋红酵母对凡纳滨对虾生长及免疫的影响[J].广东农业科学,2013,40(14):133-137.
[31] 王洛洋,纪政,胡宗仁,等.高超氧化物歧化酶活性海洋红酵母的筛选[J].食品与生物技术学报,2012,31(4):433-437.
[32] 周鲜娇,田丽,梁如璞,等.一株海洋红酵母的鉴定及其培养基的优化[J].水产科学,2012,31(2):107-110.
[33] 杨铿,陈永青,梁晓华,等.海洋胶红酵母Y2产类胡萝卜素发酵促进剂的研究[J].南方水产科学,2013,9(2):45-49.
[34] 杨世平,刘慧玲,刘付文添.沼泽生红冬孢酵母的固体培养条件[J].广东海洋大学学报,2013,33(3):22-26.
[35] 王伟霞,李福后,浦寅芳.海洋红酵母产类胡萝卜素的研究[J].食品研究与开发,2007,28(10):55-58.
[36] Bhosale P,Gadre R V.Production of β-carotene by a Rhodotorula glutinis mutant in sea water medium[J].Bioresource Technology,2001,76(1):53-55.
[37] 杨莺莺,陈永青,杨铿,等.海洋红酵母RH1菌株发酵培养条件的研究[J].南方水产科学,2012,8(1):67-74.
[38] 赵玉巧,陈玲玲,杜云建.产类胡萝卜素的海洋红酵母的培养条件优化研究[J].安徽农业科学,2013,41(9):4071-4074.
Identification and nutrient analysis of a species yeast Rhodotorula benthica
ZHANG Xia,XU Zhi-jin,LIU Min-hai,LI Wei-ye,LI Ling-gang,YE Jian-ying,FU Rong-bing
(Zhoushan Fisheries Research Institute of Zhejiang Province,Zhoushan 316000,China)
Identification,culture performance and nutrient analysis were conducted in a yeast Rhodotorula benthica by physiological and biochemical and molecular methods to explore the possibility of a yeast Rhodotorula benthica as dietary protein resource in aquaculture.It was found that the strain was similar to another Rhodotorula benthica in colony,cell morphology and physiological biochemical characteristics.Amplification and partially sequencing of ITS gene revealed that there was a 598 bp fragment in the total DNA sequence of the yeast,with 99%homology of nucleotide sequence with that in the reported Rhodotorula slooffiae ITS gene by NCBI GenBank,indicating that the yeast strain is Rhodotorula slooffiae.The peak value of 2.25×108cfu/mL and the maxiaml carotenoid concentration of 83.6 μg/g were observed in the liquid medium culture of the yeast strain.The findings indicate that Rhodotorula slooffiae is rich in nutrients including vitamins,unsaturated fatty acids and proteins,playing an important role in aquaculture in the future.
Rhodotorula benthica;nutritional property;physiological and biochemical analysis;carotenoid
S963
A
10.16535/j.cnki.dlhyxb.2017.04.010
2095-1388(2017)04-0434-06
2016-08-18
海洋经济创新发展区域示范项目(浙海渔计〔2015〕29号);舟山市公益类科技项目(2013C31047,2015C31009);浙江省公益技术研究农业项目(2015C32111)
章霞(1989—),女,工程师。E-mail:yufan414515@163.com
傅荣兵(1971—),男,高级工程师。E-mail:853966748@qq.com
