银离子络合法分离纯化余甘子核仁油中α-亚麻酸
2017-07-20葛双双张雯雯
葛双双,张雯雯,李 坤,冯 颖,甘 瑾,郑 华,张 弘*
(中国林业科学研究院资源昆虫研究所,国家林业局特色森林资源工程技术研究中心,云南 昆明 650224)
银离子络合法分离纯化余甘子核仁油中α-亚麻酸
葛双双,张雯雯,李 坤,冯 颖,甘 瑾,郑 华,张 弘*
(中国林业科学研究院资源昆虫研究所,国家林业局特色森林资源工程技术研究中心,云南 昆明 650224)
利用Ag+络合技术分离、纯化余甘子核仁油中α-亚麻酸,旨在获得高纯度的α-亚麻酸。通过单因素试验考察了AgNO3溶液浓度、甲醇溶液体积分数、络合时间、络合温度对α-亚麻酸纯度及回收率的影响。在单因素试验基础上,以α-亚麻酸纯度及回收率为响应值,进行Box-Behnken试验设计,优化得到的最佳工艺条件为络合温度为0 ℃、AgNO3溶液浓度为2.29 mol/L、甲醇溶液体积分数为38.00%、络合时间为1.93 h,在此工艺条件下,α-亚麻酸纯度及回收率分别为93.30%及73.37%。对络合后的AgNO3进行回收并二次络合,结果表明:AgNO3的回收率达93.83%,回收的Ag+具有较好的络合效果,在整个络合工艺中并未引入Ag+,因此,该方法不仅实现了对余甘子核仁油中α-亚麻酸的分离、纯化,而且降低了络合工艺的操作成本,同时具有一定安全性,为余甘子核仁油的工业化应用提供理论依据。
余甘子核仁油;α-亚麻酸;Ag+络合
葛双双, 张雯雯, 李坤, 等. 银离子络合法分离纯化余甘子核仁油中α-亚麻酸[J]. 食品科学, 2017, 38(14): 213-220. DOI:10.7506/spkx1002-6630-201714033. http://www.spkx.net.cn
GE Shuangshuang, ZHANG Wenwen, LI Kun, et al. Separation and purification of α-linolenic acid from Phyllanthus emblica L. seed oil by silver iron complexation[J]. Food Science, 2017, 38(14): 213-220. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714033. http://www.spkx.net.cn
余甘子核仁油中含有丰富的不饱和脂肪酸,其中(Z,Z,Z)-9,12,15-十八碳三烯酸(α-亚麻酸)含量更是高达68.25%[1],这与富含α-亚麻酸的亚麻籽油[2-3]、紫苏籽油[4]相近。α-亚麻酸属于ω-3系列多不饱和脂肪酸,是人体不能自身合成的必需脂肪酸,具有降血脂、降血压、抑制过敏、抗血栓、抗肿瘤、保护视力等作用[5-7]。因此,从余甘子核仁油中分离、纯化高纯度的α-亚麻酸,对扩大余甘子核仁油的利用、提高油脂的附加值具有重大的意义。
目前,分离α-亚麻酸的方法主要有:分子蒸馏法[8]、超临界流体萃取法[9-10]、尿素包合法[11-12]、柱色谱法[13]、Ag+络合法[14-16]等[17-18]。其中,分子蒸馏法、超临界流体萃取法、柱色谱法对设备要求较苛刻,并且操作成本高,不适合工业化生产[19-21]。尿素包合法具有投资少、操作简单等特点,已被工业化应用。但是,尿素包合法是基于脂肪酸中双键的存在形态而分离、纯化多不饱和脂肪酸,饱和与单不饱和脂肪酸比较容易进入尿素分子间的空管道,进而形成具有六棱柱结构的尿素包合物,对于含有2 个及2 个以上双键的多不饱和脂肪酸来说,因其碳链比较弯曲且具有一定的空间结构,尿素包合法很难将其分离[22]。Ag+络合法是基于Ag+能够与含有特殊官能团或结构的有机物形成p-络合作用[23],目前该方法已经成功应用于蚕丝纤维[24]、茄尼醇[25]、萘[23]、多不饱和脂肪酸[26-27]等成分的分离纯化,并且络合效率较高。但是,相关研究中多数未对络合后的Ag+进行回收,并且没有对回收的Ag+进行再次利用,因此,使用该方法不仅增加了操作成本,而且造成了重金属的污染,同时,对于茄尼醇、多不饱和脂肪酸等功能性成分,Ag+的使用具有一定的安全问题[28]。本实验针对上述缺陷,在采用Ag+络合技术对余甘子核仁油中α-亚麻酸纯化基础上,考虑实际操作成本及安全性问题,针对络合后的Ag+进行回收再利用,并对纯化后的α-亚麻酸进行Ag+残留检测,旨在开发出高效、低成本、安全富集α-亚麻酸的工艺。
1 材料与方法
1.1 材料与试剂
余甘子核仁由中国林业科学研究院资源昆虫研究所景东亚热带试验站提供;混合脂肪酸由尿素包合精制。
异辛烷(分析纯) 西陇化工有限公司;无水硫酸钠(分析纯) 天津风船化学试剂有限公司;氯化钠(分析纯) 天津致远化学试剂有限公司;正己烷、乙二醇、石油醚(沸程60~90 ℃)、硝酸银(均为分析纯) 广东光华科技有限公司;三氟化硼甲醇络合物上海麦克林生化科技有限公司;十九烷酸甲酯、α-亚麻酸甲酯(色谱纯) 美国Sigma公司。
1.2 仪器与设备
AB204-S精密型电子天平 瑞士梅特勒-托利多(中国)有限公司;XMT-DA型数显恒温水浴锅 余姚市亚星仪器仪表有限公司;DC-0210低温恒温槽 上海匡贝实业有限公司;N1000 Rotavapor R11型旋转蒸发仪日本东京理化器械株式会社;ITQ 900气相色谱-质谱联用仪、iCAP QICP-MS电感耦合等离子质谱仪 赛默飞世尔科技(中国)有限公司;DFY-5L/30低温恒温反应槽巩义市予华仪器有限公司。
1.3 方法
1.3.1 Ag+络合混合脂肪酸
将混合脂肪酸配制成0.2 g/mL的石油醚溶液,配制一定浓度的AgNO3-甲醇溶液,将二者等体积混合,在一定温度条件下,于300 r/min磁力搅拌一定时间,静置分层,将下层水相与等体积的石油醚混合,在50 ℃搅拌30 min,重复上述反萃取步骤3 次,合并石油醚相,分别用等体积的饱和氯化钠溶液与去离子水洗涤3 次,加入无水硫酸钠脱水,溶剂经回收得到富含α-亚麻酸的脂肪酸。
1.3.2 脂肪酸的甲酯化
参照GB/T 17376—2008《动植物油脂 脂肪酸甲酯制备》中三氟化硼法。
1.3.3 气相色谱-质谱分析条件
气相色谱条件:CP7420毛细管柱(100 m× 0.25 mm,0.25 μm);升温程序:初始温度100 ℃,保持20 min,以20 ℃/min的速率升至190 ℃,保持20 min,然后以1 ℃/min的速率升温到210 ℃,保持10 min,再以20 ℃/min的速率升温至230 ℃,最后保持1 min;进样口温度230 ℃;载气为高纯氦气,流速1.0 mL/min;分流比50∶1;进样量1 μL。
质谱条件:电子电离源;离子源温度230 ℃;传输线温度250 ℃;质量扫描范围40~400 u。
采用面积归一化法计算α-亚麻酸的相对含量,即α-亚麻酸的纯度。
1.3.4 AgNO3的回收率的测定
将反萃取后的AgNO3溶液置于45 ℃条件下,避光磁力搅拌至溶液呈糊状,将浓缩的AgNO3溶液置于50 ℃的烘箱中,干燥至恒质量,将样品取出并置于干燥器中,待其冷却至室温后称质量,计算AgNO3的回收率。
1.3.5 回收AgNO3的二次络合
配制2.29 mol/L回收的AgNO3-甲醇(甲醇-水(19∶50,V/V))溶液,加入等体积0.2 g/mL多不饱和脂肪酸溶液,在0 ℃、300 r/min磁力搅拌1.93 h。将得到的水相按照1.3.4节中反萃取步骤,萃取富含α-亚麻酸的脂肪酸。
1.3.6 纯化后脂肪酸中Ag+残留量检测
取络合后富含α-亚麻酸的脂肪酸0.1 g,加入10 mL硝酸,30 min后加入5 mL的H2O2,样品摇匀后进行微波消解。将微波消解后的样品,用超纯水定容至100 mL,样品过0.45 μm滤膜后进行电感耦合等离子质谱检测。
1.3.7 单因素试验设计
1.3.7.1 AgNO3浓度的确定
在络合温度0 ℃、络合时间2 h、甲醇溶液体积分数40%的条件下,考察AgNO3溶液浓度分别在1、2、3、4、5 mol/L时,对α-亚麻酸纯度及回收率的影响,确定AgNO3溶液浓度。
1.3.7.2 络合时间的确定
在络合温度0 ℃、AgNO3溶液浓度2 mol/L、甲醇溶液体积分数40%的条件下,考察络合时间分别在0.5、1.0、1.5、2.0、2.5 h时,对α-亚麻酸纯度及回收率的影响,确定络合时间。
1.3.7.3 甲醇溶液体积分数的确定
在络合温度0 ℃、AgNO3溶液浓度2 mol/L、络合时间2 h的条件下,考察甲醇溶液体积分数分别在0%、10%、20%、30%、40%、50%时,对α-亚麻酸纯度及回收率的影响,确定甲醇溶液体积分数。
1.3.7.4 络合温度的确定
在AgNO3溶液浓度2 mol/L、络合时间2 h、甲醇溶液体积分数40%的条件下,考察络合温度分别在-5、0、5、10、15、20 ℃时,对α-亚麻酸纯度及回收率的影响,确定络合温度。
1.3.8 响应面优化试验设计
在单因素试验基础上,以α-亚麻酸纯度及回收率为响应值,以AgNO3溶液浓度、络合时间、甲醇溶液体积分数为考察因素,进行三因素三水平响应面试验,见表1。

表1 响应面优化试验因素与水平Table 1 Factors and their levels used in the Box-Behnken design
1.3.9 Ag+络合纯化后脂肪酸中α-亚麻酸绝对含量的测定
1.3.9.1 α-亚麻酸校正因子的测定
[29]选取十九烷酸甲酯作为内标物,分别配制2、4、6、8、10 mg/mL的α-亚麻酸甲酯及2 mg/mL的十九烷酸甲酯溶液,分别移取不同质量浓度的α-亚麻酸甲酯溶液1 mL与1 mL的十九烷酸甲酯溶液混合均匀,进行气相色谱-质谱检测,每个样品平行测定3 次,按公式(1)计算校正因子:

式中:fALA为α-亚麻酸的校正因子;AALA、A19分别为α-亚麻酸甲酯与十九烷酸甲酯的峰面积;mALA、m19分别为α-亚麻酸甲酯与十九烷酸甲酯的质量/mg。
1.3.9.2 α-亚麻酸绝对含量的测定
将纯化前后的脂肪酸按照1.3.2节进行甲酯化,并分别配制成2 mg/mL的溶液,将络合前后的脂肪酸甲酯溶液与2 mg/mL的十九烷酸甲酯溶液等体积混合,取适量混合液进行气相色谱-质谱检测,每个样品平行测定3 次,按公式(2)下计算α-亚麻酸的绝对含量:
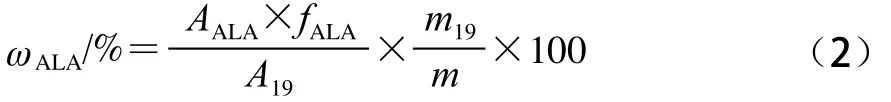
式中:ωALA为α-亚麻酸的绝对含量/%;fALA为α-亚麻酸的校正因子;AALA、A19分别为α-亚麻酸甲酯与十九烷酸甲酯的峰面积;m19、m分别为十九烷酸甲酯与样品的质量/mg。
1.3.9.3 α-亚麻酸回收率计算
按公式(3)计算α-亚麻酸回收率:

式中:Y为Ag+络合法纯化后α-亚麻酸回收率/%;m、m1分别为混合脂肪酸质量和Ag+络合后混合脂肪酸质量/g;p、p1分别为混合脂肪酸中α-亚麻酸纯度和Ag+络合后混合脂肪酸中α-亚麻酸纯度/%。
2 结果与分析
2.1 单因素试验结果
2.1.1 AgNO3溶液浓度对α-亚麻酸纯度及回收率的影响

图1 AgNO3溶液浓度对α-亚麻酸纯度及回收率的影响Fig. 1 Effect of silver nitrate concentration on the purity and yield of α-linolenic acid
Ag+与—C=C—络合的原理,普遍接受Dewar-Chatt-Duncanson模型(DCD模型),该模型认为—C=C—中不饱和电子与Ag+能够形成σ配位键;Ag+给出一对d电子到—C=C—π*反键轨道,形成反馈π键[30-32]。因此,双键越多、碳链越短、空间位阻越小的不饱和脂肪酸越容易与Ag+形成络合物。如图1所示,随着AgNO3溶液浓度增加,α-亚麻酸的纯度呈下降趋势,相反,α-亚麻酸回收率呈上升趋势。研究发现,余甘子核仁油中多不饱和脂肪酸的主要成分为(Z,Z)-9,12-十八碳二烯酸(亚油酸)和α-亚麻酸[1]。随着Ag+浓度的增大,越来越多的α-亚麻酸与Ag+形成络合物进入水相[33],在后续操作过程中更多的α-亚麻酸被洗脱分离出来,因而α-亚麻酸的回收率升高。与此同时,当体系中Ag+浓度增大时,会形成越来越多的亚油酸-nAg+络合物[27],因此,α-亚麻酸相对含量,即纯度下降。
2.1.2 甲醇溶液体积分数对α-亚麻酸纯度及回收率的影响

图2 甲醇溶液体积分数对α-亚麻酸纯度及回收率的影响Fig. 2 Effect of volume fraction of methanol on the purity and yield of α-linolenic acid
α-亚麻酸为非极性物质,由于碳链较长,当其与Ag+形成络合物时,仍然具有一定的疏水性[15],因此,选择合适的溶剂尤为重要。本实验选取甲醇溶液作为溶剂,能够保持α-亚麻酸-nAg+络合物的稳定性[34]。如图2所示,随着甲醇溶液体积分数的增加,α-亚麻酸纯度呈现先升高后降低的趋势,并在甲醇溶液体积分数为40%时达到最大值。当甲醇溶液体积分数增加时,不仅增大了络合萃取的分配比[16],而且提高了α-亚麻酸-nAg+络合物的稳定性[15,34],因此,α-亚麻酸的纯度升高。当甲醇溶液体积分数超过40%以后,越来越多的脂肪酸主要是因为甲醇的物理溶解作用进入水相,而Ag+络合作用则变为次要作用,两者互相作用的结果,使得α-亚麻酸的纯度下降[35]。同样,α-亚麻酸的回收率也出现一个先升高后降低的趋势,并在甲醇溶液体积分数为40%达到最高。在一定范围内,随着甲醇溶液体积分数增大,越来越多的α-亚麻酸与Ag+形成络合物,进而分离、纯化出来,当甲醇溶液体积分数达到50%的时候,由于在低温条件下操作,部分AgNO3在反应的过程中析出[36],因此,起到络合作用的有效Ag+量相对减少,导致α-亚麻酸回收率下降。
2.1.3 络合时间对α-亚麻酸纯度及回收率的影响
α-亚麻酸与Ag+的络合过程为可逆反应,因此,需要一定的络合时间才能达到稳定。如图3所示,随着络合时间的延长,α-亚麻酸纯度呈先升高后降低的趋势,并在络合时间为2.0 h时达到最高。当络合时间比较短时,α-亚麻酸-nAg+络合物不稳定,并且络合萃取的分配系数较小[34,37],进而被络合的α-亚麻酸较少,因此纯度比较低。当络合时间比较长时,Ag+不仅会络合α-亚麻酸,也会对亚油酸有一定络合,因而,α-亚麻酸相对含量下降,即纯度下降[26]。随着络合时间的延长,α-亚麻酸回收率呈先升高后平缓的趋势。随着络合时间的延长,越来越多的α-亚麻酸与Ag+形成较为稳定络合物,之后α-亚麻酸被洗脱分离出来,因此,α-亚麻酸回收率升高。当达到2.0 h以后,络合反应达到动态平衡[36],即α-亚麻酸-nAg+络合物的量一定,被纯化、分离出来的α-亚麻酸量基本恒定不变,因此,α-亚麻酸回收率基本不变。

图3 络合时间对α-亚麻酸纯度及回收率的影响Fig. 3 Effect of complexation time on the purity and yield of α-linolenic acid
2.1.4 络合温度对α-亚麻酸纯度及回收率的影响

图4 络合温度对α-亚麻酸纯度及回收率的影响Fig. 4 Effect of complexation temperature on the purity and yield of α-linolenic acid
温度是络合反应的一个重要参数,不仅影响反应过程的快慢,而且对络合物的稳定存在至关重要。由图4可见,随着络合温度的降低,α-亚麻酸纯度先增高后降低,并且在10 ℃时达到最高。Ag+络合过程属于放热反应[28],温度的降低有利于络合反应正向进行,越来越多的α-亚麻酸被Ag+络合纯化出来,因此,α-亚麻酸纯度升高。当络合温度低于10 ℃时,不仅有利于α-亚麻酸-nAg+络合物生成,也有利于亚油酸-nAg+络合物的稳定存在[35],使得部分亚油酸被反萃取出来,进而导致α-亚麻酸相对含量下降,即纯度下降。络合温度对α-亚麻酸回收率影响效果显著,随着络合温度的降低,α-亚麻酸回收率呈上升趋势,但是,当温度低于0 ℃时,α-亚麻酸回收率急剧下降。α-亚麻酸与Ag+的络合过程为放热反应,温度的升高不利于α-亚麻酸-nAg+络合物稳定存在[34-35],即被络合出来的α-亚麻酸的量减少,因而α-亚麻酸回收率降低。当温度低于0 ℃时,有白色絮状物质即α-亚麻酸-nAg+络合物沉淀产生[36],白色絮状物的存在使后续洗脱分离过程变得困难,因而,α-亚麻酸回收率的降低;另外,当络合温度过低时,部分AgNO3直接析出而没有起到络合α-亚麻酸的效果,使得α-亚麻酸回收率降低。2.2 响应面优化试验结果
2.2.1 工艺模型的建立及其显著性检验
α-亚麻酸与Ag+的络合过程属于放热反应,温度越低越有利于络合反应的进行,但是,随着温度的降低,AgNO3在甲醇溶液中的溶解度降低,当温度过低时,部分AgNO3直接析出,并未真正起到络合作用。在实际操作过程中发现,当温度低于0 ℃时,α-亚麻酸-nAg+络合物形成沉淀,不利于后续的反萃取过程,因此,在单因素试验的基础上,采用Box-Behnken试验方案进行三因素三水平试验设计,选用络合温度为0 ℃,以AgNO3溶液浓度、甲醇溶液体积分数、络合时间为考察因素,α-亚麻酸纯度Y1以及α-亚麻酸回收率Y2为响应值,见表2。

表2 响应面试验方案及结果Table 2 Box-Behnken design arrangement with response variables
对表2中的试验数据进行多元回归拟合分析,得到以α-亚麻酸纯度Y1及α-亚麻酸回收率Y2为目标函数的2 个二次多元回归方程,如表3所示。由2 个数学模型的决定系数(R2)及预测决定系数(R2Adj)可知,2个数学模型的拟合程度较好,因而模型可靠性高。
由表4可知,2 个回归模型失拟项不显著(P>0.05),并且α-亚麻酸纯度及回收率回归模型极显著(P<0.000 1),表明2 个模型实测值与预测值拟合度较好,因而该模型能较好地分析和预测余甘子核仁油中α-亚麻酸的纯化效果。

表 3α-亚麻酸纯度及回收率回归模型拟合结果Table 3 Fitted regression models for the purity and yield of α-linolenic acid

表4 α-亚麻酸纯度及回收率方差分析结果Table 4 Analysis of variance for the purity and yield of α-linolenic acid
对于α-亚麻酸纯度Y1,一次项A(AgNO3溶液浓度)、B(甲醇溶液体积分数)、C(络合时间)均极显著;交互项AB、AC、BC均极显著;二次项A2不显著,B2、C2均极显著。结合表4中F值大小,可知各因素对α-亚麻酸纯度影响效应依次为:AgNO3溶液浓度>甲醇溶液体积分数>络合时间。
对于α-亚麻酸回收率Y2,一次项A(AgNO3浓度)、B(甲醇溶液体积分数)极显著,C(络合时间)显著;交互项AB极显著,AC、BC均不显著;二次项A2、B2均极显著,C2不显著。结合表4中F值大小,可知各因素对α-亚麻酸回收率影响效应依次为:AgNO3溶液浓度>甲醇溶液体积分数>络合时间。
2.2.2 响应面分析
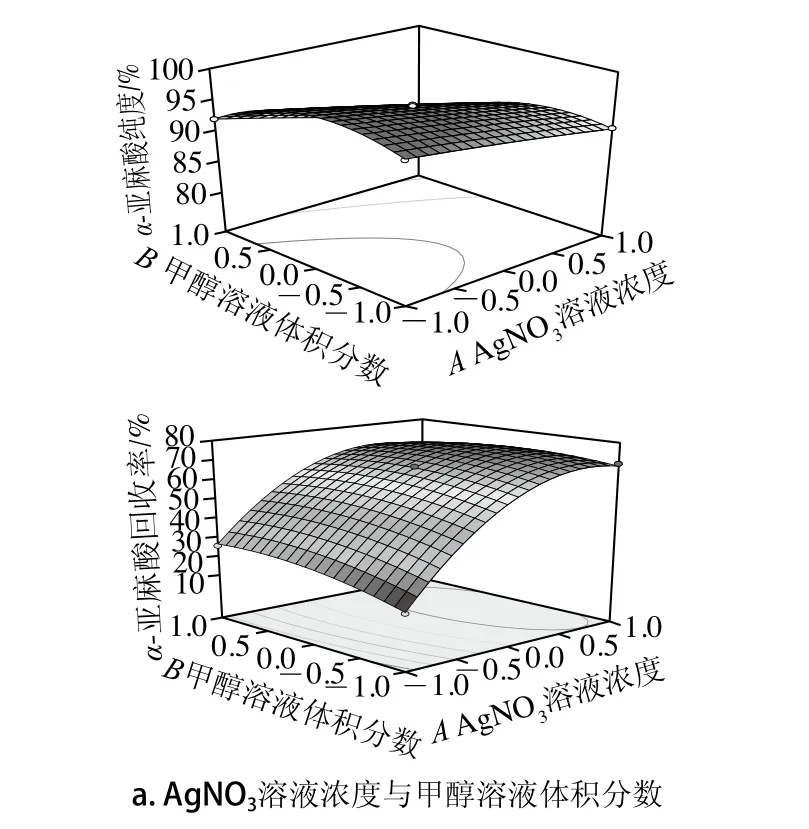
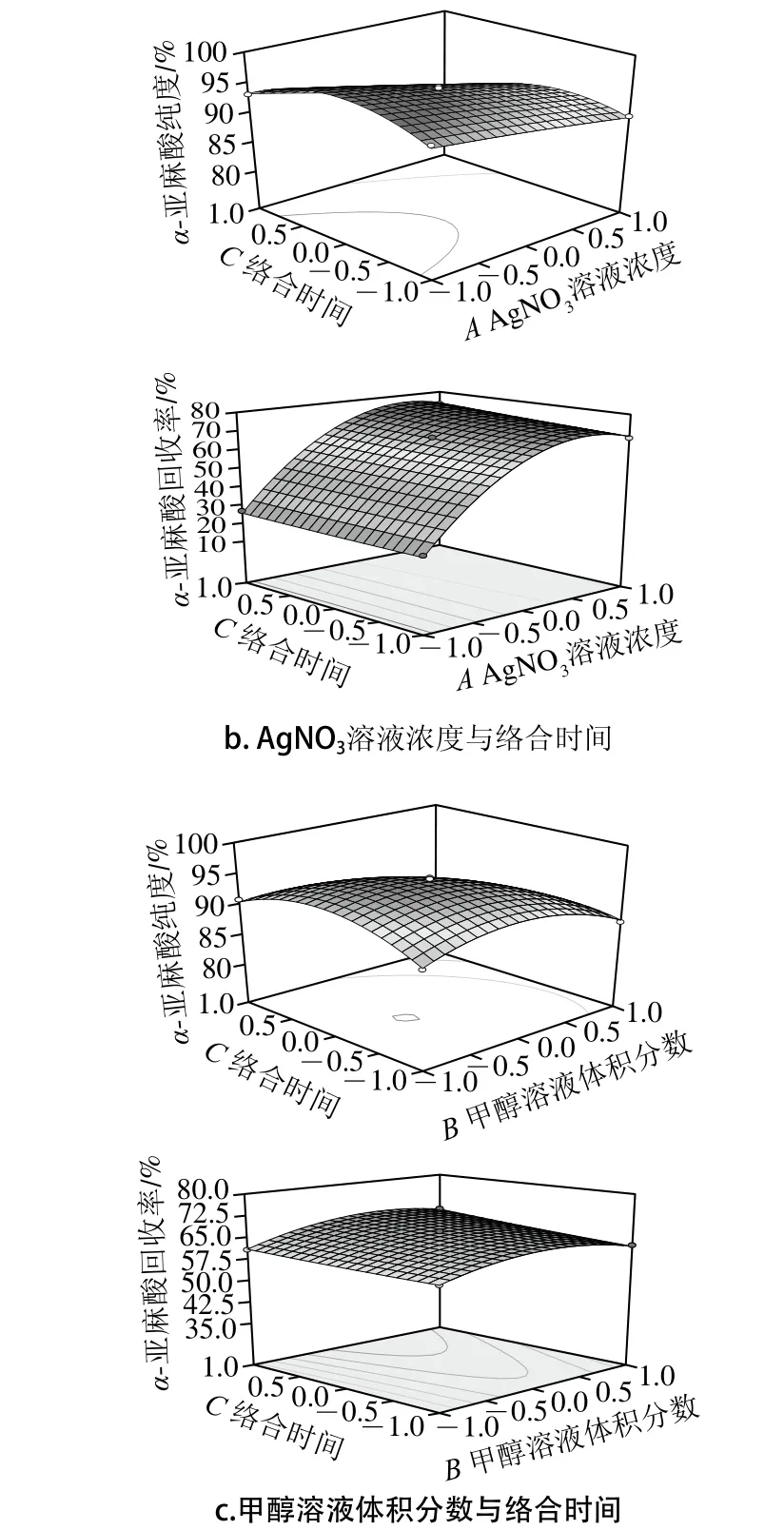
图5 两因素交互作用对α-亚麻酸纯度和回收率影响的响应面图Fig. 5 Response surface plots for the interactive effects of various factors on the yield of α-linolenic acid
如图5所示,AgNO3溶液浓度、甲醇溶液体积分数、络合时间3 个因素对α-亚麻酸纯度和回收率的影响,并能够反映3 个因素中任何两因素的交互影响。3 个因素中,AgNO3溶液浓度对α-亚麻酸纯度和回收率的影响最大,其次是甲醇溶液体积分数,络合时间影响最小。
2.3 验证实验结果
在Design-Expert 8.0.6优化下,最佳组合条件为AgNO3溶液浓度2.29 mol/L、甲醇溶液体积分数37.90%、络合时间1.93 h,在此条件下响应面模型预测得到的α-亚麻酸纯度及回收率分别为94.13%、70.59%。考虑到实际工艺操作,将优化条件圆整为:AgNO3溶液浓度2.29 mol/L、甲醇溶液体积分数38.00%、络合时间1.93 h,进行3 次验证实验,实际测得α-亚麻酸纯度及回收率分别为(93.30±0.21)%、(73.37±0.51)%。实验结果与预测值结果相差不大,说明2 个模型方程与实际情况拟合度较好,响应面法得到的模型方程,用于预测Ag+络合余甘子核仁油中的α-亚麻酸过程是可行的。
2.4 络合前后脂肪酸成分分析
如图6A、B所示,以α-亚麻酸甲酯与十九烷酸甲酯的质量浓度比为横坐标(x),相对应的α-亚麻酸甲酯与十九烷酸甲酯峰面积比为纵坐标(y),进行线性回归,其回归方程以及α-亚麻酸甲酯的校正因子,结果见表5。由图6C可知,混合脂肪酸主要有5 种脂肪酸,其中,饱和脂肪酸相对含量为1.14%,单不饱和脂肪酸相对含量为2.95%,多不饱和脂肪酸相对含量为95.23%。

图6 Ag+络合法纯化前后混合脂肪酸总离子流图(A、B)和脂肪酸相对含量变化(C)Fig. 6 Total ion current (TIC) chromatograms of mixed fatty acids and changes in relative contents of fatty acids before and after silver iron complexation

表 5α-亚麻酸甲酯相对十九烷酸甲酯的标准曲线及校正因子Table 5 Standard curve and correction factor forα-linolenic acid methyl ester relative to nonadecanoic acid methyl ester
混合脂肪酸经过Ag+络合后,α-亚麻酸的绝对含量则由原来的71.06%提高到94.17%,α-亚麻酸回收率为73.37%。分离、纯化得到的α-亚麻酸为人体不能自身合成而必需从外界摄取的必需脂肪酸,利用Ag+络合法将余甘子核仁油中的α-亚麻酸分离、纯化出来,为以后余甘子核仁油的进一步开发提供了良好的基础。
2.5 AgNO3的回收及其二次络合效果分析
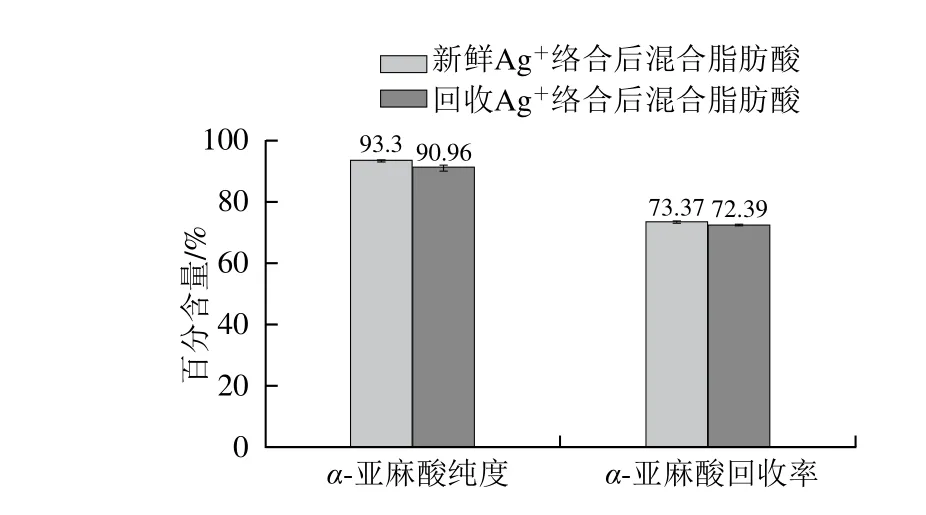
图7 不同种类AgNO3对α-亚麻酸纯度及回收率的影响Fig. 7 Effect of fresh and recovered silver nitrate on the purity and yield of α-linolenic acid
为避免Ag+对环境的污染,降低工艺成本,本实验对络合后的AgNO3进行回收,回收实验结果表明,回收率达到93.83%。将回收的AgNO3进行重复络合α-亚麻酸实验,如图7所示。新鲜的AgNO3与回收的AgNO3络合后的混合脂肪酸中α-亚麻酸纯度相差2.34%,α-亚麻酸回收率相差0.98%,整体来看,回收的AgNO3仍然具有较好的络合效果,并且,络合后的AgNO3回收率较高。因此,该方法不仅能够降低Ag+对环境的污染,有利于环保,而且,大大节省了该工艺的操作成本,对以后的工业化应用具有一定的指导意义。
2.6 纯化后脂肪酸中Ag+含量分析

表6 不同样品中Ag+含量变化Table 6 Comparison of silver iron content in different samples
由表6可知,混合脂肪酸中含有一定的Ag+,它的来源可能分为2 个部分:来源于未经任何加工的余甘子核仁本身,余甘子果树在生长过程中会富集土壤或水体当中的Ag+,且通过实验发现余甘子核仁中Ag+含量为4.80 ng/g;来源于加工过程,混合脂肪酸的制备需要经过余甘子核仁油的提取、皂化等一系列的加工过程,在加工过程中,用到的试剂中可能含有Ag+,因而,混合脂肪酸的加工过程亦是原料及试剂中的Ag+不断被富集的过程,这也从侧面印证了不饱和脂肪酸对Ag+有较强的络合能力,该配位键极易形成,从而使得混合脂肪酸中Ag+含量高于余甘子核仁。经Ag+络合后混合脂肪酸中Ag+含量略低于混合脂肪酸,说明在络合过程中并未引入Ag+,相反,在后续反萃取过程中,利用饱和氯化钠溶液以及蒸馏水洗涤时,将混合脂肪酸中部分Ag+经沉淀去除,同时也说明了反萃取方法能够将脂肪酸与Ag+较为彻底的洗脱分离。Ag+络合法纯化后的α-亚麻酸产品中Ag+含量远低于硝酸银硅胶柱层析法纯化后鱼油中的二十碳五烯酸[38],说明该方法具有一定的安全性。由上述结果可知,络合后的α-亚麻酸产品中并未引入Ag+,这为纯化后的α-亚麻酸进一步利用打下良好的基础[39]。
3 讨 论
利用Ag+络合技术成功将余甘子核仁油中α-亚麻酸分离、纯化出来。通过响应面优化,确定了最佳Ag+络合工艺参数:络合温度0 ℃、AgNO3溶液浓度2.29 mol/L、甲醇溶液体积分数38.00%、络合时间1.93 h,在此工艺条件下,α-亚麻酸纯度为93.30%,混合脂肪酸中的α-亚麻酸有73.37%被回收。经过分离、纯化之后的α-亚麻酸绝对含量达到94.17%。对络合后的AgNO3进行回收,回收率高达93.83%,回收后的AgNO3仍然具有较好的络合效果,因此,该方法不仅实现了AgNO3回收再利用,而且大大降低了该工艺的操作成本。考虑到产品安全性问题,对络合后的α-亚麻酸进行Ag+离子残留检测,结果显示,该工艺并未引入Ag+离子,相反,在后续操作过程中,还将混合脂肪酸中部分Ag+离子进行沉淀去除,这为纯化得到的α-亚麻酸进一步利用提供了安全保障。
Ag+离子络合技术分离、纯化余甘子核仁油中α-亚麻酸,方法操作简单,AgNO3可重复利用,操作成本大大降低,并且络合过程是在低温条件下完成的,能更好地保持α-亚麻酸活性,得到的α-亚麻酸产品中并未引入Ag+,具有一定的安全性。因此,该方法对余甘子核仁油中α-亚麻酸的开发及工业应用,具有一定的指导意义。
参考文献:
[1] 赵谋明, 刘晓丽, 罗维, 等. 超临界CO2萃取余甘子籽油及其成分研究[J]. 林产化学与工业, 2007, 27(5): 107-112. DOI:10.3321/ j.issn:0253-2417.2007.05.022.
[2] 龙云飞, 王沛佩, 杨克迪, 等. 响应面法优化亚麻籽油提取工艺[J].食品科学, 2012, 33(14): 45-49.
[3] 许晖, 孙兰萍, 李善菊, 等. 超声波辅助提取亚麻籽油的工艺条件优化[J]. 中国粮油学报, 2009, 24(7): 64-68.
[4] 陈琳, 李荣, 刘韬, 等. 冷、热榨对紫苏油酸价及不饱和脂肪酸含量的影响[J]. 食品科学, 2014, 35(8): 279-282. DOI:10.7506/spkx1002-6630-201408056.
[5] TSUZUKI T, TOKUYAMA Y, IGARASHI M, et al. Tumor growth suppression by alpha-eleostearic acid, a linolenic acid isomer with a conjugated triene system, via lipid peroxidation[J]. Carcinogenesis, 2004, 25(8): 1417-1425. DOI:10.1093/carcin/bgh109.
[6] BUDOWSKI P, CRAWFORD M A. α-Linolenic acid as a regulator of the metabolism of arachidonic acid: dietary implications of the ratio, n-6:n-3 fatty acids[J]. Proceedings of the Nutrition Society, 1985, 44(2): 221-229. DOI:10.1079/PNS19850041.
[7] BOSCO A D, CASTELLINI C, BIANCHI L, et al. Effect of dietary α-linolenic acid and vitamin E on the fatty acid composition, storage stability and sensory traits of rabbit meat[J]. Meat Science, 2004, 66(2): 407-413. DOI:10.1016/S0309-1740(03)00127-X.
[8] 陈乐清, 林文, 丁朝中, 等. 分子蒸馏纯化亚麻籽油中α-亚麻酸的研究[J]. 食品工业科技, 2013, 34(4): 216-219.
[9] PERRETTI G, MOTORI A, BRAVI E, et al. Supercritical carbon dioxide fractionation of fish oil fatty acid ethyl esters[J]. Journal of Supercritical Fluids, 2007, 40(3): 349-353. DOI:10.1016/ j.supflu.2006.07.020.
[10] COELHO J P, CRISTINO A F, MATOS P G, et al. Extraction of volatile oil from aromatic plants with supercritical carbon dioxide: experiments and modeling[J]. Molecules, 2012, 17(9): 10550-10573. DOI:10.3390/molecules170910550.
[11] IDRIS A, LOH S K, CHOO Y M. Urea fractionation of used palm oil methyl esters[J]. Journal of Oil Palm Research, 2014, 26(3): 226-231. DOI:10.1007/978-1-4614-6249-1_1 .
[12] FEI C Y, SALIMON J, SAID M. Optimisation of urea complexation by Box-Behnken design[J]. Sains Malaysiana, 2010, 39(5): 795-803.
[13] CAMPRA-MADRID P, GUIL-GUERRERO J L. High-performance liquid chromatographic purification of gamma-linolenic acid (GLA) from the seed oil of two boraginaceae species[J]. Chromatographia, 2002, 56(11): 673-677. DOI:10.1007/BF02492467.
[14] WANG J, ZHANG J L, WU F. Enrichment process for α-linolenic acid from silkworm pupae oil[J]. European Journal of Lipid Science and Technology, 2013, 115(7): 791-799. DOI:10.1002/ejlt.201200324.
[15] 杨克迪, 胡小明, 黄海基, 等. 硝酸银络合萃取蚕蛹油α-亚麻酸酯[J]. 中国油脂, 2008, 33(1): 30-32. DOI:10.3321/ j.issn:1003-7969.2008.01.008.
[16] 蒋艳忠, 胡小明, 杨克迪. 硝酸银络合法浓缩蚕蛹油中α-亚麻酸的研究[J]. 食品工业科技, 2008, 29(4): 205-206.
[17] 魏决, 罗雯, 陈玲. 酶法从紫苏子油中制取α-亚麻酸工艺研究: 脂肪酶水解工艺的探讨[J]. 食品科学, 2005, 26(2): 117-119.
[18] 许松林, 郑弢. 短程蒸馏提纯胡麻籽油中α-亚麻酸的工艺研究[J].中草药, 2004, 35(3): 264-266. DOI:10.3321/j.issn:0253-2670.2004.03.013.
[19] 孙兰萍, 张少君, 马龙, 等. α-亚麻酸的分离与纯化技术研究进展[J]. 包装与食品机械, 2011, 29(2): 51-55. DOI:10.3969/ j.issn.1005-1295.2011.02.013.
[20] 闫晓松, 谷克仁, 马磊, 等. α-亚麻酸纯化技术研究进展[J]. 粮食与油脂, 2014, 27(9): 9-13. DOI:10.3969/j.issn.1008-9578.2014.09.003.
[21] 吴彩娥, 许克勇, 李元瑞. n-3多不饱和脂肪酸富集纯化的研究进展[J]. 中国油脂, 2005, 30(12): 45-49. DOI:10.3321/ j.issn:1003-7969.2005.12.014.
[22] WU M, HUI D, SONG W, et al. Optimizing conditions for the purification of linoleic acid from sunflower oil by urea complex fractionation[J]. Journal of the American Oil Chemists Society, 2008, 85(7): 677-684. DOI:10.1007/s11746-008-1245-7.
[23] 王方, 段林. 载银离子交换树脂π络合吸附萘的研究[J]. 环境化学, 2013, 32(11): 2115-2120. DOI:10.7524/j.issn.0254-6108.2013.11.014.
[24] 赵为陶, 林红, 陈宇岳, 等. 银离子络合蚕丝纤维的工艺研究[J]. 丝绸, 2007(1): 28-30. DOI:10.3969/j.issn.1001-7003.2007.01.009.
[25] 陈晓, 赵辛元, 王伟, 等. 银离子络合萃取法分离纯化烟叶中茄尼醇的研究[J]. 湖北科技学报(医学版), 2012, 26(5): 369-371. DOI:10.3969/j.issn.1008-0635.2012.05.001.
[26] 黄晨蕾. 多不饱和脂肪酸甲酯的分离[D]. 杭州: 浙江工业大学, 2015.
[27] 江莉莉. 鱼油多不饱和脂肪酸高纯度分离技术及山药抗性淀粉制备技术研究[D]. 镇江: 江苏大学, 2008.
[28] 邱榕, 范维澄. 银离子络合物萃取DHA乙酯的络合机理研究[J]. 光谱学与光谱分析, 2001, 21(3): 328-330. DOI:10.3321/ j.issn:1000-0593.2001.03.020.
[29] 王思寒. 沙棘籽油分离富集不饱和脂肪酸的工艺研究[D]. 杭州: 浙江大学, 2010.
[30] MU H, JIN J, XIE D, et al. Combined urea complexation and argentated silica gel column chromatography for concentration and separation of PUFAs from tuna oil: based on improved DPA level[J]. Journal of the American Oil Chemists Society, 2016, 93(8): 1157-1167. DOI:10.1007/s11746-016-2842-5.
[31] KLEINER-SHUHLER L, V☒ZQUEZ L, AKOH C C. Purification of stearidonic acid from modified soybean oil by argentation silica gel column chromatography[J]. Journal of the American Oil Chemists Society, 2011, 88(8): 1161-1171. DOI:10.1007/s11746-011-1780-5.
[32] 陈钧, 新井邦夫. 银离子络合萃取法及其在分离鱼油活性成分中的应用[J]. 江苏大学学报(自然科学版), 2000, 21(6): 18-22. DOI:10.3969/j.issn.1671-7775.2000.06.005.
[33] AND J T, MELITO C. Steam-cooking and dry heating produce resistant starch in legumes[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2642-2645. DOI:10.1021/jf950824d.
[34] LAM S, GRUSHKA E. Silver loaded aluminosilicate as a stationary phase for the liquid chromatographic separation of unsaturated compounds[J]. Journal of Chromatographic Science, 1977, 15(7): 234-238. DOI:10.1093/chromsci/15.7.234.
[35] 靳革, 孙凯, 崔新宇, 等. 银离子络合法提取核桃油中不饱和脂肪酸[J]. 光谱实验室, 2012, 29(4): 348-352. DOI:10.3969/ j.issn.1004-8138.2012.04.079.
[36] 王远, 闫树军, 饶在生, 等. 响应面法优化紫苏子中α-亚麻酸的纯化工艺[J]. 食品工业科技, 2012, 33(15): 229-232.
[37] XIAO H, YAO Z, PENG Q, et al. Extraction of squalene from camellia oil by silver ion complexation[J]. Separation and Purification Technology, 2016, 169: 196-201. DOI:10.1016/j.seppur.2016.05.041.
[38] BELARBI E H, MOLINA E, CHISTI Y. A process for high yield and scaleable recovery of high purity eicosapentaenoic acid esters from microalgae and fish oil[J]. Enzyme and Microbial Technology, 2000, 26(7): 516-529. DOI:10.1016/S0141-0229(99)00191-X.
[39] GUIL-GUERRERO J L, CAMPRA-MADRID P, NAVARROJU☒REZ R. Isolation of some PUFA from edible oils by argentated silica gel chromatography[J]. Grasas Y Aceites, 2003, 54(2): 116-121. DOI:10.3989/gya.2003.v54.i2.253.
Separation and Purification of α-Linolenic Acid from Phyllanthus emblica L. Seed Oil by Silver Iron Complexation
GE Shuangshuang, ZHANG Wenwen, LI Kun, FENG Ying, GAN Jin, ZHENG Hua, ZHANG Hong*
(Research Center of Engineering and Technology on Forest Resources with Characteristics, State Forestry Administration, Research Institute of Resources Insects, Chinese Academy of Forestry, Kunming 650224, China)
The objective of this research was to purify α-linolenic acid from Phyllanthus emblica L. seed oil by using silver iron complexation in order to obtain high purity and yield of α-linolenic acid. Firstly, the effects of silver nitrate concentration, volume fraction of methanol, complexation time and complexation temperature on the purity and yield of α-linolenic acid were investigated by one-factor-at-a-time method. Afterwards, three independent variables were selected out of the four process parameters for the optimization experiments which were done using Box-Behnken design with the purity and yield of α-linolenic acid as response variables. The results indicated that the optimal process parameters were obtained as follows: complexation temperature, 0 ℃; silver nitrate concentration, 2.29 mol/L; methanol volume fraction, 38.00%; and complexation time, 1.93 h, under which the purity and yield of α-linolenic acid were 93.30% and 73.37%, respectively. The remaining silver nitrate was recovered for a second complexation. The recovery of silver nitrate was 93.83% and the recovered Ag+still had good complexation effect. Particularly, exogenous Ag+was not introduced in the whole complexation process. Therefore, this method allowed successful separation and purification of α-linolenic acid from P. emblica L. seed oil while reducing the operating cost. Meanwhile, the method of silver iron complexation was safe and helpful for industrial application of P. emblica L. seed oil.
Phyllanthus emblica L. seed oil; α-linolenic acid; silver iron complexation
10.7506/spkx1002-6630-201714033
TQ645.6;TS225.1
A
1002-6630(2017)14-0213-08引文格式:
2016-10-26
“十三五”国家重点研发计划重点专项(2016YFD0600806);
中央级公益性科研院所基本科研业务费专项(riricaf2015003M)
葛双双(1990—),女,硕士研究生,研究方向为天然产物开发与利用。E-mail:geshuangshuang0407@163.com
*通信作者:张弘(1963—),男,研究员,博士,研究方向为林业生物资源化学与工程。E-mail:kmzhhong@163.com
