荞麦壳水提物调控糖尿病大鼠肠道菌群结构的研究
2017-07-19周中凯张惠媛天津科技大学食品工程与生物技术学院天津300457
张 芹 周中凯 张惠媛(天津科技大学食品工程与生物技术学院,天津 300457)
荞麦壳水提物调控糖尿病大鼠肠道菌群结构的研究
张 芹 周中凯 张惠媛
(天津科技大学食品工程与生物技术学院,天津 300457)
为研究荞麦壳水提物对糖尿病大鼠粪便菌群的影响,选取12只Wistar大鼠,糖尿病模型建立后随机分为糖尿病组和荞麦壳组,每组6只,于第5周末无菌采集大鼠粪便,对粪便菌群16SrRNA的V1-V3区进行扩增,利用Miseq高通量测序平台测定基因序列,最后进行比对、分类。结果表明,荞麦壳水提物组和糖尿病组大鼠粪便中菌群结构及多样性有较大差别,在目(Order)的水平上,荞麦壳组Lactobacillales含量高于糖尿病组,糖尿病组Clostridiales含量高于荞麦壳组;在属(Genus)的水平上,荞麦壳组Lactococcus、Blautia、Prevotella、Klebsiella含量高于糖尿病组,糖尿病组Ruminococcaceae_uncultured、Ruminococcaceae_unclassified、Clostridium_sensu_stricto_1、Turicibacter和Oligella含量较荞麦壳组增加。说明糖尿病导致肠道菌群紊乱,大鼠通过饮用荞麦壳水提物可改善肠道菌群的结构。
荞麦壳水提物 糖尿病 肠道菌群 高通量测序
荞麦是一种药食同源的食物资源,分布于亚洲和欧洲,其中我国是世界荞麦的主要产区之一,我国栽培的荞麦种质资源中以甜荞为主,苦荞种植相对较少。在荞麦中存在许多有益成分,它既可以用作食材也可以作为药用植物,因其优良的保健功能,近年来荞麦产品越来越受到人们的关注。然而荞麦壳作为荞麦制品的副产物,通常利用率很低,仅少部分被用于枕芯填料,大部分被直接丢弃,造成了资源的浪费。
荞麦壳中含有大量的膳食纤维及黄酮、肌醇等,已有的研究表明,黄酮、肌醇等对于降血糖均具有一定的效果[1]。荞麦壳中含有的抗氧化活性成分主要有芦丁、槲皮素、没食子酸、儿茶素和其他黄酮类物质等。其中芦丁含量最高,其作为一种次级植物代谢产物,具有很强的生物活性,对人体健康具有保健作用,能够降低毛细血管通透性和脆性的作用,保持及恢复毛细血管的正常弹性,降低动脉硬化的风险[2]。此外,芦丁等生物类黄酮可通过保护胰岛β细胞而预防和治疗糖尿病,其对胰岛素信号途径的保护效应可调节血脂代谢、控制细胞循环,从而实现降低糖脂毒性和改善胰岛素抵抗[3]。近几年来,有研究表明,存在于肠道内的微生物,即肠道菌群,与糖尿病的发生密切相关,糖尿病患者通常伴随着肠道菌群紊乱的状况[4]。荞麦壳的活性成分在改善糖尿病症状的同时[1],是否对肠道菌群有一定的改善作用,却鲜有报道。因而,本研究通过建立糖尿病大鼠模型,研究荞麦壳对糖尿病大鼠肠道菌群的影响,以期为荞麦副产物的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器
荞麦壳:为苦荞(F.tataricumL.Gaertn.)品种,产自四川凉山地区。2%链脲佐菌素(Streptozocin,STZ)溶液:溶剂为0.1 mol/L,pH=4.5的柠檬酸-柠檬酸钠缓冲液,现用现配。Stool DNA Kit粪便DNA提取试剂盒:Omega Biotek公司。ABI GeneAmp®9700型PCR仪:美国ABI公司。
1.1.2 实验动物和样品采集
Wistar大鼠:中国军事医学科学院,许可证号:2012-0004,平均体重146.25±5.04 g,于天津科技大学实验动物中心清洁级屏障动物实验室饲养。动物日常护理及实验条件参照《中华人民共和国卫生部实验动物环境及设施标准》。本次动物试验得到天津科技大学动物伦理委员会的许可,许可证号:2014-14-027。
大鼠自购入起基础饲料适应1周后尾静脉注射STZ,注射量为45 mg/kg体重,注射时STZ冰浴并且30 min内注射完,大鼠72 h后尾静脉采血测随机血糖值,血糖≥16.7 mmol/L作为大鼠建模成功的标准。造模成功的大鼠随机分为糖尿病组(T1D组)和荞麦壳组(HULL组),荞麦壳组大鼠自由饮用荞麦壳水提物,而糖尿病组大鼠自由饮水,各组动物自由采食基础饲料,饲料营养成分见表1。每组2笼,每笼3只。于第5周末,无菌采集大鼠粪便,每组取3个重复,放入灭菌后的离心管中以备菌群分析。
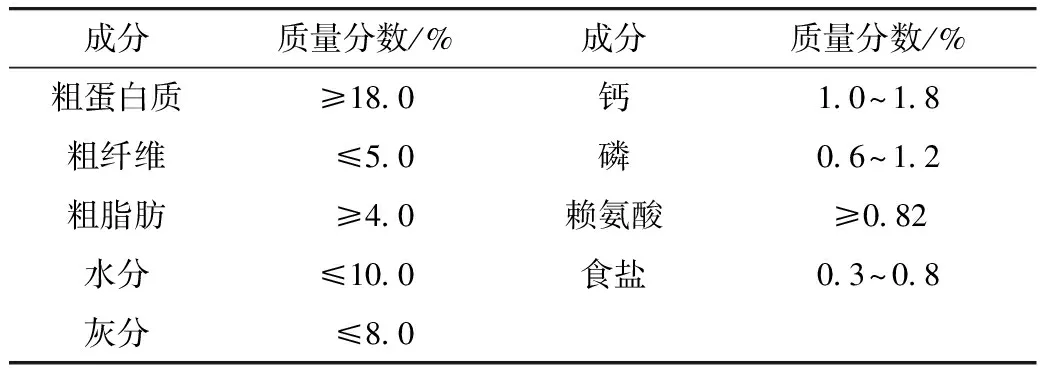
表1 动物饲料营养成分表
1.2 方法
1.2.1 荞麦壳水提物的制备及抗氧化能力和多酚含量的测定
荞麦壳样品用75%的食用乙醇进行杀菌处理,然后自然晾干。将30 g处理后的荞麦壳样品加入500 mL纯净水中,进行超声波双频提取,频率分别为25 kHz和40 kHz,功率为240 W,时间为40 min,然后进行离心(3 000 r/min,15 min),取上清液采用HPLC法测定总酚、黄酮、没食子酸、原儿茶酸、芦丁和槲皮素的含量[5]。每个指标均进行3次重复,结果以平均数±标准偏差(x±s)表示。
1.2.2 大鼠粪便菌群的基因组DNA提取与PCR扩增
采用Stool DNA Kit抽提大鼠粪便DNA,步骤按照说明书进行。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA完整性。
采用引物27F 5′-AGAGTTTGATCCTGGCTCAG-3′、533R 5′-TTACCGCGGCTGCTGGCAC-3′,扩增细菌16SrRNA的V1-V3区。PCR反应体系为:5×FastPfu缓冲液4 μL,5 μmol/L的正向引物0.8 μL,5 μmol/L的反向引物0.8 μL,DNA 10 ng,2.5 mmol/L dNTP 2 μL,FastPfu聚合酶0.4 μL,加ddH2O至总体积20 μL。PCR反应条件为:95 ℃ 3 min;26个循环包括95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s;72 ℃ 5 min,至10 ℃时停止。每个样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,上样量为3 μL。
1.2.3 生物信息学分析
PCR产物采用Miseq高通量测序平台进行高通量测序。高质量序列的提取:Miseq测序得到的PE reads首先根据overlap关系进行拼接,将成对的reads拼接成1条序列,同时对reads质量和merge的效果进行质量质控和过滤,去除序列末端的后引物和接头序列、多碱基N、polyA/T尾巴及低质量碱基;去除所得序列的barcode标签序列、前引物序列以及长度短于200 bp、模糊碱基数>0、序列平均质量低于20的序列。
操作单元(operational taxonomic units,OTU)聚类分析:提取非重复序列,使用QIIME分析平台进行序列的生物信息学分析,与Silva数据库中已比对的16S核糖体序列数据库进行比对,对相似性在97%以上的序列进行归并,生成分类操作单元OTU;菌群多样性分析:根据OTU聚类分析结果,进行alpha和beta多样性计算,采用Ace、Chao、Simpson、Shannon评估指数分别对样本进行多样性分析。其中Ace、Chao指数是对菌群丰度进行评估;Simpson、Shannon指数对菌群多样性进行评估;菌群分类学分析:采用R软件将OTU中全部序列与Silva数据库进行比对,找出其最相近且可信度达80%以上的种属信息。并将每一个OTU中的所有序列进行类比,找出同一OTU中的不同序列的最近祖先的种属信息。根据Silva库中的参考序列对OTU进行种属鉴定;菌群群落结构分析:根据分类学分析比对结果,在属水平上对样品中群落结构进行菌群种类和丰度分析。
1.2.4 数据统计分析
采用R软件(R i386 3.0.1)进行绘图分析,数据采用SPSS 16.0统计软件进行统计和分析。
2 结果与讨论
2.1 荞麦壳中部分酚类物质含量
由表2可见,荞麦壳水提物中总酚、黄酮含量均较高,总酚达到4.359 mg/g,黄酮含量为3.096 mg/g,进一步检测水提物中主要多酚物质的含量,包括没食子酸、原儿茶酸、芦丁和槲皮素,其中以芦丁含量为最高,达3.055 mg/g,说明荞麦壳水提物中的黄酮成分主要为芦丁。

表2 荞麦壳水提物中酚类物质含量/mg/g
2.2 大鼠粪便菌群测序质量及多样性统计分析
由表3可见,糖尿病组粪便菌群基因序列经97%相似性归并后得到256个OTUs,荞麦壳组得到241个OTUs。糖尿病组OTU较荞麦壳组多,表明糖尿病组菌群多样性较高,测序深度(Coverage)均在0.99以上,说明样品中序列未被测到的概率较低。糖尿病组Chao指数平均值为296,荞麦壳组为283,Ace、Chao指数是对菌群丰度进行的评估,以上数据表明,糖尿病组菌群丰富性较荞麦壳组高;糖尿病组Simpson指数平均值为0.06,Shannon指数为3.87,荞麦壳组Simpson指数平均值为0.09,Shannon指数为3.66,Simpson指数值越大,表明群落多样性越低,Shannon值越大,表明群落多样性越高。以上数据均表明糖尿病大鼠肠道菌群多样性和丰度升高,而通过荞麦壳水提物的饮食干预可在一定程度上减少糖尿病大鼠肠道菌群的多样性和丰度。

表3 糖尿病组与荞麦壳组微生物丰度及多样性比较
注:各数据无上标表示同列间无显著性差异(P>0.05)。
2.3 微生物群落结构分析
在Phylum(门)的水平上,各组样品的微生物群落构成及其相对丰度如图1所示。所有样品均包含Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门)2个主要的门,同时还包含Proteobacteria(变形菌门)、Actinobacteria(放线菌门),Tenericutes(柔壁菌门)及其它一些门的微生物。
由图2可见,在目(Order)的水平上,相对丰度较高的是Clostridiales、Lactobacillales、Bacteroidales3个主要的目,糖尿病组Clostridiales含量显著高于荞麦壳组,而荞麦壳水提物组Lactobacillales显著高于糖尿病组。另外,糖尿病组Erysipelotrichales、RF9、Burkholderiales含量高于荞麦壳组,而荞麦壳水提物组Corynebacteriales、Enterobacteriales含量高于糖尿病组。

注:HULL为荞麦壳处理组,T1D为糖尿病组,各组均3个重复,余同。
图1 糖尿病组和荞麦壳大鼠粪便菌群在门水平上的分布
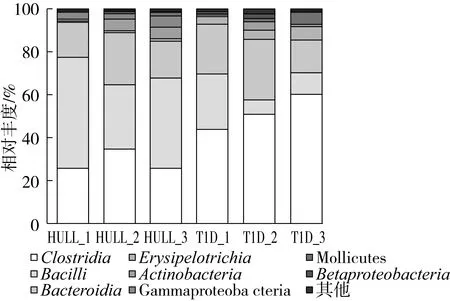
图2 糖尿病组和荞麦壳组大鼠粪便菌群在目水平上的分布
由图3可见,在属(Genus)的水平上,相对丰度较高的是Lactobacillus(乳酸菌属)、S24-7_norank、Ruminococcaceae_uncultured3个属,荞麦壳组Lactobacillus、Lactococcus、Blautia、Prevotella、Klebsiella较糖尿病组升高,而Ruminococcaceae_uncultured、Ruminococcaceae_unclassified、Clostridium_sensu_stricto_1、Turicibacter、Oligella较糖尿病组有一定程度降低。
2.4 荞麦壳组和糖尿病组大鼠肠道微生物群落结构差异性比较
将丰度在前64位的微生物进行各组间丰度相似性聚类得到的heatmap,通过颜色梯度及相似程度反映各组在属水平上群落组成的相似性和差异性。由图4可见,糖尿病组3个重复有较高的相似性,荞麦壳组3个重复间也呈现出较高的相似性。
通过门和属水平的分析以及微生物群落结构的heatmap分析,初步表明荞麦壳组大鼠与糖尿病大鼠肠道微生物群落结构有较大差异。为进一步分析其差别,对每一样品的OTU信息构建了未加权的Unifrac欧氏距离矩阵(unweighted Unifrac distance matrix)。基于这一矩阵进行了主坐标分析(Principal Co-ordinates Analysis,PCoA)。结果如图5所示,前2个主成分分别解释了总变量的53.67%和18.94%,说明其导致了糖尿病组和荞麦壳组肠道菌群的差异,共解释总变量的72.61%。在X轴的方向上,荞麦壳组和糖尿病组的3个重复之间差异均较小,糖尿病组3个重复之间也差异较小,荞麦壳组3个重复与糖尿病组3个重复在X轴的方向距离较远,2组饲养条件及糖尿病造模一致,表明可能是荞麦壳水提物的添加导致了2组肠道菌群之间差异较大。

图3 糖尿病组和荞麦壳组大鼠粪便菌群在属水平上的分布

图4 糖尿病组和荞麦壳组粪便菌群热图分析

图5 荞麦壳组和糖尿病大鼠粪便菌群的主坐标分析
3 讨论
本试验对荞麦壳水提物影响糖尿病鼠的肠道菌群进行了较为深入的研究,发现荞麦壳水提物可影响糖尿病大鼠粪便菌群的多样性和丰度。本课题组已对糖尿病大鼠的肠道菌群的变化特征进行了多次研究,均发现糖尿病可导致其肠道微生物的多样性和丰度升高。Claesson等[6]对老年人的肠道菌群进行分析发现,肠道菌群的多样性增加与体弱及疾病有很大关联。本研究与该报道一致,糖尿病大鼠粪便菌群多样性较高,而通过饲喂荞麦壳水提物后,菌群多样性有一定程度的降低,说明肠道菌群与糖尿病的发病之间可能存在一定关联。
近几年,较多研究表明,糖尿病患者肠道菌群发生了改变[4,7-8]。Larsen等[7]以18个2型糖尿病男性患者及18个正常男性为研究对象,采用454高通量测序技术对其粪便中微生物16SrRNA基因的V4区进行了测序,发现糖尿病患者微生物菌群多样性有较大差异。Lê等[8]采用实时荧光定量PCR技术研究糖尿病患者和正常人群的粪便菌群,发现2型糖尿病患者肠道的双歧杆菌数目显著低于健康人,而肠粪球菌数目高于健康人。Qin等[4]利用最新的肠道宏基因组测序(MGWAS)技术研究了342例中国2型糖尿病患者的粪便发现,糖尿病患者的肠道菌群发生了轻度紊乱,某些产丁酸细菌减少、机会致病菌增加,如Bacteroidescaccae、Clostridiumhathewayi、Clostridiumramosum、Clostridiumsymbiosum、Eggerthellalenta及Escherichiacoli,说明糖尿病患者通常伴随着肠道菌群紊乱。
本研究采集大鼠粪便,采用Miseq高通量测序平台检测微生物组成和多样性,将检测到的微生物由门到种进行各个水平上的分类,发现糖尿病大鼠粪便菌群与荞麦壳组的粪便菌群存在差异。在目(Order)的水平上,Clostridiales、Lactobacillales、Bacteroidales在糖尿病组和荞麦组均含量较高,荞麦壳组Lactobacillales、Corynebacteriales、Enterobacteriales含量高于糖尿病组;糖尿病组Clostridiales、Erysipelotrichales、Burkholderiales含量高于荞麦壳组,Burkholderiales属变形菌门纲(Proteobacteria),为革兰氏阴性菌,包含很多重要的病原菌。在属(genus)水平的分类上,荞麦壳组Lactobacillus、Lactococcus、Blautia、Prevotella、Klebsiella较糖尿病组升高,Lactobacillus属菌株通过在肠道内产生有机酸降低肠道pH值、产生H2O2及细菌素等抗菌物质抑制病原菌在肠道内的增殖,以保持肠道微生态平衡。Lactococcus也是肠道中的有益菌,Lactobacillus和Lactococcus常被添加于酸奶及微生态制剂中用于调节肠道菌群。Blautia属在肠道内发酵产生短链脂肪酸,对于维持肠道健康有重要作用。Prevotella在以碳水化合物为主导饮食的人体肠道中含量较多,说明糖尿病大鼠饮用荞麦壳水提物改善了肠道菌群。Klebsiella是肠道中的正常菌群,为适应特定的环境会大量增殖,本研究中Klebsiella在种水平上进行分类为Klebsiella_unclassified,其与荞麦壳提取物的代谢存在怎样的关系有待进一步研究。从微生物在属(genus)水平的分布柱状图中也可发现,荞麦壳组Ruminococcaceae_uncultured、Ruminococcaceae_unclassified、Clostridium_sensu_stricto_1、Turicibacter、Oligella较糖尿病组有一定程度降低,Ruminococcaceae为大肠和粪便中的优势菌群,Oligella在种水平上进行分类为Oligellaureolytica,其为需氧革兰氏阴性病原菌,常引起机体的感染。Clostridium_sensu_stricto_1及Turicibacter目前报道较少,但本课题组在前期的研究中也发现,相对于无糖尿病的大鼠,糖尿病大鼠粪便中Clostridium_sensu_stricto_1及Turicibacter显著升高,因而Clostridium_sensu_stricto_1及Turicibacter与糖尿病之间的相关性仍需进一步的研究。肠道菌群在目和属水平上的含量分布均表明,糖尿病大鼠与荞麦壳处理的大鼠肠道菌群存在较大差异。本研究检测糖尿病大鼠的粪便菌群,发现其中含有大量的致病菌,如Oligellaureolytica、Burkholderiales等,表明糖尿病大鼠存在一定程度的肠道菌群紊乱状况。本研究中,糖尿病大鼠粪便中致病菌种类与Qin等[4]的报道不一致,可能是由于试验对象和饮食结构不同造成的。
荞麦壳组和糖尿病组大鼠肠道菌群发生显著变化的因素可能是荞麦壳水提物的使用(图5)。荞麦壳含有大量的酚类化合物(表1),可以作为抗氧化剂,起到抗炎症、免疫调节、预防和抗癌以及抑制醛糖还原酶活性的作用[9]。酚类化合物在食物组分中是很重要的部分,其含量虽远低于碳水化合物、蛋白质等,但相关研究表明这类化合物在调控肠道微生物结构等方面起到很重要的作用,参与多数肠道微生物的代谢过程,在大肠中酚类化合物与大肠微生物的交互作用对机体健康的影响起到重要作用[10]。酚类化合物在人体内的吸收行为较复杂,目前较多研究表明,多酚在人体内99%以自由酚的形式存在,经人体摄入后,只有5%~10%在人体的十二指肠中被吸收,其余多酚未被小肠吸收而到达大肠,在大肠中被肠道微生物菌群代谢[11]。大鼠饮用荞麦壳水提物后,很多种类的微生物的比例发生了显著变化,荞麦壳中的多酚物质怎样促进或者抑制肠道那些微生物生长的关系仍有待进一步的研究。
4 结论
利用大鼠建立糖尿病模型,并使糖尿病大鼠饮用荞麦壳水提物,利用高通量测序技术研究糖尿病大鼠和荞麦壳组大鼠的粪便菌群。发现糖尿病大鼠存在肠道菌群紊乱的状况,而利用荞麦壳提取物干预糖尿病大鼠,可增加粪便中有益菌含量,表明荞麦壳提取物改善了糖尿病大鼠的肠道菌群。利用食品加工技术,将荞麦壳加工成相关制品或提取有效成分,以供糖尿病患者食用,将对改善糖尿病症状起到积极的效果。
[1]Salib J Y,Michael H N,Eskande E F.Anti-diabetic properties of flavonoid compounds isolated from Hyphaene thebaica epicarp on alloxan induced diabetic rats[J].Pharmacognocy Resarch,2013,5(1):22-29
[2]Wójcicki J,Barcew-Wiszniewska B,Samochowiec L,et al.Extractum Fagopyri reduces artheriosclerosis in high-fat diet fed rabbits[J].Die Pharmazie,1995,50(8):560-562
[3]Holasova M,Fiedlerova V,Smrcinova H,et al.Buckwheat-the source of antioxidant activity in functional foods[J].Food Research International,2002,35:207-211
[4]Qin J J,Li Y R,Cai Z M,et al.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature,2012,490:55-60
[5]任顺成,孙军涛.荞麦粉、皮、壳及芽中黄酮类含量分析研究[J].中国粮油学报,2008,23(6):210-214 Ren S C,Sun J T.Analysis of flavonoid contents in buckwheat flour,bran,hull and sprout[J].Journal of the Chinese Cereals and Oils Association,2008,23(6):210-214
[6]Claesson M J,Jeffery I B,Conde S,et al.Gut microbiota composition correlates with diet and health in the elderly[J]. Nature,2012,488:178-184
[7]Larsen N,Vogensen F K,Van den Berg F W,et al.Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J].Plos One,2010,5(2):e9085
[8]Lê K A,Li Y,Xu X,et al.Alterations in fecalLactobacillusandBifidobacteriumspecies in type 2 diabetic patients in Southern China population[J].Frontiers in Physiology,2013,3:496
[9]Moongngarm A,Saetung N.Comparison of chemical compositions and bioactive compounds of germinated rough rice and brown rice[J].Food Chemistry,2010,122(3):782-788
[10]Kemperman R A,Bolca S,Roger L C,et al.Novel approaches for analysing gut microbes and dietary polyphenols:challenges and opportunities[J].Microbiology,2010,156(11):3224-3231
[11]Qin B,Dawson H D,Schoene N W,et al.Cinnamon polyphenols regulate multiple metabolic pathways involved in insulin signaling and intestinal lipoprotein metabolism of small intestinal enterocytes[J].Nutrition,2012,28(11-12):1172-1179.
The Manipulation of Faecal Microbiota in Diabetic Rats Intervened with Water Extract of Buckwheat Hull
Zhang Qin Zhou Zhongkai Zhang Huiyuan
(College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457)
In order to investigate the effect of water extract of buckwheat hull on faecal microbiota of diabetic rats,12 Wistar rats were randomly divided into diabetic and buckwheat hull groups.The fecal bacterial composition was investigated by Miseq high-throughput sequencing of the V1-V3 region of the 16SrRNA gene.Results showed that bacterial diversity and richness in diabetic subjects were somewhat higher than that in buckwheat hull group.Using the taxonomic characterization from the gene sequence,the results showed that the microbials enriched in buckwheat hull group were fromLactobacillales.while most of T1D-enriched microbials were from orderClostridiales,This study also found the proportion of genusLactobacillus,Lactococcus,Blautia,PrevotellaandKlebsiellawere increased in buckwheat hull group compared to that in the diabetic group,and the genusRuminococcaceae_uncultured,Ruminococcaceae_unclassified,Clostridium_sensu_stricto_1,TuricibacterandOligellawere reduced in buckwheat hull group compared to that in diabetic group.Our findings indicated that T1D rats had a moderate degree of gut bacterial dysbiosis,and water extract of buckwheat hull had a positive effect on gut microbiota.
water extract of buckwheat hull,diabetes,microbiota,high-throughput sequencing
国家自然科学基金(31471701)
2015-09-24
张芹,女,1981年出生,助理研究员,微生物学
周中凯,男,1964年出生,教授,博士生导师,食品科学与营养
3
A
1003-0174(2017)04-0031-07
