反复妊娠失败患者种植窗期子宫内膜调节性T细胞功能相关因子的表达
2017-07-18刁梁辉丁锦丽尹太郎黄春宇杨菁曾勇
刁梁辉,丁锦丽,尹太郎,黄春宇,杨菁,曾勇*
(1.深圳中山泌尿外科医院生殖医学中心.深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所.深圳 518045;2.武汉大学人民医院生殖医学中心,武汉 430060)
·实验研究·
反复妊娠失败患者种植窗期子宫内膜调节性T细胞功能相关因子的表达
刁梁辉1,丁锦丽2,尹太郎2,黄春宇1,杨菁2,曾勇1*
(1.深圳中山泌尿外科医院生殖医学中心.深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所.深圳 518045;2.武汉大学人民医院生殖医学中心,武汉 430060)
目的 分析反复妊娠失败患者种植窗期子宫内膜调节性T细胞相关生物标记物的表达情况。 方法 利用免疫组织化学技术分析反复种植失败(repeated implantation failure,RIF)(n=23)、复发性流产(recurrent miscarriage,RM)(n=33)与对照组(n=15)女性FOXP3、CTLA-4和TGF-β3水平。通过Vectra®自动病理成像定量分析系统计算其阳性细胞率。 结果 RIF组、RM组患者子宫内膜CTLA-4阳性细胞率显著高于对照组(P<0.01),而TGF-β3阳性细胞率显著低于对照组(P<0.01)。FOXP3阳性细胞率与CTLA-4阳性细胞率显著正相关(r=0.68,P<0.01)。 结论 RIF、RM患者子宫内膜种植窗期TGF-β3、CTLA-4表达异常,表明TGF-β3、CTLA-4可能参与RIF、RM种植窗期子宫内膜免疫耐受调节,影响其子宫内膜容受性。
反复种植失败; 复发性流产; 调节性T细胞; FOXP3; CTLA-4; TGF-β3
(JReprodMed2017,26(7):705-710)
从免疫学的角度,胚胎既可看作是“特殊的肿瘤”,亦可认为是“同种异体移植物”。因此,母胎界面免疫耐受状态的失衡与妊娠失败紧密相关。调节性T细胞(regulatory T cells,Tregs)是CD4+T细胞的亚型。研究表明,Tregs在移植物抗宿主反应、身免疫性疾病及鼠和人类母胎界面免疫耐受的维持中均发挥重要作用[1-2]。生理状态下,子宫内膜Tregs在增殖期逐渐增加,而黄体期逐渐下降[3],而在复发性流产(recurrent miscarriage,RM)或子宫内膜异位症等病理状态下,黄体期Tregs没有下降趋势。因此排卵前Tregs的增多可能对于诱导免疫耐受和胚胎成功着床,以及组织损伤和修复发挥着重要作用[3-4]。正常状态下,胚胎抗原的刺激使Tregs募集到子宫内膜局部,Tregs数量或功能降低会打破母胎界面的免疫耐受状态,使胚胎遭受母体免疫系统的攻击,从而导致妊娠失败[5-6]。另外,在胚胎着床过程中,滋养细胞入侵子宫内膜类似组织修复的过程,而Tregs在炎症修复中起着重要作用[7]。因此,研究种植窗Tregs及其相关因子在子宫内膜的表达及分布情况具有重要意义。
FOXP3是Tregs分化的关键转录因子,在Tregs的发育和功能上起重要作用,被认为是Tregs的特异性标记物。Galgani等[8]的研究表明,与对照组患者相比,RM和反复种植失败(repeated implantation failure,RIF)患者子宫内膜FOXP3+Tregs显著降低。细胞毒T淋巴细胞相关抗原4(Cytotoxic T lymphocyte-associated antigen 4,CTLA-4)主要表达于CD4+CD25+Tregs表面,可能通过细胞间相互作用传递抑制信号,增强Tregs的功能,从而参与妊娠维持。转化生长因子(transforming growth factor β,TGF-β)对初始CD4+T细胞分化为Th17细胞或Tregs具有关键调节作用[9]。TGF-β可增强FOXP3的表达,促使初始CD4+T细胞分化为Tregs[9]。CD4+CD25+Tregs主要通过TGF-β发挥抑制活性[10]。TGF-β3属于TGF-β超家族成员,有研究表明,RM患者滋养细胞TGF-β3水平是显著降低的[11],注射TGF-β3能有效降低流产模型小鼠的流产率[12],表明TGF-β3在胚胎种植及妊娠维持中可能起着重要作用。目前关于Tregs相关因子在种植窗期子宫内膜表达情况的研究较少。本研究通过免疫组化技术检测RIF、RM和正常育龄妇女子宫内膜FOXP3、CTLA-4和TGF-β3的表达水平,探讨子宫内膜Tregs相关因子与反复妊娠失败的关系。
资料与方法
一、研究对象
收集2013年10月至2016年8月在本院就诊的71例患者作为研究对象。入选标准:(1)有规律月经周期,平均27~35 d;(2)纳入研究前3个月内未接受激素治疗;(3)夫妇双方外周血染色体核型正常。本研究分为3组,分别是反复种植失败组(RIF组,23例),复发性流产组(RM组,33例)和对照组(15例)。RIF组为经历至少2次取卵周期、3次或3次以上的移植周期,移植的总优质胚胎数≥6个仍未取得临床妊娠[13-14];RM组为经历2次或2次以上20周前的自发性流产患者;对照组为:(1)因男方因素首次IVF助孕并成功分娩的患者;(2)女方内分泌及解剖结构正常。患者年龄22~39岁,平均(32.11±3.15)岁。所有纳入患者均已签署知情同意书,实验流程已获本院伦理学委员会认可。
二、研究方法
1.子宫内膜标本收集:利用子宫内膜取样器(Gynetics,Lommel,比利时)获取患者种植窗期(LH+7~9 d)子宫内膜组织。磷酸盐缓冲液(PBS)冲洗子宫内膜组织,去除血块,室温条件下用10%福尔马林固定,4~6 h后常规进行脱水、石蜡包埋。
2.性激素测定:月经第2~3天收集患者外周血,采用化学发光法检测血清FSH、LH、E2、孕酮(P)及泌乳素(PRL)水平。
3.免疫组织化学:包埋子宫内膜组织作4 μm厚度切片,常规脱蜡,3%过氧化氢15 min,5%胎牛血清封闭20 min阻断非特异性染色。乙二胺四乙酸(EDTA)抗原修复液微波加热处理后,分别滴加鼠抗人FOXP3(eBioscience,美国)、鼠抗人TGF-β3(Abcam,美国)或鼠抗人CTLA-4(Santa Cruz,美国)抗体工作液,37℃孵育1 h。以PBS代替一抗作为阴性对照,以FOXP3,CTLA-4和TGF-β3表达阳性的人扁桃体组织切片作为阳性对照。滴加兔、鼠通用二抗(Dako Cytomation,丹麦),37℃ 孵育 30 min。滴加 二氨基联苯胺(DAB)工作液(Dako Cytomation)显色,待显色至棕黄色时终止。苏木素复染,氨水返蓝,梯度酒精脱水,树胶封片。Vectra®自动病理成像定量分析系统(Perkin Elmer,美国)定量分析FOXP3,CTLA-4和TGF-β3阳性细胞率,操作流程参考文献所述[15]。纳入被组织覆盖面积超过80%的图像,阳性细胞率定义为DAB阳性细胞数/子宫内膜总细胞数。
4.HE染色:石蜡切片常规行HE染色,光学显微镜下观察组织形态,确定子宫内膜分期。
三、统计学分析
SPSS 19.0统计学软件进行统计分析。正态分布资料以均数±标准差表示,非正态分布数据以中位数和四分位数表示。正态分布数据比较采用t检验,非正态分布资料比较采用Mann-Whitney U检验。相关性分析采用Spearman’s 相关分析法。P<0.05为差异有统计学意义。
结 果
一、患者一般资料
本项研究共纳入患者71例,其中对照组15例,RIF组23例,RM组33例。组间年龄、体重指数(BMI)及基础性激素资料无显著统计学差异,RIF组、RM组妊娠失败次数均显著高于对照组(P<0.01)(表1)。
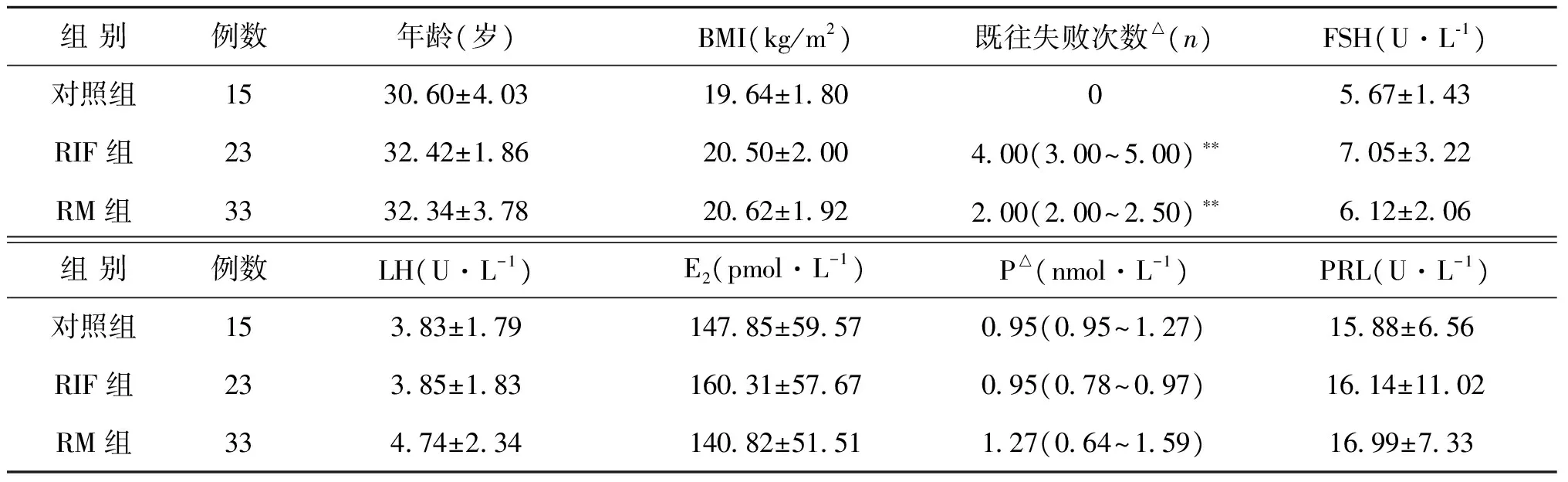
表1 RIF、RM和对照组基本资料
注:△资料呈非正态分布;与对照组比较,**P<0.01
二、FOXP3、CTLA-4和TGF-β3在子宫内膜表达及分布情况
免疫组织化学染色结果如图1。FOXP3、CTLA-4和TGF-β3阳性细胞少量分散表达于种植窗期子宫内膜组织。FOXP3主要呈细胞核表达,阳性细胞主要分布在间质。CTLA-4和TGF-β3均呈细胞膜和胞质表达,阳性细胞分布于间质(图1)。
三、FOXP3、CTLA-4和TGF-β3在各组子宫内膜的表达差异
通过比较3组种植窗期子宫内膜FOXP3、CTLA-4和 TGF-β3的阳性细胞占总细胞百分率,结果显示:RIF组、RM组的CTLA-4阳性率显著高于对照组(P<0.01),TGF-β3阳性率显著低于对照组(P<0.01),RIF、RM组FOXP3阳性率与对照组比较无显著统计学差异(P>0.05)(表2)。
四、FOXP3、CTLA-4和TGF-β3相关性分析
种植窗期子宫内膜FOXP3、CTLA-4和TGF-β3阳性率的相关性分析结果显示,FOXP3与CTLA-4显著正相关(r=0.68,P<0.01),但FOXP3与TGF-β3、TGF-β3与CTLA-4无显著相关性(r=0.14,P>0.05;r=0.04,P>0.05)(图2)。
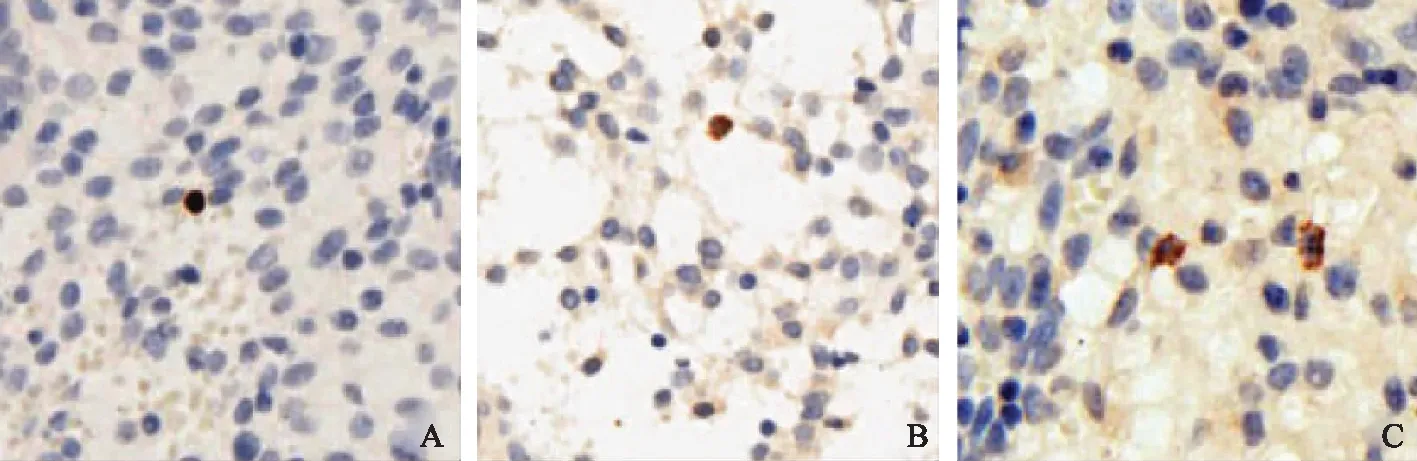
A:FOXP3; B:TGF-β3; C:CTLA-4图1 FOXP3、TGF-β3和CTLA-4在子宫内膜的免疫组织化学染色 200×
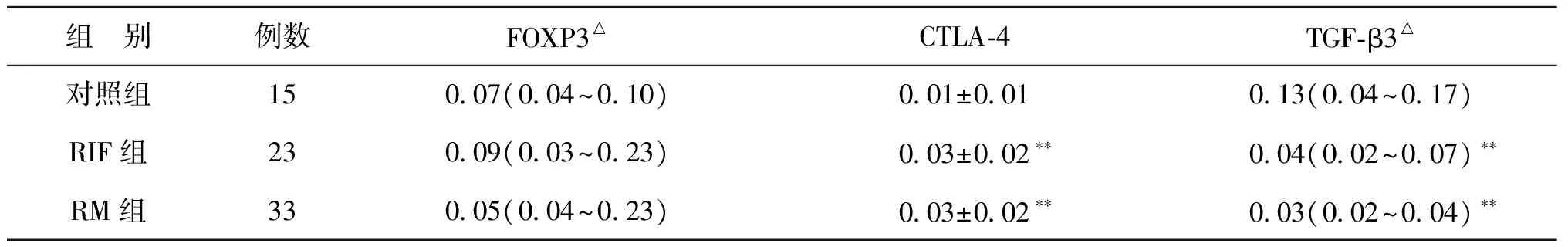
组 别例数FOXP3△CTLA⁃4TGF⁃β3△对照组15007(004~010)001±001013(004~017)RIF组23009(003~023)003±002∗∗004(002~007)∗∗RM组33005(004~023)003±002∗∗003(002~004)∗∗
注:△资料呈非正态分布;与对照组比较,**P<0.01
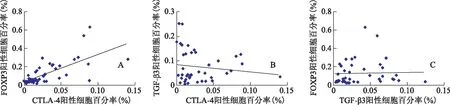
A:FOXP3与CTLA-4相关性分析;B:TGF-β3与CTLA-4相关性分析;C:FOXP3与TGF-β3相关性分析图2 3组FOXP3、CTLA-4和TGF-β3相关性分析图
讨 论
妊娠失败的主要原因包括内分泌紊乱、自身免疫性疾病、染色体异常等,其中,染色体异常是主要因素。证据显示超过50%的流产与胚胎染色体异常有关,且自然流产和RM胚胎异常率无显著差异[16-17]。成功的妊娠由胚胎和内膜共同作用而完成,正常的子宫内膜应同时具备合适的选择性和接受性。早期研究显示,约40%的RM子宫内膜为超生育力状态[18],随后的研究进一步证实,RM患者的子宫内膜无法识别高等级胚胎和低等级胚胎[19]。然而,研究表明,经种植前基因诊断技术(PGS)筛选后,囊胚的继续种植率仍然仅65.5%左右[20-21],表明即使染色体正常也不能确保成功妊娠,表明了子宫内膜在胚胎种植中的重要作用。而大量证据显示,子宫内膜免疫功能的紊乱可能降低子宫内膜容受性,且与一系列生殖并发症,如RIF和RM密切相关[22]。证据提示RIF和RM子宫内膜可能存在一些相似的问题—对胚胎的选择存在障碍,因而可能会表现在某些特定细胞因子、关键调控分子或细胞的表达差异上。胚胎种植的过程中,Tregs对子宫内环境免疫稳态的维持和胚胎种植均起重要作用[4]。Tregs的分子标记物包括FOXP3,CD25high,CD127low,CTLA-4、IL-10、TGF-β等[23]。在动物研究中,流产模型小鼠Tregs的数量显著降低,而妊娠早期转输来自正常妊娠小鼠的Tregs可显著降低其流产率[24]。在人类研究中,Sasaki 等[25]首次报道了Tregs可能与自然流产有关。数据显示在正常妊娠早期,蜕膜中含有大量CD4+CD25+Tregs,外周血中CD4+CD25+Tregs数量较非妊娠期增加,但自然流产患者蜕膜Tregs数量并未增加;与人工流产患者比较,自然流产患者蜕膜组织中CD4+CD25highTregs数量显著降低。本项研究结果表明,RM和RIF患者种植窗期子宫内膜FOXP3阳性细胞率与对照组无显著差异,与Galgani等[8]报道的RM和RIF患者FOXP3+Tregs低于对照组的结论不一致。获取和检测子宫内膜组织方法的不同可能解释两项研究结果的差异。Galgani等[8]采用免疫荧光技术检测了宫腔镜下获取的月经第21~23天的子宫内膜标本,而本项研究采用免疫组化技术检测子宫内膜取样器获取的种植窗期(LH+7~9)子宫内膜组织。正常妇女子宫内膜FOXP3+Tregs在增殖期达到高峰,而在黄体期下降,而在病理状态下,黄体期Tregs没有下降趋势[3],因此推测排卵前子宫内膜Tregs的增多对于诱导免疫耐受和胚胎成功着床可能起着重要作用。FOXP3是Tregs分化的关键转录因子,通常被认为是最特异的Tregs功能标记物,但研究显示活化T细胞也可瞬时表达FOXP3,并且在Tregs中,仅表达FOXP3并不能发挥其免疫抑制功能[26],所以本研究进一步分析其他Tregs功能相关分子的表达情况。
CTLA-4也称CD152,主要表达于Tregs和CD4+效应T细胞表面与CD28竞争结合CD80/CD86,传递负性调节信号下调T细胞免疫,被称为T细胞的刹车信号。目前关于子宫内膜CTLA-4的表达及定位的研究较少。Jin等[27]的研究表明,流产患者蜕膜组织CTLA-4蛋白水平显著低于对照组,而Wang等[28]的研究表明,自发性流产患者蜕膜CTLA-4 mRNA水平显著高于对照组。在本项研究中,RIF和RM患者CTLA-4阳性细胞率显著高于对照组,且CTLA-4和FOXP3阳性率显著正相关,提示CTLA-4和FOXP3可能在降调RIF/RM患者子宫内膜炎症方面起协同作用,即RIF和RM患者可能由于子宫炎性环境过高诱导大量活化T细胞的浸润,同时诱导Tregs的增殖,下调该炎性环境。
Tregs由CD4+幼稚T细胞分化途径受TGF-β家族调控[9]。TGF-β与初始CD4+T细胞表面受体结合,可增强FOXP3的表达,促使初始CD4+T细胞分化为Tregs[10]。另外,男性精浆中TGF-β能诱导女性耐受反应,从而促进母体对父型抗原的免疫耐受,防止胚胎丢失[2]。另外,TGF-β能将初始CD4+CD25-细胞体外诱导为具有抑制功能的CD25+FOXP3+细胞[29]。CD4+CD25+Tregs主要通过TGF-β发挥抑制活性[11],TGF-β抗体能阻断CD25 T细胞的抑制效应[30]。同时,TGF-β可参与到内膜细胞的增殖分化、血管形成和子宫内膜蜕膜化过程[31]。有研究表明,RM患者滋养层细胞TGF-β3水平是显著降低的[5]。动物实验表明,经阴道注射TGF-β3能有效降低流产率[32],表明TGF-β3在胚胎种植及妊娠维持中可能起着重要作用。本项研究检测正常妇女和RIF、RM患者种植窗期子宫内膜TGF-β3的表达情况,结果表明,种植窗期对照组患者子宫内膜TGF-β3阳性率显著高于RIF/RM组,表明TGF-β3表达的下调可能与RIF/RM患者子宫内膜Tregs数量和功能异常及子宫内膜容受性下降有关。
综上所述,本项研究结果表明,种植窗期子宫内膜免疫调节因子TGF-β3、CTLA-4的异常表达可能与RIF和RM相关,但具体的机制还需进一步研究。
[1] Leavy O.Tolerance:Induced T(Reg) cells evolved to protect the fetus[J].Nat Rev Immunol,2012,12:554-555.
[2] Robertson SA,Sharkey DJ.The role of semen in induction of maternal immune tolerance to pregnancy[J].Semin Immunol,2001,13:243-254.
[3] Berbic M,Hey-Cunningham AJ,Ng C,et al.The role of Foxp3+regulatory T-cells in endometriosis:a potential controlling mechanism for a complex,chronic immunological condition[J].Hum Reprod,2010,25:900-907.
[4] Arruvito L,Sanz M,Banham AH,et al.Expansion of CD4+CD25+and FOXP3+regulatory T cells during the follicular phase of the menstrual cycle:implications for human reproduction[J].J Immunol,2007,178:2572-2578.
[5] Fantini MC,Rizzo A,Fina D,et al.IL-21 regulates experimental colitis by modulating the balance between Treg and Th17 cells[J].Eur J Immunol,2007,37:3155-3163.
[6] Mucida D,Park Y,Kim G,et al.Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid[J].Science,2007,317:256-260.
[7] Arpaia N,Green JA,Moltedo B,et al.A Distinct Function of Regulatory T Cells in Tissue Protection[J].Cell,2015,162:1078-1089.
[8] Galgani M,Insabato L,Calì G,et al.Regulatory T cells,inflammation,and endoplasmic reticulum stress in women with defective endometrial receptivity[J].Fertil Steril,2015,103:1579-1586.
[9] Lal G,Bromberg JS.Epigenetic mechanisms of regulation of Foxp3 expression[J].Blood,2009,114:3727-3735.
[10] Putnam AL,Brusko TM,Lee MR,et al.Expansion of human regulatory T-cells from patients with type 1 diabetes[J].Diabetes,2009,58:652-662.
[11] Chai JG,Tsang JY,Lechler R,et al.CD4+CD25+T cells as immunoregulatory T cells in vitro[J].Eur J Immunol,2002,32:2365-2375.
[12] Giannubilo SR,Landi B,Pozzi V,et al.The involvement of inflammatory cytokines in the pathogenesis of recurrent miscarriage[J].Cytokine,2012,58:50-56.
[13] Simon A,Laufer N.Assessment and treatment of repeated implantation failure (RIF)[J].J Assist Reprod Genet,2012,29:1227-1239.
[14] Coughlan C,Ledger W,Wang Q,et al.Recurrent implantation failure:definition and management[J/OL].Reprod Biomed Online,2014,28:14-38.
[15] Huang W,Hennrick K,Drew S. A colorful future of quantitative pathology:validation of Vectra technology using chromogenic multiplexed immunohistochemistry and prostate tissue microarrays[J].Hum Pathol,2013,44:29-38.
[16] Wang Y,Cheng Q,Meng L,et al.Clinical application of SNP array analysis in first-trimester pregnancy loss:a prospective study[J].Clin Genet,2016,doi:1111/cge.12926.
[17] Choi TY,Lee HM,Park WK,et al.Spontaneous abortion and recurrent miscarriage:A comparison of cytogenetic diagnosis in 250 cases[J].Obstet Gynecol Sci,2014,57:518-525.
[18] Salker M,Teklenburg G,Molokhia M,et al.Natural selection of human embryos:impaired decidualization of endometrium disables embryo-maternal interactions and causes recurrent pregnancy loss[J/OL].PLoS One,2010,5:e10287.
[19] Weimar CH,Kavelaars A,Brosens JJ,et al.Endometrial stromal cells of women with recurrent miscarriage fail to discriminate between high-and low-quality human embryos[J/OL].PLoS One,2012,7:e41424.
[20] Capalbo A,Rienzi L,Cimadomo D,et al.Correlation between standard blastocyst morphology,euploidy and implantation:an observational study in two centers involving 956 screened blastocysts[J].Hum Reprod,2014,29:1173-1181.
[21] Peeraer K,Couck I,Debrock S,et al.Frozen-thawed embryo transfer in a natural or mildly hormonally stimulated cycle in women with regular ovulatory cycles:a RCT[J].Hum Reprod,2015,30:2552-2562.
[22] Evans J,Salamonsen LA,Winship A,et al.Fertile ground:human endometrial programming and lessons in health and disease[J].Nat Rev Endocrinol,2016,12:654-667.
[23] Corthay A.How do regulatory T cells work?[J].Scand J Immunol,2009,70:326-336.
[24] Williams LM,Rudensky AY.Maintenance of the Foxp3-dependent developmental program in mature regulatory T cells requires continued expression of Foxp3[J].Nat Immunol,2007,8:277-284.
[25] Sasaki Y,Sakai M,Miyazaki S,et al.Decidual and peripheral blood CD4+CD25+regulatory T cells in early pregnancy subjects and spontaneous abortion cases[J].Mol Hum Reprod,2004,10:347-353.
[26] Wang J,Ioan-Facsinay A,van der Voort EI,et al.Transient expression of FOXP3 in human activated nonregulatory CD4+T cells[J].Eur J Immunol,2007,37:129-138.
[27] Jin LP,Fan DX,Zhang T,et al.The costimulatory signal upregulation is associated with Th1 bias at the maternal-fetal interface in human miscarriage[J].Am J Reprod Immunol,2011,66:270-278.
[28] Wang X,Ma Z,Hong Y,et al.Expression of CD28 and cytotoxic T lymphocyte antigen 4 at the maternal-fetal interface in women with unexplained pregnancy loss[J].Int J Gynaecol Obstet,2006,93:123-129.
[29] Chen W,Jin W,Hardegen N,et al.Conversion of peripheral CD4+CD25-naive T cells to CD4+CD25+regulatory T cells by TGF-beta induction of transcription factor Foxp3[J].J Exp Med,2003,198:1875-1886.
[30] Belghith M,Bluestone JA,Barriot S,et al.TGF-beta-dependent mechanisms mediate restoration of self-tolerance induced by antibodies to CD3 in overt autoimmune diabetes[J].Nat Med,2003,9:1202-1208.
[31] Quaglino DJ,Nanney LB,Kennedy R,et al.Transforming growth factor-beta stimulates wound healing and modulates extracellular matrix gene expression in pig skin.I.Excisional wound model[J].Lab Invest,1990,63:307-319.
[32] Clark DA,Fernandes J,Banwatt D.Prevention of spontaneous abortion in the CBA x DBA/2 mouse model by intravaginal TGF-beta and local recruitment of CD4+8+FOXP3+cells[J].Am J Reprod Immunol,2008,59:525-534.
[编辑:郭永]
《生殖医学杂志》补刊补订消息
本刊尚有库存2005~2016年度各期过刊,需要者可来函与本刊编辑部联系。2010~2015年度每期8折优惠。2010年以前,每期6~7折优惠。2017年度期刊尚可补订,每期12.00元,全年144.00元(含邮费)。邮发代号:80-419。
编辑部地址:北京帅府园1号北京协和医院(邮编:100730);电话:010-69155670;Email:1399668426@qq.com
本刊编辑部
Expressions of regulatory T cell related factors in endometrium during implantation window in women with repeated reproductive failure
DIAOLiang-hui1,DINGJin-li2,YINTai-lang2,HUANGChun-yu1,YANGJing2,ZENGYong1*
1.ShenzhenKeyLaboratoryforReproductiveImmunologyofPreimplantation,ShenzhenZhongshanInstituteforReproductionandGenetics,FertilityCenter,ShenzhenZhongshanUrologyHospital,Shenzhen5180452.ReproductiveMedicalCenter,RenminHospitalofWuhanUniversity,Wuhan430060
Objective:To analyze the expression of regulatory T(Treg)cell related biomarkers in the endometrium during implantation window in the women with repeated implantation failure (RIF) or recurrent miscarriage (RM).
Methods:Immunohistochemistry was used to identify fork head box P3 (FOXP3),cytotoxic T-lymphocyte-associated protein 4 (CTLA-4) and transforming growth factor β-3 (TGF-β3) in the endometrium during implantation window from the women with RIF (n=23) or RM (n=33) and matched controls (n=15).The images were acquired and analyzed automatically by the Vectra®automated quantitative pathology imaging system.
Results:The rate of CTLA-4 positive cells in RIF group and RM group was significantly higher than that in control group (P<0.01),while the rate of TGF-β3 positive cells was significantly lower than that of control group(P<0.01).The percentage of FOXP3+and CTLA-4+in the endometrium were positively correlated(r=0.68,P<0.01).
Conclusions:The expressions of endometrial CTLA-4 and TGF-β3 in pre-implantation endometrium of women with RIF and RM are abnormal,which suggests that these immune suppression markers may involve in regulating endometrial receptivity.
Repeated implantation failure; Recurrent miscarriage; Regulatory T cells; FOXP3; CTLA-4;TGF-β3
10.3969/j.issn.1004-3845.2017.07.017
2016-12-05;
2017-01-14
深圳市科技创新委员会基础研究项目(JCYJ20140415114504394)、深圳市卫生计生系统科研项目(201505029)
刁梁辉,男,广东河源人,博士,生物化学与分子生物学专业.(*
,zengyong1966@gmail.com)
