丝氨酸对葡萄酒酿造过程中酿酒酵母产H2S的形成研究
2017-07-18张玉洁李莹秦义宋育阳刘延琳
张玉洁,李莹,秦义,2,宋育阳,2,刘延琳,2*
(1.西北农林科技大学葡萄酒学院,陕西杨凌712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌712100)
丝氨酸对葡萄酒酿造过程中酿酒酵母产H2S的形成研究
张玉洁1,李莹1,秦义1,2,宋育阳1,2,刘延琳1,2*
(1.西北农林科技大学葡萄酒学院,陕西杨凌712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌712100)
为探究丝氨酸对葡萄酒酿造过程中酿酒酵母产H2S的影响,以自主筛选的本土酿酒酵母32y12为研究对象,分别在正常氮源(300 mg N/L)和低浓度氮源(150 mg N/L)条件下,比较了外源丝氨酸的添加对酿酒酵母32y12发酵过程中产H2S的影响。结果显示,相对于正常氮源水平,低氮条件下外源添加140.8 mg/L(5倍)和281.5 mg/L(10倍)丝氨酸时,H2S释放量显著增加,分别达到573.1 μL/L和798.6 μL/L。为了进一步研究酵母自身丝氨酸合成对H2S产生的影响,借助Cre-Loxp系统敲除了丝氨酸合成关键基因SER33,结果发现在不同氮源水平下,基因SER33的敲除均显著降低H2S产量(P<0.05),并且外源添加不同浓度丝氨酸也并不会显著增加基因SER33敲除菌株的H2S释放量(P>0.05)。该结果为工业生产中针对低氮葡萄原料选择发酵助剂提供了理论支持。
酿酒酵母;丝氨酸;硫化氢;基因敲除;氮源
在葡萄酒酿造过程中,由酵母代谢产生的香气物质是影响葡萄酒质量及感官的重要因素之一。其中,葡萄酒中的挥发性硫化物以其强挥发性、低阈值而受到广泛关注[1]。挥发性硫化物主要分为两类:一类为挥发性硫醇,大部分挥发性硫醇具有不良气味,少部分具有热带水果及黄杨木的味感[2],和葡萄柚与热带水果的香气[3-4];另一类为具有较强的挥发性、给葡萄酒带来臭鸡蛋味的硫化氢(H2S),该物质不仅具有较低的嗅觉阈值(50~80 μg/L),并且其不良气味很难被掩盖[5]。
有研究发现[6-7],葡萄酒中H2S的主要来源是发酵过程中酿酒酵母代谢产生的。在酿酒酵母硫代谢途径中,S2-合成与消耗速率决定了酿酒酵母H2S产生量。若S2-能够与来源于氮代谢的O-乙酰高丝氨酸完全结合,则S2-会合成酵母正常生长所需要的含硫氨基酸(如甲硫氨酸、半胱氨酸等),否则将以H2S形式释放。因此,氮源是影响酵母H2S产生的重要因素之一[8]。
葡萄汁中的总氮含量与H2S的产量之间存在负相关性[9]。在葡萄酒酿造过程中,常会采用补充足量的可同化氮源,以确保足够的氨基酸前体物质,来限制H2S的形成[10-11]。但是过高的可同化氮会产生有害物质,如氨基甲酸乙酯、生物胺等,同时也会促进有害微生物的生长。因此,为避免过高氮源的添加对葡萄酒酿造的风险,探究不同氮源种类对H2S的释放具有实际意义。尽管目前已有报道[12],添加谷氨酸、天冬氨酸、天冬酰胺、精氨酸等不同氨基酸会造成菌株H2S产量的显著差异,但是作为参与硫代谢下游途径的关键物质的丝氨酸,对酿酒酵母产H2S特性的相关研究仍缺乏。
基于以上分析,为探究丝氨酸与H2S产生的关系,以本课题组筛选的野生二倍体酿酒酵母(Saccharomyces cereviviae)32y12为研究对象,分别比较在正常氮源(300mg N/L)和低浓度氮源(150 mg N/L)条件下,添加不同浓度丝氨酸对酿酒酵母产H2S的影响;此外,通过敲除丝氨酸合成途径关键基因SER33,弱化酿酒酵母丝氨酸合成能力,进一步探究丝氨酸与H2S合成的关系,研究结果将为葡萄酒酿造中降低H2S产量提供新的思路与方法。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株和质粒
酿酒酵母(Saccharomycescereviviae)32y12、质粒pUG6、质粒pSH65:本实验室保藏。
1.1.2 引物
脱氧核糖核酸(deoxyribose nucleic acid,DNA)测序和合成由上海生工完成,本实验所用引物见表1。

表1 敲除菌株的构建及验证引物Table 1 Establishment of knockout strains and primers validation
1.1.3 主要试剂
DNA聚合酶、SD-UraDOSupplement:TAKARA(大连)有限公司;葡萄糖、果糖、肌醇、麦角固醇、L-精氨酸、L-脯氨酸、DL-色氨酸等氨基酸(纯度均>99%)、无氨基酵母氮源(yeast nitrogen base,YNB):北京索莱宝科技有限公司;L-(+)酒石酸、L-(-)苹果酸、柠檬酸(纯度均>99%):阿拉丁试剂(上海)有限公司;半乳糖、水解酪蛋白(纯度均>99%):美国Sigma公司;蛋白胨、酵母浸粉、Tween-80、无水氯化钙、磷酸铵、氢氧化钾等为国产分析纯。
1.1.4 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20g/L,蛋白胨20g/L,酵母浸粉10g/L,固体YPD培养基添加2%琼脂粉。
YPD-遗传霉素(geneticin)G418培养基:在YPD培养基中添加G418至终质量浓度为300 mg/L,固体YPD-G418培养基添加2%琼脂粉。
酵母浸出粉胨半乳糖(yeast extract peptone galactose,YPG)培养基:半乳糖20g/L,蛋白胨20g/L,酵母浸粉10g/L,固体培养基中加入2%琼脂粉。
酵母缺陷型培养基(SD-Ura):葡萄糖20 g/L,无氨基酵母氮源YNB1.7g/L,SD-Uradosupplement0.77g/L,pH6.8。
Triple M培养基:参照SPIROPOULOS A等[6]的配方。
TripleM培养基中不同氨基酸含量参考BELTRANB等[13]研究进行调整。Triple M培养基的正常氮源(包括120 mg N/L的无机铵盐与180 mg N/L的混合氨基酸)质量浓度为300 mg N/L时,Triple M培养基中丝氨酸浓度(将该浓度设为1倍)为56.3 mg/L(7.5 mg N/L),因此0倍、5倍和10倍丝氨酸的添加分别为0、281.5 mg/L(37.5 mg N/L)及562.9 mg/L(75 mg N/L)。Triple M培养基的低氮源质量浓度为150 mg N/L(包括60 mg N/L的无机铵盐与90 mg N/L的混合氨基酸),此时Triple M培养基中丝氨酸质量浓度(将该浓度设为1倍)为28.2 mg/L(3.8 mg N/L),因此0倍、5倍和10倍丝氨酸的添加分别0、140.8 mg/L(18.8 mg N/L)及281.5 mg/L(37.5 mg N/L)。
1.2 仪器与设备
MJPS-250型恒温培养箱:上海精宏仪器有限公司;ZWY2102全温摇床:上海智诚分析仪器制造有限公司;FRESC017高速冷冻离心机、ND 1000微量紫外可见分光光度计:美国Thermo公司;DYY-10C电泳仪:北京市六一仪器厂;C1000 PCR仪:美国Bio-Rad公司;GBOX-EF凝胶成像系统:印度Syngene公司;SS325高压蒸汽灭菌锅:日本Tomy公司;Cary60紫外可见分光光度计:美国安捷伦公司;YBL10-71103血球计数板:上海求精生化试剂仪器有限公司;H2S检测管:上海豫东电子科技有限公司。
1.3 试验方法
1.3.1 酿酒酵母的发酵特性及H2S表型检测
采用正常质量浓度氮源(300 mg N/L)和低质量浓度氮源(150 mg N/L)Triple M培养基发酵,并按比例分别添加0倍、281.5 mg/L(5倍)和562.9 mg/L(10倍)丝氨酸进行模拟发酵。发酵体积为300 mL,发酵温度为20℃,摇床转速为150r/min。酵母菌的接种量为5×105CFU/mL(利用血球计数板计数对数期培养的菌株以控制接种量),每株酵母菌进行3个平行发酵。发酵每24 h称量发酵损失质量,监测CO2质量损失,以未接菌的发酵瓶为对照,直到连续两次质量损失不变,此时认为发酵中止。硫化氢的检测使用H2S检测管,单位以μL/L计,每8 h检测一次H2S产量。装置参考王春晓等[14]方法,将H2S检测管用橡胶管连接于球形弯管上,每次取样时读取H2S检测管上的变色刻度即为H2S的产生量,当检测管变色刻度接近最大量程时更换新的检测管。
1.3.2 野生二倍体酵母SER33敲除菌株构建
利用Cre-Loxp基因编辑系统,首先构建SER33第一次敲除框:在基因SER33的读码框外设计45 bp同源臂与pUG6中的Loxp-KanMX-Loxp引物融合后对其进行扩增得到(引物为SER33-D1-F/R,DNA聚合酶为PrimeSTAR HS DNA Polymerase高保真酶,聚合酶链反应(polymerase chain reaction,PCR)条件按照TAKARA官网中该酶的使用建议,并将退火温度调整为59℃,后续PCR均按照此方法);第二次敲除框在基因SER33的读码框内设计45 bp同源臂,并按照第一次设计原理进行敲除框的扩增;将两次PCR产物纯化后测序保存在-20℃待转化。
采用醋酸锂转化法[15],将第一次敲除框转入32y12 Δura3,利用YPD培养基复苏24h,而后涂布于添加了300mg N/L YPD-G418培养皿上,30℃培养48 h,挑取转化子,用验证引物(SER33-A-F、SER33-KanB-R、SER33-KanC-F、SER33-D-R,分别位于SER33读码框上游、KanMX中前、KanMX中后及SER33读码框下游)进行PCR验证,得到转化子。将pSH65质粒转入上一步得到的转化子,利用YPG培养基复苏24 h后涂布于YPG平板,30℃培养48 h后影印于YPD-G418平板。随后30℃静置培养24 h,挑取在影印培养皿上不能生长的菌落进行PCR验证。
采用同样的方法将第二次敲除框转入并经过PCR验证最终得到二次敲除的菌株,转入pSH65质粒切除KanMX标记得到32y12的SER33基因敲除菌株。
1.3.3 数据分析
采用SPSS19.0软件进行数据分析,方差分析采用Duncan检验法,每组实验3组重复,Origin8.0用于绘制发酵曲线等。
2 结果与分析
2.1 外源添加丝氨酸对S.cereviviae32y12产H2S量的影响
为了探究外源丝氨酸的添加(0倍、5倍、10倍)是否会影响菌株的生长及硫化氢产生,分别在正常质量浓度氮源(300 mg N/L)和低质量浓度氮源(150 mg N/L)的Triple M模拟汁中进行发酵,在不同氮源条件下的发酵特性及H2S释放量,结果见图1。由图1A可知,在正常氮源(300mgN/L)条件下,添加不同质量浓度的丝氨酸,并不会改变S.cereviviae 32y12的CO2释放量;而在低质量浓度氮源(150 mg N/L)条件下,虽然添加不同质量浓度丝氨酸没有显著改变菌株的发酵速率(CO2释放量分别达到27.5g、27.6g、26.5 g),但是相比于正常氮源(300 mg N/L),S.cereviviae32y12的发酵速率均减缓,且结束发酵时间均延长至240 h,较正常浓度氮源下的发酵时间多48 h。
由图1B可知,在正常氮源(300mgN/L)条件下,外源添加丝氨酸不会显著增加H2S的释放,尤其当外源丝氨酸添加至10倍时,S.cereviviae32y12的H2S释放与未添加丝氨酸没有显著差异(P>0.05)。而在低浓度氮源下(150mgN/L)未添加丝氨酸时,H2S释放379.8 μL/L,而当添加5倍和10倍丝氨酸时,S.cereviviae32y12的H2S释放显著增加(P<0.05),分别达到573.1 μL/L和798.6 μL/L。由此说明,低氮条件下外源添加丝氨酸能够增加H2S的释放。该结果为工业生产中针对低氮原料选择发酵助剂提供了试验依据,即发酵醪中氮源水平较低时,尽量避免外源添加丝氨酸,从而防止葡萄酒发酵过程中产生较高的H2S。
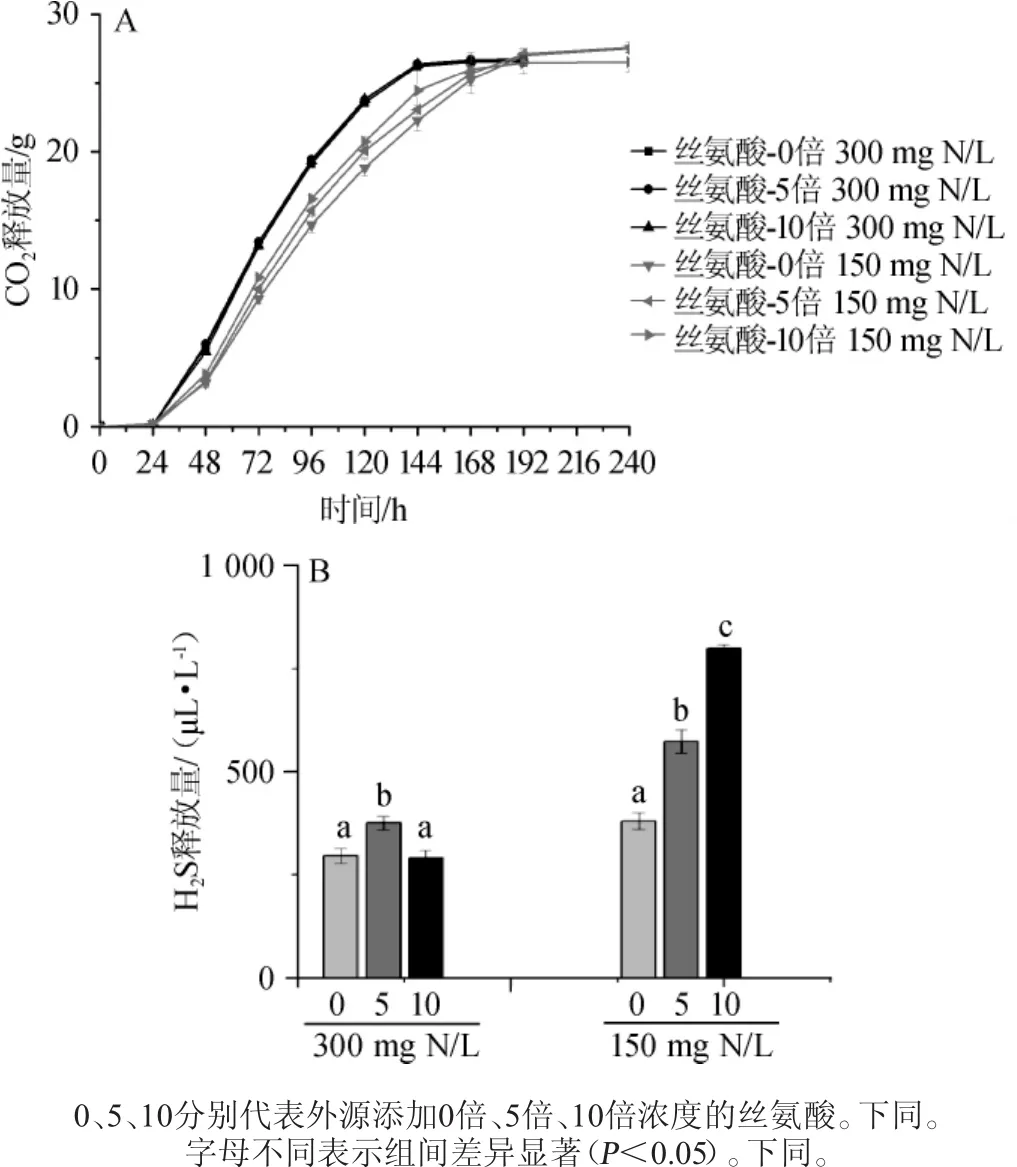
图1 不同浓度氮源下酿酒酵母32y12的CO2(A)及H2S(B)释放量Fig.1 Release amount of CO2(A)and H2S(B)ofS.cerevisiae 32y12 under different concentration of nitrogen source
2.2 基因SER33缺陷菌株的构建及发酵特性
为降低丝氨酸在葡萄酒酿造过程中(尤其是低氮条件下)对酵母H2S产生的影响,以S.cereviviae32y12为基础,采用Cre-Loxp基因编辑系统来构建基因SER33缺陷菌株,降低细胞合成丝氨酸的能力,从而探究酿酒酵母自身合成的丝氨酸与H2S合成的关系。
2.2.1 第一个及第二个SER33同源基因的敲除
以SER33-D1-F/SER33-D1-R为引物,pUG6为模板,扩增得到长度约为1 800 bp的SER33第一次敲除组件。将经测序验证的敲除组件转入32y12中,筛选并挑取转化子,分别用SER33-A-F/SER33-D-R、SER33-A-F/SER33-KanB-R、SER33-KanC-F/SER33-D-R对转化子S1-1验证,结果见图2。
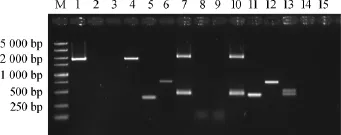
图2 基因SER33敲除菌株PCR验证结果Fig.2 PCR verification results of geneSER33knockout strains
由图2可知,采用SER33读码框上游引物SER33-A-F/ SER33-D-R,分别对32y12和转化子S1-1进行PCR扩增,对照32y12的条带约为1 800 bp(泳道1),而转化子S1-1得到的片段应为两条1 948 bp和1 760 bp(泳道4),其中1 948 bp大小片段经测序验证为loxP-KanMX-loxP片段,表明S1-1基因组中一个SER33同源基因被成功替换;采用SER33-A-F/ SER33-KanB-R、SER33-KanC-F/SER33-D-R进一步对对照菌株和转化菌株PCR,验证loxP-KanMX-loxP片段成功插入SER33位点,对照菌株无KanMX插入(泳道2,3),而S1-1得到两条带351 bp和730 bp(泳道5,6),符合预期结果;上述结果证实loxP-KanMX-loxP成功替换了32y12基因组中的一个SER33同源基因。
将pSH65转化入S1-1,同时利用半乳糖诱导Cre酶表达,从而切除loxP-KanMX-loxP中的KanMX基因,获得重组菌株S1-2。采用SER33-A-F/SER33-D-R(泳道7)、SER33-A-F/ SER33-KanB-R(泳道8)、SER33-KanC-F/SER33-D-R(泳道9)三对引物分别进行PCR验证。泳道7为两条带,分别为切除KanMX片段和SER33未敲除片段。而泳道8,9中没有条带也进一步证明KanMX在基因组中已丢失,从而获得敲除一个SER33等位基因的菌株S1-2。
为避免第二次重组发生在第一次重组位点,SER33的二次敲除组件的同源臂设计在SER33的开放读码框内部。采用SER33-D2-F/SER33-D2-R扩增得到二次敲除组件,转化于S1-2,在YPD-G418平板上筛选转化子,并采用SER33-A-F/ SER33-D-R、SER33-A-F/SER33-KanB-R、SER33-KanC-F/ SER33-D-R分别验证。泳道10得到两条片段约为2 000 bp和400 bp,说明第二次敲除组件发生重组。以SER33-A-F/ SER33-KanB-R(泳道11)、SER33-KanC-F/SER33-D-R(泳道12)为引物的PCR得到对应KanMX大小,表明敲除组件重组位置正确,获得重组菌株S2-1。最后,转入pSH65,切除G418抗性标记,最终得到基因组上SER33被完全敲除的菌株S2-2。经SER33-A-F/SER33-D-R验证,得到约为400 bp,500bp两条带(泳道13),无KanMX验证条带(泳道14,15),从而获得S.cereviviae32y12的SER33双缺失菌株32y12Δser33。2.2.2SER33敲除菌株的模拟发酵和产H2S特征
为了探究SER33敲除菌株的发酵特性和产H2S表型,利用1.3节中的方法进行Triple M模拟汁发酵,SER33缺陷菌株在不同生长时期的H2S释放量及发酵特性结果见图3。由图3可知,SER33敲除菌株的生长速率受到抑制,敲除菌株在480 h后发酵仍在继续,且CO2的质量损失仅达到20 g,显著低于原始菌株S.cereviviae32y12(25 g)。对于产H2S特性,SER33敲除菌株在48 h产生H2S,96 h内变化最大,约为27 μL/L,120 h后停止产生,最终产量约为65 μL/L,显著低于S.cereviviae32y12的H2S释放量(P<0.05)。
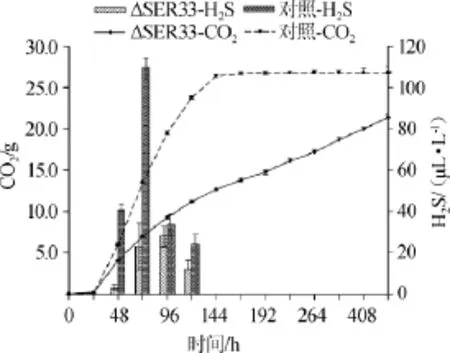
图3 基因SER33敲除菌株模拟发酵H2S释放量及发酵特征Fig.3 H2S release amount and fermentation characteristic of geneSER33knockout strains stimulated fermentation
2.3 外源添加丝氨酸对SER33敲除菌株H2S产量的影响
尽管破坏酿酒酵母丝氨酸合成途径能够显著降低其H2S释放,但是外源添加丝氨酸是否会补偿SER33敲除对H2S释放的影响仍不清楚。采用2.1的方法,在正常氮源(300 mg N/L)和低浓度氮源(150 mg N/L)的Triple M培养条件下进行模拟汁发酵,结果见图4。由图4可知,在正常的Triple M发酵条件下,丝氨酸的添加浓度不会显著增加SER33敲除菌株的H2S释放量,该结果与2.1中S.cereviviae 32y12菌株一致。而与正常氮源相比,在低质量浓度氮源下(150 mg N/L)虽然SER33敲除菌株的H2S释放量显著增高,但是与不添加丝氨酸相比较,添加5倍和10倍浓度丝氨酸不会显著增加SER33敲除菌株的H2S释放(P>0.05),这与出发菌株S.cereviviae32y12显著不同(P<0.05)。

图4 不同浓度氮源下基因SER33敲除菌株的H2S释放量Fig.4 H2S release amount of geneSER33knockout strains under different concentration of nitrogen source
3 结论
本研究以S.cereviviae32y12为研究对象,分别在正常氮源(300 mg N/L)和低浓度氮源(150 mg N/L)条件下,比较了丝氨酸对S.cereviviae32y12发酵过程中H2S产生的影响。其中,相比于正常氮源水平,低氮条件下添加外源丝氨酸(5、10倍)显著增加了H2S的释放(573.1μL/L和798.6μL/L)。此外,为了研究酵母自身丝氨酸合成对H2S产生的影响,本研究敲除了S.cereviviae32y12的SER33基因,结果发现尽管敲除SER33能够破坏丝氨酸合成途径,并显著降低H2S产量至65 μL/L,但是与出发菌株S.cereviviae32y12不同的是,低浓度氮源下,添加不同浓度丝氨酸并不会显著增加SER33敲除菌株的H2S释放量(P>0.05)。该结果为葡萄酒酿造过程中不同氮源条件下发酵助剂的选择提供了依据。
[1]马捷,刘延琳.葡萄酒中重要挥发性硫化物的代谢及基因调控[J].微生物学报,2011,51(1):14-20.
[2]MESTRES M,BUSTO O,GUASCH J.Analysis of organic sulfur compounds in wine aroma[J].J Chromatogr A,2000,881(1):569-581.
[3]LUND C M,THOMPSON M K,BENKWITZ F,et al.New Zealand Sauvignon blanc distinct flavor characteristics:Sensory,chemical,and consumer aspects[J].Am J Enol Viticult,2009,60(1):1-12.
[4]HARSCH M J,GARDNER R C.Yeast genes involved in sulfur and nitrogen metabolism affect the production of volatile thiols from Sauvignon Blanc musts[J].Appl Microbiol Biotechnol,2013,97(1):223-35.
[5]SWIEGERS J H,PRETORIUS I S.Modulation of volatile sulfur compounds by wine yeast[J].Appl Microbiol Biotechnol,2007,74(5):954-960.
[6]SPIROPOULOS A,TANAKA J,FLERIANOS I,et al.Characterization of hydrogen sulfide formation in commercial and natural wine isolates of Saccharomyces[J].Am J Enol Viticult,2000,51(3):233-248.
[7]LINDERHOLM A,DIETZEL K,HIRST M,et al.Identification of MET10-932 and characterization as an allele reducing hydrogen sulfide formation in wine strains ofSaccharomyces cerevisiae[J].Appl Environ Microbiol,2010,76(23):7699-7707.
[8]WINTER G,HENSCHKE P A,HIGGINS V J,et al.Effects of rehydration nutrients on H2S metabolism and formation of volatile sulfur compounds by the wine yeast VL3[J].Appl Microbiol Biotechnol Express, 2011,1(1):1-11.
[9]MENDES-FERREIRA A,BARBOSA C,FALCO V,et al.The production of hydrogen sulphide and other aroma compounds by wine strains of Saccharomyces cerevisiaein synthetic media with different nitrogen concentrations[J].J Ind Microbiol Biotechnol,2009,36(4):571-83.
[10]MENDES-FERREIRA A,BARBOSA C,INES A,et al.The timing of diammonium phosphate supplementation of wine must affects subsequent H2S release during fermentation[J].J Appl Microbiol,2010,108 (2):540-9.
[11]郭在力,栾静,孙玉梅.可同化氮对葡萄酒发酵影响的研究进展[J].中国酿造,2016,35(4):19-23.
[12]JIRANEKV,LANGRIDGEP,HENSCHKEPA.Regulationofhydrogen sulfide liberation in wine-producingSaccharomyces cerevisiaestrains by assimilable nitrogen[J].Appl Environ Microbiol,1995,61(2):461-467.
[13]BELTRAN B,ROZES N,MAS A,et al.Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption[J].J Agr Food Chem,2005, 53(4):996-1002.
[14]王春晓,刘延琳.酿酒酵母菌株发酵过程中硫化氢产率动态变化研究[J].酿酒科技,2012(10):43-45.
[15]GIETZ R D,WOODS R A.Genetic transformation of yeast[J].Biotechniques,2001,30(4):816-831.
Effect of serine on the H2S formation during wine fermentation ofSaccharomyces cerevisiae
ZHANG Yujie1,LI Ying1,QIN Yi1,2,SONG Yuyang1,2,LIU Yanlin1,2*
(1.College of Enology,Northwest A&F University,Yangling 712100,China; 2.Shaanxi Engineering Research Center for Wine and Viticulture,Yangling 712100,China)
In order to investigate the effect of serine on H2S production inSaccharomyces cerevisiaeduring wine brewing process,using the native S.cerevisiae32y12 screened independently as research object,under the normal nitrogen source(300 mg N/L)and low concentration nitrogen source (150 mg N/L),the effect of adding exogenous serine onS.cerevisiae32y12 producing H2S during fermentation was compared.The results showed that compared with the normal nitrogen source,under low nitrogen concentration,adding exogenous serine could significantly increase H2S production, which could achieve 573.1 μl/L and 798.6 μl/L in adding serine 140.8 mg/L(5 times)and 281.5 mg/L(10 times),respectively.For further research the effect of yeast synthesis serine on H2S production,the key geneSER33of serine synthesis was knocked by Cre-Loxp system.Results showed that under different levels of nitrogen,the knockout of geneSER33decreased H2S production significantly(P<0.05),and the adding different concentrations of serine could not increase H2S production of strains knocked geneSER33significantly(P>0.05),which provided the theoretical support for fermentation agent selection of grape raw materials with low concentration nitrogen in industrial production.
Saccharomyces cerevisiae;serine;hydrogen sulfide;gene deletion;nitrogen source
TS261
0254-5071(2017)06-0121-05
10.11882/j.issn.0254-5071.2017.06.025
2017-04-11
国家自然科学基金项目(31571812);国家葡萄产业技术体系建设专项(CARS-30-jg-3)
张玉洁(1991-),女,硕士研究生,研究方向为酿酒微生物。
*通讯作者:刘延琳(1966-),女,教授,博士,研究方向为葡萄酒及酿酒微生物。
