追根求源
2017-07-14陈世明
【摘要】提出从选定的零水准出发,通过追根求源,列举出相关质子转移方程式,进而书写出混合溶液的质子平衡式;并从试题命制角度进行深入思考分析,分类归纳总结,从而化难为易,实施意义教学。
【关键词】混合溶液;质子平衡式
质子平衡式作为酸碱溶液中H+求算的基础,已成为电解质溶液教学的重点和难点,也是历届各地高考命题的热点。对于只含一种溶质的溶液,简单的酸碱平衡体系(如CH3COOH溶液),电荷平衡式就是质子平衡式;复杂酸碱平衡体系(如NaHCO3溶液),可通过联立物料平衡式和电荷平衡式求得,还可以根据酸碱平衡体系的组成通过状态对比直接书写。然而,对于含有多种溶质的酸碱平衡体系(如Na2CO3和NaHCO3的混合溶液),大学分析化学中介绍得很少,中学教材中更是没有,但近几年的高考和模拟试题中的出现率却越来越高,目前解决此类问题时一般都是采用上述联立方程的方法解决[1][2]。由于大家都已意识到这种方法存在耗时多、错误率高、化学含义不明等不足,近日,解决此类问题的新的方法正在不断被挖掘[3]。笔者学习后以为平衡式及推导过程化学含义不明等不足仍未得到很好解决,因而将已经过一轮教学实践的“追根求源直写法”介绍给大家。笔者以为,通过追根求源,能实现混合溶液质子平衡式的快速书写,且书写过程能很好地体现微粒观、守恒观等化学观念。
一、基本思想
依据酸碱质子理论,酸碱反应的实质是质子的转移,在酸碱反应中,酸失去的质子数与碱得到的质子数一定相等,无论是单溶质酸碱平衡体系,还是多溶质酸碱平衡体系。因而,多溶质酸碱平衡体系中存在的H+的量应为失质子物质(即酸)提供质子的量与得质子物质(即碱)消耗质子的量之差,或体系中存在的OH-的量应为碱提供OH-的量与酸消耗OH-的量之差。
二、基本步骤
第一步,选定零水准。通常以溶液中大量存在的并参与质子转移的组分(一般为各溶质和水)为零水准。
第二步,确定质子转移。从零水准出发,写出所有相关的得失H+或OH-的方程式。
第三步,书写质子平衡式。根据质子得失守恒原则,依据上述基本思想建立等式,注意浓度前的系数,得质子的物质比参考水准多几个H+,此物质浓度前的系数即为几;失质子的物质比参考水准少几个H+,此物质浓度前的系数则为几。得失OH-亦然。
三、方法举例
(一)混合酸(碱)溶液
常见的混合酸溶液有强酸与强酸混合溶液,弱酸与弱酸混合溶液,强酸与弱酸混合溶液;常见的混合碱溶液有强碱与强碱混合溶液,弱碱与弱碱混合溶液,强碱与弱碱混合溶液等。
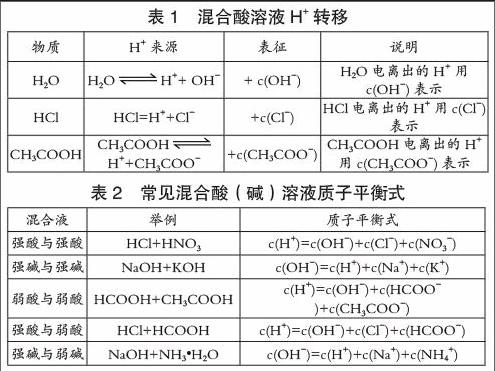
例1 试写出c1mol/L HCl与c2mol/LCH3COOH混合溶液的质子平衡式。
解析:选定零水准为HCl、CH3COOH和H2O,提供H+的物质及数目如表1所示。
质子平衡式为:c(H+)= c(OH-)+ c(Cl-)+c(CH3COO-)
反思與命题策略:
(1)该类质子平衡式形式上与电荷平衡式相同,但二者含义不同。
(2)命题时可根据HCl与CH3COOH之间的浓度关系进行式变换,如当c1=c2时,c(Cl-)= c(CH3COO-)+ c(CH3COOH),将此物料守恒关系代入上述质子平衡式,可得下列质子平衡式变式:c(H+)= c(OH-)+ c(CH3COOH)+2c(CH3COO-)。
(3)其他常见混合酸(碱)溶液质子平衡式如表2所示。
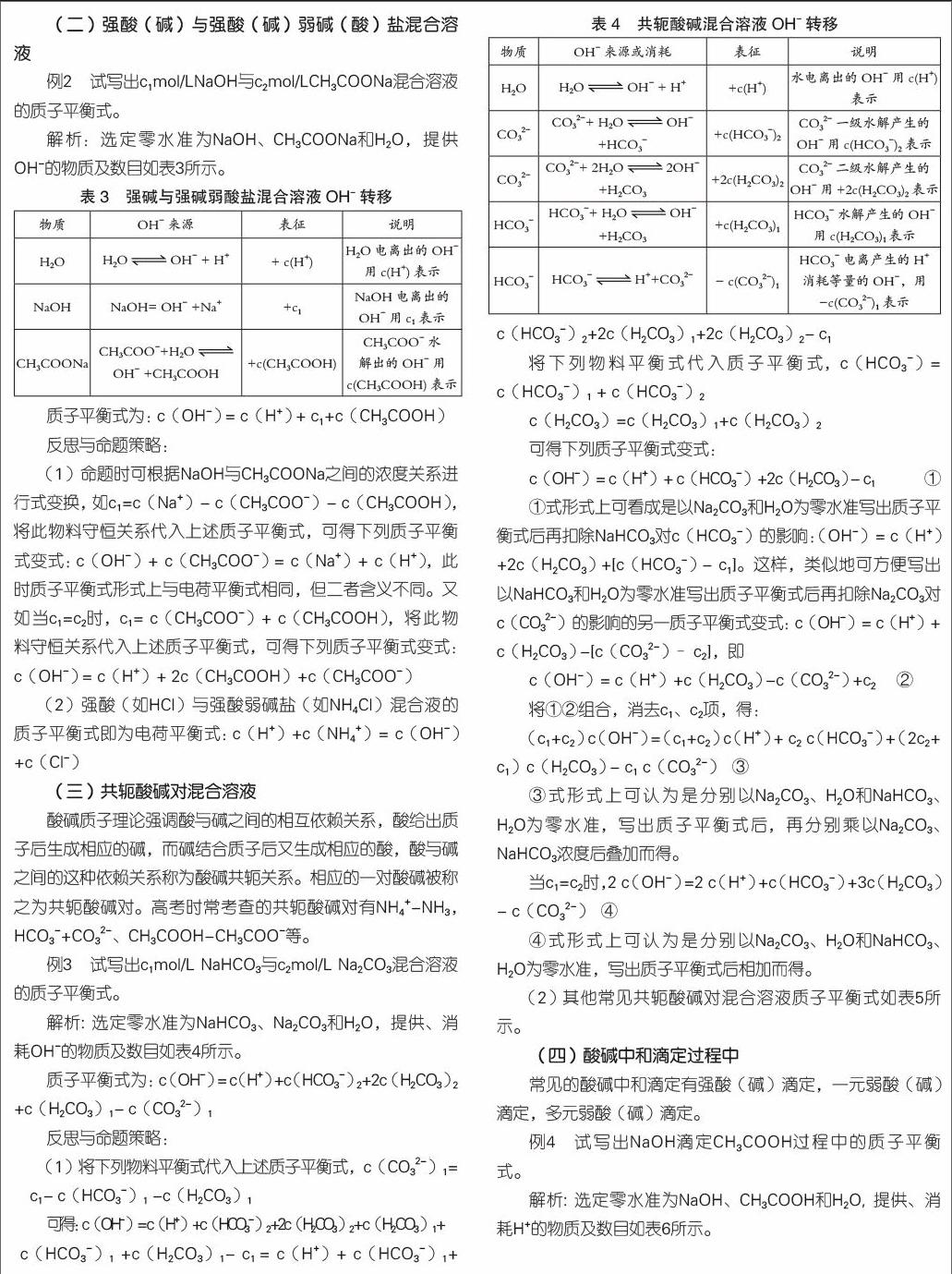
(二)强酸(碱)与强酸(碱)弱碱(酸)盐混合溶液
例2 试写出c1mol/LNaOH与c2mol/LCH3COONa混合溶液的质子平衡式。
解析:选定零水准为NaOH、CH3COONa和H2O,提供OH-的物质及数目如表3所示。
质子平衡式为:c(OH-) = c(H+) + c1+c(CH3COOH)
反思与命题策略:
(1)命题时可根据NaOH与CH3COONa之间的浓度关系进行式变换,如c1=c(Na+)- c(CH3COO-)- c(CH3COOH),将此物料守恒关系代入上述质子平衡式,可得下列质子平衡式变式:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+),此时质子平衡式形式上与电荷平衡式相同,但二者含义不同。又如当c1=c2时,c1= c(CH3COO-)+ c(CH3COOH),将此物料守恒关系代入上述质子平衡式,可得下列质子平衡式变式: c(OH-) = c(H+)+ 2c(CH3COOH)+c(CH3COO-)
(2)强酸(如HCl)与强酸弱碱盐(如NH4Cl)混合液的质子平衡式即为电荷平衡式:c(H+)+c(NH4+)= c(OH-)+c(Cl-)
(三)共轭酸碱对混合溶液
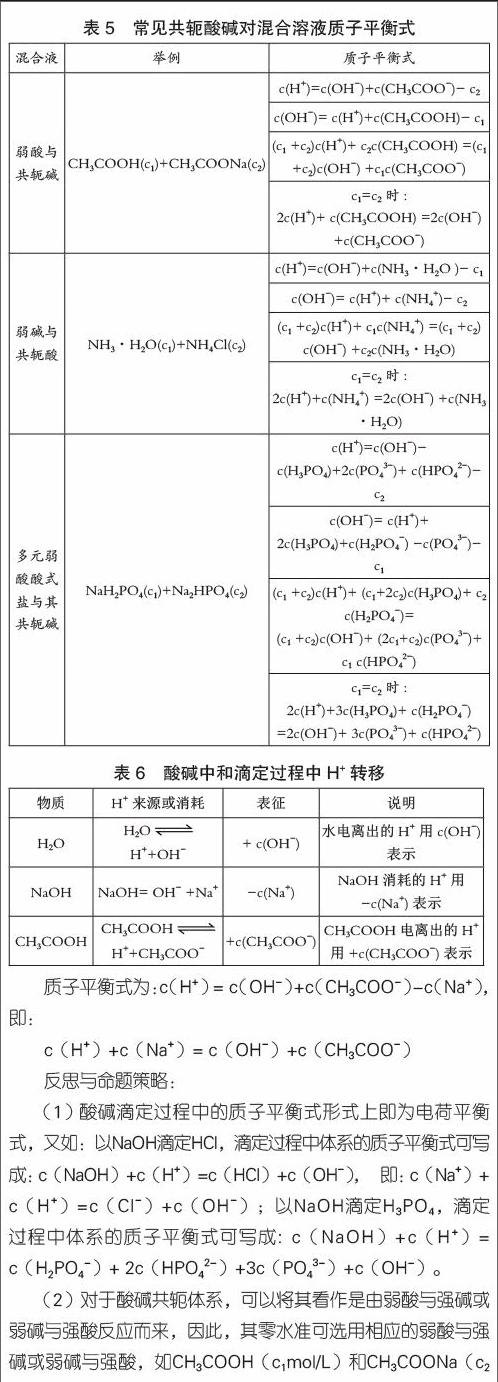
酸碱质子理论强调酸与碱之间的相互依赖关系,酸给出质子后生成相应的碱,而碱结合质子后又生成相应的酸,酸与碱之间的这种依赖关系称为酸碱共轭关系。相应的一对酸碱被称之为共轭酸碱对。高考时常考查的共轭酸碱对有NH4+-NH3,HCO3-+CO32-、CH3COOH-CH3COO-等。
例3 试写出c1mol/L NaHCO3与c2mol/L Na2CO3混合溶液的质子平衡式。
解析: 选定零水准为NaHCO3、Na2CO3和H2O,提供、消耗OH-的物质及数目如表4所示。
四、结束语
通过上述分析可以看出,书写混合溶液的质子平衡式关键是要仔细分析出体系中所有参与质子转移的反应方程式,然后再结合H+或OH-的来龙去脉,直接书写出有明确化学含义的质子平衡式,有时还需结合试题情境作适当变化。另外,从质子平衡式书写结果来看,可以归纳为两类,如表7所示。
【参考文献】
[1]曹旭琴.缓冲溶液中的离子平衡[J].化学教学,2009(10):63-64.
[2]茆建军.溶液中离子浓度大小比较的解题策略[J].化学教学,2010(6):71-75.
[3]曾应超.用组分分离法书写混合溶液的质子守恒式[J].化学教学,2013(5):70-71.
作者简介:
陈世明,中学高级教师。1990年8月至2011年8月在扬中县中工作;2011年8月至2014年8月在扬中市新坝中学工作;2014年8月至今在扬中市第二高级中学工作。扬中市学科带头人、镇江市骨干教师,江苏省中小学优秀班主任。
