火焰辅助热解方法制备Ag2O/TiO2及其光催化制氢性能
2017-07-05赵之皓李乔丹陈阳崔晓莉
赵之皓 李乔丹 陈阳 崔晓莉
(复旦大学材料科学系,上海200433)
火焰辅助热解方法制备Ag2O/TiO2及其光催化制氢性能
赵之皓 李乔丹 陈阳 崔晓莉*
(复旦大学材料科学系,上海200433)
以钛酸丁酯和硝酸银为前驱体,采用一步火焰辅助热解法制备了Ag2O/TiO2光催化剂并研究了样品在紫外-可见光照射下的光催化制氢性能。利用X射线衍射(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X射线光电子能谱(XPS)和紫外-可见漫反射吸收光谱(UV-Vis DRS)对样品进行了表征。XRD结果表明TiO2均为锐钛矿晶型,Ag的引入对XRD结果无明显影响。SEM图显示未修饰的TiO2是微球形貌,随着引入Ag含量的增加,微球减少直至消失。通过XPS分析和化学沉淀法表明样品中Ag的存在形式为Ag2O。UV-Vis DRS测试发现引入Ag后提高了样品的光吸收。前驱体中Ag的量影响样品的光催化活性,最高的光催化制氢的活性可以达到相同条件下的P25的15倍。对光催化反应后的样品进行分析,认为在光催化过程中部分Ag2O通过光生电子转化为Ag形成Ag/TiO2,进一步提高光催化制氢活性。
火焰辅助法;Ag2O复合;TiO2;光催化;制氢
0 引言
氢能是一种能量密度高、无毒、无污染的新能源。在获得氢能的多种途径中,由于不消耗化石能源,利用太阳能光催化分解水制氢是一种前景广阔的制氢途径。在各种光催化剂中,TiO2因其稳定、无毒、价格低廉的优势,被认为是理想的光催化剂[1-2]。但锐钛矿和金红石晶型TiO2的禁带宽度分别高达3.2和3.0 eV,只能吸收紫外光,且光生电子-空穴复合率较高[3],因而通过对其改性以提高光催化活性的研究得到广泛关注。
研究表明,在TiO2表面负载贵金属或过渡金属氧化物的纳米粒子可以成为电子陷阱,有效抑制光生电子-空穴的复合[4-8]。在各种贵金属修饰TiO2体系的选择中,Ag/TiO2是一种被广泛研究的体系。Binitha等[9]用溶胶凝胶法制得Ag纳米粒子掺杂的TiO2光催化剂,置于0.01‰的甲基橙溶液经阳光照射3 h后降解率达到94%。Lü等[10]使用电化学沉积法,以FTO为基板在P25表面沉积Ag纳米粒子,显著提高了光催化活性。Cheng等[11]以Ag纳米线为模板,用蒸汽热法制备了Ag/TiO2,降解罗丹明B的速率高于P25,且易回收。在二元或多元半导体复合物中,Ag2O/TiO2复合材料也被广泛研究。Zhou等[12]采用共沉淀法合成了Ag2O/TiO2异质结,增强了对甲基橙的降解能力。Yuan等[13]通过二步合成法,制备了Ag2O/TiO2/V2O5三元半导体复合物,形成能带阶梯,大幅拓宽了样品的光吸收范围。
目前对于Ag2O/TiO2或Ag/TiO2的光催化性能研究集中在光催化降解方面,对其光催化制氢性能研究较少。本文采用简便的、无需退火处理的火焰辅助热解方法[14-15]一步制备Ag2O修饰的TiO2,研究了其在紫外-可见光下光催化分解水制氢速率,并与不含Ag的TiO2以及P25的光催化能力进行比较。
1 实验部分
1.1 样品的制备
以钛酸四丁酯(tetrabutyl orthotitanate,TBOT,化学纯,国药集团化学试剂有限公司)、无水乙醇(分析纯,上海振兴化工一厂)、硝酸银(AgNO3,分析纯,上海化学试剂有限公司)为原料,采用火焰辅助热解法制备样品。
以35 mL无水乙醇、5 mL TBOT配置成溶液,分别加入4.5、9、18 mg的AgNO3。混合均匀后,用火柴点燃溶液。待燃烧停止后,研磨得到灰色/黑色粉末。按照Ag的质量分数由小到大的顺序,将以上3个样品分别命名为0.25%Ag2O/TiO2、0.5%Ag2O/TiO2、1%Ag2O/TiO2,将未加入AgNO3而制备的样品命名为0-TiO2。
1.2 样品表征
利用Bruker AXS D8型X射线粉末衍射仪(XRD,Cu Kα,λ=0.154 18 nm)表征样品的晶体结构,工作电压和电流分别为40 kV和40 mA,扫描范围(2θ)为10°~80°。通过PHILIPS-XL30FEG型扫描电子显微镜(SEM)表征样品的形貌,工作电压为15 kV。通过JEOL JEM-2011型透射电子显微镜(TEM)表征样品的微观结构,工作电压200 kV。利用RBD upgraded PHI-5000C ESCA型X射线光电子谱(XPS)分析Ag的存在形式和状态,测量条件为Mg靶(Mg Kα,hν=1 253.6 eV),工作电压和电流分别为14 kV和20 mA,并由284.6 eV的C1s为基准进行结合能校正。由岛津UV-3150型扫描分光光度计测试紫外-可见漫反射吸收光谱(UV-Vis DRS)表征样品光吸收能力。
1.3 光催化制氢性能的测试
配置80 mL 20%甲醇溶液置于特制石英烧瓶中,加入0.2 g样品,通N230 min后密封。在磁力搅拌和水浴控温下,使用500 W的氙灯(CHF-XV135,北京畅拓科技有限公司)连续光照3 h,每30 min从反应瓶中采集3 mL气体样品进行H2含量的定量分析(上海天美科学仪器有限公司的GC 7900型气相色谱仪,检测器为TCD检测器,色谱柱为5A分子筛,N2作载气)。
2 结果与讨论
2.1 XRD结果
图1为不同Ag含量样品的XRD图,25.3°、37.9°、48.1°衍射峰分别对应锐钛矿型TiO2的(101)、(004)、(200)晶面。相比不含Ag的样品(a),含Ag的样品随着Ag含量的增加,锐钛矿相的特征峰强度减弱。根据谢乐公式,0-TiO2、0.25%Ag2O/TiO2、0.5% Ag2O/TiO2、1%Ag2O/TiO2的平均晶粒尺寸分别为24.2、22.5、19.8和23.5 nm。右侧小图为25.3°附近的放大图,可观察到(101)晶面对应峰位未发生偏移,初步表明Ag没有掺入TiO2晶格。
此外,在修饰Ag的样品中未发现Ag或Ag2O相关的衍射峰,这可能是缘于样品中的Ag的量较少。

图1 TiO2和不同Ag含量Ag2O/TiO2样品的XRD图Fig.1XRD patterns of TiO2and Ag2O/TiO2composites
2.2 样品的形貌表征
图2为不同Ag含量样品的SEM图。图2(a)显示不含Ag的样品呈微球形貌,这与文献[15]结果一致。引入Ag后,样品的成球率随Ag含量的增加而下降(b~d)。样品0.25%Ag2O/TiO2中出现了一些2~10 μm的块体。而样品0.5%Ag2O/TiO2中仅存极少的微球形貌。样品1%Ag2O/TiO2则几乎全部是块体,样品的微球形貌消失,这与前文报道的SiO2修饰TiO2[17]、Pt修饰TiO2[18]以及Fe修饰TiO2[19]的结果一致。
为了进一步揭示样品的形貌特征,对0.5% Ag2O/TiO2样品进行了TEM表征和EDS元素分析(图3)。图3(A,B)显示,样品的表面微观结构为片层状结构,且结晶度较低,这与XRD表征结果吻合。图3(B)中未观察到明显的Ag或Ag2O的纳米颗粒。图3(D~F)是O、Ti、Ag三种元素的分布图,各元素分布均匀,可知Ag元素在TiO2中呈均匀、无序分布状态。

图2 TiO2和不同Ag含量Ag2O/TiO2样品的SEM图Fig.2SEM images of TiO2and Ag2O/TiO2composites

图3 0.5%Ag2O/TiO2样品的TEM图(A,B),元素分布图(C)以及氧(D)、钛(E)、银(F)各元素的分布图Fig.3TEM images of 0.5%Ag2O/TiO2(A,B)and EDS mapping:all elements(C),O(D),Ti(E)and Ag(F),respectively
2.3 XPS元素成分分析
为了研究样品中Ag的存在形式,对不同Ag含量的样品进行了XPS表征。图4为样品的Ti2p电子能谱。其中,含Ag与不含Ag的样品的结合能均位于458.8和464.6 eV,对应的是Ti4+的Ti2p3/2、Ti2p1/2的2个能级[20-21]。而含Ag的样品与不含Ag的样品相比,峰位并没有发生偏移,说明Ag没有掺入TiO2,这一现象与XRD表征结果相吻合。
图5为XPS样品的Ag3d电子能谱。由于Ag的含量较少,曲线很不平滑,信噪比较低,背景噪声对于峰强和峰位的影响无法忽略或排除。根据2个峰的峰位(367.4±0.2)、(373.6±0.2)eV大致判断,Ag的存在形式为Ag2O,分别对应Ag2O中的Ag3d5/2和Ag3d3/2[22]。

图4TiO2和不同Ag含量Ag2O/TiO2样品的Ti2p电子谱Fig.4XPS spectra for Ti2p core level of TiO2and Ag2O/TiO2composites
为了进一步验证样品中Ag的价态和存在形式,采用如下化学方法检验样品中Ag的存在形式。取65 mg 0.5%Ag2O/TiO2样品,加入16 mL氨水(24%~28%),混合均匀,离心,取清液4 mL。配置20 mL盐酸溶液(浓度7.4%),向盐酸溶液中逐滴加入上述清液。在加入2 mL时可观察到在每次滴入的清液附近出现白色沉淀。当清液全部加入时,静置可观察到少量白色悬浮物,判断为AgCl。由此推断样品中存在Ag2O,与氨水和盐酸发生如下反应(1~2)产生AgCl白色沉淀。
Ag2O+4NH3·H2O→2Ag[(NH3)2]++2OH-+3H2O(1)

图6 P25、0-TiO2以及不同Ag含量Ag2O/TiO2样品的紫外-可见漫反射吸收谱(A)和对应的Tauc图(B)Fig.6UV-Vis diffuse reflectance spectra(A)and corresponding Tauc plots(B)for P25,0-TiO2and Ag2O/TiO2composites

图5 不同Ag含量Ag2O/TiO2样品的Ag3d电子谱Fig.5XPS spectra for Ag3d core level of Ag2O/TiO2composites

另取65 mg经过2 h光催化制氢测试的样品,重复上述实验,观察到在加入3 mL清液后,在滴入的清液附近出现极少量的白色沉淀。当清液全部加入后静置,观察到液面上的白色沉淀的量远少于光催化实验前样品中观察到的量。初步推测出Ag2O/ TiO2参与光催化制氢后,部分Ag2O发生反应而被消耗。
2.4 紫外-可见漫反射谱分析
图6(A)给出了P25、0-TiO2与不同Ag含量的TiO2样品的紫外-可见漫反射吸收谱,从图中可以看出所有样品的光吸收均高于P25,Ag的引入提高了样品在紫外-可见光区的光吸收性能,随着Ag含量的增加,光吸收增大,但样品1%Ag2O/TiO2的光吸收相比其他制备的样品有所下降。
由于锐钛矿TiO2是间接带隙半导体[16],光学吸收系数满足Tauc公式:(αhν)1/2=A(hν-Eg)(A是常数,Eg是带隙),因此作出(αhν)1/2与光子能量hν关系曲线图6(B),由此估算带隙。相比0-TiO2(带隙为2.79 eV),0.25%,0.5%,1%Ag2O/TiO2样品的带隙分别减小至2.50、2.38与2.65 eV,即样品0.5%Ag2O/TiO2带隙最小,且3个样品的带隙均小于P25的带隙(2.90 eV,本文实验测定值)。这种变化主要是由于样品中窄带隙Ag2O的含量增加所致,此外样品中C元素的存在也会减小光催化剂的表观带隙[17]。
2.5 光催化制氢活性
图7给出了各样品光催化制氢量曲线。由图7 (A)可见,引入Ag后,样品的光催化制氢速率较不含Ag的TiO2的催化制氢速率有明显提高,其中0.5% Ag2O/TiO2样品的催化活性最好。当Ag含量过多或过少时,样品的光催化活性都相对较低。
从图7(B)中还可以发现,含Ag的3个样品的光催化制氢速率先经过1~2 h的迟滞后,出现明显提升,且放氢速率均加速增加。这一现象与Jung等[23]利用Cu2O/TiO2光催化分解水制氢的结果相似。其中以0.5%Ag2O/TiO2作催化剂时,单位质量样品的最大制氢速率为110.1 μmol·h-1·gcat-1,而不含Ag的TiO2光催化制氢速率是0.5 μmol·h-1·gcat-1,故引入Ag之后,样品的光催化效率提高了220倍,为P25的15倍。
推测以上这些现象是由Ag2O/TiO2异质结和表面Ag粒子的共同作用所引起。Ag2O的价带和导带分别高于TiO2的价带和导带[23],能带匹配,电子向TiO2移动而空穴向Ag2O移动,增加了光生电子-空穴对的寿命(图8(A))。同时,由于Ag2O带隙较小,能够吸收TiO2无法吸收的可见光,增加了入射光的利用率。这与上文提到的Jung等[23]实验的原理也相似,区别是Jung等的实验中,Cu2+仅被还原为Cu+,未得到Cu0。
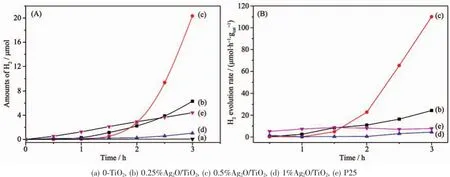
图7 TiO2(a)、不同Ag含量Ag2O/TiO2样品以及P25的光催化产氢量(A)和产氢速率(B)随时间变化关系图Fig.7H2evolution(A)and H2evolution rate(B)over TiO2,Ag2O/TiO2composites and P25

图8 Ag2O/TiO2(A)和Ag/TiO2(B)光催化机理示意图Fig.8Schematic diagrams of photocatalytic mechanism by Ag2O/TiO2(A)and Ag/TiO2(B)
对于制氢速率加速增大的现象,这可能是由于在光催化反应初期1h内,Ag2O/TiO2仅以异质结形式存在(图8(A)),光生电子更易于先与Ag2O反应,将Ag2O还原为Ag[12]。当还原过程进行到一定程度时,表面Ag粒子的存在引起表面等离子体共振效应[25-28],即光子入射到Ag表面产生电子空穴对,电子向TiO2移动,并与H+结合生成氢气(图8(B)),同时Ag的存在也促进光生电子-空穴的分离[29],使更多的光生电子还原溶液中的H+并生成氢气。光催化后样品的化学分析结果也为此推测提供了一定的证据。
由于过量的Ag粒子可以成为电子和空穴的复合中心[30],且根据XRD表征结果,1%Ag2O/TiO2样品的晶粒稍大于0.5%Ag2O/TiO2样品,根据UV-Vis DRS表征结果,样品1%Ag2O/TiO2的带隙也相对较大,故1%Ag2O/TiO2样品的光催化活性有所降低。
3 结论
采用新颖的火焰辅助热解方法一步制备了不同Ag含量的Ag2O/TiO2,合成方法方便快捷。研究表明,少量Ag的引入有助于提高TiO2的光催化制氢性能。0.5%Ag2O/TiO2样品在紫外可见光下的光催化制氢速率最高,相比不含Ag的样品,制氢速率提高了220倍,达到110.1 μmol·h-1·gcat-1,这是Ag2O/TiO2异质结和Ag修饰TiO2共同作用所致。同时,以该方法制备的Ag2O/TiO2在光催化制氢的初期,氢气生成量很少,而在光照数十分钟后,开始明显产生氢气,这是由于反应初期光生电子更易与Ag2O发生还原反应生成Ag,通过对光催化反应前后的样品进行化学分析验证了推测的反应机理。
Acknowledgements:The authors thank Dr.MA Xiao-Qing for the help in experiments.
[1]Hoffmann M,Choi W,Bahnemann D.Chem.Rev.,1995,95 (1):69-96
[2]Linsebigler A,Lu G,Yates J.Chem.Rev.,1995,95(3):735-758
[3]Carp O,Huisman C,Reller A.Prog.Solid State Chem.,2004, 32(1/2):33-177
[4]Epifani M,Giannini C,Tapfer L,et al.J.Am.Ceram.Soc., 2000,83(10):2385-2393
[5]Chien S,Liou Y,Kuo M.Synth.Met.,2005,152(1):333-336
[6]Huang L,Peng F,Wang H,et al.Catal.Commun.,2009,10 (14):1839-1843
[7]Zhou J,Zhang Y,Zhao X,et al.Ind.Eng.Chem.Res.,2006, 45(10):3503-3511
[8]Grandcolas M,Du K,Bosc F,et al.Catal.Lett.,2008,123(1/ 2):65-71
[9]Binitha N,Yaakob Z,Reshmi M,et al.Catal.Today,2009, 147:S76-S80
[10]Lü X,Gao F,Yang Y,et al.Ind.Eng.Chem.Res.,2015,55 (1):107-115
[11]Cheng B,Le Y,Yu J.J.Hazard.Mater.,2010,177(1):971-977
[12]Zhou W,Hong L,Wang J,et al.ACS Appl.Mater.Interface, 2010,2(8):2385-2392
[13]Wang Y,Liu L,Xu L,et al.Nanoscale,2014,6(12):6790-6797
[14]Ma X,Chen Y,Li H,et al.Mater.Res.Bull.,2015,66:51-58
[15]Zhang X,Sun Y,Cui X,et al.Int.J.Hydrogen Energy,2012, 37(2):1356-1365
[16]Reyes-CoronadoD,Rodríguez-GattornoG,Espinosa-Pesqueira M,et al.Nanotechnology,2008,19(14):145605(10 pages)
[17]Li H,Ma X Q,Cui X L.Mater.Res.Express,2014,1(2): 025502
[18]Li H,Zhang X Y,Cui X L.Int.J.Photoenergy,2014,2014: 414281(9 pages)
[19]CHEN Xi(陈希),LI Hui(李绘),SUN Tong(孙通),et al. Chem.J.Chinese Universities(高等学校化学学报),2013, 34(12):2855-2860
[20]Wang R,Sakai N,Fujishima A,et al.J.Phys.Chem.B, 1999,103(12):2188-2194
[21]Takeuchi M,Onozaki Y,Matsumura Y,et al.Nucl.Instrum. Methods B,2003,206(1):259-263
[22]Hammond J,Gaarenstroom S,Winograd N.Anal.Chem., 1975,47(13):2193-2199
[23]Yu W,Liu X,Chu H,et al.J.Mol.Catal.A:Chem.,2015, 407:25-31
[24]Priya R,Baiju K,Shukla S,et al.J.Phys.Chem.C,2009, 113(15):6243-6255
[25]Xu Y,Schoonen M.Am.Mineral.,2000,85(3/4):543-556
[26]Logar M,Jancar B,Sturm S,et al.Langmuir,2010,26(14): 12215-12224
[27]Awazu K,Fujimaki M,Rockstuhl C,et al.J.Am.Chem. Soc.,2008,130(5):1676-1680
[28]Christopher P,Ingram D,Linic S.J.Phys.Chem.C,2010, 114(19):9173-9177
[29]Yoshiteru M,Yoji M,Tatsuya S,et al.Ultrason.Sonochem., 2007,14(3):387-392
[30]Li Y,Lu G,Li S.Appl.Catal.A:Gen.,2001,214(2):179-185
Facile Synthesis and Photocatalytic Activity for Hydrogen Evolution of Ag2O/TiO2
ZHAO Zhi-HaoLee JordanCHEN YangCUI Xiao-Li*
(Department of Materials Science,Fudan University,Shanghai 200433,China)
The Ag2O/TiO2composite was synthesized via a facile flame thermal method using tetrabutyl orthotitanate and AgNO3as precursors.The samples were characterized with X-ray diffraction(XRD),scanning electron microscopy(SEM),transmission electron microscopy(TEM),X-ray photoelectron spectroscopy(XPS),ultravioletvisible diffuse reflectance spectroscope(UV-Vis DRS)and photocatalytic hydrogen evolution under UV-Vis light irradiation.XRD results showed that anatase TiO2was obtained directly and no obvious effect on the crystal structure was observed with the introduction of desired amount of Ag.SEM images show microspherical morphology for the as-synthesized samples without Ag and irregular morphology for those with higher content of Ag.XPS and chemical precipitation method results indicated that Ag existed in the forms of Ag2O in the resulted samples.UV-Vis DRS showed that the introduction of Ag could enhance light absorption.The highest photocatalytic hydrogen generation rate of sample was about 15 times as high as that of P25.The sample after photocatalytic reaction was chemically analyzed and it is assumed that the Ag2O was partly photoreduced to Ag, which further benefits the photocatalytic hydrogen production from Ag/TiO2heterostructures.
flame thermal method;Ag2O;TiO2;photocatalysis;hydrogen evolution
O643.32
A
1001-4861(2017)05-0738-07
10.11862/CJIC.2017.098
2016-11-30。收修改稿日期:2017-03-16。
国家自然科学基金(No.21273047)和复旦大学本科生曦源项目(No.15609)资助。
*通信联系人。E-mail:xiaolicui@fudan.edu.cn;会员登记号:S06N5428M1304。
猜你喜欢
杂志排行
无机化学学报的其它文章
- Tm3+/Er3+/Ho3+共掺SiO2-Bi2O3-AlF3-BaF2玻璃发光性能
- 一种三足四齿Schiff碱的Cu(Ⅱ)、Co(Ⅲ)配合物的合成、晶体结构与表征
- Syntheses, Crystal Structures and Insulin-like Activity of Maltolato- and Ethylmaltolato-Coordinated Oxovanadium(Ⅴ) Complexes Derived from 4-Fluoro-N′-(3-ethoxy-2-hydroxybenzylidene)benzohydrazide
- Electrochemically Self-Assembled Fe/Cu Nanocomposite with Improved High-Rate and Low-Temperature Performances for Nickel-Iron Alkaline Battery
- 碳化硅衍生碳的制备及其超级电容性能
- Crystal Structures and DNA Interaction Properties of Niand Ni(Ⅱ) and Cd(Ⅱ)Complexes with a Semicarbazone Ligand Bearing Pyrazine Unit
