多指标正交试验优化理冲生髓饮的醇提工艺
2017-07-03王艳宏赵娟萍尚冬雪赵雪田苗韩凤娟
王艳宏,赵娟萍,尚冬雪,赵雪,田苗,韩凤娟
多指标正交试验优化理冲生髓饮的醇提工艺
王艳宏1,赵娟萍1,尚冬雪1,赵雪1,田苗2,韩凤娟2
1.黑龙江中医药大学药学院,黑龙江哈尔滨 150040; 2.黑龙江中医药大学附属第一医院,黑龙江哈尔滨 150040
目的 优选理冲生髓饮的最佳醇提工艺。方法 采用L9(34)正交试验法,以毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd、黄芪甲苷的转移率和干膏得率为指标,通过综合评分法,考察乙醇浓度、提取时间、提取温度、溶媒用量对理冲生髓饮醇提工艺的影响。结果 最佳提取工艺为:10倍量60%乙醇浸泡2 h后,加热回流提取2次,提取时间1.5 h,提取温度80 ℃。结论 该工艺提取率高,工艺稳定、可行,可为理冲生髓饮的进一步研究提供数据。
理冲生髓饮;正交试验;多指标;醇提工艺
理冲生髓饮是国家级老中医、黑龙江省名中医王秀霞教授在理冲丸的基础上结合多年临床实践总结出的有效防治卵巢肿瘤的中药复方制剂。现代研究表明其可提高卵巢癌患者的免疫功能[1],对人卵巢癌细胞SKOV3的体外生长有抑制作用,可阻断Bcl-2癌基因蛋白表达[2-3],对化学致癌因子诱发的大鼠卵巢肿瘤有抑制和阻断作用[4],对P53基因蛋白、血管内皮生长因子基因蛋白、Casp-8和CXCL2基因的过度表达有调节作用[5-7]。理冲生髓饮具有破血消癥、软坚散结、补气养血、填精益髓之功。方中所含有效成分种类众多,包括挥发油类、皂苷类、黄酮类、多糖类等。其中,毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd和黄芪甲苷等成分具有抗肿瘤、提高免疫功能等活性[8-14]。本研究采用正交试验法,考察乙醇浓度、提取时间、提取温度、溶媒用量对上述成分转移率和干膏得率等多指标的影响,优选理冲生髓饮的醇提工艺,以期为理冲生髓饮的进一步深入研究提供数据。
1 仪器与试药
SFE220-40-100超临界萃取装置(江苏温奥机械设备有限公司),AK-400B中药粉碎机(泰州金诚制药机械有限公司),DZF-6050真空干燥箱(北京北方利辉试验仪器设备有限公司),KDM-1000调温电热套(江苏杰瑞尔电器有限公司),TGL-16G高速离心机(北京佳源兴业科技有限公司),FA2104A电子分析天平(上海精天电子仪器有限公司),LC-20AT高效液相色谱仪(日本岛津公司),BenchTop K真空冷冻干燥机(美国VIRTIS公司),WFZUV-4802H紫外分光光度计(上海尤尼柯仪器有限公司),N1100-OSB- 2100旋转蒸发仪(上海爱朗仪器有限公司)。
理冲生髓饮方中各药(人参、黄芪、淫羊藿、莪术等)均由黑龙江中医药大学第一附属医院提供,经黑龙江中医药大学孙慧峰教授鉴定均符合2015年版《中华人民共和国药典》各药项下规定。对照品人参皂苷Rg1(批号110703-201128)、人参皂苷Rb1(批号110704-201424)、人参皂苷Re(批号110754- 201324)、黄芪甲苷(批号110781-201314)、毛蕊异黄酮葡萄糖苷(批号111920-201304)、淫羊藿苷(批号110737-200415)、宝藿苷Ⅰ(批号111852-201102),中国食品药品检定研究院;人参皂苷Rd(批号MUST- 11041212),成都曼斯特生物科技有限公司。乙腈(GR级,美国迪马科技有限公司),磷酸(GR级,天津赛孚瑞科技有限公司),HPLC所用水为屈臣氏蒸馏水,实验用水为重蒸馏水,其余试剂均为分析纯。
2 方法与结果
2.1 理冲生髓饮的制备
取处方量饮片,以超临界流体萃取法(SCFE)萃取,获得萃取物;药渣继续以适宜浓度乙醇回流提取,提取液回收乙醇后浓缩至适量;药渣挥尽溶剂后,继续以水回流提取,水提液浓缩后,与上述浓缩液合并,加入萃取物,搅匀,即得。本研究采用正交试验法优化其中的醇提工艺。
2.2 干膏得率测定
取1/10正交试验获得的提取液,置干燥至恒重的蒸发皿中,水浴蒸干后,置105 ℃烘箱中干燥至恒重,在干燥器中冷却30 min,精密称定,计算干膏得率。
2.3 黄酮类和皂苷类成分检测
2.3.1 对照品溶液的制备 精密称取毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ对照品适量,加甲醇制成每1 mL含0.25 mg毛蕊异黄酮葡萄糖苷、1.00 mg淫羊藿苷、0.50 mg宝藿苷Ⅰ的混合对照品贮备液。精密称取人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd和黄芪甲苷对照品适量,加甲醇制成每1 mL含1.0 mg人参皂苷Rg1、2.0 mg人参皂苷Re、1.0 mg人参皂苷Rb1、1.0 mg人参皂苷Rd和1.0 mg黄芪甲苷的混合对照品贮备液。
2.3.2 供试品溶液的制备 正交试验获得的提取液,减压回收乙醇后加水分散,然后用乙酸乙酯萃取至无色,合并乙酸乙酯层,减压回收乙酸乙酯后,加甲醇溶解,过滤,即得。
2.3.3 阴性对照溶液的制备 分别按处方比例称取除黄芪、淫羊藿,除黄芪、人参之外的其余药味,按“2.1”项下方法制备缺黄芪、淫羊藿阴性对照溶液和缺黄芪、人参阴性对照溶液。
2.3.4 色谱条件 采用Dikma Diamonsil-C18色谱柱(250 mm×4.6 mm,5 µm),流动相为0.1%磷酸水溶液(A)-乙腈(B),梯度洗脱(见表1),柱温30 ℃,流速1.0 mL/min,进样量20 µL,检测波长为270 nm(黄酮类成分)、203 nm(皂苷类成分)。
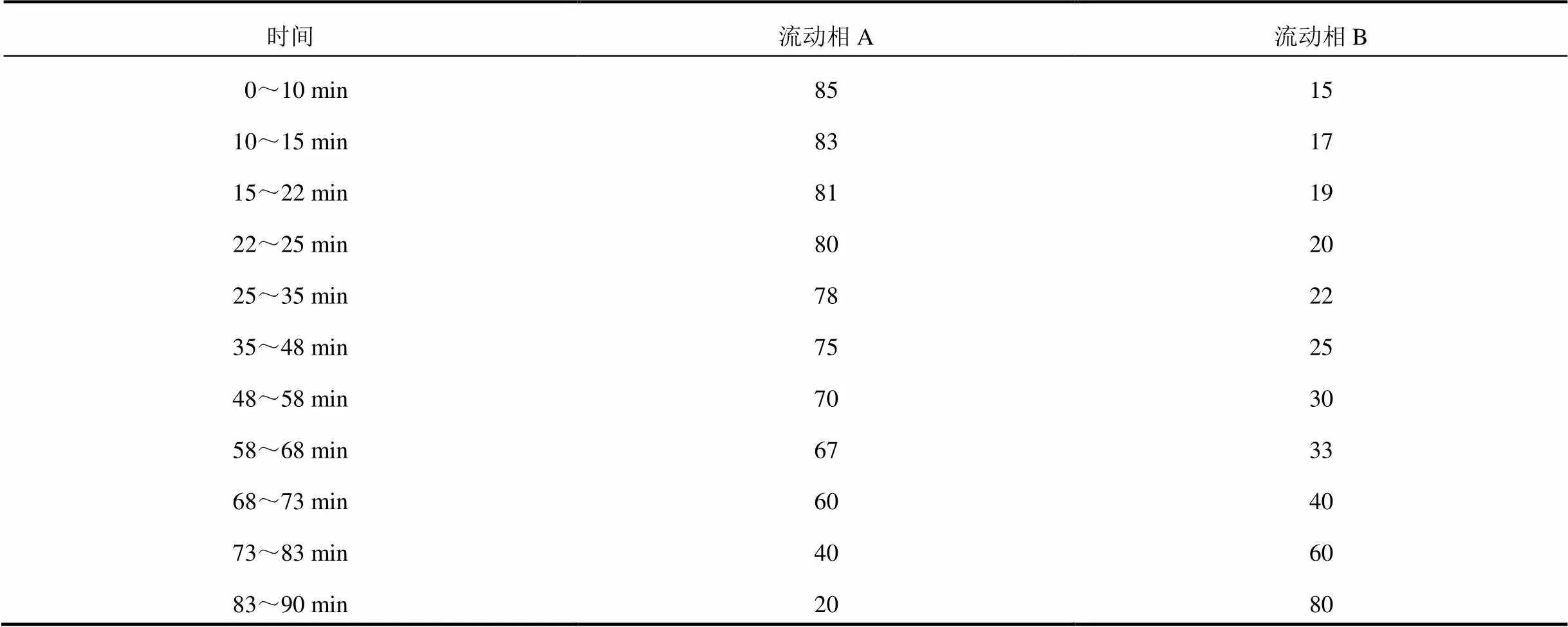
表1 流动相梯度洗脱条件(%)
2.3.5 系统适用性试验 分别取对照品溶液、供试品溶液、阴性对照溶液和空白甲醇,按“2.3.4”项下色谱条件进样,记录色谱图(见图1、图2)。各主要色谱峰与其左右峰的分离度均大于1.5,理论塔板数均大于7000。
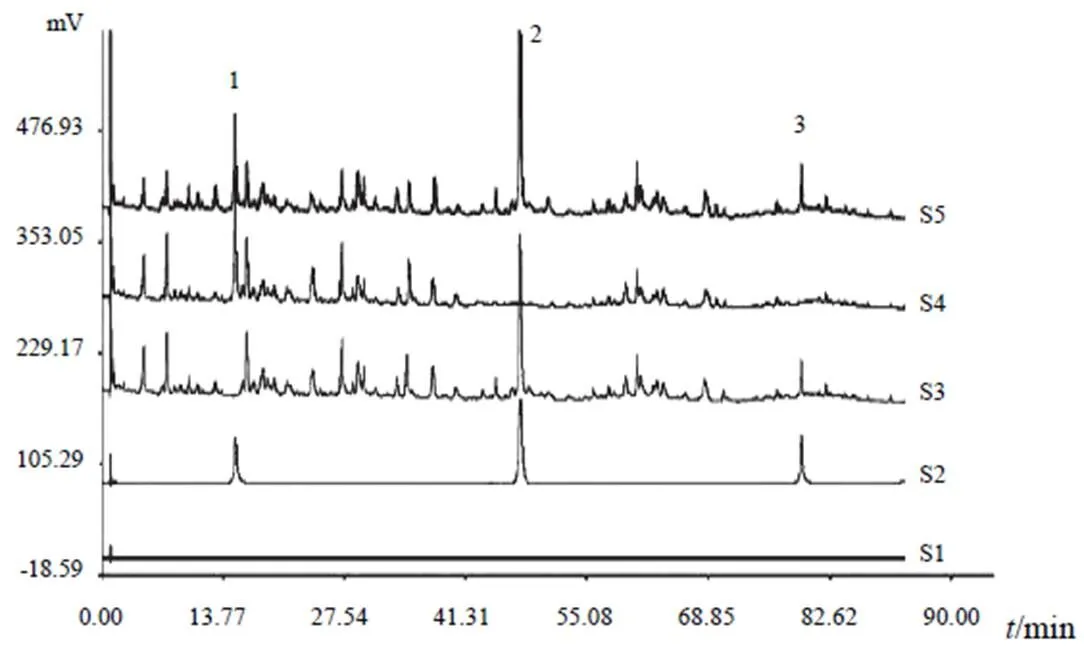
注:S1.空白溶剂;S2.对照品;S3.缺黄芪阴性对照; S4.缺淫羊藿阴性对照;S5.供试品; 1.毛蕊异黄酮葡萄糖苷;2.淫羊藿苷;3.宝藿苷Ⅰ
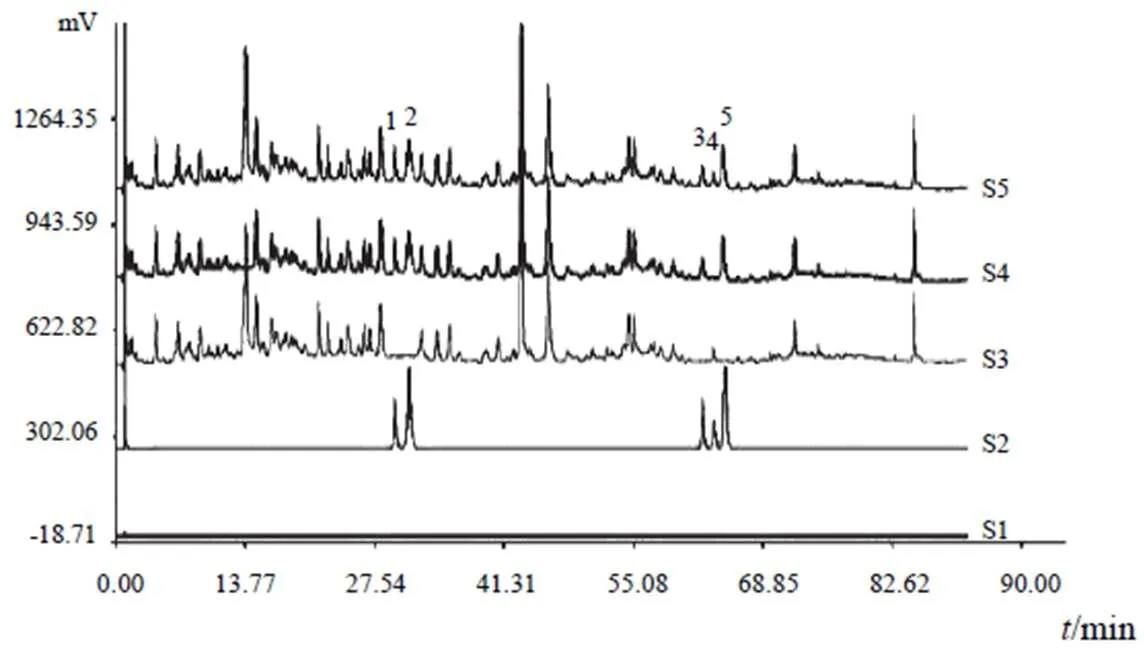
注:S1.空白溶剂;S2.对照品;S3.缺人参阴性对照;S4.缺黄芪阴性对照; S5.供试品;1.人参皂苷Rg1;2.人参皂苷Re;3.人参皂苷Rb1; 4.黄芪甲苷;5.人参皂苷Rd
2.3.6 线性关系考察 按逐级稀释法,分别精密吸取适量混合对照品溶液于10 mL量瓶中,加甲醇定容至刻度,得混合对照品系列溶液,按“2.3.4”项下色谱条件进行测定,以峰面积()对质量浓度()进行线性回归,得到各成分的回归方程。毛蕊异黄酮葡萄糖苷:=5.0E+7-984 485,=0.999 9,在0.25~2.5 µg范围内线性关系良好;淫羊藿苷:=3.0E+7+45 106,=0.999 8,在1.0~10.0 µg范围内线性关系良好;宝藿苷Ⅰ:=7.0E+7+69 274,=0.999 8,在0.5~5.0 µg范围内线性关系良好。人参皂苷Rg1:=1.0E+7-35 999,=0.999 6,在1.0~10.0 µg范围内的线性关系良好;人参皂苷Re:=1.0E+7+47 082,=0.999 7,在2.0~20.0 µg范围内线性关系良好;人参皂苷Rb1:=1.0E+7+112 642,=0.999 7,在1.0~10.0 µg范围内线性关系良好;人参皂苷Rd:=1.0E+7-88 267,=0.999 7,在1.0~10.0 µg范围内线性关系良好;黄芪甲苷:=1.0E+7-10 578,=0.999 8,在1.0~10.0 µg范围内线性关系良好。
2.4 醇提工艺优化
2.4.1 提取次数 取处方量药材,考察提取次数对醇提工艺的影响。结果表明,提取次数对醇提工艺的影响较大。提取2次与提取1次相比,各成分转移率及干膏得率均较高,当提取次数增加至3次时,各成分转移率无明显变化,见表2。为减少溶剂的消耗,节省提取时间,故选择提取次数为2次。

表2 不同提取次数对干膏得率及各成分转移率的影响(%)
2.4.2 正交试验 以乙醇浓度(A)、提取时间(B)、提取温度(C)、溶媒用量(D)作为自变量因素,采用L9(34)正交试验,以多指标综合加权评分方法确定最佳醇提工艺。设定满分为100分,干膏得率及毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ转移率标准化数据的权重系数为10,人参皂苷Rg1、Re、Rb1、Rd和黄芪甲苷转移率标准化数据的权重系数为12。综合评分=10×干膏得率ib+10×毛蕊异黄酮葡萄糖苷转移率ib+10×淫羊藿苷转移率ib+10×宝藿苷Ⅰ转移率ib+12×人参皂苷Rg1转移率ib+12×人参皂苷Re转移率ib+12×人参皂苷Rb1转移率ib+12×人参皂苷Rd转移率ib+12×黄芪甲苷转移率ib。其中i=1,2,3,…,9;指标ib为以各指标的最大值作为参照对该指标各数据进行标准化处理后的值,即指标ib=指标i÷指标max。正交试验因素水平见表3,正交试验结果见表4、表5,方差分析见表6。
直观分析结果表明,4个影响因素的主次顺序为D(溶媒用量)>C(提取温度)>A(乙醇浓度)>B(提取时间),最佳工艺A1B2C3D3。方差分析结果表明,取离均差平方和最小项(B)作为误差估计,用以检验其他因素作用的显著性。结果表明,4个影响因素的主次顺序仍为D(溶媒用量)>C(提取温度)>A(乙醇浓度)>B(提取时间),其中,因素D有极显著影响(<0.01),因素C和A有显著影响(<0.05)。最终确定理冲生髓饮的最佳工艺为A1B2C3D3,即:加入10倍量60%乙醇浸泡2 h,加热回流提取2次,提取时间1.5 h,提取温度80 ℃。
2.4.3 最佳工艺验证 取处方量药材,按“2.4.2”项下最佳工艺条件进行验证性试验,分别测定理冲生髓饮干膏得率及毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd、黄芪甲苷的转移率,结果见表7。结果表明,该工艺各指标成分提取均较完全,且重复性好、可行性高。
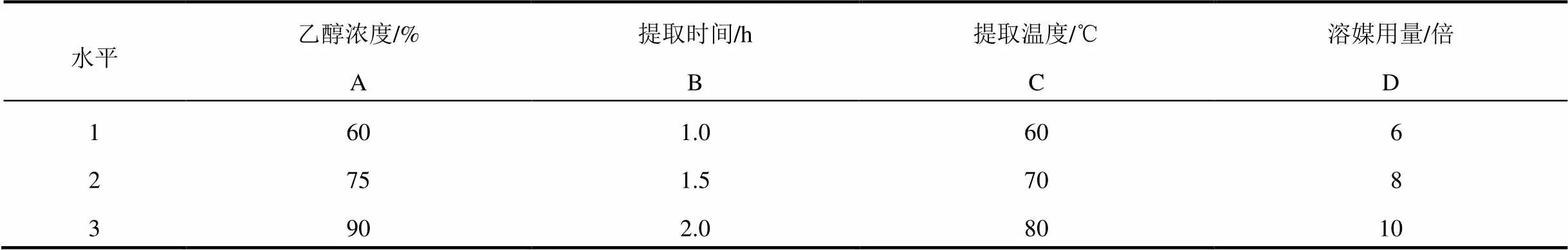
表3 正交试验因素水平表
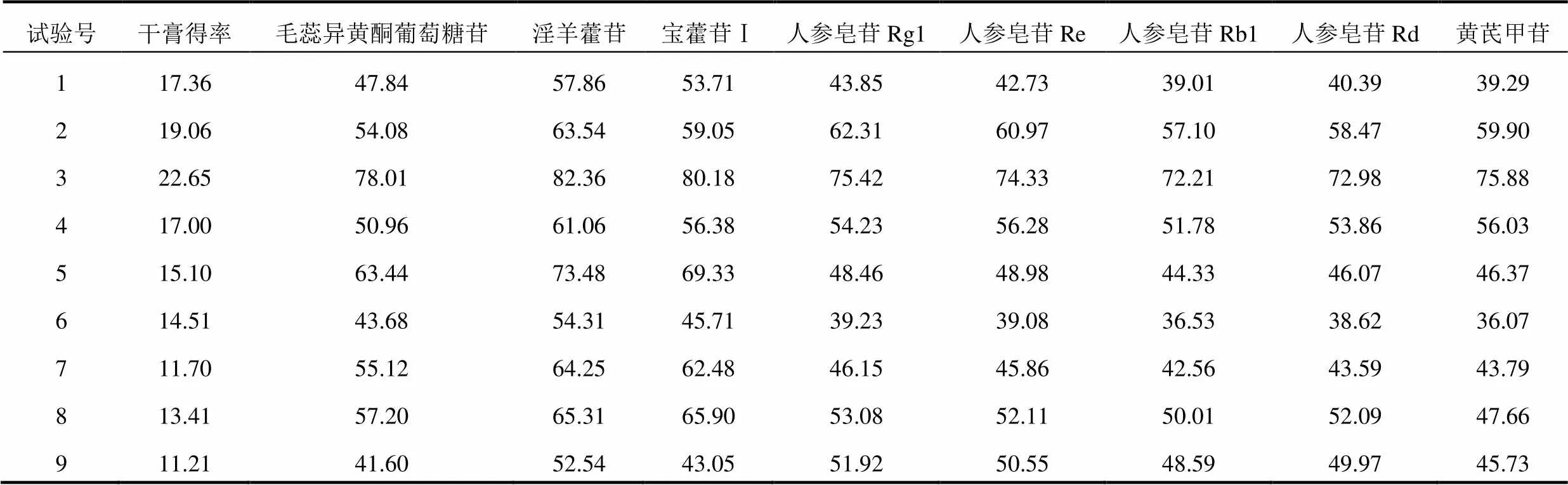
表4 正交试验干膏收率和各成分转移率(%)
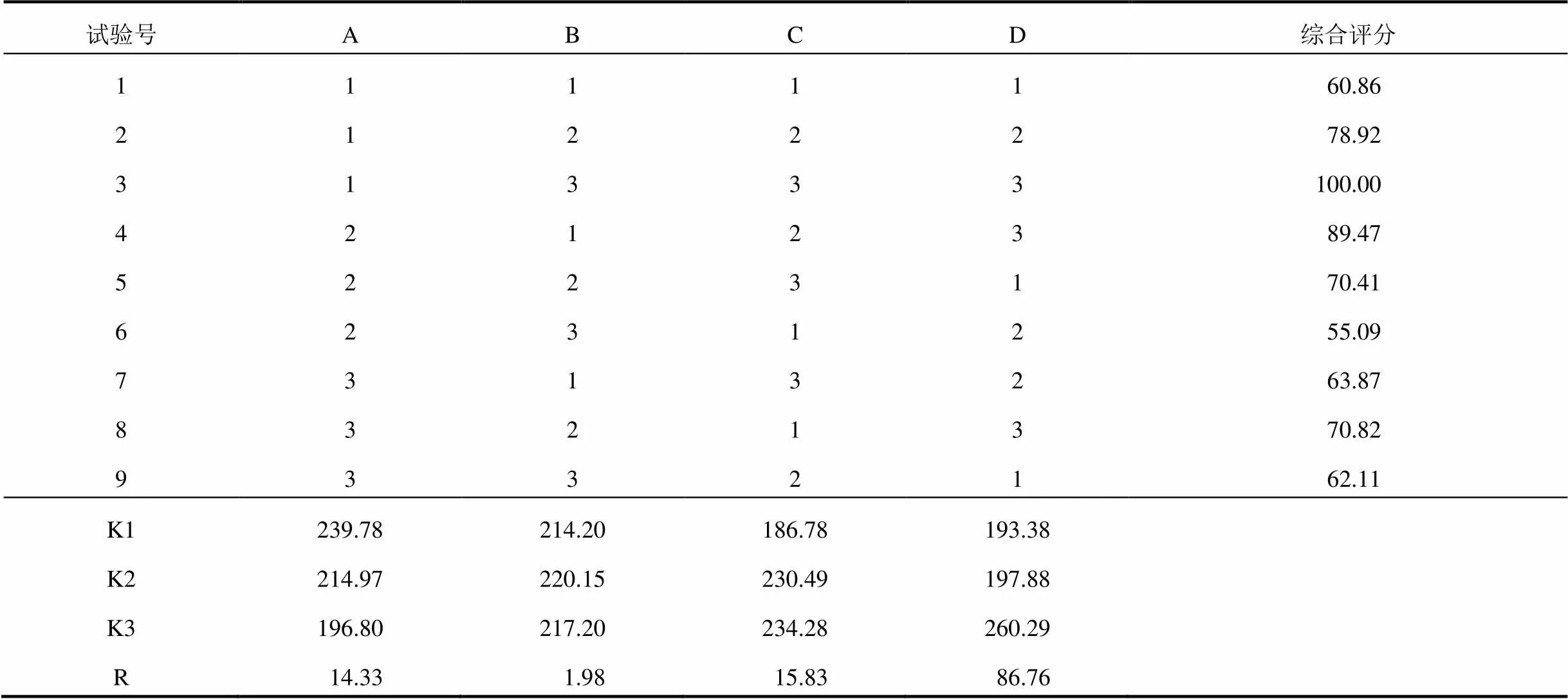
表5 正交试验设计与结果
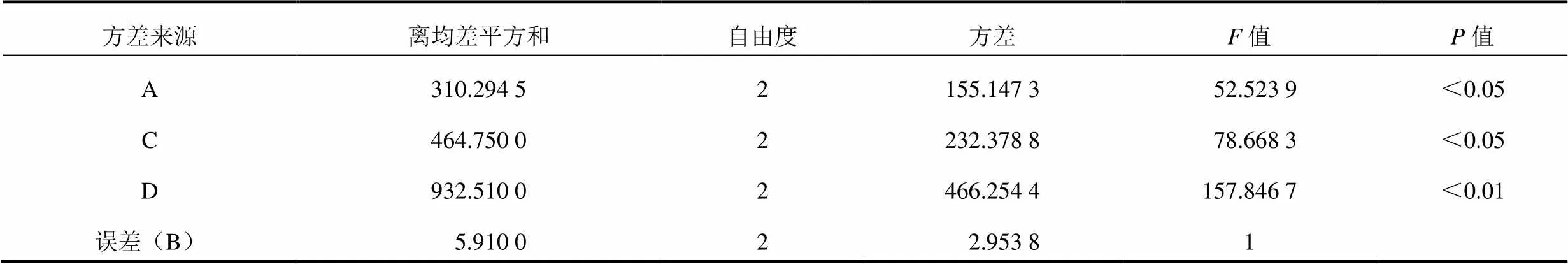
表6 试验结果的方差分析
注:0.05(2,2)=19,0.01(2,2)=9
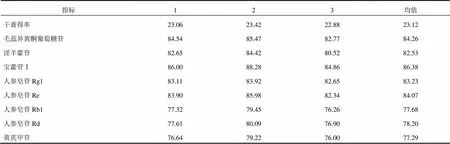
表7 最佳工艺验证性试验(%,n=3)
3 讨论
理冲生髓饮由人参、黄芪、淫羊藿、莪术等8味中药组成。2015年版《中华人民共和国药典》(一部)人参、黄芪、淫羊藿药材项下分别以人参皂苷Rg1、Re、Rb1及黄芪甲苷、毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷为含量测定指标[15]。现代研究亦表明,上述成分均具有不同程度的抑制肿瘤作用[8-13]。此外,人参皂苷Rd具有显著的抗癌活性[14]。故本研究采用毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd、黄芪甲苷的转移率和干膏得率为指标,并采用综合加权评分法,根据各有效成分对肿瘤抑制作用的贡献大小,进行综合评分,使其可以更合理、更客观、更全面地评价理冲生髓饮的醇提工艺。
本试验参考2015年版《中华人民共和国药典》(一部)人参、黄芪、淫羊藿药材项下含量测定方法[15]和文献中报道的HPLC分析方法[16-17],通过预试验考察了不同供试品制备方法、不同流动相组成、不同检测波长等对理冲生髓饮醇提液分析效果的影响,最后确定供试品用乙酸乙酯处理,流动相为0.1%磷酸水溶液-乙腈,检测波长为270 nm(黄酮类成分)、203 nm(皂苷类成分)。该方法不仅能同时测定毛蕊异黄酮葡萄糖苷、淫羊藿苷、宝藿苷Ⅰ这3种黄酮类成分,还能同时测定人参皂苷Rg1、Re、Rb1、Rd及黄芪甲苷这5种皂苷类成分,并采用同一PDA检测器实现了3种黄酮类和5种皂苷类成分的同时测定,从而为进一步建立理冲生髓饮质量标准奠定了良好的基础。
单因素试验表明,在相同的提取工艺条件下,提取次数为2次以上,黄酮类和皂苷类成分含量变化不明显,故选择提取次数2次。以乙醇浓度、乙醇用量、提取温度、提取时间4个因素为自变量,采用L9(34)正交试验,以综合加权评分法为评价基础,最终确定醇提最佳工艺,即:将SCFE萃取后的药渣加60%乙醇浸泡2 h,80 ℃加热回流提取1.5 h,提取2次,合并提取液减压浓缩至适量。该工艺具有提取率高、稳定性好的特点。
[1] 韩凤娟,隋丽华,马荣,等.理冲生髓饮对卵巢上皮性癌患者免疫状态影响的临床研究[J].中医药信息,2003,20(2):37-38.
[2] 龚丽红,韩凤娟,王秀霞,等.理冲生髓饮对卵巢癌细胞株SKOV3基因表达的影响[J].山东中医药大学学报,2007,31(4):334-337.
[3] 韩凤娟,王艳红,隋丽华,等.理冲生髓饮药物血清对卵巢癌细胞集落形成和Bcl-2蛋白表达的影响[J].中国中医药科技,2005,12(6):345- 346.
[4] 韩凤娟,王艳红,王秀霞,等.复方理冲生髓饮对二甲基苯蒽诱发的大鼠卵巢肿瘤组织形态学的影响[J].中医药学报,2006,34(6):31-33.
[5] 韩凤娟,徐峰,王艳红,等.理冲生髓饮对大鼠卵巢肿瘤组织P53和PCNA表达影响的研究[J].中国中医药科技,2007,14(6):402-403.
[6] 怀其娟,韩凤娟,王秀霞,等.中药复方理冲生髓饮对Casp-8和CXCL2基因在人卵巢癌细胞株SKOV3中表达的影响[J].中国妇幼保健,2010, 25(12):1689-1692.
[7] 邱丽楠,韩凤娟,吴效科,等.理冲生髓饮对Fischer344大鼠卵巢肿瘤组织的抑瘤作用及对VEGF表达的影响[J].世界中西医结合杂志,2010, 5(11):939-941.
[8] 张有为,窦德强,陈英杰,等.人参皂苷对人体骨肉瘤细胞U2OS增殖的影响[J].中草药,2001,32(3):232-235.
[9] 葛迎春,刘平,韩信昌.人参皂Rb1,Rg1,Re和Rh1对Hela细胞的影响[J].中药药理与临床,1997,13(6):18-20.
[10] 张冬青,汪德清,于勇.黄芪总黄酮和毛蕊异黄酮对K562细胞的抑制作用及其机制研究[J].中国中药杂志,2011,36(24):3502-3505.
[11] 刘明华,任美萍,陈健平,等.黄芪皂苷抗肿瘤活性研究[J].中药药理与临床,2009,25(2):68-70.
[12] 李翠玲,张玲,顾洪涛,等.淫羊藿苷体内抑瘤作用及其机制[J].中国肿瘤生物治疗杂志,2007,14(2):137-142.
[13] 王婷,张金超,陈瑶,等.6种淫羊藿黄酮抗氧化和抗肿瘤活性的比较[J].中国中药杂志,2007,32(8):715-718.
[14] YANG Z G, SUN H X, YE Y P. Ginsenoside Rd from Panax notoginseng is cytotoxic towards HeLa cancer cells and induces apoptosis[J]. Chem Biodivers,2006,3(2):187-197.
[15] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:8,302,327.
[16] 范辉,顾泉琳,贝伟剑.HPLC法测定乌参醒脑滴丸中人参皂苷Rg1、Re、Rb1和Rd[J].中成药,2012,34(7):1280-1283.
[17] 宋成英,封加福.HPLC同时测定黄芪药材中毛蕊异黄酮葡萄糖苷和黄芪甲苷[J].中国实验方剂学杂志,2013,19(11):115-117.
Optimization of Ethanol Extraction Technology ofDecoction by Multi-index Orthogonal Test
WANG Yan-hong1, ZHAO Juan-ping1, SHANG Dong-xue1, ZHAO Xue1, TIAN Miao2, HAN Feng-juan2
Objective To optimize the ethanol extraction technology ofDecoction. Methods An L9(34) orthogonal test was used in the study. The extraction rates of calycosin glycoside, icariin, baohuoside Ⅰ, ginsenoside Rg1, ginsenoside Re, ginsenoside Rb1, astragaloside, and ginsenoside Rd were set as indexes. The influence of ethanol concentration, extraction time, extraction temperature, and amount of ethanol on the yield ofDecoction were detected by comprehensive scoring method. Results The optimal ethanol extraction technology forDecoction was soaking for 2 h with ten times of 60% ethanol and then reflux extracting for two times; extraction time was 1.5 h each time at 80 ℃. Conclusion The optimal extraction technology is efficient, stable and feasible, which can provides data for the further study ofDecoction.
Decoction; orthogonal test; multi-index; ethanol extraction technology
10.3969/j.issn.1005-5304.2017.07.018
R283.5
A
1005-5304(2017)07-0076-05
国家自然科学基金(81273788、81473717)
韩凤娟,E-mail:hanfengjuan2004@163.com
(2016-09-08)
(2016-09-21;编辑:陈静)
