芝麻枯萎病菌毒素主成分结构与特性分析
2017-06-30李海玲苗红梅张海洋魏其超
李海玲++苗红梅++张海洋++魏其超++段迎辉+汪学德

摘要:芝麻枯萎病是芝麻主要病害之一,由尖孢镰刀菌芝麻专化型侵染引起。为探明芝麻枯萎病菌产毒类型,试验采用高效乙酸乙酯萃取法,对尖孢镰刀菌株HSFO07021菌液进行了粗毒素提取;采用中压制备色谱仪,首次成功分离了尖孢镰刀菌芝麻专化型3种主要毒素。结构鉴定显示,尖孢镰刀菌芝麻专化型的3种毒素分别为镰刀菌酸、9,10-脱氢镰刀菌酸和10-羟基镰刀菌酸。种子处理结果表明,尖孢镰刀菌芝麻专化型产生的镰刀菌酸和9,10-脱氢镰刀菌酸均能抑制芝麻幼苗的茎叶生长和根部伸长,对幼苗产生毒害;镰刀菌酸的毒性强于9,10-脱氢镰刀菌酸。
关键词:芝麻;尖孢镰刀菌芝麻专化型;镰刀菌酸;9,10-脱氢镰刀菌酸;分离
中图分类号: S435.653文献标志码: A文章编号:1002-1302(2017)08-0082-05
芝麻为胡麻科胡麻属植物,是世界上最古老的特色油料作物之一,也是我国重要的优势农产品[1]。芝麻籽粒富含不饱和脂肪酸和维生素E[2-4],并富含木酚素等多种生物活性物质,对人体健康非常有益。但是在实际生产中,芝麻易受病害、渍涝等因素侵袭,产量与品质均受影响。芝麻枯萎病是由尖孢镰刀菌芝麻专化型(Fusarium oxysporum f. sp. sesami,FOS)侵染引起的1种真菌病害[5-6]。研究表明,尖孢镰刀菌在生长代谢过程中能够产生毒素(例如镰刀菌酸),对寄主植物有强烈的毒害作用[7-8]。在香蕉枯萎病菌株培养液中,发现有镰刀菌酸(FA)等多种毒素成分存在[8],镰刀菌酸可导致香蕉表现枯萎症状,而其他毒素成分则在致枯萎过程中起了增效作用,加速了植株枯萎。Wu等研究表明,尖孢镰刀菌侵染时所产生的镰刀菌酸能够引起西瓜的氮素代谢紊乱;此外研究也显示,枯萎病菌毒素是较为普遍存在的一类毒素,成分复杂,对农作物生产和食品安全有重要影响[9]。Smith等从猪饲料、干玉米、高水分谷物、小麦、大麦中均不同程度地检测出了镰刀菌酸的存在[10]。近期研究表明,芝麻枯萎病菌亦能产生镰刀菌毒素(统称为FOS毒素),主要成分应包括镰刀菌酸(FA)以及FA-H2、FA+O和FA+O2等3种镰刀菌酸类似物[11]。但是受毒素提取纯化技术的限制,目前尚未获得各毒素纯品;芝麻枯萎病菌各主要毒素的特性如何尚不得而知。以往研究结果显示,为获得镰刀菌毒素,人们多采用活性炭吸附法[12]、乙酸乙酯萃取法[13]从尖孢镰刀菌滤液中提取。Bani等使用乙酸乙酯萃取法,提取了尖孢镰刀菌粗毒素;随后采用硅胶板+乙酸乙酯-甲醇-水(体积比为8.5 ∶2 ∶1)流动相的分离条件,成功分离到了尖孢镰刀菌酸[14]。为此,本研究主要探讨芝麻枯萎病菌毒素主成分的制备和特性,首次获得了FOS毒素3个主成分的纯品,明确了毒素主成分对芝麻幼苗生长的毒害特点,为下一步开展芝麻枯萎病菌致病机理和防控技术研究奠定了技术和材料基础。
1材料与方法
1.1病原菌株及保存
选取尖孢镰刀菌芝麻专化型菌株(编号:HSFO07021)开展毒素提取研究。菌株由河南省农业科学院芝麻研究中心病理室保存。
1.2仪器与试剂
毒素提取及分离用仪器设备主要包括:Waters 2695液相色谱仪(Waters公司,美国)、Waters LC150半制备液相色谱(Waters公司,美國)、液质联用质谱仪(UPLC-QTOF,xEVO G2,美国)、NICOLET 6700傅利叶红外光谱仪(赛默飞世尔公司,美国)、500 MHz Bluke核磁共振仪(布鲁克公司,德国)、离心机、分液漏斗、冻干机、真空旋转蒸发仪、布氏漏斗、真空抽滤机等。盐酸、乙酸乙酯等试剂均为分析纯(国产)。乙腈(TEDIA,America)、乙酸(国产)均为高效液相色谱纯度级别,水为纯净水级别。
1.3菌株培养
挑取HSFO07021菌株少量菌丝(-70 ℃保藏),接种在PDA平板培养基上,于28 ℃培养4 d。用无菌打孔器沿菌落边缘打出直径为8 mm菌片3~5个,接入装有250 mL PD培养液的500 mL三角瓶内,28 ℃、120 r/min振荡培养4 d。用灭菌纱布滤除菌丝,收集孢子液,用无菌水将所得孢子液浓度调至107个/mL孢子,作为接菌母液。取1 mL接菌母液,加入100 mL理查德培养液中,28 ℃、120 r/min振荡培养,用于毒素提取试验。5 d取样1次,用于检测培养液FA含量,共计45 d。
PDA培养基:马铃薯200 g(煮熟过滤),葡萄糖20 g,琼脂15 g,水1 000 mL。PD培养液:马铃薯150 g(煮熟过滤),葡萄糖20 g,水1 000 mL。理查德培养液:KNO3 10 g,KH2PO4 5 g,MgSO4·7H2O 2.5 g,FeCl3 0.02 g,蔗糖50 g,蒸馏水 1 000 mL。
1.4FOS滤液的HPLC检测
取少量的HSFO07021菌株理查德培养液,2层镜头纸过滤,以滤除菌丝;经0.22 μm水系滤膜过滤后进行液相色谱分析。色谱柱选用sunfireC18反相柱(250 mm×4.6 mm,5 μm);流动相A和B分别为乙腈、0.1%乙酸水溶液。梯度洗脱程序设置:0~12 min,A ∶B=5 ∶95;12~13 min,A相变化范围为5%~27%,B相变化范围为95%~73%;13~16 min,A ∶B=27 ∶73;16~17 min,A相变化范围为27%~10%,B相变化范围为73%~90%;17~22 min,A ∶B=10 ∶90;22~23 min,A相变化范围为10%~5%,B相变化范围为90%~95%;23~25 min,A ∶B=5 ∶95。流速为 1 mL/min,检测波长为270 nm,进样量为10 μL。
1.5FOS粗毒素提取
培养45 d后,取一定量的HSFO07021理查德培养液,用2层纱布过滤,以滤除菌丝;4 000 r/min条件下离心15 min,合并上清液,用于粗毒素提取。用2 mol/L盐酸溶液调制上清液pH值至最佳条件。选用乙酸乙酯(A)与上清液(B)不同配比溶液进行粗毒素提取;分别合并上层有机相和水相。真空旋转蒸发上层有机相,以去除乙酸乙酯,获得FOS粗毒素。对水相进行检测,放于-20 ℃保存备用。
1.6FOS毒素主成分的分离与纯化
采用Waters LC150半制备液相色谱仪对FOS滤液进行分离和纯化。洗脱程序参照1.4 FOS滤液的HPLC检测方法进行。流速为10 mL/min;检测波长为270 nm;进样量为 500 μL,特定时间分别对提取物进行收集。将收集到的不同物质溶液分别合并,30 ℃真空旋转蒸发,去除部分溶剂后真空冻干。将获得的物质分别做液质、红外和核磁共振氢谱分析,确定物质结构。
1.7FOS毒素主要成分对芝麻毒性分析
挑选豫芝11号芝麻种子各500粒,用清水冲洗种子表面5 min。3%次氯酸钠浸泡种子10 min后,用无菌水冲洗种子3~4次;将消毒后的种子放入装有10 mL无菌水的三角瓶中振荡培养24 h。挑选露白的芝麻种子,分别接种在加有 5 μg/mL FA或9,10-脱氢FA的MS固体培养基上,25 ℃、光—暗周期14 h—10 h下培养。每个处理设置3个重复,每个重复接种6粒种子,2周后调查芝麻幼苗及根生长情况,拍照记录。
2结果与分析
2.1尖孢镰刀菌芝麻专化型培养液毒素成分检测
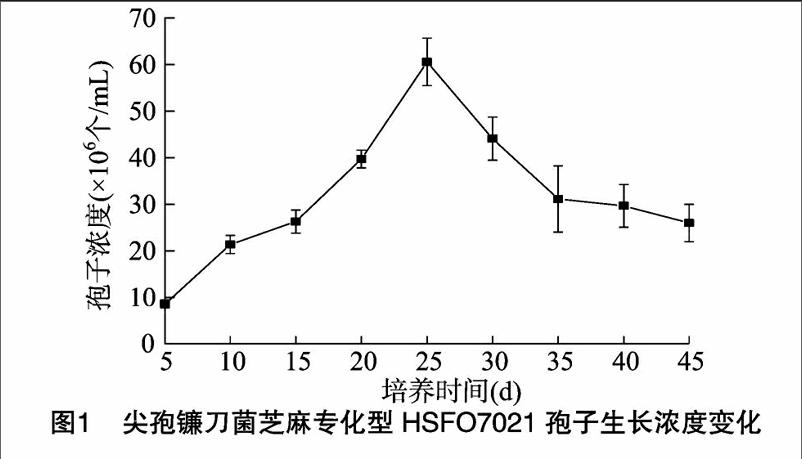
选取尖孢镰刀菌芝麻专化型HSFO07021菌株,理查德培养液培养45 d,期间进行孢子浓度检测(图1),并对菌液滤液进行液相色谱分析(图2)。结果显示,在5~45 d培养过程中,理查德培养液中HSFO07021菌株的孢子数量在8×106~60×106个/mL范围,孢子生长量有一定的增长;在25 d时,孢子浓度达到最大值。液相色谱分析表明,在保留时间分别是8.461、18.255、19.770 min时, 菌液中存在3种特异物质,
分别命名为物质Ⅰ、Ⅱ和Ⅲ。物质保留时间与朱强宾等报道的物质Ⅱ、Ⅲ和Ⅳ[11]较为一致。
2.2尖孢镰刀菌芝麻专化型毒素制备与鉴定
根据上述3种物质的液相色谱峰位置,最终确定尖孢镰刀菌芝麻专化型毒素物质Ⅰ的收集时间为5.328~5.980 min(图3-a);物质Ⅱ的收集时间是17.520~17.978 min,物质Ⅲ的收集时间为18.321~18.860 min(图3-b)。
将收集到的上述3种物质溶液分别合并,30 ℃真空旋转蒸发去除部分溶剂后,真空冻干,获得物质Ⅰ、Ⅱ和Ⅲ纯品。其中物质Ⅰ为棕黄色黏稠状液体,物质Ⅱ为微黄色粉末,物质Ⅲ为白色粉末。以FA标准品为对照,将获得的3种物质进行结构分析。
2.3毒素主要成分结构分析
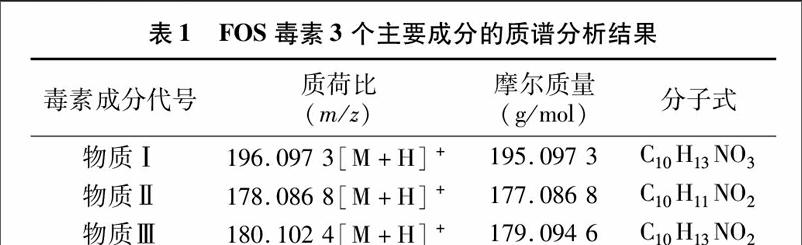
采用质谱仪对获得的粗毒素和各纯化分离毒素成分进行分析(表1)。结果显示,物质Ⅰ的质核比值为196.097 3[M+H]+,218.079 0[M+Na]+;物质Ⅱ的质核比值为 178.086 8[M+H]+;物质Ⅲ的质核比值为180.102 4[M+H]+。3种物质的摩尔质量分别是195.097 3、177.086 8、179.094 6 g/mol,分子式分别为C10H13NO3、C10H11NO2和 C10H13NO2。
因物质Ⅰ获取量过少、纯度较低,我们随后对物质Ⅱ、Ⅲ开展了傅立叶红外光谱仪分析。对比结果显示,FA标品(图4-a)在2 957.44、2 858.88、1 463.92 cm-1处有吸收峰,结构中存在甲基;物质Ⅱ(图4-b)在3 079.22~3 004.55、1 639.28、1 535.71、1 309.45 cm-1处有特异的吸收峰,表明分子结构中存在端基烯烃键。比较发现物质Ⅲ(图4-c)的峰位与FA完全一致,因此可以判定物质Ⅲ与镰刀菌酸标准品完全相同。
为确定上述3种物质的结构,进一步进行了核磁共振氢谱信息分析(图5)。
与镰刀菌酸标准品的核磁共振氢谱数据比对,确定物质Ⅰ结构为10-羟基镰刀菌酸(10-OH-FA)。该物质常温下为黏液状,可能与溶剂残留较多有关。物质Ⅱ结构为9,10-脱氢FA,纯度约98%。物质Ⅲ核磁共振氢谱数据与标准品FA数据完全相同,再次确定该物质为镰刀菌酸FA,纯度>98%。
根据上述结果,最终确定上述3种毒素主成分分别为镰刀菌酸(FA)、9,10-脱氢镰刀菌酸(9,10-脱氢FA)和10-羟基镰刀菌酸(10-OH-FA)。结构见图6。
2.4FOS毒素主要成分的毒性分析
为判定FOS毒素主要成分对芝麻的毒害作用,采用HSFO7021菌液制备的FA和9,10-脱氢FA纯品进行了芝麻幼苗处理。由图7可知,对照中芝麻幼苗处于1对真叶期,根生长正常(图7-a、图7-d)。与对照相比,在5 μg/mL FA
和5 μg/mL 9,10-脱氢FA处理2周后,FA处理组植株真叶尚未展开,生长迟缓(图7-b、图7-c);9,10-脱氢FA处理组根伸长缓慢(图7-e)或尚未长出(图7-f)。结果表明,FA和9,10-脱氢FA毒素对芝麻有毒害作用;相对于FA,9,10-脱氢FA毒素处理对芝麻茎叶生长和根伸长的抑制程度弱。
3结论与讨论
为评价尖孢镰刀菌芝麻专化型产生毒素的种类和水平,本研究利用建立的高效乙酸乙酯萃取方法和分离方法,首次从HSFO7021菌液中制备出了镰刀菌酸、9,10-脱氢镰刀菌酸和10-羟基镰刀菌酸等3种FOS毒素,研究结果为后续的芝麻枯萎病菌致病机理及芝麻抗病机理研究奠定了技术和材料基础。在镰刀菌毒素提取方面,目前主要选用活性炭吸附法[12,15]、活性炭吸附萃取法[16]和乙酸乙酯萃取法[13]进行。Lffler等发现引起百合茎腐病的尖孢镰刀菌可以产生镰刀菌酸,并采用反相HPLC法和GC-MS法成功测定了粗毒素中镰刀菌酸的含量[17]。Amalfitano等建立了镰刀菌酸和脱氢镰刀菌酸(FA-2H)及其甲酯化物的液相快速检测方法[18]。在毒素分离方面,通用的方法為TLC(thin layer chromatography)法和柱色谱法[14]。但是由于该方法操作繁琐,且物质获取量小、成功率低,毒素分离应用受到限制。本研究借助于半制备液相色谱仪,结合液相检测方法,最终确定用5%乙腈水溶液溶解粗毒素,以改进液相分离方法,从而成功建立了FOS毒素制备及分离方法。与原洗脱程序相比,新方法在毒素分离方面节省了时间,且样品分离效率得到显著提高(数据未公开)。
鐮刀菌酸是一种非特异性真菌毒素,可以由许多镰刀菌属种类产生,可加速植物的枯萎。除镰刀菌酸外,亦有学者从镰刀菌的培养液中,发现了其他镰刀菌酸类似物。Cappaso等首次从Fusarium nygamai菌株滤液中发现并分离出了FA和9,10-脱氢FA甲酯化物。处理后发现,FA甲酯化物可导致番茄叶片变黄并迅速坏死,并能严重抑制根的生长[19]。近期朱强宾等研究结果显示,采用液体培养基培养弱致病力菌株HSFO07021和强致病力菌株HSFO09100,不同菌株形成峰的数量有显著差异[11]。检测发现HSFO07021菌液有4种峰物质存在。本研究从HSFO07021菌株的理查德培养液滤液中检测到了10-羟基镰刀菌酸(物质Ⅰ)、9,10-脱氢镰刀菌酸(物质Ⅱ)和镰刀菌酸(物质Ⅲ)等3种主成分(图2),纯品收集时间分别为5.328~5.980 min、17.520~17.978 min和 18.321~18.860 min(图2)。结构检测进一步表明,以上3种物质分别对应了朱强宾等预测的物质Ⅱ、Ⅲ和Ⅳ[11]。研究首
次确定,尖孢镰刀菌芝麻专化型菌株产生的镰刀菌酸和脱氢镰刀菌酸2种毒素均对芝麻幼苗生长发育有抑制作用,且毒害水平有一定差异(图7)。Bani等通过叶片穿刺试验,证实了FA和9,10-脱氢FA对豌豆叶均表现出了高毒害活性[14]。Stipanovic开展了镰刀菌酸、吡啶甲酸及其类似物对棉花子叶的生物测定试验,研究发现镰刀菌酸甲酯化物的毒性最高[20]。为明确芝麻枯萎病菌致病机理,下一步我们将深入开展FA及其类似物的毒害机理研究,以最终实现对芝麻枯萎病害的高效防控。
参考文献:
[1]Zhang H Y,Miao H M,Wang L,et al. Genome sequencing of the important oilseed crop Sesamum indicum L.[J]. Genome Biology,2013,14(1):401.
[2]Ashri A. Sesame breeding:plant breeding reviews[M]. Oxford:Oxford Press,1998:79-228.
[3]Li C,Miao H M,Wei L B,et al. Association mapping of seed oil and protein content in Sesamum indicum L. using SSR markers[J]. PLoS One,2014,9(8):e105757.
[4]李桂华,王瑞雪,王婷婷. 河南省黑芝麻及其油脂组成成分分析研究[J]. 河南工业大学学报(自然科学版),2008,29(5):10-13.
[5]仇存璞,张海洋,常淑娴,等. 芝麻枯萎病病原菌致病力室内鉴定方法[J]. 植物病理学报,2014,44(1):26-35.
[6]苏银玲,苗红梅,魏利斌,等. 芝麻枯萎病病原菌分离和纯化方法研究[J]. 河南农业科学,2012,41(1):92-94.
[7]袁红旭,商鸿生. 棉花枯萎病菌接种及粗毒素处理后棉苗维管束病理特征[J]. 植物病理学报,2002,32(1):16-20.
[8]于莉,黎永坚,李赤,等. 香蕉枯萎病菌毒素的成分分析及其生物测定[C]//中国植物病理学会2008年学术年会论文集. 北京:中国农业科学技术出版社,2008:228-234.
[9]Wu H S,Yin X M,Zhu Y Y,et al. Nitrogen metabolism disorder in watermelon leaf caused by fusaric acid[J]. Physiological and Molecular Plant Pathology,2007,71(1/2/3):69-77.
[10]Smith T K,Sousadias M G. Fusaric acid content of swine feedstuffs[J]. Journal of Agricultural and Food Chemistry,1993,41(12):2296-2298.
[11]朱强宾,张海洋,段迎辉,等. 芝麻枯萎病菌毒素成分分析及其对芝麻幼苗的毒性[J]. 植物保护,2016,42(4):27-33,42.
[12]台莲梅,许艳丽,高凤昌. 尖孢镰刀菌毒素的初步研究[J]. 黑龙江八一农垦大学学报,2004,16(4):9-12.
[13]王纯利,王冬梅,黄炜,等. 西瓜枯萎病菌致病力与镰刀菌酸和β-1,4糖苷酶活性的关系研究[J]. 新疆农业大学学报,2000,23(1):1-6.
[14]Bani M,Rispail N,Evidente A,et al. Identification of the main toxins isolated from Fusarium oxysporum f. sp. pisi race 2 and their relation with isolatespathogenicity[J]. Journal of Agricultural and Food Chemistry,2014,62(12):2574-2580.
[15]徐敬友,张华东,张红,等. 立枯丝核菌菌毒素的产生及致病力的关系[J]. 扬州大学学报,2004,25(2):61-64.
[16]Vidhyasekaran P,Ponmalar T R,Samiyappan R,et al. Host-specific toxin production by Rhizoctonia solani,the rice sheath blight pathogen[J]. Phytopathology,1997,87(12):1258-1263.
[17]Lffler H,Mouris J R. Fusaric acid:phytotoxicity and in vitro production by Fusarium oxysporum f.sp. lilii,the causal agent of basal rot in lilies[J]. Netherlands Journal of Plant Pathology,1992,98(2):107-115.
[18]Amalfitano C,Pengue R,Andolfi A,et al. HPLC analysis of fusaric acid,9,10-dehydrofusaric acid and their methyl esters,toxic metabolites from weed pathogenic Fusarium species[J]. Phytochemical Analysis,2003,13(5):277-282.
[19]Capasso R,Evidente A,Cutignano A,et al. Fusaric and 9,10-dehydrofusaric acids and their methyl esters from Fusarium nygamai[J]. Phytochemistry,1996,41(4):1035-1039.
[20]Stipanovic R D,Puckhaber L S,Liu J,et al. Phytotoxicity of fusaric acid and analogs to cotton[J]. Toxicon,2011,57(1):176-178.
