1株蓝变真菌的拮抗菌株的筛选
2017-06-29宋瑞清
曹 翠,宋瑞清
(1.渭南师范学院 丝绸之路艺术学院,陕西 渭南 714099;2.东北林业大学 林学院,哈尔滨150040)
【现代应用技术研究】
1株蓝变真菌的拮抗菌株的筛选
曹 翠1,宋瑞清2
(1.渭南师范学院 丝绸之路艺术学院,陕西 渭南 714099;2.东北林业大学 林学院,哈尔滨150040)
采用平板对峙法和相对抑菌效果来判别真菌拮抗能力的大小,筛选出对蓝变菌株抑制效果显著的菌株,试验结果表明:所选的10种拮抗菌(6种慢速生长菌和4种快速生长菌)对蓝变真菌(Ophiostomapenicillatum)都有不同程度的抑菌作用,拮抗效果最佳的菌株有Fusariumtricinctum、Gibberellamoniliformis和Hypocrealixii,相对抑制率分别为34.7、6.77和0.36(60 h),所筛选出的拮抗菌株都具有潜在的生物防治开发前景。
蓝变真菌;拮抗作用;筛选
根据生态学理论,森林病虫害流行是生物间一种不平衡的现象。[1]林木病害生物防治的原理就是建立一种新的能抑制病害流行的生物间动态平衡关系,通过生物间相互制约达到防治植物病害的目的。拮抗作用的研究是拮抗菌筛选和生防技术开发的基础。本试验以6个慢速生长真菌和4个快速生长真菌作为拮抗菌,以1个蓝变真菌作为拮抗对象,采用平板对峙培养法筛选对蓝变真菌拮抗效果显著的拮抗菌,为病害的生物防治提供功能性菌株。
1 试验材料与方法
1.1 试验材料
蓝变菌株和拮抗菌株均由东北林业大学林学院实验室提供,其中:蓝变菌株:C3-Ophiostomapenicillatum;拮抗菌株:共10个(见表1)。
1.2 试验方法
实验采用平板对峙培养法。平板对峙培养能较好地反映同一生境内不同真菌间的相互关系。[2]不同菌种的生长速度不同,当生长缓慢的菌株和迅速生长的菌株同时置于一个培养皿内对峙培养,生长快的菌株往往会完全抑制生长慢的菌株的生长,因此Shaw TM[3]建议生长缓慢的菌株先于生长快速的菌株接入培养皿,使二者能在培养皿中心直径处相遇,从而为生长缓慢的菌株提供足够的时间在培养基上定殖。
在直径90 mm 的PDA 平板培养基上,相距45 mm分别接入半径0.5 cm 的培养6 d、近乎同质等量的拮抗菌与病原菌菌落,对照则将病原菌菌株单独培养。将10个拮抗菌株按照培养基上生长速度快慢分为两类,4个快速生长菌株和6个慢速生长菌株(见表1)。与快速生长菌株对峙培养前先接种蓝变菌株,3 d后再接入快速生长菌株;慢速生长菌株和蓝变菌株同时接种。每处理设3个重复,置于25℃生化培养箱中培养,每12 h测量菌落的相对生长半径(共4个半径)。当两菌落相接触相交后,观察并记录拮抗菌株对C3的抑制、包围以及C3对拮抗菌株包围、侵占的反作用。拮抗结果计算时,采用两菌落相向半径进行拮抗生长测定。
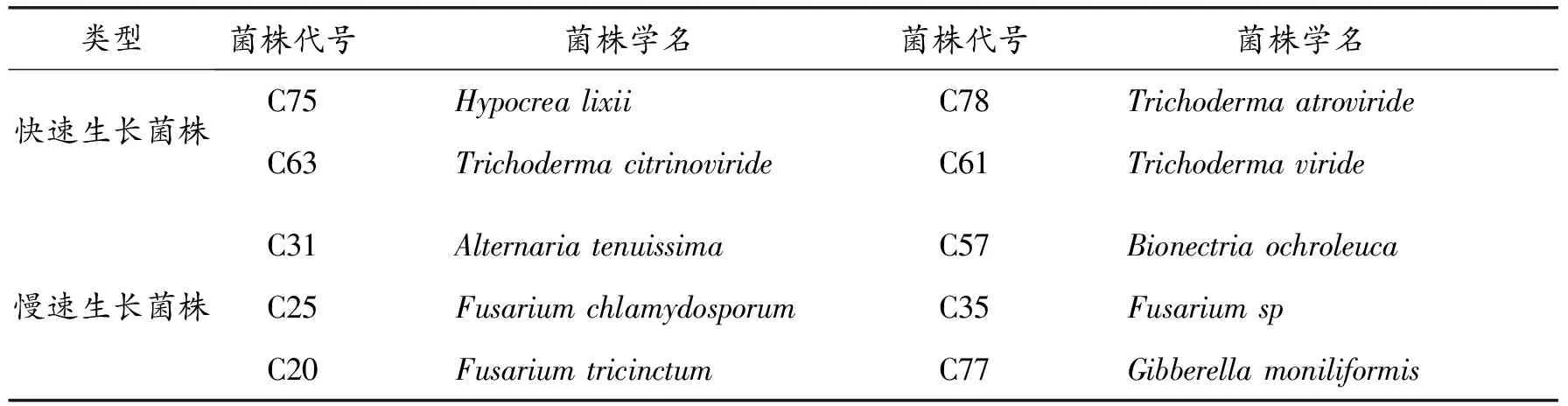
表1 拮抗菌株信息表
被抑制率是拮抗菌和病原菌各自被对方的抑制率,相对抑制效果是拮抗菌在抑制病原菌时本身也被抑制损耗,自身被抑制一个单位即l%时所产生的抑菌效果。[4]由于同一生境下真菌群落内各个成员之间的作用必然是相互的,相对抑制效果更能体现拮抗菌的真实作用。被抑制率与相对抑菌效果的计算如下[5]:
被抑制率=(单独培养菌落半径 - 菌落趋向半径)/ 单独培养菌落半径×100 %,
相对抑菌效果=病原菌被抑制率/拮抗菌被抑制率。
2 结果与分析
6种慢速生长菌与C3对峙培养的结果分析如下(见表2和图1至图6):
(1)在C20与C3的对峙培养中,24~48 h,两菌株相互之间均有促生作用(被抑制率为负值);72 h后相互之间才产生抑制作用,随时间的增加,各自的被抑制率逐渐增大,144 h达到最大。相对抑制效果在96 h最高,为34.7。
(2)在C25与C3的对峙培养中,72 h之前C25对C3的生长有显著的促进作用,96 h后才产生抑制作用,144 h抑制作用达到最大,被抑制率均随时间的增加而增大,C25对C3的拮抗作用随时间的增加而增高;而在整个对峙培养过程中,C3对C25的生长一直处于抑制状态,随时间的延长,作用一直在增大,144 h达到最大。其相对抑制效果在96 h后超过1,144 h最高,为1.40。
(3)在C31与C3的对峙培养中,48 h之前C31一直促进C3 生长,72 h后才有抑制作用,C3被抑制率随时间的增加而增大,144 h达到最大。C3对C31的生长一直处于抑制状态,144 h达到最高。相对抑制效果在120 h达到最高,为2.48。
(4)在C35与C3的对峙培养中,48 h之前双方生长处于相互促进中,72 h后双方生长处于相互抑制状态,各自的被抑制率均在144 h达最高,而相对抑制效果在96 h最大,为1.91。
(5)在C57与C3的对峙培养中,72 h之前C3的生长一直处于被 C57促进状态,96 h处于被抑制状态;120 h之前C57的生长基本处于不显著的被促进状态,之后才逐渐被抑制。C57对C3的相对抑制效果144 h达到最高,接近4。
(6)在C77与C3的对峙培养中,C3 被抑制率随时间的增加而增大,144 h达最高;72 h之前C77生长处于被促进状态,96 h后生长被抑制。C77对C3的相对抑制效果144 h达到最高,为6.77。
在6种慢速生长菌与C3的对峙培养过程中,拮抗菌与C3整体上基本均有相互抑制作用,抑制率的大小差异很大,病原菌的被抑制率在-31.65%~65.88%之间,拮抗菌的被抑制率在18.37%~71.96%之间。从表2中可以看出,随着时间的推移,C3的被抑制情况整体呈上升趋势,其中对C3 抑制效果相对明显的有C20、C77,其相对抑制效果分别为34.7、6.77,且都是在144 h达到最高值。在初期接入,有的拮抗菌和C3均有相互促进生长的趋势,所以被抑制率呈现负值;随着时间的推移,大部分在72 h后开始相互抑制(C25、C57是在96 h开始相互抑制)。
在快速生长菌C63、C61、C78和C75与C3的对峙培养中(见表3和图7至图10),可能由于C3先接入培养基培养,表现出强烈的营养和空间优势,使快速生长菌的被抑制率大于C3。4个快速生长菌株与菌株C3之间均产生明显的抑菌带并呈包围状态,说明在短时间内产生了抗生素。在整个对峙培养过程中,相对抑制效果均小于1,均在60 h达最高,分别为0.29、0.29、0.35和0.36。
图1 C3与C20对峙
图2 C3与C25对峙
图3 C3与C31对峙
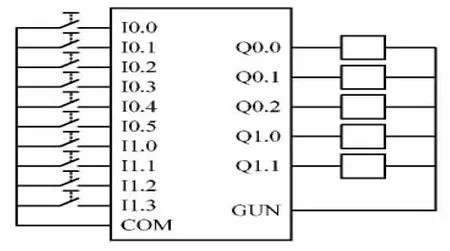
图4 C3与C35对峙
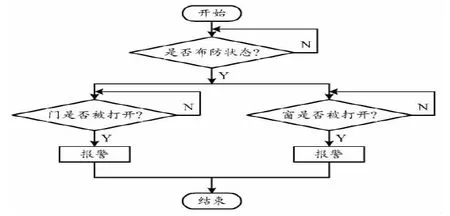
图5 C3与C57对峙
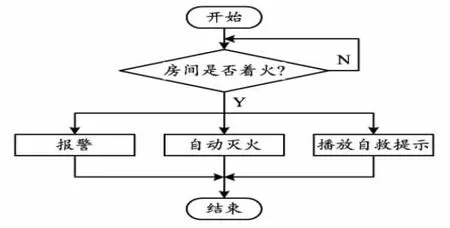
图6 C3与C77对峙
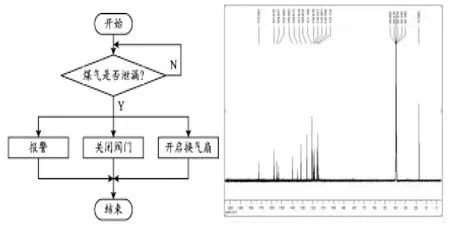
图7 C3与C63对峙
图8 C3与C61对峙
图9 C3与C78对峙
图10 C3与C75对峙
C63、C61、C78分别在36 h与C3菌落接触,接触后即呈现对峙之势,两菌落停止生长,且出现明显的抑菌带;C75在36 h与C3接触之后,C75菌落继续生长侵入C3的菌落而使C3菌落减小,也出现明显的抑菌带。相对慢速生长菌而言,快速生长菌在短时间内(36 h)对C3产生强烈的抑制作用,且相对抑制效果分别为0.29、0.29、0.35和0.36。综上,表明C75对C3有显著的抑制效果,其他3个菌株有较好的抑制作用。因此,对C3相对抑制效果相对好的菌株为C20(34.70)、C77(6.77)和快速生长菌C75(60 h达0.36)。
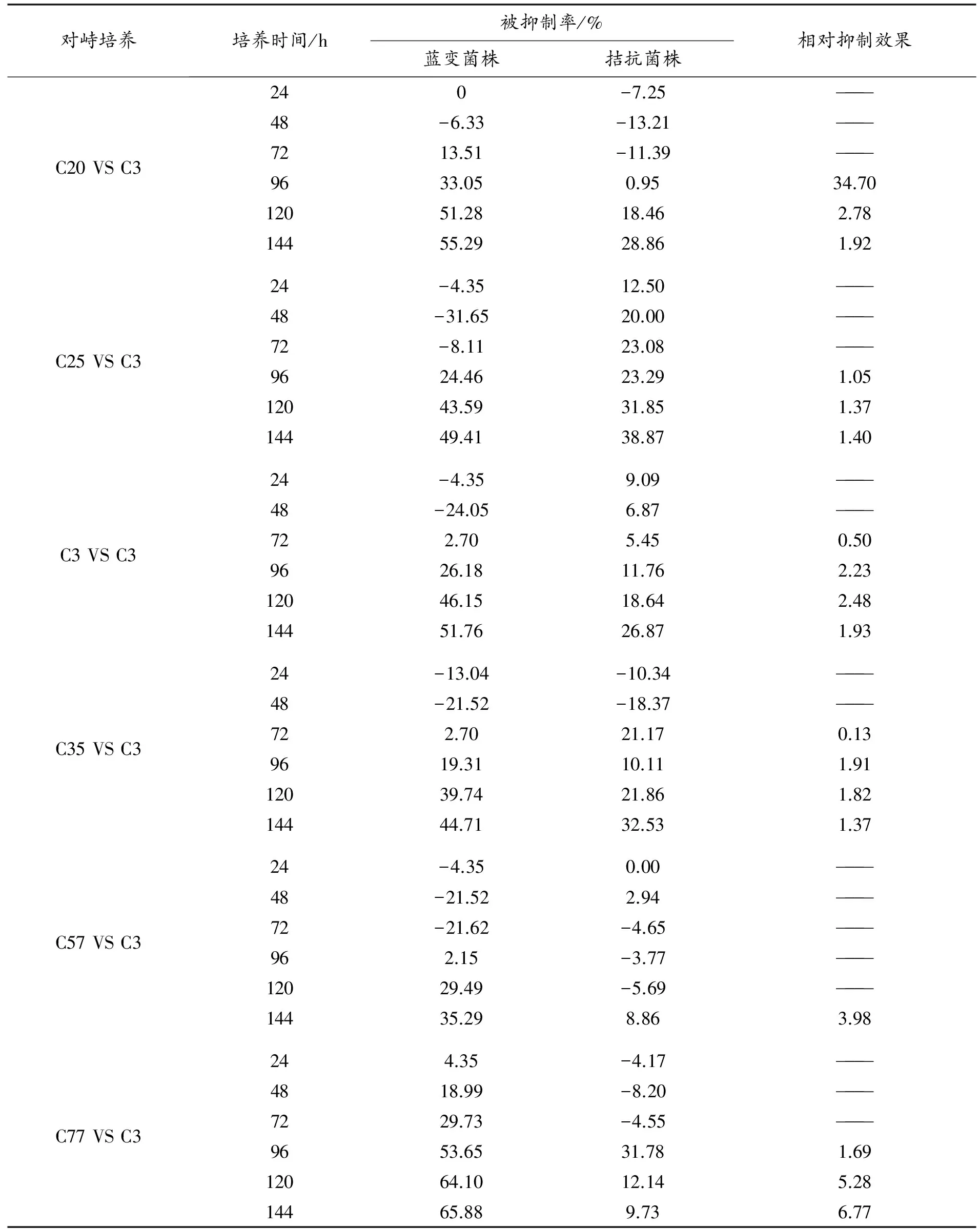
表2 慢速生长菌株与菌株C3对峙培养结果
3 结语
通过离体的平板对峙培养法,利用被抑制率和相对抑制率两个指标共同衡量10个拮抗菌株对蓝变菌株的拮抗效果,结果表明:筛选出对C3抑制效果最佳的菌株为C20、C77和快速生长菌C75,尤其C77对C3的抑制更强,在96 h时C3生长很慢,几乎不再生长。由于蓝变菌株先接入培养基培养,表现出强烈的营养和空间优势,而使快速生长菌的被抑制率显著大于蓝变菌株的,相应的相对抑制效果也较小,但是在短时间内快速生长菌菌丝迅速生长与C3的菌落有菌丝交叉和包围现象,且产生明显的抑菌带,从而对蓝变菌株产生较强的抑制作用,说明在短时间内产生了抗生素;慢速生长菌与C3同时接入培养基培养,生长速度差别不大,故慢速生长菌与C3的拮抗效果表现为拮抗菌菌落与C3菌落形成明显的抑制带;由于接入时间不同而使快、慢生长菌的相对抑制效果不同。结合其相对抑制效果的大小筛选出的最佳抑制菌株均具备作为生物防治资源的潜力。
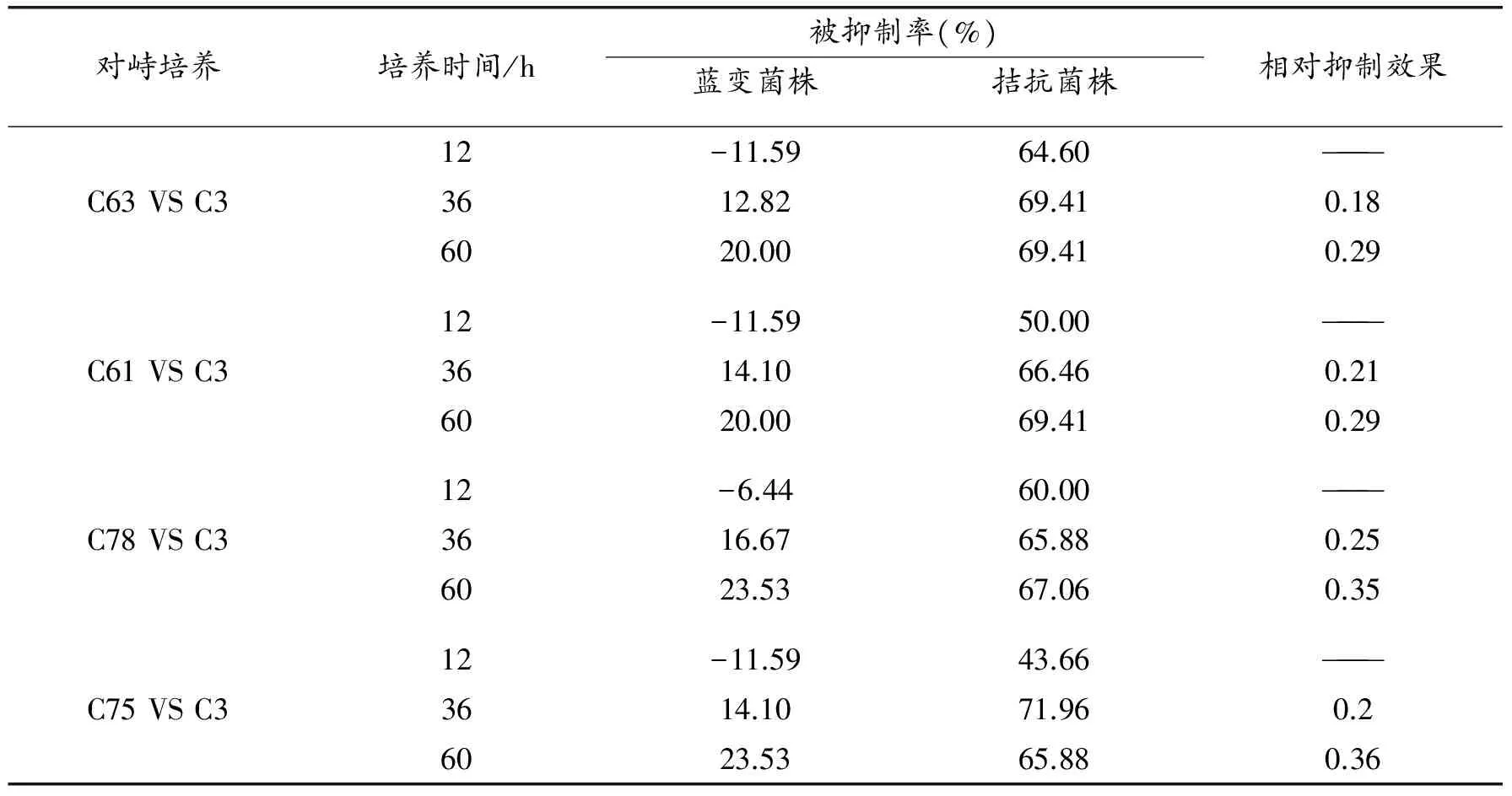
表3 快速生长菌株与菌株C3对峙培养结果
[1] 胡容平.四川几种重要药用植物病害调查与川芎根腐病(Fusarium solani)防治初探[D].雅安:四川农业大学硕士学位论文,2008.
[2] Murphy E A,Mitchell D.Interactions between Tricholomopsis rutilans and ectomycorrhizal fungi in Paired culture and in association with seedlings of lodgepole pine and Sitka-spruce[J].Forest Pathology,2001,31:331-344.
[3] Shaw T M,Dighton J,Sanders F E.Interactions between ectomycorrhizal and saprotrophic fungi on agar and in association with seedlings of lodgepole pine(Pinus contorta)[J].Mycological Research,1995,99:159-165.
[4] 黄永青.红松树栖真菌群落分析[D].哈尔滨:东北林业大学博士学位论文,1993.
[5] 宋瑞清,周秀华.Trichodermo spp.对樟子松枯梢病病原菌的影响[J].东北林业大学学报,2004,32(4):29-30.
【责任编辑 马小侠】
Screen to Antagonistic Strains of 1 Sapstain Fungi
CAO Cui1,SONG Rui-qing2
(1.Art School of Silk Road,Weinan Normal University,Weinan 714099,China; 2.School of Forestry,Northeast Forestry University,Harbin 150040,China)
We adopt the methods of tablet standoff and relative bacteriostatic effect to distinguish the ability of antagonisting,and Fungi with obvious and significant effects on Sapstain Fungi were screened.The results demonstrate that 10 antagonistic fungi have different control degree on Ophiostoma penicillatum,and that Strains Fusarium tricinctum,Gibberella moniliformis and Hypocrea lixii have significant inhibition effects on strain C3 growth-the relative antagonistic effects are 34.7,6.77 and 0.36 (60 hours after antagonistic culture),respectively.Strains which are screened out have a potential prospect of biological preservation.
Sapstain Fungi; antagonism; screening
S476
A
1009-5128(2017)08-0057-05
2016-12-20
陕西省教育厅自然科学研究计划项目:秦东地区湿地景观格局演变特征及动力机制研究(16JK1274);渭南师范学院科研计划项目:陕西黄河湿地生物多样性的研究及可持续开发(15YKP001)
曹翠(1985—),女,山西朔州人,渭南师范学院丝绸之路艺术学院讲师,农学硕士,主要从事园林植物配置、植物病虫害及防治研究。
