麦麸酯酶的分离纯化及酶学性质研究
2017-06-27申光辉黎杉珊张志清
杨 雪,叶 麟,高 玮,申光辉,黎杉珊,张志清
(1.四川农业大学食品学院,四川雅安 625014; 2.攀枝花市食品药品监督管理局,四川攀枝花 617000)
麦麸酯酶的分离纯化及酶学性质研究
杨 雪1,2,叶 麟1,高 玮1,申光辉1,黎杉珊1,张志清1
(1.四川农业大学食品学院,四川雅安 625014; 2.攀枝花市食品药品监督管理局,四川攀枝花 617000)
为了能更好地将麦麸酯酶用于检测食品中的农药残留,采用硫酸铵分段沉淀、透析、SephadexG-200凝胶层析、超滤浓缩等方法对麦麸中提取的酯酶粗液进行了分离和纯化,并对其酶学性质进行了研究。结果表明,得到的麦麸酯酶比活力为289.14 U·mg-1,回收率为47.7%,纯化倍数为16.17。麦麸酯酶的分子量约为26.0 kDa,最大紫外吸收峰为224 nm和280 nm,最适反应温度为30 ℃,稳定范围为25~40 ℃;最适pH为8.0,pH稳定范围为4.0~8.0。Cu2+、Mg2+、Ca2+、Al3+、柠檬酸钠、四硼酸钠均对麦麸酯酶有抑制作用,而Fe2+、Mn2+、柠檬酸、硫酸铝钾对该酶有促进作用;以α-乙酸萘酯为底物的动力学参数Km和Vmax值分别为0.85 mg·mL-1和0.93 mg·mL-1·min-1。4 ℃时,麦麸酯酶半衰期为10.4 d,而25 ℃时,酯酶半衰期为8.6 d。本研究结果对麦麸酯酶的应用具有一定参考价值。
麦麸;酯酶;分离纯化;酶学性质
麦麸是小麦加工的副产品,在加工中其产量约为小麦加工量的五分之一[1]。植物酯酶(plant esterase,PE)是植物不同部位、各个成长时期的细胞组成成分[2],是羧酸酯水解酶类的一种[3]。以植物酯酶作为农残检测的酶标记物[4],与胆碱酯酶相比,具有价格低廉、来源广泛、检测时间短、检测限低、检测灵敏性好等优点[5-6]。杜 英等[7]发现,金属离子Sn2+、Zn2+、Hg2+、Ag+、Cr6+、Cu2+对海参乙酰胆碱酯酶有不同程度的抑制作用。Surinenaite等[8]从假单胞菌3121-1中分离得到一种脂肪酶, Fe2+、Ba2+、Mn2+对该酶有不同程度的抑制作用,Ca2+、Mg2+、K+、Na+对该酶有不同程度的促进作用。目前,国内对于酯酶酶学性质的研究主要集中于乙酰胆碱酯酶和脂肪酶,鲜见植物酯酶酶学性质的研究。本研究拟对麦麸酯酶粗提液进行分离纯化,并研究纯化后酶的酶学特性,以期为该酶的进一步开发利用提供理论依据。
1 材料与方法
1.1 材 料
供试材料:麦麸,雅安市售。
1.2 测定项目与方法
1.2.1 粗酶液的制备
麦麸→粉碎→0.15 mol·L-1、pH 6.5的NaNO3-PBS缓冲液浸提(料液比1∶5,水浴35 ℃,静置60 min)→过滤(四层纱布)→离心(4 ℃,8 000 r·min-1,5 min)→上清液即为粗酶液。
1.2.2 麦麸酯酶的分离与纯化
(1)硫酸铵分段盐析和透析
在0 ℃条件下,根据溶液体积和硫酸铵饱和度常用表计算所需的固体硫酸铵的量,向10 mL的粗酶液中分别缓慢添加固体硫酸铵粉末,使其饱和度分别达到20%、25%、30%、35%、40%、45%,4 ℃静置4 h,6 000 r·min-1离心15 min,取上清液并再次缓慢向其加入(NH4)2SO4,使其饱和度分别达到50%、55%、60%、65%、70%、75%,4 ℃静置4 h,6 000 r·min-1离心15 min,沉淀即为麦麸酯酶粗提物。用10 mL pH 7.3的0.02 mol·L-1PBS缓冲液溶解沉淀,并测定总酶活和蛋白质含量。硫酸铵盐析分级沉淀时采用的硫酸铵饱和度各梯度见表1。将分级盐析后的酶液用超纯水4 ℃冷藏透析。
(2) Sephadex G-200凝胶层析
Sephadex G-200常规处理后自然沉降法装柱,用0.2 mol·L-1NaCl溶液平衡2~5 h,上样体积为2 mL,自动收集器收集样品,洗脱液为0.2 mol·L-1NaCl溶液,流速为0.2 mL·min-1,每管1.8 mL。洗脱结束以后测定样品在280 nm处的吸光度及酶活。
(3) 浓缩干燥
收集酶活性较高的样品进行超滤,将超滤后的酶液置于冻干机内(-50 ℃,24 h)进行冷冻干燥,制成粉末状成品。

表1 硫酸铵分级盐析时硫酸铵饱和度梯度Table 1 Saturation gradient of ammonium sulfate in fractional salting out
1.2.3 麦麸酯酶酶学性质分析
(1)紫外吸收光谱的确定
取冻干酶粉适量,用超纯水配制成1 mg·mL-1的酶液,在200~800 nm波长处进行扫描,绘图查看样品图谱的走势、峰形及出峰位置。
(2)麦麸酯酶的最适温度和热稳定性检测
取冻干酶粉适量,用pH 7.0的 PBS(0.2 mol·L-1)缓冲液配制成1 mg·mL-1的酶液,将酶液在不同温度(25、30、35、40、45、50 ℃)下保温5 min,在室温下测定酶活力。将酶液在25、30、35、40、45、50 ℃分别保温2、4、6、8 h后迅速冷却至室温,测定酶活力。
(3)麦麸酯酶的最适pH值和pH稳定性检测
取冻干酶粉适量,用pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0的PBS(0.2 mol·L-1)缓冲液分别配制成1 mg·mL-1的酶液,在最适温度下保温5 min测定其酶活。将pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0的酶液4 ℃保温24、48、72 h后,在最适温度下测定其酶活。
(4)金属离子及化学试剂对麦麸酯酶的影响
取冻干酶粉适量,加入最适pH值的PBS (0.2 mol·L-1)缓冲液配制成1 mg·mL-1的酶液,在麦麸酯酶最适pH值和温度下,分别加入0.25 mL的2、4、6 mmol·L-1的Mg2+、Cu2+、Fe2+、Ca2+、Mn2+、Al3+、柠檬酸、柠檬酸钠、硫酸铝钾、四硼酸钠0.25 mL,测定酶活力,以未添加金属离子和有机化合物时的麦麸酯酶的酶活力为100%,计算相对酶活力。
(5)麦麸酯酶米氏常数的确定
取冻干酶粉适量,加入最适pH值的PBS (0.2 mol·L-1)缓冲液配制成1 mg·mL-1的酶液,将底物α-乙酸萘酯用无水乙醇配制成不同浓度(0.25、0.75、1.25、1.75、2.25 mg·mL-1),与纯化后的麦麸酯酶反应,分别测定不同底物浓度下的反应速度(用吸光度A599表示)。以浓度的倒数为横坐标,反应速度的倒数为纵坐标作图,按Lineweaver-Burk双倒数作图原理,求出米氏常数Km。
(6)麦麸酯酶半衰期的确定
按上述(5)的方法配制酶液,将酶液分别在4 ℃、25 ℃下保存,每3 d取样一次,每次用样0.25 mL,预热到室温,测定麦麸酯酶酶活。根据以下公式计算半衰期[9]:t1/2=0.693/[(2.303/t)·lg(E0/E)]
式中:t1/2:半衰期;E0:原始酶活;t:终止时的天数;E:t时的酶活。
1.2.4 酶活测定
取上述各步骤中的酶液0.25 mL→与4.25 mL pH 7.2 的PBS缓冲液混匀→加入0.25 mL 8×10-4mol·L-1的 α-乙酸萘酯溶液→40 ℃恒温水浴5 min→加入0.25 mL 4.25% 的SDS水溶液和0.3 mg·mL-10.25 mL固兰B盐→反应30 s→ 加入0.25 mL 50%的HCl溶液→测定。
根据以下公式计算单位酶活:
EAs=(k×OD+b)/(5×V)×N
式中:EAs:酶液的单位酶活,1 U定义为在一定条件下,每分钟催化得到1 μmol α-萘酚所需的酶量;N:酶液的稀释倍数;k:α-萘酚标准曲线的斜率;b:α-萘酚标准曲线的截距;OD:反应液的吸光度;V:反应酶液的体积;5:测定反应时间为5 min。
根据以下公式计算总酶活、比活力、酶活回收率 、纯化倍数:
E1=EAs×V1
式中:E1:酶液总酶活;V1:酶液总体积。
比活力=麦麸酯酶活性/蛋白含量
酶活回收率=处理后的麦麸酯酶酶活/处理前粗提酶液的麦麸酯酶酶活
纯化倍数=处理后的麦麸酯酶比活力/处理前粗提酶液的麦麸酯酶比活力
1.2.5 蛋白质含量的测定
分别取粗酶液、硫酸铵分级沉淀后的酶液、透析后的酶液、凝胶层析后的酶液以及超滤后的酶液各1 mL,加5 mL考马斯亮蓝G-250溶液显色,在595 nm测吸光度。根据牛血清蛋白标准曲线计算出样品中的蛋白含量。
1.2.6 SDS-PAGE酶谱分析及分子量测定
电泳条件:浓缩胶浓度为4.5%,电压90 V,时间30 min;分离胶浓度为12%,电压120 V,时间120 min;电极缓冲液使用pH 8.3的Tris-Gly缓冲液。电泳结束后,凝胶用考马斯亮蓝R-250(0.1%)染色。
1.3 数据处理
试验均3次重复。采用SPSS 20.0软件进行相关显著性分析,采用Quantity One软件进行电泳图谱采集和分子量的计算,其余试验数据采用Excel 2007进行数据分析并作图。
2 结果与分析
2.1 麦麸酯酶的最佳分离纯化条件
2.1.1 硫酸铵分段盐析
由图1可知,随着硫酸铵浓度的增加,麦麸酯酶纯化倍数和回收率的变化趋势基本一致。2号管即第一级沉淀硫酸铵饱和度为25%、第二级沉淀硫酸铵饱和度为55%时的麦麸酯酶纯化倍数和回收率最高。故选择2号管的硫酸铵饱和度进行梯度盐析。

曲线上不同字母表示处理间差异显著(P<0.05)。
Different letters on curve mean significant difference among treatments(P<0.05).The smae in Fig.5.
图1 不同硫酸铵饱和度梯度下麦麸酯酶的纯化倍数及回收率
Fig.1 Effect of different saturation of ammonium sulfate on wheat bran esterase purification fold and recovery rate
2.1.2 Sephadex G-200凝胶层析
由图2可知,洗脱曲线上有一个主要蛋白峰和3个杂峰;经检测,第一个和第二个峰均具有酶活性,但第二个峰酶活较低,因此只对第一个峰的酶进行收集、超滤浓缩、真空冷冻干燥,并对其酶学性质进行研究。
2.1.3 麦麸酯酶的纯化
由表2可知,与粗酶液相比,经过硫酸铵分级沉淀、透析、凝胶层析以及超滤后的酶活逐渐降低,但比活力分别提高了1.11倍、2.18倍、11.88倍、16.17倍。酯酶比活力的增加表明,经过硫酸铵分级沉淀、透析、凝胶层析以及超滤后,酯酶得到了一定程度的纯化。
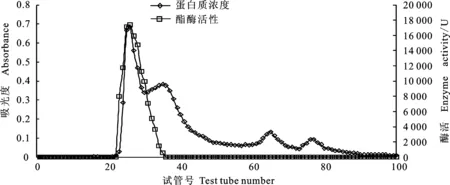
图2 SephadexG-200洗脱曲线
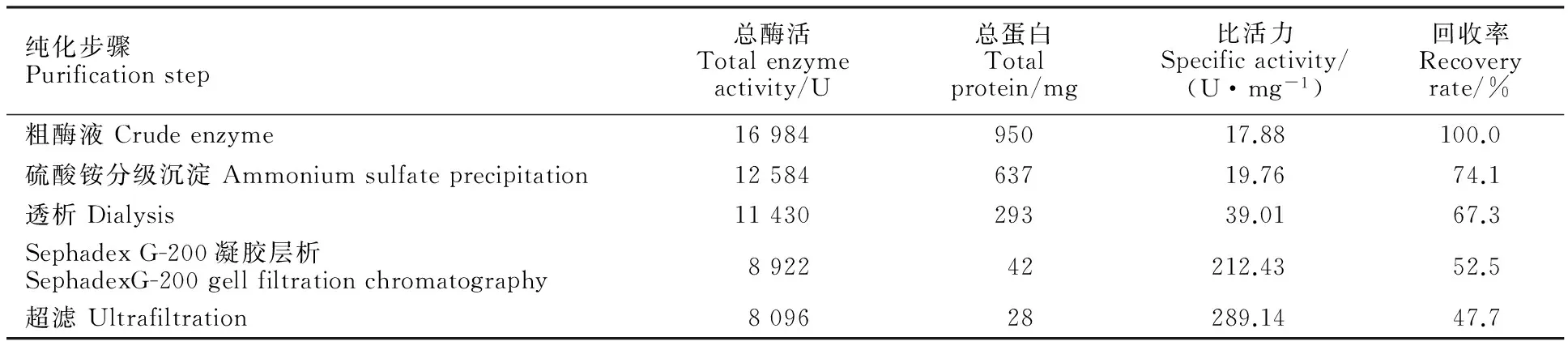
纯化步骤Purificationstep总酶活Totalenzymeactivity/U总蛋白Totalprotein/mg比活力Specificactivity/(U·mg-1)回收率Recoveryrate/%粗酶液Crudeenzyme1698495017.88100.0硫酸铵分级沉淀Ammoniumsulfateprecipitation1258463719.7674.1透析Dialysis1143029339.0167.3SephadexG-200凝胶层析SephadexG-200gellfiltrationchromatography892242212.4352.5超滤Ultrafiltration809628289.1447.7
2.1.4 SDS-PAGE酶谱分析及分子量测定
由图3可以看出,经过逐级的纯化,蛋白杂带逐渐减少,SDS-PAGE图谱变得更加清晰,证明纯化效果较好,去除了大部分的杂蛋白。植物酯酶的分子量约为29.0 kDa[10]。利用蛋白分析软件(Quantity One)计算本试验所提取麦麸酯酶的分子量约为26.0 kDa。图3中的其他模糊带可能是由于柱层析载体或洗脱液速度等原因导致酶液中含有其他杂蛋白。
2.2 麦麸酯酶的基本酶学性质
2.2.1 紫外吸收光谱
如图4所示,纯化后的麦麸酯酶有两个吸收峰(224 nm和280 nm)。根据蛋白质光谱的特性可知,蛋白质在190~380 nm范围的紫外波长下有两个特征吸收峰,一是由于其含有色氨酸和酪氨酸残基,分子内部存在共轭双键,在280 nm处有一个吸收峰,二是由于肽键的存在,在220 nm处有一个吸收峰。说明麦麸酯酶在蛋白质紫外吸收光谱的特征范围内。
2.2.2 麦麸酯酶的最适温度及热稳定性
从图5可知,温度对麦麸酯酶的相对酶活具有显著影响(P<0.05),随着温度的升高,酶活先升高后降低, 30 ℃时酶活达到最大,当温度高于35℃后,酯酶失活速度加快,50 ℃时,酶的活力仅为最大值的44.17%。这是因为过高的温度会影响麦麸酯酶活性部位三维结构的完整性,而这种三维结构又是保持酶活力的关键[11]。由表3可知,随着时间的延长,麦麸酯酶的相对活性呈下降趋势。随温度升高,相对酶活呈先升后降趋势,以30 ℃时相对酶活最高,保温8 h后仍保留有71.23%的酶活;35 ℃次之,保温8 h后保留有64.90%的酶活; 50 ℃稳定性较差,保温2 h,相对酶活为64.50%,保温8 h活性仅保留39.80%。说明麦麸酯酶在较高温度下的稳定性较差,原因可能与温度对酶构象的影响、酶分子的三级结构与原子间的疏水相互作用、范德华力、氢键等作用力有关,热处理会导致这些键不稳定从而使酶分子的展开,酶分子的展开会直接影响酶活性中心的特定结构[12],从而影响酶的活性。

M:Marker; A:粗酶液样; B:硫酸铵盐析样; C:Sephadex G-200柱层析样; D:超滤浓缩样。
M:Marker; A:Sample of crude enzyme; B:Sample of ammonium sulfate precipitation; C:Sample of sephadex G-200 gell filtration chromatography; D:Sample of ultrafiltration.
图3 麦麸酯酶的SDS-聚丙烯酰胺凝胶电泳图
Fig.3 SDS-PAGE picture of wheat bran esterase

图4 麦麸酯酶紫外吸收光谱图
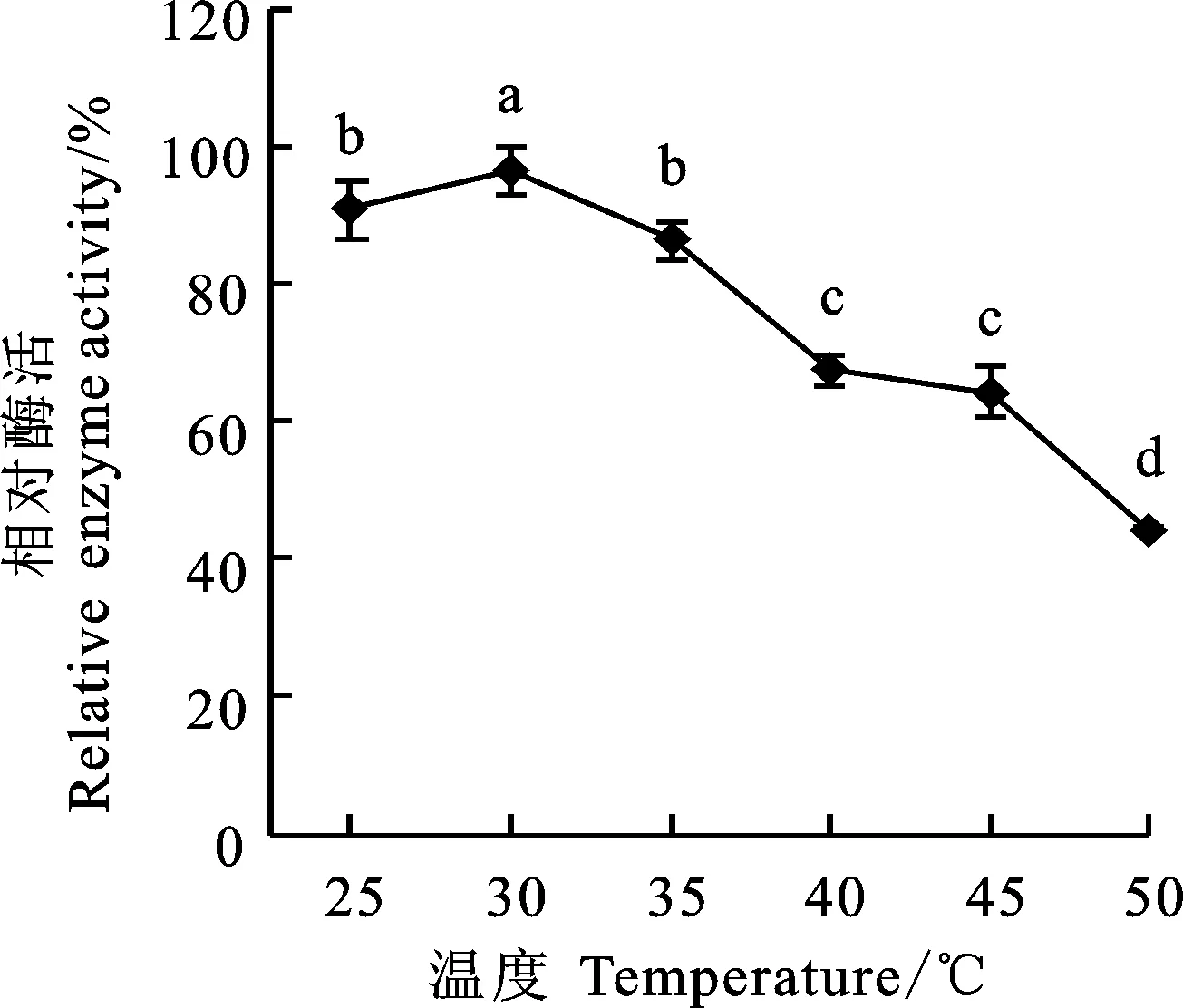
图5 温度对麦麸酯酶活性的影响

%
对照:最佳条件下的酶活。同行数据后不同字母表示处理间差异显著(P<0.05),表4~6同。
Control:The enzyme activity with the best condition.Different letters following date at same line mean significant difference among treatments(P<0.05).The same in table 4-6.
2.2.3 麦麸酯酶的最适pH及稳定性
如图6所示,麦麸酯酶在pH为8.0时的相对酶活显著高于其他处理, pH 7.0、9.0时的相对酶活显著高于其他低pH处理,pH为3.0时的相对酶活显著低于其他处理,仅为最大值的47.80%,说明麦麸酯酶最适pH值为8。
由表4可知,pH4.0~8.0范围内,麦麸酯酶的相对酶活较稳定,pH值为8时,麦麸酯酶保温24 h后的相对酶活与空白组没有显著差异。表明在最适pH值下,保温24 h内麦麸酯酶酶活较稳定,保温72 h后其相对酶活仍保留有92.10%。pH值为7时,麦麸酯酶也具有较好的稳定性,保温72 h后其相对酶活保留有89.00%。在过酸的情况下,麦麸酯酶失活较快,在pH值为3时保温24 h后,麦麸酯酶的相对酶活仅为18.20%。
2.2.4 金属离子对麦麸酯酶的影响
由表5可知,Mg2+对麦麸酯酶酶活的影响不显著;低浓度Cu2+(2 mmol·L-1)对麦麸酯酶相对酶活的抑制作用显著,而高浓度的Cu2+(4和6mmol·L-1)对麦麸酯酶相对酶活没有显著的影响;低浓度Fe2+(2 mmol·L-1)对麦麸酯酶相对酶活具有促进作用,高浓度的Fe2+(6 mmol·L-1)对麦麸酯酶相对酶活的抑制作用显著;Ca2+、Al3+对麦麸酯酶的相对酶活具有显著抑制作用; 当Al3+的浓度为6 mmol·L-1时,麦麸酯酶的相对酶活仅为41.91%。可能是6 mmol·L-1的Al3+引起了麦麸酯酶的变性。Ca2+可能与酯酶中的某些基团结合使酯酶的活性降低。供试的不同浓度的Mn2+对麦麸酯酶相对酶活均具有显著促进作用,但各处理间差异不显著。

图柱上不同字母表示处理间差异显著(P<0.05)。
Different letters above column mean significant difference among treatments(P<0.05).
图6 pH对麦麸酯酶活性的影响
Fig.6 Effect of pH on wheat bran esterase activity

表4 麦麸酯酶在不同pH值下保存不同时间后的相对酶活Table 4 Relative enzyme activity of wheat bran esterase with different pH and time %

表5 不同金属离子作用下麦麸酯酶的相对活性Table 5 Relative enzyme activity of wheat bran esterase with different metal ions %
2.2.5 化学试剂对麦麸酯酶的影响
由表6可知,供试浓度的硫酸铝钾对麦麸酯酶酶活均具有显著促进作用,但不同处理间差异不显著,相对酶活最大值达到了148.29%,表明硫酸铝钾对麦麸酯酶酶活具有显著的促进作用。不同浓度的四硼酸钠对麦麸酯酶相对酶活均具有显著抑制作用,但不同处理间差异不显著,柠檬酸对麦麸酯酶相对酶活没有显著的影响;不同浓度的柠檬酸钠对麦麸酯酶相对酶活均具有显著抑制作用影响,但不同处理间差异不显著。

表6 不同化学物质作用下麦麸酯酶的相对活性Table 6 Effect of different chemical substances on wheat bran esterase activity %
2.2.6 麦麸酯酶米氏常数的确定
以反应初速度倒数对底物浓度倒数作图,根据Lineweaver-Burk双倒数作图法获得的方程为:1/v=0.915[1/S]+1.072 4。由该方程得麦麸酯酶的动力学参数,Km和Vmax值分别为0.85 mg·mL-1和0.93 mg·mL-1·min-1。
2.2.7 麦麸酯酶半衰期的确定
由图7可知,麦麸酯酶在4 ℃条件下,相对酶活下降较慢,半衰期为10.4 d,在15 d时,相对酶活为36.7%。在25 ℃条件下,半衰期为8.6 d,在12 d时,相对酶活为37.9%,12 d后酶活迅速下降。因此,推荐将酯酶在4 ℃下避光保存。

图7 麦麸酯酶的半衰期
3 讨 论
本研究中,麦麸酯酶的最适反应温度为30 ℃,而来源于大豆的植物酯酶的最适反应温度为25 ℃[13],原因可能与酶的构象有关。高温下植物酯酶的酶活会受到显著影响,这是因为酶蛋白的变性是时间和温度的函数,随着温度的升高,酶的二级结构和三级结构发生变化。此外,氨基酸序列的长度[14]也是影响酶的最适温度及温度稳定性的主要因素,不同来源的植物酯酶,其氨基酸序列组成和长度也可能存在差异。本研究中,麦麸酯酶的最适pH为8.0,pH稳定范围为4.0~8.0,这与前人的研究结果基本一致[15-16],存在的一定差异可能与酶所在部位或酶的生物学特性[17]相关。酶分子只能在一定范围的pH条件下保持稳定,超过界限,酶分子就会变性[18]。过酸或过碱环境不仅会破坏酶分子的静电键、氢键等保持天然构象的平衡力,同时酶分子的解离状态以及作用部位及作用方式也会发生改变[19]。植物酯酶在强酸或强碱条件下失活速度都很快,但强酸比强碱条件更快[13]。
现有的研究表明,植物酯酶不是单一的酶系,而是由多种酯酶同工酶共同组成[3,13,15,20],单一的同工酶还可能由不同的酶蛋白亚基构成,所以植物酯酶是一个复杂的酶体系。周艳利[13]从大豆中提取植物酯酶,经差速冷冻离心、硫酸铵盐析、透析,然后依次进行纤维素DEAE-32离子交换层析和葡聚糖Sephadex G-100凝胶过滤层析,最终得到三种纯的大豆酯酶同工酶(Soybean Esterase Isozyme,SEI),分别记为SEIl、SEI2和SEI3,其中,SEI2是由两个相对分子量分别为37.2 kDa和21.4 kDa的酶蛋白亚基组成的共聚体。刘文君[21]直接采用DEAE-52离子交换层析对小麦酯酶进行提纯,最终分离得到三种小麦酯酶同工酶,其中,用0.1 mol·L-1的NaCl进行洗脱时酶活性最高。本试验的后续研究将从分离纯化以得到单一植物酯酶组分着手,以对麦麸酶酯进行更深入研究。
[1] 王丽丽,陶海腾,徐同成,等.麦麸酚类化合物研究进展[J].中国食物与营养,2012,18(12):36.WANG L L,TAO H T,XU T C,etal.Research on phenolic compounds of wheat bran [J].FoodandNutritioninChina,2013,18(12):36.
[2] TAKAHASHI K,SHIMADA T,KONDO M,etal.Ectopic expression of an esterase,which is a candidate for the unidentified plant cutinase,causes cuticular defects inArabidopsisthaliana[J].PlantandCellPhysiology,2010,51(1):123.
[3] 江媛媛.有机磷农药检测用植物酯酶的研究[D].长沙:中南林业科技大学,2012:18.JIANG Y Y.The Researches on phytoesterase used for the detection of organophosphorus pesticides [D].Changsha:Central South University of Forestry and Technology,2012:18.
[4] 阮长青,杨 娟,郭德军.不同植物酯酶对α-乙酸萘酯催化活性研究[J].食品科学,2009,30(13):183.RUAN C Q,YANG J,GUO D J.Catalytic activity of esterases from different crops to α-naphthalene acetic acid [J].FoodScience,2009(13):183.
[5] YANG L M,HUO D Q,HE K,etal.Role of tryptophan in the active site of plant esterase:Chemical modification and fluorometric studies [J].AppliedBiochemistryandBiotechnology,2013,170(4):909.
[6] HOU C J,HE K,YANG L M,etal.Catalytic characteristics of plant-esterase from wheat flour [J].WorldJournalofMicrobiologyandBiotechnology,2012,28(2):541.
[7] 杜 英,朱蓓薇,吴海涛,等.海参乙酰胆碱酯酶的酶学特性研究[J].食品与机械,2011,27(2):11.DU Y,ZHU B W,WU H T,etal.Characteristics of acetylcholinesterase from sea cucumber [J].Food&Machinery,2011,27(2):11.
[8] SURINENAITE B,BENDIKIENE V,BACHMATOVA I.Characterization and physicochemical properties of a lipase fromPseudomonasmendocina[J].BiotechnologyandAppliedBiochemistry,2002,36(8):51.
[9] 陈石根,周润琦.酶学[M].上海:复旦大学出版社,2006:209.CHEN S G,ZHOU R Q.Enzymology [M].Shanghai:Fudan University Press,2006:209.
[10] 孟 玲.辽春9号小麦酯酶的分离纯化、固定化研究及在有机磷农药残留快速检测中的应用[D].沈阳:沈阳农业大学,2006:67.MENG L.Study on separating,purification and immobilization of Liaochun 9 wheat esterase and its application on detecting of organophosphorus pesticide [D].Shenyang:Shenyang Agricultural University,2006:67.
[11] 刘海霞,韩承辉.用植物酯酶片测定有机磷农药的显色剂研究[J].江苏广播电视大学学报,2003,14(3):41.LIU H X,HAN C H.Study on developer of determination organophosphate pesticides using plant-esterase tickets [J].JournalofJiangsuRadio&TelevisionUniversity,2003,14(3):41.
[12] 张 宁.植物酯酶检测有机磷农药残留影响因素的研究[J].湖南农业科学,2007(3):57.ZHANG N.Research on primary factor for rapid test plant-esterase in organophosphorus pesticide residue [J].HunanAgriculturalSciences,2007(3):57.
[13] 周艳利.大豆酯酶同工酶的分离纯化及其对有机磷和氨基甲酸酯类农药敏感性的研究[D].西安:陕西师范大学,2008:56.ZHOU Y L.Separation and purifieation of soybean esterase isozyme and its sensitivities to organophosphate and carbamate pesticides [D].Xi'an:Shaanxi Normal University,2008:56.
[14] 李文革,石鹏君,卢海强,等.Achaetomium sp.Xz8甘露聚糖酶在毕赤酵母中的表达及其酶学性质分析[J].核农学报,2015,29(1):92.LI W G,SHI P J,LU H Q,etal.Expression and characterization of a novel mannanse fromAchaetomiumsp.Xz8 inPichiapastoris[J].JournalofNuclearAgriculturalSciences,2015,29(1):92.
[15] 穆随选.有机磷及氨基甲酸酯类农药残留检测用豇豆酯酶的初步研究[D].杨凌:西北农林科技大学,2009:43.MU S X.Elementary research onViganunguiculata(linn.) esterase used for detecting organophosphorus and carbamate pesticides residues [D].Yangling:Northwest A&F University,2009:43.
[16] 周艳明,刘 丹,胡 睿,等.有机磷农残检测用植物酯酶的分离纯化及酶学性质的研究[J].食品科技,2008,33(3):55.ZHOU Y M,LIU D,HU R,etal.Study on purification and characterization of plant-esterase for detecting the residues of organophosphate pesticides [J].FoodScienceandTechnology,2008,33(3):55.
[17] 吴 萍,史 钧,李正鹏,等.杏鲍菇产木聚糖酶固态发酵条件优化及其酶学性质[J].核农学报,2010,24(3):545.WU P,SHI J,LI Z P,etal.Solid-phase fermentation condition and enzymatic characteristiocs of xylanase fromPleurotuseyngii[J].JournalofNuclearAgriculturalSciences,2010,24(3):545.
[18] 徐 斐,张慧君,许学勤,等.用于有机磷农药残留检测的植物酯酶筛选[J].上海理工大学学报,2003,25(2):111.XU F,ZHANG H J,XU X Q,etal.Selection of phytoesterase used in detecting the residue of organophosphate pesticides [J].JournalofUniversityofShanghaiforScienceandTechnology,2003,25(2):111.
[19] 栾崇林,马文石,汪 军.植物酯酶法检测有机磷农药残留量研究[J].分析试验室,2006,25(9):105.LUAN C L,MA W S,WANG J.Study on detection of organophosphorus pesticides by plant-esterase [J].ChineseJournalofAnalysisLaboratory,2006,25(9):105.
[20] 胡晓燕.有机磷农药对植物酯酶的抑制及应用研究[D].杭州:浙江工业大学,2009:31.HU X Y.Research and application on plant-esterase inhibition by organophosphorous pesticides [D].Hangzhou:Zhejiang University of Technology,2009:31.
[21] 刘文君.小麦酯酶农药速测卡的研制和应用[D].南宁:广西大学,2007:49.LIU W J.Deve1opment and app1ication of wheat-esterase paper for determining pesticide residues [D].Nanning:Guangxi University,2007:49.
Purification and Characterization of Wheat Bran Esterase
YANG Xue1,2,YE Lin1,GAO Wei1,SHEN Guanghui1,LI Shanshan1,ZHANG Zhiqing1
(1.College of Food Science,Sichuan Agricultural University,Ya’an,Sichuan 625014,China; 2.Panzhihua Food and Drug Administration,Panzhihua,Sichuan 617000,China)
Collecting plant esterase from the wheat bran and studying the enzymatic properties in the experiment can provide worthful theoretical data for the application of wheat bran esterase in detecting pesticides in food. The liquid of crude enzyme extraction solution was purified by fractional ammonium sulfate precipitation,dialysis,SephadexG-200 gell filtration chromatography and ultrafiltration. The results showed that the specific activity of the enzyme was 289.14 U·mg-1,and recovery of activity was 47.7%,and the purification fold was 16.17. The molecular weight of wheat bran esterase was 26.0 kDa,and the maximum ultraviolet absorption was at 224 nm and 280 nm. The optimum temperature is 30 ℃,with temperature stability range from 25 to 40 ℃. The optimum pH is 8.0,with stable range from 4.0 to 8.0. Esterase activity was inhibitied by Cu2+,Mg2+,Ca2+,Al3+,citric acid sodium,and sodium tetraborate,while it was enhenced by Fe2+,Mn2+,citric acid,and potassium aluminum sulfate. The esterase kinetic parametersKmandVmaxvalues with α-naphthyl acetate as substrate are 0.85 mg·mL-1and 0.93 mg·mL-1·min-1,respectively. The half-life were 10.4 and 8.6 d when storing at 4 and 25 ℃,respectively. This study made fundamental knowledge for using wheat bran esterase.
Wheat bran; Esterase; Isolation and purification; Characterization of esterase
10.7606/j.issn.1009-1041.2017.06.18
时间:2017-06-07
2016-10-08
2016-11-07
E-mail:834261391@qq.com
张志清(E-mail:zqzhang721@163.com)
S512.1;S312
A
1009-1041(2017)06-0846-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170607.1005.036.html
