基于近红外免疫层析技术食源性诺如病毒快速检测方法研究*
2017-06-26霍江莲杨向莹畅晓晖李小林陈广全
张 捷,王 琳,霍江莲,杨向莹,畅晓晖,李小林,张 园,陈广全
(1.北京出入境检验检疫局检验检疫技术中心,北京 100026;2.出入境食品安全检测北京市重点实验室,北京 100026;3.国际检验检疫标准与技术法规研究中心,北京 100028;4.中国合格评定国家认可中心,北京 100162;5.天津出入境检验检疫局工业产品安全技术中心,天津 300308)
诺如病毒(norovirus,NVs)又称诺罗病毒、诺沃克病毒或脓融病毒。近年来,食源性病毒是严重威胁人类健康的危险因子之一,特别是诺如病毒和轮状病毒是引起世界范围内流行性胃肠炎暴发的主要因素[1-3]。诺如病毒感染流行大多源于水或某种食物的污染,特别是牡蛎、蛤等贝类水产品引起的感染。其基因组为单股正链RNA,根据VP1序列的同源性,诺如病毒可分为GI~GV5个基因群(Genogroup),其中引起人类感染的主要是GI和GII群,基因群可进一步分为不同的基因型(Genotype)[4]。自1995~1996年诺如病毒首次导致世界性大流行以来,GII群中的第四基因型GII.4一直在世界范围内的流行中占据主导地位。
目前,虽然很多研究建立了诺如病毒的检测方法,但缺乏诺如病毒监测的统一高效的病毒浓缩、检测、确证等标准检测方法。基于传统的检测方法耗时费力,无法快速有效地降低食源性疾病的发生率,我们急需建立标准化的检测技术、研发高效的快速检测试剂盒。近红外免疫层析技术(near-infrared immunochromatographic techniques)是将近红外荧光与免疫层析法相结合的一种新型免疫层析技术。近年来,近红外免疫法鉴于其背景干扰小、组织穿透力强等突出的优点,在生物、医学等各领域受到越来越多的关注[5-7]。本研究通过研制近红外免疫层析试纸条及配套标准物质,针对GⅡ型诺如病毒建立一种近红外荧光免疫层析快速检测方法,以期进一步提高诺如病毒快速检测的灵敏度和特异性。
1 材料与方法
1.1 材料与试剂
GⅡ型诺如病毒(由中国疾控中心病毒病研究所提供);羊抗鸡IgY(上海慧耘生物科技有限公司);鼠抗诺如病毒衣壳蛋白单克隆抗体(购自Pierce公司)。兔抗诺如病毒衣壳蛋白多克隆抗体(由中国疾控中心病毒病研究所提供);稀释液(5%BSA,0.1%Tween 20,PBS);荧光染料dylight 800由武汉珈源量子点开发有限公司提供;10×PCR缓冲液:TaqDNA聚合酶;DNA提取试剂盒;PCR扩增引物:引物序列为P1:5’-ATACCACTATGATGCAGATTA -3’,P2:5’-TCATCATCACCATAGAAAGAG-3’;探针序列为5’-FAM-TGGGAGGGCGATCGCAATCT-TAMRA-3’,用灭菌去离子水配制,浓度为10mmol/L(所有引物均由上海生工合成,其中诺如病毒RNA的检测采用 Ta Ka Ra 公司的 Premix Ex Taq TM (Probe qPCR),试剂盒由宝生物工程(大连)有限公司提供)。
1.2 仪器与设备
恒温摇床(江苏太仓实验仪器设备厂)、高速低温离心机(Sigma,3-18K)、超纯水仪(Thermo)、高压灭菌器(上海博迅实业有限公司医疗设备厂)、便携式高灵敏度近红外点荧光扫描仪(北京博润福得科技发展有限公司)。
1.3 检测方法
1.3.1 近红外荧光染料标记病毒单抗:将兔抗诺如病毒衣壳蛋白多克隆抗体用划膜液稀释为1.5 mg/mL作为划膜抗体。将鼠抗诺如病毒衣壳蛋白单克隆抗体用PBS稀释为1 mg/mL,,取100 μL,加入7 μL荧光染料 dylight 800,涡旋混匀后于室温避光静置1 h,1 h后加入100 μLPBS稀释混匀,终浓度为0.5 mg/mL做为标记抗体,将标记抗体放入透析袋,于PBS中4 ℃过夜透析,回收抗体作为最终标记抗体。
1.3.2 诺如病毒免疫层析试纸条的制备:试纸条由样品垫、金标垫、硝酸纤维质膜(NP膜)、吸水纸及试纸板组成,按次序依次搭接,而后以切割机切成试纸条。以羊抗鸡 Ig Y为质控抗体(C线),用划膜液稀释为1 mg/mL,将兔抗诺如病毒多克隆抗体(划膜抗体)1.5 mg/mL作为检测线(T线)。将羊抗鸡Ig Y抗体和兔抗诺如病毒多克隆抗体用划膜仪划于NP膜上,C,T线间距为0.5 cm,且C、T线中线于NP膜中线重合。室温放置3 h,粘贴吸水纸,金标垫,样品垫,进行切条。如图1所示。

图1 基于低噪声激发式荧光标记的诺如病毒免疫层析试纸条示意图 注:1.样品垫;2.结合垫;3.硝酸纤维素膜;4.检测线;5.质控线;6.吸水垫;7.底板。
1.3.3 定性检测:标记抗体鼠抗诺如病毒单抗用层析缓冲液1∶50稀释,羊抗鸡抗体IgY 1∶2000稀释(浓度0.5 mg/mL) ,鼠抗诺如病毒单抗与IgY 1∶1(90 μL+90 μL)稀释得混合液,将诺如病毒稀释,每100 μL病毒稀释液+4 μL混合液,涡旋混匀,滴加至试纸条,室温放置15 min后,用便携式近红外荧光扫描仪读数。若检测线区域和质控区域同时出现荧光峰为阳性结果。
1.3.4 特异性实验:在无菌条件下,分别取实验室分离的肠道病毒EV71、腺病毒、轮状病毒原液稀释,吸取30 μL加70 μL层析液和4 μL混合液滴加到样品垫上,室温放置15 min后,用便携式近红外荧光扫描仪读数。
1.4 评价方法
1.4.1 RT-PCR检测方法:(1)按照《SN/T 1635-2005贝类中诺沃克病毒检测方法,普通PCR和实时荧光PCR方法》[6]对来自实验室的15份贝类样品(样品包括贝、螺丝、蛏子等)进行样品前处理。(2)实时荧光RT-PCR,采用诺如病毒试剂盒试剂盒:sureFast Norovirus/Hepatitis A 3plex。见表1。

表1 诺如病毒实时荧光PCR反应体系 μL
1.4.2 染毒实验组贝类样品的处理:取未检出诺如病毒的贝类样品消化腺0.5 g,研钵研磨,用3.5 mL甘氨酸(pH值为9.6)缓冲液研磨样品,分别在2 mL研磨液中加入20 μL病毒上清,另取1 mL研磨液不加病毒加至EP管,同时对照组为1 mg/mLBSA溶液。采用12 500 g,离心30 min(室温离心),离心后用0.45 μm过滤膜过滤。各取800 μL,用浓缩管浓缩至于60 μL(12 000 r/min,20 min)。各取30 μL浓缩液加70 μL层析,再加4 μL混合液,用诺如病毒试纸条进行免疫层析。
1.4.3 近红外免疫层析试纸条检测实际样品:按照所建立的近红外免疫层析法,对来自实验室的15份样品(与1.4.1的15份样品一致)进行检测,并将检测结果进行比较。(1)贝类样品诺如病毒的富集:按照1.4.2建立的方法,15份样品分别取贝类消化腺0.5 g,加3.5 mL匀浆液,充分研磨。采用离心机12 500 g,离心30 min(室温离心),离心后用0.45 μm过滤膜过滤。15份样品各取800 μL,用超滤浓缩管浓缩至于60 μL左右(12 000 r/min,20 min离心)。(2)检测:15份样品各取30 μL浓缩液加70 μL层析液,再加4 μL 混合液滴加到样品垫上,室温放置15 min后,用便携式近红外荧光扫描仪读数。分别作两个平行试验。
1.4.4 胶体金法:采用RIDA QUICK Norovirus诺如病毒抗原快速检测试剂卡检测15份样品。
2 实验结果
2.1 诺如病毒定性检测结果
本实验采用近红外荧光染料标记的双抗体夹心免疫层析试纸条检测诺如病毒。实验发现,检测中所使用的近红外荧光染料为发射波长位于777 nm的有机分子,优选活化的近红外荧光染料DyLight 800。所述的基于低噪声激发式荧光标记的诺如病毒免疫层析试纸条,低噪声激发式荧光染料为发射波长为650~1000 nm。分别测定检测线4和质控线5区域的荧光强度,若质控线5区域出现荧光发射峰,则表明该试纸条有效,反之则无效;若检测线4区域同时出现荧光发射峰则为阳性结果,反之则为阴性。阳性结果见图2。
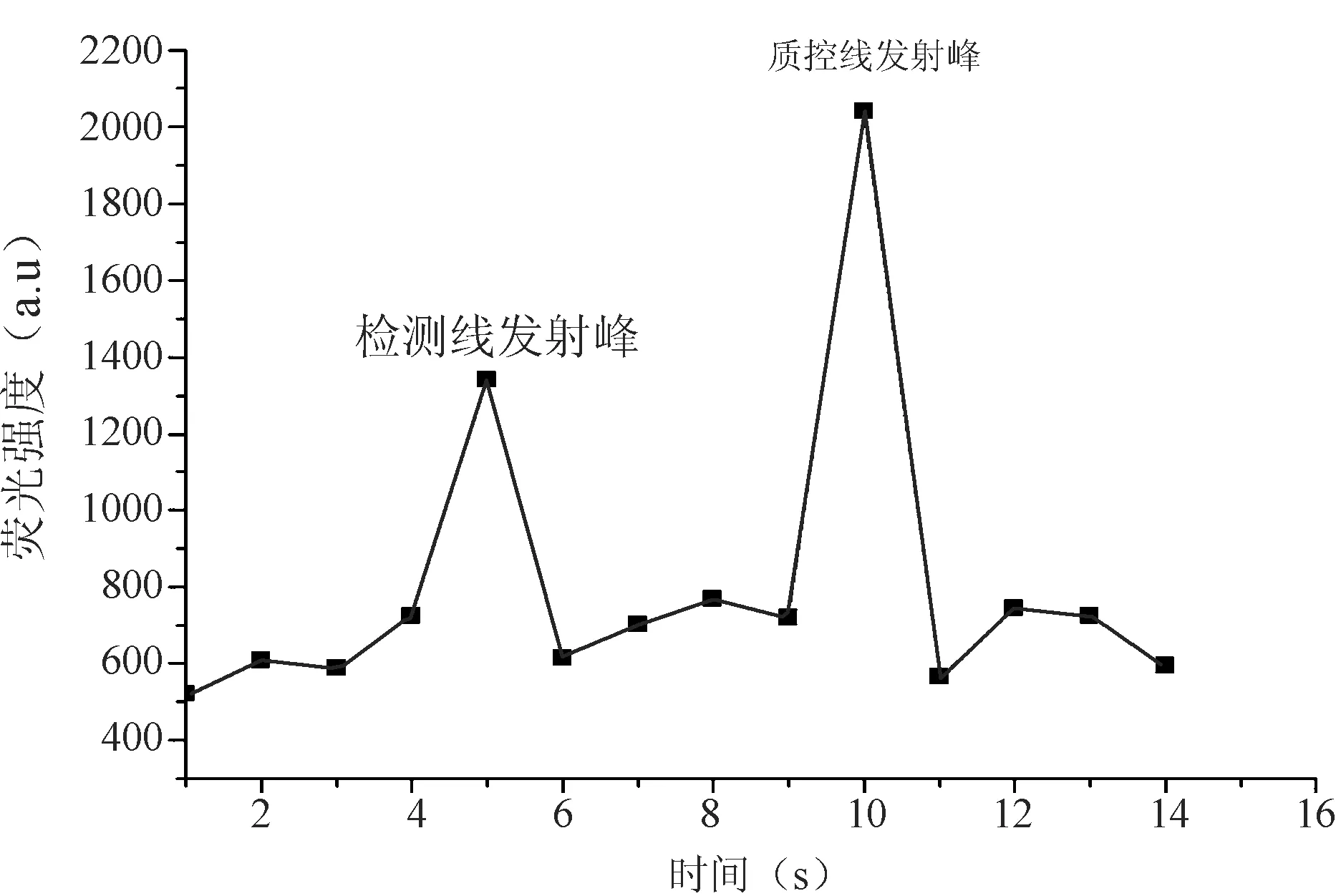
图2 诺如病毒低噪声激发式荧光检测
2.2 特异性试验结果
分别将肠道病毒EV71,腺病毒、轮状病毒、甲肝病毒原液用层析液稀释,加入试纸条进行检测。轮状病毒WA、轮状病毒SALL、肠道病毒EV71、腺病毒、甲肝病毒与诺如病毒试纸条均无交叉反应。检测结果见图3。

图3 诺如病毒试纸条特异性试验结果 注:从左到右依次为诺如病毒、轮状病毒Wa、轮状病毒SALL、肠道病毒EV71、甲肝病毒、腺病毒病毒。
2.3 实际样品的近红外荧光法检测结果
15份贝类样品经过样品前处理和病毒富集后,各取50 μL样品稀释液加50 μL层析液,再加4 μL mix滴加到样品垫上,室温放置15min后,用便携式近红外荧光扫描仪读数。(分别作2个平行试验)检测结果除B1为阳性外,其余14份样品均为阴性(图4、图5)。图3显示样品B1检测峰值为2400。

图4 实际样品B1近红外荧光法检测结果
2.4 近红外免疫层析法与荧光RT-PCR、胶体金法比较
按照《SN/T 1635-2005 贝类中诺沃克病毒检测方法 普通RT-PCR和实时荧光RT-PCR方法》对来自实验室的15份贝类样品(样品包括贻贝、螺丝、蛏子等)进行检测。仅样品B1近红外检测结果与其他两种方法不一致,其余结果均相符。近红外荧光法与其他两种方法的符合率达到93.3%。见表2。

图5 实际样品B2近红外荧光法检测结果
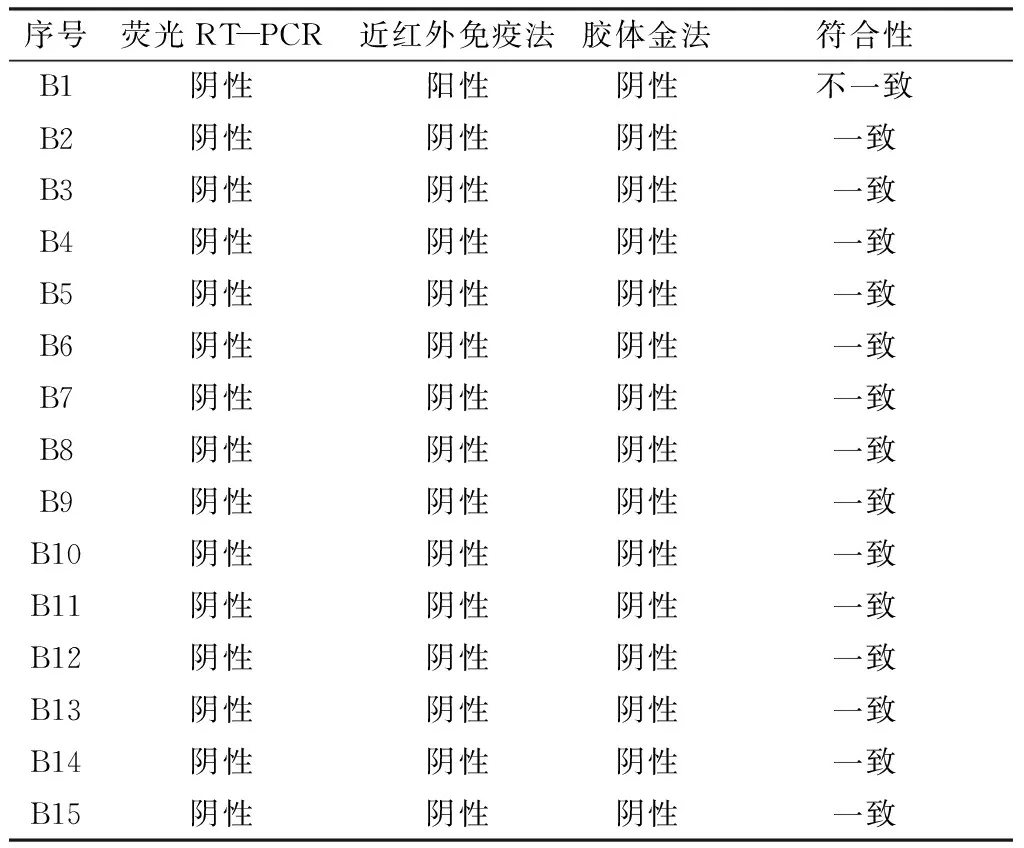
序号荧光RT-PCR近红外免疫法胶体金法符合性B1阴性阳性 阴性不一致B2阴性阴性阴性一致B3阴性阴性阴性一致B4阴性阴性阴性一致B5阴性阴性阴性一致B6阴性阴性阴性一致B7阴性阴性阴性一致B8阴性阴性阴性 一致B9阴性阴性阴性 一致B10阴性阴性阴性一致B11阴性阴性阴性一致B12阴性阴性阴性一致B13阴性阴性阴性一致B14阴性阴性阴性一致B15阴性阴性阴性 一致
3 讨论
诺如病毒是全球范围内引起人类急性肠胃炎的最重要病原之一,可导致严重的公共卫生问题,不仅因其高度变异,而且具有传染性和抵抗力的新变异重组株将会导致全球的流行。近年来,每年都有多起因食用贝类而引起诺如病毒胃肠炎暴发的报道。2006年年底日本诺如病毒胃肠炎暴发流行,2个月内感染诺如病毒以儿童为主的患者高达303.9万人。 2007-12—2008-01间英国感染诺如病毒患胃肠炎的人数高达200万人。随着我国对诺如病毒检测技术的深入发展,近年来该病毒引起急性胃肠炎暴发的报道逐渐增多,特别是在北京、河北、广东、广西、浙江等地相继爆发[8-12]。
由于诺如病毒不能进行细胞和组织培养,也没有合适的动物模型,其检测方法受很大限制。目前用于该病毒的检测方法主要有电镜法、免疫学法及分子生物学法。电镜检测法具有直接、可靠的优点,但检测灵敏度较低,通常粪便标本病毒滴度达到106/g才能达到检测要求。现有的胶体金免疫层析技术,虽然在病原体检测方面,其敏感性、特异性具有其他免疫学方法无可比拟的优势,且无需特殊仪器设备,对检测人员的专业要求低,有良好的基层应用开发前景。但该法存在标记物的稳定性较差、颜色单一、灵敏度较低、受基质的背景干扰大等缺陷,且只能定性检测,不能做到精确定量检测,标记灵敏度有限且无法实现精确定量的缺点。诺如病毒的免疫学检测发展较快,目前至少有3 种免疫学检测试剂盒进入市场,其中包括德国的 RIDASCREEN试剂盒、英国的 IDEIA 试剂盒与日本的SRSV (Ⅱ) -AD试剂盒。Castriciano 等[13]通过检测 228 份诺如病毒阳性腹泻样本,对三者的灵敏度、特异性等方面进行了详细的比较,研究表明,RIDASCREEN的检出率为80.3% ,IDEIA 的检出率为 60.6% ,SRSV (Ⅱ) -AD的灵敏性和特异性为 36.4% 和96.9% 。
近年来流行病学资料表明,诺如病毒是美国最普遍的食源性病毒[14-15]。免疫磁珠分离法具有分离样品快速、特异性强、操作简单和仪器设备简单等特点,已经广泛应用于细胞分离、病原体检测等领域,但限制免疫磁珠分离法在诺如病毒检测方面应用的主要原因是诺如病毒的抗原变异性,很难用一种或少数几种抗体富集所有的诺如病毒。吴清平等[16]采用单克隆抗体免疫磁珠结合RT-PCR法可检测到 10-7稀释度的样本,而多克隆抗体免疫磁珠结合RT-PCR 法只能检测到10-5 稀释度的样本,前者的灵敏度比后者高 100 倍,表明单克隆抗体包被免疫磁珠进行诺如病毒富集检测具有更好的优势。Gilpatrick等[17]建立了免疫磁性捕获反转录-聚合酶链式反应 (IMC/RT-PCR)检测诺如病毒,特异性和灵敏度均较高。Shinichi Kobayashi等[18]用杆状病毒表达的诺如病毒重组衣壳蛋白抗体包被磁珠捕获和浓缩食物中的诺如病毒,进行RT-PCR 检测。免疫磁珠分离法操作简便、不需要特别的设备、耗时短、 减少了 PCR 的干扰物质,适用于食物样品中诺如病毒的检测。
本研究基于低噪声激发式荧光标记的诺如病毒免疫层析试纸条,其发射光谱位于低噪声激发式区域(波长为650~1100 nm)的低噪声激发式荧光探针具有较高的信噪比,并由此保障了其高检测灵敏度,同时由于生物基体极少在低噪声激发式光谱区自发荧光,使得基于此类探针标记的分析检测免受背景荧光干扰;因散射光强度与波长的四次方成反比,发射光位于长波区的低噪声激发式荧光探针受其干扰小。基于低噪声激发式荧光染料标记的免疫层析体系对靶标病毒的灵敏度与实时荧光PCR法相近,检测限低于胶体金法。本方法所涉及的免疫层析试纸条及低噪声激发式荧光扫描仪均属于便携可移动装置,且整个检测过程可在45 min内完成,适用于现场、即时、快速检测,相对于实时荧光定量PCR法等分子生物学方法则在仪器的检测速度、便携性及现场适用性上呈现明显优势。
综上所述,本研究采用量子点作为标记,采用免疫层析技术制备靶向于诺如病毒的免疫层析试纸条,检测时采用专用便携式低噪声激发式荧光扫描仪分别扫描质控线和检测线,以检测线荧光强度检测值实现样本的定性检测,该试纸条适用于食品中诺如病毒的即时检测,具有快速、高效及便携的优点。
[1] JIN H,WANG B,FANG Z Y,etal.Hospital-based study of the economic burden associated with rotavirus diarrhea in eastern China[J].Vaccine,2011,29:7801-7806.[2] FANKHAUSER R L,MONROE S S,Noel J S,et al.Epidemiologic and molecular trends of Norwalk-like viruses associated with out-breaks of gastroenteritis in the United States[ J].J Infect Dis,2002,186(1):1-7.
[3] LOPMAN B A,REACHER M H,DUIJNHOVEN Y V,etal.Viral gas-troenteritis outbreaks in Europe,1995-2000[ J].Emerg Infect Dis,2003,9(1):90-96.
[4] ANDO T,NOEL J S,FANKHAUSER R L.Genetic classification of“Norwalk-like viruses”[ J].J Infect Dis,2000,181(2):336-348.
[5] PYO D J,YOO J S.2012.New trends in fluorescence immunochromatography [J].Journal of Immunoassay & Immunochemistry,2012,33(2): 203-222.
[6] AMIOT C L,XU S P,LIANG S,etal.Near-infrared fluorescent materials for sensing of biological targets [J].Sensors,2008,8(5): 3082-3105.
[7] ALANDER J T,BOCHKO V,MARTINKAUPPI B,etal.A review of optical nondestructive visual and near-infrared methods for food quality and safety[J].International Journal of Spectroscopy,2013,2013: 1-36.
[8] 李晖,方苓,邹丽容,等.广东省暴发性胃肠炎中诺如病毒的分子流行病学特点分析[J].中华微生物学和免疫学杂志,2007,27(1):5-8.
[9] 贾立平,钱渊,张又,等.北京市某些医院内腹泻暴发与诺如病毒的相关性研究[J].中华流行病学杂志,2007,28(3):213- 217.
[10] 李海,莫兆军,杨进业,等.广西自治区2006- 2007年诺如病毒腹泻暴发疫情特征分析[J].华南预防医学,2008,34(5):6- 13.
[11] 谢立,崔威武,邓晶,等.杭州市诺如病毒肠炎暴发疫情分析[J].中国预防医学杂志,2009,10(1):23- 25.
[12] 孔志芳,曹品元,黄美林,等.一起诺瓦克病毒引起感染性腹泻爆发疫情调查分析[J].疾病监测,2007,27(6):422- 423.
[13] CASTRICIANO S,LUINSTRA K,PETRICH A,etal.Comparison of the RIDASCREEN norovirus enzyme immunoassay to IDEIA NLV GI /GII by testing stools also assayed by RT-PCR and electron microscopy[J].J Virol Meth,2007,141:216-219
[14] BLANTON L H,ADAMS S M,BEARD R S,etal.Molecular and epidemiologic trends of caliciviruses associated with outbreaks of acute gastroenteritis in the United States,2000-2004[J].J Infect Dis,2006,193( 3) : 413-421.
[15] TSENG F C,LEON J S,MACCORMACK J N,etal.Molecular epidemiology of norovirus gastroenteritis outbreaks in North Carolina,United States: 1995-2000[J].J Medl Virol,2007,79( 1) : 84-91.
[16] YAO L,WU Q P,WANG D P,etal.Development of monoclonal antibody-coated immunomagnetic beads for separation and detection of norovirus( genogroup II) in fecal extract samples[J].Lett Appl Microbiol,2009(49):173-178.
[17] GILPATRICK S G,SCHWEAB K J,ESTESM K,etal.Development of an immunomagnetic capture reverse transcription PCR assay for the detection of Norwalk virus[J].J Virol Methods,2000,90 (1):69-78.
[18] SHINICHI Kobayashi,KATSURO Natori,NAOKAZU Takeda,etal.Immunomagnetic capture RT-PCR for detection of norovirus from foods implicated in a foodborne outbreak[J].Microbiol Immunol,2004,48 (3):201-204.
