肌纤维类型转化的分子信号通路及其营养调控进展
2017-06-24郭秋平文超越王文龙段叶辉李颖慧李凤娜
郭秋平 文超越 王文龙 段叶辉 李颖慧 李凤娜
(1.中国科学院亚热带农业生态研究所,畜禽养殖污染控制与资源化技术国家工程实验室,中国科学院亚热带农业生态过程重点实验室,长沙410125;2.中国科学院大学研究生院,北京100049;3.湖南师范大学生命科学学院,动物营养与人类健康实验室,长沙410006;4.湖南畜禽安全生产协同创新中心,长沙410128)
肌纤维类型转化的分子信号通路及其营养调控进展
郭秋平1,2文超越1,3王文龙1,3段叶辉1,2李颖慧1,2李凤娜1,4*
(1.中国科学院亚热带农业生态研究所,畜禽养殖污染控制与资源化技术国家工程实验室,中国科学院亚热带农业生态过程重点实验室,长沙410125;2.中国科学院大学研究生院,北京100049;3.湖南师范大学生命科学学院,动物营养与人类健康实验室,长沙410006;4.湖南畜禽安全生产协同创新中心,长沙410128)
骨骼肌由不同类型的肌纤维组成,根据肌纤维肌球蛋白重链的不同,将肌纤维分为Ⅰ、Ⅱa、Ⅱx和Ⅱb型。骨骼肌中肌纤维类型的组成可影响屠宰后肉质,而肌纤维类型的转化则受体内多种信号通路和调控因子的调节以及饲粮营养因素的调控。本文对肌纤维转化的分子信号通路及其营养调控进行初步总结,为今后研究通过营养策略调控肉品质提供参考。
骨骼肌;肌纤维类型转化;信号通路;营养调控;肉品质
骨骼肌由不同类型的肌纤维组成。传统分类方法是利用组织化学染色法,依据肌纤维代谢和收缩特点将肌纤维分为慢速氧化型(Ⅰ型)、快速酵解型(Ⅱ型)和氧化-酵解混合型[1];利用现代分子生物学方法,根据肌纤维所含肌球蛋白重链(myosin heavy chain,MyHC)的不同,将肌纤维分为Ⅰ、Ⅱa、Ⅱx和Ⅱb 4种,代谢类型从氧化到酵解过渡,收缩速度依次增加。肌肉中不同肌纤维类型的比例可影响屠宰后的肉品质[2]。哺乳动物肌纤维数目在出生前已经基本确定,其中猪在胚胎期90 d以后肌纤维的数目就已不再发生变化[3]。哺乳动物成熟骨骼肌表现出高度可塑性,年龄、营养、激素和运动等因素均可以使肌纤维类型发生转化,肌纤维转化遵循Ⅰ↔Ⅱa↔Ⅱx↔Ⅱb的变化规律[4]。肌纤维的转化受到多条信号通路和诸多细胞因子的调节(图1)[5]。MyHC表达水平的改变,表现为肌纤维类型的转化。本文总结了近年来通过营养调控包括植物提取物、饲粮能量与粗蛋白质水平和不饱和脂肪酸对肌纤维类型的调节作用,为今后研究通过营养策略改善肌纤维类型和肉品质提供理论依据。
1 肌纤维类型转化信号通路
肌纤维的转化受多条信号通路的调节,主要是骨骼肌细胞内钙离子(Ca2+)浓度和代谢产物的变化,激活下游信号分子通路,并进而调节与肌纤维类型相关基因的表达,引起肌纤维适应性转化。
1.1 腺苷酸激活的蛋白激酶(AMPK)/过氧化物酶受体增殖激活受体γ辅助激活因子-1α(PGC-1α)/沉默信息调节因子1(SIRT1)信号通路
AMPK是一种重要的平衡细胞能量的调节激酶,被称为“细胞能量调节器”。在运动时,AMPK对维持能量供应至关重要。AMPK受多种代谢信号的调节,如AMP/ATP值过高、运动等,AMPK磷酸化激活后可调节机体包括骨骼肌组织在内的多条下游靶向通路。AMPK基因缺失的小鼠耐力训练时Ⅱb向Ⅱa、Ⅱx肌纤维型转化能力降低[6]。PGC-1α在骨骼肌中高度表达,在肌纤维转化中有重要作用。PGC-1α是AMPK下游重要靶分子,可直接被AMPK磷酸化,PGC-1α能促进线粒体的生物合成、有氧代谢以及慢型肌纤维的形成[7]。Lin等[8]发现骨骼肌超表达PGC-1α的小鼠酵解型纤维中Ⅰ型纤维含量增加,氧化代谢相关蛋白增加,肌肉抗疲劳性也相应提高。Arany等[9]也发现转入PGC-1α的诱导小鼠抗疲劳性增加,且诱导Ⅱx型肌纤维向Ⅰ型肌纤维转化,而骨骼肌特异性敲除PGC-1α会促使肌纤维从Ⅰ型、Ⅱa型氧化型向Ⅱx、Ⅱb酵解型转化[10]。SIRT1是机体内另一重要能量感受器。SIRT1是依赖烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶,与能量代谢调节、氧自由基代谢等多种生理过程有关。机体内AMPK可通过调节尼克酰胺磷酸核糖转移酶活性,使NAD+/还原型烟酰胺腺嘌呤二核苷酸(NADH)值升高,从而激活SIRT1[11]。小鼠骨骼肌中SIRT1超表达促进快肌纤维向慢肌纤维转化,且提高PGC-1α水平[12]。SIRT1可通过调节生肌调节因子(myofiber regulation factors,MRFs)影响肌纤维的分化。MRFs家族包括成肌分化抗原(MyoD)、肌细胞生成素(myogenin)、Myf5和MRF4 4种。MRFs可调节成肌细胞向不同方向分化,改变肌纤维类型。在出生之后MRF4在成年个体慢肌纤维中持续高表达,推测其参与肌纤维表型调控[13]。MyoD可调节肌细胞特异性增强结合因子2(myocyte-specific enhancer-binding factor 2,MEF2)影响MyHC基因的表达,改变肌纤维类型,而SIRT1可以特异性抑制肌细胞分化标志基因MyoD和MEF2的表达,使肌卫星细胞分化受阻,最终改变肌纤维类型[14]。
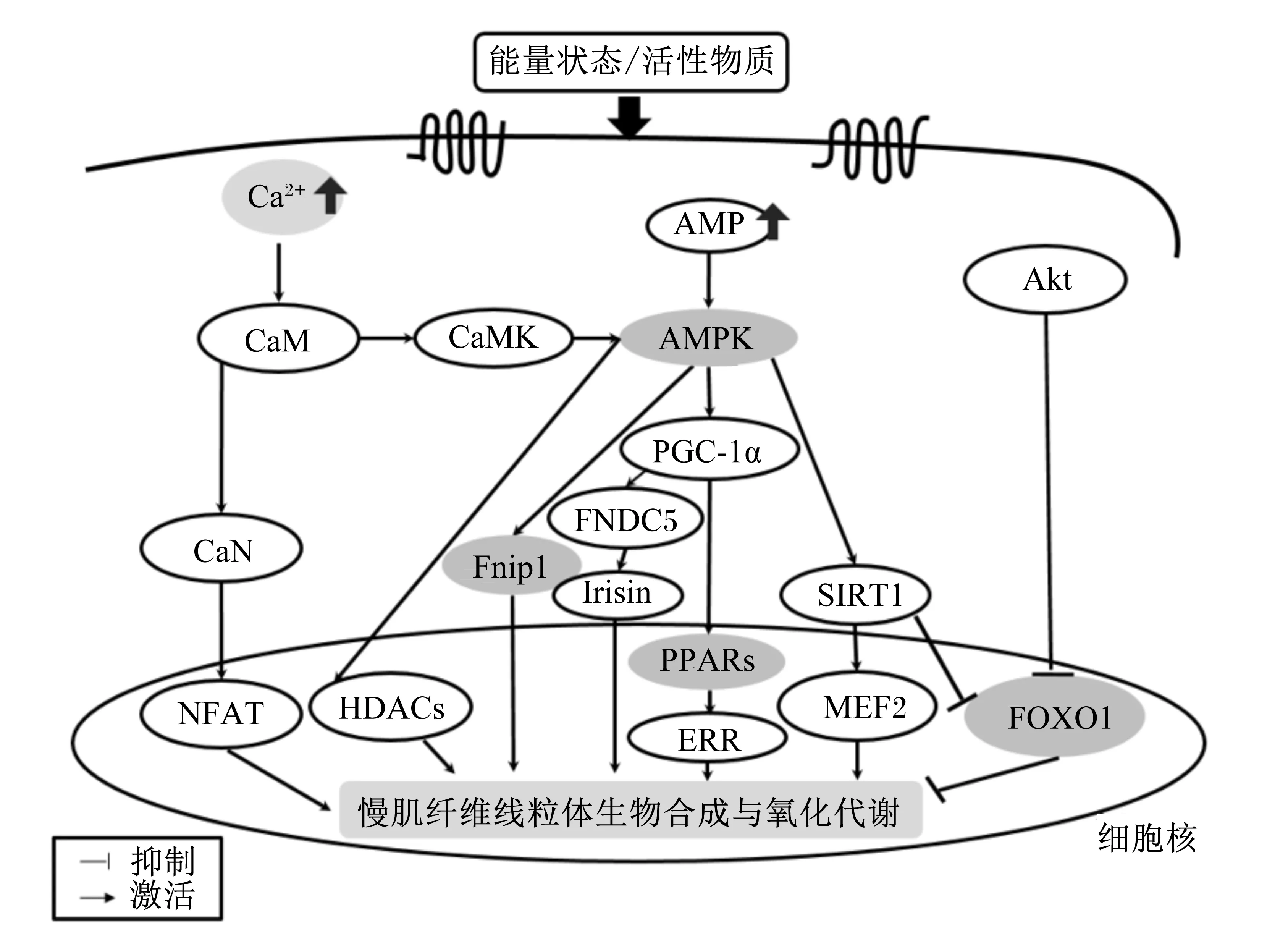
CaM:钙调素 calmodulin;CaMK:钙调素依赖性蛋白激酶 calmodulin dependent protein kinase; AMPK:腺苷酸活化蛋白激酶 AMP-activated protein kinase;SIRT1:沉默信息调节因子1 silent information regulator 1;PGC-1α:过氧化物酶受体增殖激活受体γ辅助激活因子-1α peroxisome proliferator-activated receptor γ co-activator 1α;MEF2:肌细胞特异性增强结合因子2 myocyte-specific enhancer-binding factor 2;CaN:钙调磷酸酶 calcineurin;NFAT:T细胞核因子 nuclear factor of activated T cells;HDACs:组蛋白脱乙酰酶 histone deacetylases;Fnip1:卵泡素互作蛋白1 folliculin interacting protein-1;FNDC5:纤维连结蛋白Ⅲ型域包含蛋白5 fiber links protein Ⅲ domain contains 5;Irisin:鸢尾素;FoxO1:叉头框转录因子O亚族1 forkhead box transcription factor O1;Akt:蛋白激酶B protein kinase B;PPARs:过氧化物酶体增殖剂激活受体peroxisome proliferators-activated receptors;ERR:雌激素相关受体 estrogen-related receptor。
图1 骨骼肌纤维类型转化信号通路图
Fig.1 Signaling pathways of skeletal muscle fiber transition[5]
1.2 Ca2+/钙调磷酸酶(CaN)/钙调素依赖性蛋白激酶(CaMK)信号通路
在骨骼肌中,Ca2+依赖的转运途径对肌纤维转化起着重要的作用,可以通过激活转录因子,调节线粒体核编码基因,使肌纤维发生类型转化[15]。激活转录因子CaN信号转导调节是重要的Ca2+依赖转运途径。钙调磷酸酶是一种依赖于Ca2+/钙调素(CaM)的丝氨酸/苏氨酸蛋白磷酸酶。肌纤维出现动作电位时,肌纤维内Ca2+含量持续增加,与CaM结合并激活CaN,进而使T细胞核因子(nuclear factor of activated T cells,NFAT)去磷酸化,移位进入细胞核,与靶基因结合,促进慢肌纤维基因的表达[16]。运动可以通过调节CaN信号影响肌纤维的转化。吴金富[17]发现载负荷离心运动可激活Ca2+,并通过CaN调节肌纤维的转化。小鼠敲除CaN基因,Ⅰ型肌纤维比例下降,而CaN基因过表达,骨骼肌中Ⅰ、Ⅱa型肌纤维比例升高[18]。McCullagh等[19]发现NFAT促进了慢肌纤维基因的表达,抑制快肌纤维基因的表达。CaMK可被细胞内升高的Ca2+激活,引起肌纤维类型转化。当进行力量运动时,体内CaMKⅡ活性升高,并随着运动强度增加而升高,表明Ca2+/CaMK参与肌纤维类型的转化,其调控路径为激活的CaMK与组蛋白脱乙酰酶(histone deacetylases,HDACs)作用后,HDACs转移至细胞核质内,使MEF2活化,诱导慢肌纤维基因表达[18-20]。CaMKⅡ也作为AMPK上游信号分子调节小鼠肌肉的氧化代谢能力[21]。
1.3 其他重要调控因子
1.3.1 卵泡素互作蛋白1(folliculin interacting protein-1,Fnip1)
Fnip1是在体内与卵泡素相互作用的一种蛋白质。Baba等[22]研究发现在肾脏细胞中,Fnip1可被AMPK磷酸化,加入AMPK抑制剂后,其磷酸化水平降低,推测Fnip1可能与AMPK参与的能量感知相关。在此基础上,Park等[23]发现与野生型小鼠相比,Fnip1基因缺失的小鼠前B细胞AMPK水平增加,且与AMPK相关线粒体代谢基因和葡萄糖摄取增加,表明在前B细胞中,Fnip1作为AMPK下游物质对代谢应激后代谢平衡的维持十分重要。同时,Park等[23]发现Fnip1在骨骼肌中表达水平较高。Reyes等[24]发现在骨骼肌细胞中,Fnip1基因缺失导致线粒体氧化磷酸化水平增加,线粒体功能增强,氧化型肌纤维增加,肌纤维类型发生转化。Fnip1可能通过直接或间接途径调控AMPK,从而调节线粒体生物合成与肌纤维类型。
1.3.2 叉头框转录因子O亚族1(FoxO1)
FoxO1是FoxO家族中主要的调控因子,受多种磷酸化激酶调控,在成肌细胞增殖分化及肌纤维类型转化中发挥重要作用。Schachter等[25]发现FoxO1受磷酸化的蛋白激酶B(Akt)调节。在骨骼肌中,禁食期间FoxO1可调节碳水化合物分解以提供能量[26]。Kamei等[27]发现转入人类FoxO1基因的小鼠表现为肌肉体积、重量降低,且肌肉颜色发白。史新娥等[28]发现通过shRNA干扰FoxO1表达促进猪成肌细胞中MyHCⅠ的表达,与张辉等[29]研究发现FoxO1抑制猪骨骼肌MyHCⅠ的表达结果一致。急速或慢速偏心运动会改变快骨外肌浅区FoxO1 mRNA的表达水平,进而改变肌纤维类型[30]。
1.3.3 过氧化物酶体增殖激活受体(PPARs)
PPARs是在转录水平调节基因表达的一类核内受体。Wang等[31]发现小鼠灌胃PPARδ激动剂后,线粒体合成增加,且Ⅰ型肌纤维含量增加,表明PPARδ可能是肌纤维转化过程中的关键分子。Luquet等[32]发现骨骼肌中超表达PPARδ,能够促进肌纤维由Ⅱ型向Ⅰ型肌纤维转变,并使骨骼肌氧化代谢能力增强。耐力训练使PPARγ和PGC-1α在不同肌纤维类型中有不同水平的升高,可能与改变肌纤维中线粒体含量和氧化类型有关[33]。Schuler等[34]敲除小鼠PPARβ发现肌纤维氧化能力下降,PPARβ同时刺激PGC-1α表达。PPARγ可能与PGC-1α由于蛋白之间的相互作用而被激活[35]。PPARs与雌激素相关受体(estrogen-related receptor,ERR)直接或间接作用促进慢肌纤维表达[36]。
2 肌纤维类型转化的营养调控措施
2.1 天然植物提取物
天然植物提取物中常含有多种多酚类物质,多酚类物质能够提高骨骼肌AMPK磷酸化程度,进而促进PGC-1α磷酸化并活化,推测天然植物提取物可能通过调节AMPK途径调控肌纤维类型的转化[37]。饲粮添加杜仲多酚提取物,猪背最长肌中Ⅰ型肌纤维相关基因的表达水平显著升高,而Ⅱb型肌纤维的表达水平显著降低[38]。小鼠灌服红景天苷和红景天能够促进快肌纤维向慢肌纤维的转化[39]。小鼠饲粮中添加5%苹果多酚能提高肌肉中慢肌纤维的比例,随后试验表明,0.5%的添加量也能促进慢肌纤维的形成[40-41]。Murase等[42]研究发现小鼠饲粮中添加富含多酚的绿茶提取物提高肌肉力耐受力和氧化能力。王丽娜等[43]在育肥猪饲粮中添加表没食子儿茶素没食子酸酯反而导致Ⅰ型肌纤维含量减少,AMPK表达量降低,且PGC-1α表达量受到抑制,这可能与提取物的种类以及添加量有关。
2.2 能量与粗蛋白质水平
饲粮中能量和粗蛋白质水平与来源可调节肌纤维类型的组成。Harrison等[44]发现,营养不良对3~7周龄猪背最长肌中各类型肌纤维的含量无影响,但显著提高菱形肌中Ⅰ型肌纤维的比例,推测营养水平可能对不同部位肌纤维转化的影响不一致,表现出组织部位的特异性。Lefaucheur[45]研究发现,仔猪营养不良导致背最长肌Ⅱb型肌纤维的比例显著升高,而Ⅱa型肌纤维的比例显著降低,相反限饲可使肌肉中的Ⅰ型肌纤维比例显著增加。Li等[46]研究发现饲粮不同能量来源影响育肥猪肌纤维类型,低淀粉、高脂和高纤维饲粮组Ⅰ型和Ⅱa型肌纤维增加,Ⅱx和Ⅱb型肌纤维减少,表明低淀粉高纤维饲粮能减少酵解型肌纤维的比例,提高育肥猪的肉质。孙相俞[47]发现,与低能量组相比,高能量组肌肉中Ⅱa和Ⅱx型肌纤维比例增加,Ⅱb型肌纤维比例降低。陈佳[48]研究发现,饲粮粗蛋白质水平越高,杜约八三元杂交猪肌纤维直径越粗;Li等[49]发现,饲粮粗蛋白质水平由16%降低至13%,生长育肥猪背最长肌和腰大肌Ⅱa型肌纤维及股二头肌Ⅰ型肌纤维的比例显著增加;杨飞云等[50]则在试验中发现营养水平对荣昌猪和杜长大三元杂交猪背最长肌中肌纤维类型的组成无显著影响,推测研究结果的差异可能与猪品种和生长阶段有关。此外,蛋白质的来源也会影响肌纤维类型相关基因的表达,牛肉提取物促进小鼠趾长伸肌慢肌纤维基因的表达,而鱼蛋白则降低小鼠比目鱼肌PGC-1α含量和Ⅰ型肌纤维基因的表达量[51-52]。AMPK作为机体内重要的能量感受器,调控细胞能量的输出,饲粮能量和粗蛋白质水平均会导致肌纤维类型组成的改变,可能与能量感受网络中AMPK的调节作用有关。
2.3 不饱和脂肪酸
最新的研究表明,脂肪中脂肪酸的组成与比例也影响肌纤维类型的转化。任阳[53]发现不饱和脂肪酸促进小鼠Ⅰ型肌纤维基因的表达,并推测可能与AMPK通路有关。妊娠后期和哺乳期饲粮中添加不饱和脂肪酸可通过母体效应促进后代哺乳仔猪肌肉组织中相关基因的表达,提高仔猪氧化型肌纤维的比例[53]。不饱和脂肪酸处理肌细胞后,AMPK基因表达量显著上调,推测不饱和脂肪酸促进氧化型肌纤维的形成可能与AMPK信号通路的激活相关[53]。不饱和脂肪酸的种类对肌纤维类型的转化也有一定的影响。田春庄[54]发现n-3家族不饱和脂肪酸添加能促进猪肌肉组织Ⅰ和Ⅱa型肌纤维相关基因的表达,从而改善肌纤维类型组成。与饲喂富含n-6多不饱和脂肪酸的大豆油相比,饲粮中添加富含n-3多不饱和脂肪酸的鱼油显著增加小鼠趾长伸肌Ⅱx型肌纤维的比例,而显著降低Ⅱb型肌纤维的比例[55]。
3 小 结
肌纤维转化受多种信号通路及调控因子的影响,营养因素对肌纤维的转化有着不同程度的调节作用。近年来,除了对诱导成肌纤维细胞转化的研究不断深入之外,对诱导肌卫星细胞定向分化从而调控肌纤维类型的研究也一直在进行。对肌卫星细胞全基因组时序表达谱检测发现,肌卫星细胞始终参与肌肉干细胞的形成和功能的维持[56]。肌卫星细胞可分化为不同的亚群,包括快肌亚群、慢肌亚群和可转化亚群[57]。正常生理条件下,肌卫星细胞在基膜和基底膜之间处于静息状态,当机体状态发生改变,肌卫星细胞在细胞因子的刺激下进入细胞周期,形成新的成肌纤维细胞[58]。控制肌卫星细胞的定向分化,为调控肌纤维类型的转化提供了一个新的研究方向。肌纤维类型转化研究工作的深入开展,为畜牧养殖领域的精准饲养和畜禽肉品质的靶向营养调控奠定理论基础,也为人类肌病的治疗方案提供参考借鉴。
[1] ASHMORE C R,DOERR L.Comparative aspects of muscle fiber types in different species[J].Experimental Neurology,1971,31(3):408-418.
[2] LISTRAT A,LEBRET B,LOUVEAU I,et al.How Muscle structure and composition influence meat and flesh quality[J].Scientific World Journal,2016,2016:3182746.
[3] PICARD B,LEFAUCHEUR L,BERRI C,et al.Muscle fibre ontogenesis in farm animal species[J].Reproduction Nutrition Development,2002,42(5):415-431.
[4] PETTE D,STARON R S.Transitions of muscle fiber phenotypic profiles[J].Histochemistry and Cell Biology,2001,115(5):359-372.
[5] HOPPELER H.Molecular networks in skeletal muscle plasticity[J].Journal of Experimental Biology,2016,219(2):205-213.
[6] SUWA M,NAKANO H,KUMAGAI S.Effects of chronic AICAR treatment on fiber composition,enzyme activity,UCP3,and PGC-1 in rat muscles[J].Journal of Applied Physiology,2003,95(3):960-968.
[7] 文超越,段叶辉,李颖慧,等.能量感应网络AMPK/SIRT1/PGC-lα对骨骼肌纤维类型转化调节[J].动物营养学报,2016,28(1):57-63.
[8] LIN J D,WU H,TARR P T,et al.Transcriptional co-activator PGC-1α drives the formation of slow-twitch muscle fibres[J].Nature,2002,418(6899):797-801.
[9] ARANY Z,LEBRASSEUR N,MORRIS C,et al.The transcriptional coactivator PGC-1β drives the formation of oxidative type ⅡX fibers in skeletal muscle[J].Cell Metabolism,2007,5(1):35-46.
[10] 于亮,张鹏,王瑞元,等.PGC-1α对骨骼肌肌纤维类型及运动能力的调控作用[J].生理科学进展,2013,44(1):59-62.
[12] CHALKIADAKI A,IGARASHI M,NASAMU A S,et al.Muscle-specific SIRT1 gain-of-function increases slow-twitch fibers and ameliorates pathophysiology in a mouse model of duchenne muscular dystrophy[J].PLoS Genetics,2014,10(7):e1004490.
[13] WALTERS E H,STICKLAND N C,LOUGHNA P T.MRF-4 exhibits fiber type- and muscle-specific pattern of expression in postnatal rat muscle[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2000,278(5):R1381-R1384.
[14] 刘蓓蓓,卢健.SIRT1对肌卫星细胞和骨骼肌再生的影响[J].中国运动医学杂志,2013,32(3):275-280,274.
[15] CHIN E R.Role of Ca2+/calmodulin-dependent kinases in skeletal muscle plasticity[J].Journal of Applied Physiology,2005,99(2):414-423.
[16] SWOAP S J,HUNTER R B,STEVENSON E J,et al.The calcineurin-NFAT pathway and muscle fiber-type gene expression[J].American Journal of Physiology:Cell Physiology,2000,279(4):C915-C924.
[17] 吴金富.Ca2+/CaN途径在悬吊再负荷大鼠肌纤维类型转化中的作用[D].硕士学位论文.北京:北京体育大学,2010:42-47.
[18] 贾安峰,冯京海,张敏红.调控骨骼肌肌纤维类型转化的因素及机制[J].动物营养学报,2014,26(5):1151-1156.
[19] MCCULLAGH K J A,CALABRIA E,PALLAFACCHINA G,et al.NFAT is a nerve activity sensor in skeletal muscle and controls activity-dependent myosin switching[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(29):10590-10595.
[20] 张楠.运动对AMPK不同基因型小鼠骨骼肌PGC1-MEF2的影响[D].硕士学位论文.北京:北京体育大学,2011:26-31.
[21] RANEY M A,TURCOTTE L P.Evidence for the involvement of CaMKⅡ and AMPK in Ca2+-dependent signaling pathways regulating FA uptake and oxidation in contracting rodent muscle[J].Journal of Applied Physiology,2008,104(5):1366-1373.
[22] BABA M,HONG S B,SHARMA N,et al.Folliculin encoded by theBHDgene interacts with a binding protein,FNIP1,and AMPK,and is involved in AMPK and mTOR signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(42):15552-15557.
[23] PARK H,STAEHLING K,TSANG M,et al.Disruption ofFnip1 reveals a metabolic checkpoint controlling B lymphocyte development[J].Immunity,2012,36(5):769-781.
[24] REYES N L,BANKS G B,TSANG M,et al.Fnip1 regulates skeletal muscle fiber type specification,fatigue resistance,and susceptibility to muscular dystrophy[J].Proceedings of the National Academy of Sciences of the United States of America,2014,112(2):424-429.
[25] SCHACHTER T N,SHEN T S,LIU Y G,et al.Kinetics of nuclear-cytoplasmic translocation of FoxO1 and FoxO3A in adult skeletal muscle fibers[J].American Journal of Physiology:Cell Physiology,2012,303(9):C977-C990.
[26] KOUSTENI S.FoxO1,the transcriptional chief of staff of energy metabolism[J].Bone,2012,50(2):437-443.
[27] KAMEI Y,MIURA S,SUZUKI M,et al.Skeletal muscle FoxO1 (FKHR) transgenic mice have less skeletal muscle mass,down-regulated type Ⅰ (slow twitch/red muscle) fiber genes,and impaired glycemic control[J].Journal of Biological Chemistry,2004,279(39):41114-41123.
[28] 史新娥,郑雪莉,刘月光,等.慢病毒介导shRNA干扰FoxO1促进猪成肌细胞中MyHCⅠ的表达[J].中国生物化学与分子生物学报,2011,27(6):582-588.
[29] 张辉,史新娥,袁媛,等.FoxO1抑制猪骨骼肌MyHCⅠ的表达[J].中国生物化学与分子生物学报,2010,26(3):283-289.
[30] AZAD M,KHALEDI N,HEDAYATI M.Effect of acute and chronic eccentric exercise onFoxO1 mRNA expression as fiber type transition factor in rat skeletal muscles[J].Gene,2016,584(2):180-184.
[31] WANG Y X,ZHANG C L,YU R T,et al.Regulation of muscle fiber type and running endurance by PPARδ[J].PLoS Biology,2004,2(10):e294.
[32] LUQUET S,LOPEZ-SORIANO J,HOLST D,et al.Peroxisome proliferator-activated receptor δ controls muscle development and oxidative capability[J].The FASEB Journal,2003,17(15):2299-2301.
[33] RUSSELL A P,FEILCHENFELDT J,SCHREIBER S,et al.Endurance training in humans leads to fiber type-specific increases in levels of peroxisome proliferator-activated receptor-γ coactivator-1 and peroxisome proliferator-activated receptor-α in skeletal muscle[J].Diabetes,2003,52(12):2874-2881.
[34] SCHULER M,ALI F,CHAMBON C,et al.PGC1αexpression is controlled in skeletal muscles by PPARβ,whose ablation results in fiber-type switching,obesity,and type 2 diabetes[J].Cell Metabolism,2006,4(5):407-414.
[35] JUNG S,KIM K.Exercise-induced PGC-1α transcriptional factors in skeletal muscle[J].Integrative Medicine Research,2014,3(4):155-160.
[36] GAN Z J,RUMSEY J,HAZEN B C,et al.Nuclear receptor/microRNA circuitry links muscle fiber type to energy metabolism[J].The Journal of Clinical Investigation,2013,123(6):2564-2575.
[37] VACCA R A,VALENTI D,CACCAMESE S,et al.Plant polyphenols as natural drugs for the management of down syndrome and related disorders[J].Neuroscience & Biobehavioral Reviews,2016,71:865-877.
[38] 周艳.杜仲叶多酚提取物对猪肉品质及绿原酸缓解肝——肠损伤研究[D].博士学位论文.南昌:南昌大学,2015:33-34.
[39] 于亮,陈晓萍,王瑞元.4周红景天、红景天苷灌胃对小鼠骨骼肌纤维类型的影响及机制[J].北京体育大学学报,2014(6):54-58.
[40] MIZUNOYA W,MIYAHARA H,OKAMOTO S,et al.Improvement of endurance based on muscle fiber-type composition by treatment with dietary apple polyphenols in rats[J].PLoS One,2015,10(7):e0134303.
[41] MIZUNOYA W,OKAMOTO S,MIYAHARA H,et al.Fast-to-slow shift of muscle fiber-type composition by dietary apple polyphenols in rats:impact of the low-dose supplementation[J].Animal Science Journal,2016,doi:10.1111/asj.12655.
[42] MURASE T,HARAMIZU S,SHIMOTOYODOME A,et al.Green tea extract improves endurance capacity and increases muscle lipid oxidation in mice[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2005,288(3):R708-R715.
[43] 王丽娜,王珍,彭建龙,等.表没食子儿茶素没食子酸酯对育肥猪骨骼肌纤维类型的影响[J].畜牧兽医学报,2016,47(8):1581-1591.
[44] HARRISON A P,ROWLERSON A M,DAUNCEY M J.Selective regulation of myofiber differentiation by energy status during postnatal development[J].The American Journal of Physiology,1996,270(3 Pt 2):R667-R674.
[45] LEFAUCHEUR L.A second look into fibre typing-relation to meat quality[J].Meat Science,2010,84(2):257-270.
[46] LI Y J,LI J L,ZHANG L,et al.Effects of dietary energy sources onPostmortemglycolysis,meat quality and muscle fibre type transformation of finishing pigs[J].PLoS One,2015,10(6):E0131958.
[47] 孙相俞.不同品种和营养水平对猪肌纤维类型和胴体肉质性状的影响[D].硕士学位论文.雅安:四川农业大学,2009:31-32
[48] 陈佳.日粮蛋白水平对杜约八三元杂交猪生长性能和肉质性状的影响[D].硕士学位论文.杨凌:西北农林科技大学,2016:25-26.
[49] LI Y H,LI F N,WU L,et al.Effects of dietary protein restriction on muscle fiber characteristics and mTORC1 pathway in the skeletal muscle of growing-finishing pigs[J].Journal of Animal Science and Biotechnology,2016,7(1):47.
[50] 杨飞云,陈代文,黄金秀,等.猪背最长肌肌纤维类型的发育性变化及品种与营养影响特点[J].畜牧兽医学报,2008,39(12):1701-1708.
[51] KAWABATA F,MIZUSHIGE T,UOZUMI K,et al.Fish protein intake induces fast-muscle hypertrophy and reduces liver lipids and serum glucose levels in rats[J].Bioscience,Biotechnology,and Biochemistry,2015,79(1):109-116.
[52] YOSHIHARA H,WAKAMATSU J,KAWABATA F,et al.Beef extract supplementation increases leg muscle mass and modifies skeletal muscle fiber types in rats[J].Journal of Nutritional Science and Vitaminology,2006,52(3):183-193.
[53] 任阳.饱和与不饱和脂肪酸对猪肌纤维组成的影响及其AMPK途径研究[D].博士学位论文.杭州:浙江大学,2014:95.
[54] 田春庄.鱼油上调断奶仔猪肌纤维类型及相关基因表达促进肌肉生长的研究[D].硕士学位论文.武汉:华中农业大学,2008:55.
[55] MIZUNOYA W,IWAMOTO Y,SHIROUCHI B,et al.Dietary fat influences the expression of contractile and metabolic genes in rat skeletal muscle[J].PLoS One,2013,8(11):e80152.
[56] ALONSO-MARTIN S,ROCHAT A,MADEMTZOGLOU D,et al.Gene expression profiling of muscle stem cells identifies novel regulators of postnatal myogenesis[J].Frontiers in Cell and Developmental Biology,2016,4:58.
[57] SCHULTZ E.Satellite cell behavior during skeletal muscle growth and regeneration[J].Medicine and Science in Sports and Exercise,1989,21(Suppl.5):S181-S186.
[58] HONG Y,PAN Y,EBNER P D.Meat science and muscle biology symposium:development of bacteriophage treatments to reduceEscherichiacoliO157∶H7 contamination of beef products and produce[J].Journal of Animal Science,2014,92(4):1366-1377.
*Corresponding author, associate professor, E-mail: lifengna@isa.ac.cn
(责任编辑 田艳明)
Progress in Molecular Signaling Pathway of Skeletal Muscle Fiber Type Transformation and Its Nutritional Regulation
GUO Qiuping1,2WEN Chaoyue1,3WANG Wenlong1,3DUAN Yehui1,2LI Yinghui1,2LI Fengna1,4*
(1.KeyLaboratoryofAgro-EcologicalProcessesinSubtropicalRegion,NationalEngineeringLaboratoryforPollutionControlandWasteUtilizationinLivestockandPoultryProduction,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,Changsha410125,China; 2.GraduateUniversityofChineseAcademyofSciences,Beijing100049,China; 3.LaboratoryofAnimalNutritionandHumanHealth,CollegeofLifeScience,HunanNormalUniversity,Changsha410006,China; 4.HunanCollaborativeInnovationCenterforProductsSafetyofLivestockandPoultry,Changsha410128,China)
Skeletal muscle is made up of different types of muscle fibers which characterized by the myosin heavy chain isoform composition and consists of up to four main types: Ⅰ, Ⅱa, Ⅱx and Ⅱb. The composition of muscle fiber type in skeletal muscle influences the meat quality after animal slaughter. The skeletal muscle fiber type transformation can be regulated by different signaling pathways and regulatory factorsinvivoand also by nutritional factors in diet. This review summarized the underlying signaling pathways and certain nutritional factors, for reference in understanding of improving meat quality through nutritional intervention.[ChineseJournalofAnimalNutrition, 2017, 29(6):1836-1842]
skeletal muscle; muscle fiber type transformation; signaling pathway; nutritional regulation; meat quality
10.3969/j.issn.1006-267x.2017.06.002
2016-12-14
湖南省重大专项(2015NK1002);湖南省重点研发计划(2016NK2170);湖南省自然科学基金面上项目(S2014J504I);中国科学院青年创新促进会项目(2016326)
郭秋平(1992—),女,山东济宁人,博士研究生,从事分子营养与肉品质调控研究。E-mail: gqp9210@163.com
*通信作者:李凤娜,副研究员,E-mail: lifengna@isa.ac.cn
S811
A
1006-267X(2017)06-1836-07
