响应曲面法优化微波辅助提取人参须根粉中人参皂苷Rg5的工艺研究
2017-06-23郭丹丹成乐琴甘凤琴于秀茹
郭丹丹,成乐琴,*,李 玲,甘凤琴,于秀茹
(1.吉林化工学院化学与制药工程学院,吉林吉林 132022;2.通化百奥金森生物科技有限公司,吉林通化 134000)
响应曲面法优化微波辅助提取人参须根粉中人参皂苷Rg5的工艺研究
郭丹丹1,成乐琴1,*,李 玲2,甘凤琴2,于秀茹1
(1.吉林化工学院化学与制药工程学院,吉林吉林 132022;2.通化百奥金森生物科技有限公司,吉林通化 134000)
为直接提取制备人参须根粉中的人参皂苷Rg5,实现一步法直接制备人参皂苷Rg5,以解决提取时间长、得率低的问题。在单因素实验基础上,采用响应曲面法优化微波辅助提取制备人参皂苷Rg5的工艺。研究了提取功率、提取液酸浓度、固液比和提取时间4个因素及其相互作用对人参皂苷Rg5得率的影响。利用高效液相色谱法对人参皂苷Rg5进行定量分析。实验结果表明,对人参皂苷Rg5得率的影响次序为提取液酸浓度>提取功率>固液比>提取时间;人参皂苷Rg5的最佳提取工艺条件为:提取功率500 W,提取液酸浓度0.12 mol·L-1,固液比1∶42 (g·mL-1),提取时间9 min,人参皂苷Rg5得率可达到3.14%,表明该方法可有效提取人参须根粉中人参皂苷Rg5。
人参皂苷Rg5,微波,提取,响应曲面法,人参须根粉
人参是五加科人参属(PanaxginsengC.A,Mey)草本植物,在我国作为名贵的中草药,已有上千年的药用历史。人参具有补脾益肺、生津止渴、安神益智等功效[1]。人参中含有多种有效成分,如人参皂苷、多糖、氨基酸、黄酮等,而人参皂苷被认为是人参的主要活性成分[2],具有提高免疫力[3]、抗肿瘤[4]和保护心血管系统[5-6]等药效。但是人参皂苷通常以大分子形式存在且在人参中的含量较低,直接服用人参的药效并不显著,因此需要通过结构修饰、提取、富集等手段来制备次级稀有人参皂苷,增大稀有皂苷浓度从而提高药效。
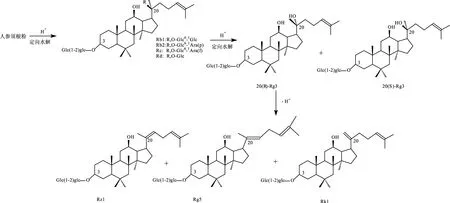
图1 人参须根粉中人参皂苷Rg5的转化途径Fig.1 Conversion pathway of ginsenoside Rg5 in GFRP
人参皂苷Rg5是红参中特有的极其微量的次级稀有人参皂苷,具有改善记忆、抗癌、抗肿瘤、益智活性等功效[7-9],人参须根粉中人参皂苷Rg5的转化途径见图1[10]。目前关于人参皂苷Rg5的制备方法主要是蒸制法,即将鲜参通过长时间的高温蒸制成红参而得到,这种方法不仅时间长,而且提取效率低[11-13]。关大鹏等[10]通过高温热裂解人参茎叶皂苷制备人参皂苷Rg5,其产率为13.17%,Soo Kyung Jo等[14]将白参于98 ℃下蒸75 h后,分离得到人参皂苷Rg5,其得率为1.756%。金银萍等[15]通过从红参的甲醇提取物中分离得到人参皂苷Rg5,其产率仅为0.012%。
微波辅助提取技术是利用不同结构的物质对微波吸收能力的差异,使物质中的部分组分被选择性加热,溶于提取剂中而被分离[16]。微波辅助提取技术综合了传统的溶剂提取技术和微波技术的优点,具有反应时间短、提取效率高、溶剂用量少、选择性高等特点,适用于热稳定性的皂苷类化合物的提取[17]。目前该方法被广泛应用于天然产物有效成分的提取,然而针对于人参皂苷Rg5的提取鲜有报道。
因此,本文以人参须根粉为原料,盐酸为催化剂,通过微波辅助提取的方式直接从人参须根粉中提取人参皂苷Rg5,以达到缩短提取时间,提高提取效率的目的;并通过响应曲面法对微波辅助提取人参皂苷Rg5的提取工艺进行优化,得到微波辅助提取人参皂苷Rg5最佳工艺条件。
1 材料与方法
1.1 材料与仪器
人参须根粉 吉林省通化彩森仁生物有限公司提供;乙腈 瑞典欧普森公司提供;甲醇 天津大茂化学试剂有限公司提供,为色谱纯试剂;正丁醇等试剂均为分析纯试剂 天津大茂化学试剂有限公司提供;对照品Rg5批号 MUST-15051917 成都曼斯特公司,纯度≥98%。
高效液相色谱仪 大连依利特分析仪器有限公司;ODS色谱柱 月旭材料科技(上海)有限公司;P230P高压恒流泵;UV230+紫外-可见检测器;AT-350 Column Heater;EC-2000 LU工作站);XH-300UL电脑微波超声波紫外光组合催化合成仪 北京祥鹄科技发展有限公司;H2050R型高速离心机 湖南湘仪实验室仪器开发有限公司;RE-2000A型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 HPLC分析 参考文献[18]的方法,条件如下:ODS(250 mm×4.6 mm,5 μm)色谱柱检测波长为203 nm,进样量20 μL,柱温35 ℃,流速1 mL·min-1,流动相为乙腈(A)-水(B)。梯度洗脱程序为:0~10 min,22% A;10~20 min,22%~27% A;20~25 min,27%~31% A;25~45 min,31%~38% A;45~60 min,38%~52% A;60~65 min,52% A;65~75 min,52%~55% A;75~82 min,55%~60% A;82~82.10 min,60%~90% A;82.10~100 min,90% A;100~100.10 min,90%~22% A;100.10~115 min,22% A。
1.2.2 人参皂苷Rg5标准曲线的绘制 准确称取人参皂苷Rg5标准品5.244 mg于10 mL容量瓶中,加色谱纯甲醇定容到10 mL。分别移取0.05、0.5、1、2.5 mL上述标准品溶液并用色谱纯甲醇定容至10 mL,配制成不同已知浓度的标准品贮备液,摇匀后静置,进行HPLC定量分析。
1.2.3 人参皂苷Rg5供试品溶液的制备 准确称取0.5 g人参须根粉(100目)于100 mL三口烧瓶中,按照预设的提取条件进行人参皂苷Rg5的提取。提取结束后提取液冷却,调pH6~7,离心8000 r/min,5 min,上清液转移至100 mL圆底烧瓶,固体加入10 mL水饱和正丁醇萃取一次,合并有机相。有机相浓缩至干,加80 mL色谱纯甲醇溶解,用0.45 μm滤膜过滤后,在“1.2.1”项色谱条件下进行HPLC分析。
1.2.4 人参皂苷Rg5得率的计算方法 取适量供试品溶液,在“1.2.1”项条件下进行HPLC定量分析,并带入人参皂苷Rg5标准曲线计算样品中人参皂苷Rg5浓度(X μg/mL)。带入下面方程计算人参皂苷Rg5得率:

式(1)
1.2.5 单因素实验 采用“1.2.3”项方法提取人参须根粉中的人参皂苷Rg5。提取条件为:准确称取人参须根粉0.5 g,固定提取功率400 W,固液比1∶35 (g·mL-1),提取液酸浓度0.07 mol·L-1,提取时间10 min,考察乙醇浓度50%、60%、70%、80%、90%对人参皂苷Rg5得率的影响;准确称取人参须根粉0.5 g,固定乙醇浓度70%,固液比1∶35 (g·mL-1),提取液酸浓度0.07 mol·L-1,提取时间10 min,考察提取功率200、300、400、500、600 W;准确称取人参须根粉0.5 g,固定乙醇浓度70%,提取功率400 W,固液比1∶35 (g·mL-1),提取时间10 min的条件下,考察提取液酸浓度为0.05、0.07、0.09、0.11、0.13 mol·L-1;准确称取人参须根粉0.5 g,固定乙醇浓度70%,提取功率400 W,提取液酸浓度0.11 mol·L-1,提取时间10 min,考察固液比1∶25、1∶35、1∶45、1∶55、1∶65 (g·mL-1);准确称取人参须根粉0.5 g,固定乙醇浓度70%,提取功率400 W,提取液酸浓度0.11 mol·L-1,固液比1∶35 (g·mL-1),考察提取时间7、10、13、16、19 min,进行单因素实验,考察各因素对人参皂苷Rg5得率的影响。
1.2.6 响应曲面法优化实验 在单因素实验基础上,以提取功率(A)、提取液酸浓度(B)、固液比(C)和提取时间(D)为考察因素,以人参皂苷Rg5的得率为考察目标,运用Design-Expert.V8.0.6软件,优化微波辅助提取人参须根粉中人参皂苷Rg5的提取工艺,响应面因素水平表见表1。

表1 Box-Behnken design实验设计因素及水平 Table 1 Factors and levels of Box-Behnken design
1.3 数据统计分析

2 结果与分析
2.1 标准曲线的绘制
在“1.2.1”项色谱条件下进行HPLC分析,制作人参皂苷Rg5的标准曲线,得到峰面积Y和人参皂苷Rg5浓度X之间的线性回归方程及线性范围为:YRg5=14.185X+40.192(7.925 ~ 264.767 μg·mL-1,r=0.9999)。
2.2 方法学考察
2.2.1 精密度考察 人参皂苷Rg5供试品溶液经0.45 μm滤膜过滤后,在“1.2.1”项色谱条件下,重复测定6次,得人参皂苷Rg5峰面积RSD为1.03%(n=6)。
2.2.2 稳定性考察 取同一人参皂苷Rg5对照品溶液,在48 h内,每隔6 h,在“1.2.1”色谱条件下进样一次,测得人参皂苷Rg5峰面积RSD为0.93%,说明人参皂苷Rg5样品溶液在48 h内具有良好的稳定性。
2.2.3 重现性考察 按照“1.2.3”项方法进行5组平行实验制备人参皂苷Rg5样品溶液,并在“1.2.1”项色谱条件下进行定量分析,得到人参皂苷Rg5平均得率为1.78%,RSD为0.91%(n=5),表明该方法重现性良好。
2.2.4 加样回收率考察 准确称取已知人参皂苷Rg5含量的样品9份,按照“1.2.3”项下条件进行提取并定容。精确加入样品中人参皂苷Rg5含量的80%、100%、120%的对照品,在“1.2.1”色谱条件下测定,结果人参皂苷Rg5的回收率在99.41%~102.15%,平均回收率为100.58%,RSD为0.64%(n=9)。
2.3 单因素实验结果分析
2.3.1 乙醇浓度对人参皂苷Rg5得率的影响 由图2可知,随着乙醇浓度的增加,人参皂苷Rg5的得率呈现先增加后减小的趋势。这是由于适量的水有助于提取原料中的PPD皂苷,而适量的有机溶剂有利于PPD皂苷转化为人参皂苷Rg5,根据“相似相溶”原理,当乙醇浓度为70%时,人参皂苷Rg5的得率最高。因此,乙醇浓度以70%为宜。考虑乙醇浓度对人参皂苷Rg5得率的影响相对较小,因此不选做进一步优化条件。

图2 乙醇浓度对人参皂苷Rg5得率的影响Fig.2 Effect of ethanol concentration on extraction yield of ginsenoside-Rg5
2.3.2 提取功率对人参皂苷Rg5得率的影响 由图3可知,在选取功率范围内,人参皂苷Rg5的得率先增加后减小,功率过大可能导致人参皂苷Rg5结构的破坏,从而降低其得率。当提取功率为400 W时,人参皂苷Rg5的得率最高。因此,最佳提取功率以400 W为宜,并选择300~500 W做响应面优化实验。

图3 提取功率对人参皂苷Rg5得率的影响Fig.3 Effect of extraction power on extraction yield of ginsenoside-Rg5
2.3.3 提取液酸浓度对人参皂苷Rg5得率的影响 人参皂苷Rg5的制备需要经过人参须根粉→原人参二醇组皂苷→Rg3→Rg5的转化过程,而酸在此转化过程中起到催化作用。图4表明,随着酸浓度的增加,有利于原料中的PPD皂苷向人参皂苷Rg5转化,而酸浓度过大,会导致人参皂苷Rg5进一步水解。当提取液酸浓度为0.11 mol·L-1时,人参皂苷Rg5的得率最高。因此,提取液酸浓度以0.11 mol·L-1为宜,并选择0.09~0.13 mol·L-1做响应面优化实验。

图4 提取液酸浓度对人参皂苷Rg5得率的影响Fig.4 Effect of acid concentration of extraction solvent on extraction yield of ginsenoside-Rg5
2.3.4 固液比对人参皂苷Rg5得率的影响 由图5可知,随着固液比的增加,人参皂苷Rg5的得率先增加后减少,分析产生这种趋势的原因是由于随着提取剂用量的增加,提取剂中可溶解的皂苷含量一定,酸浓度一定,而提取剂中电离出的H+数增加,会导致生成的人参皂苷Rg5在酸性条件下进一步发生水解,使其得率减小。当固液比为1∶35 (g·mL-1)时,人参皂苷Rg5的得率最高。因此,固液比以1∶35 (g·mL-1)为宜,并选择1∶25~1∶45做进一步优化。

图5 固液比对人参皂苷Rg5得率的影响Fig.5 Effect of solid-liquid ratio on extraction yield of ginsenoside-Rg5
2.3.5 提取时间对人参皂苷Rg5得率的影响 由图6可知,提取开始阶段,由于体系中还不存在或只少量存在人参皂苷Rg5,使得人参皂苷Rg5生成速率大于人参皂苷Rg5的分解速率,因此提取刚开始随着提取时间的延长,人参皂苷Rg5的得率增加;当提取时间大于10 min后,原料中的二醇组皂苷含量降低,因此提取时间以10 min为宜,并选择7~13 min做进一步优化实验。
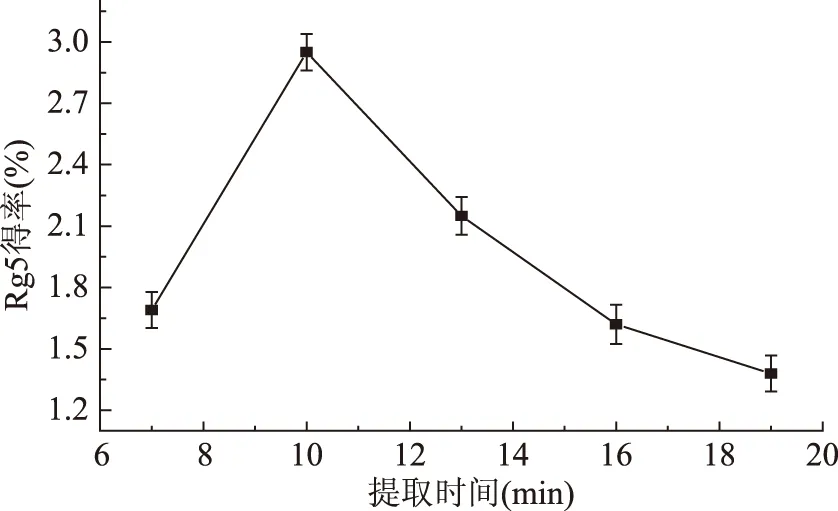
图6 提取时间对人参皂苷Rg5得率的影响Fig.6 Effect of extraction time on extraction yield of ginsenoside-Rg5
2.4 响应曲面法优化人参须根粉中人参皂苷Rg5的提取工艺
2.4.1 人参皂苷Rg5得率回归模型的建立和显著性检验 根据Box-Behnken design的中心组合实验设计实验方案,所得实验结果见表2,回归方差分析结果见表3。
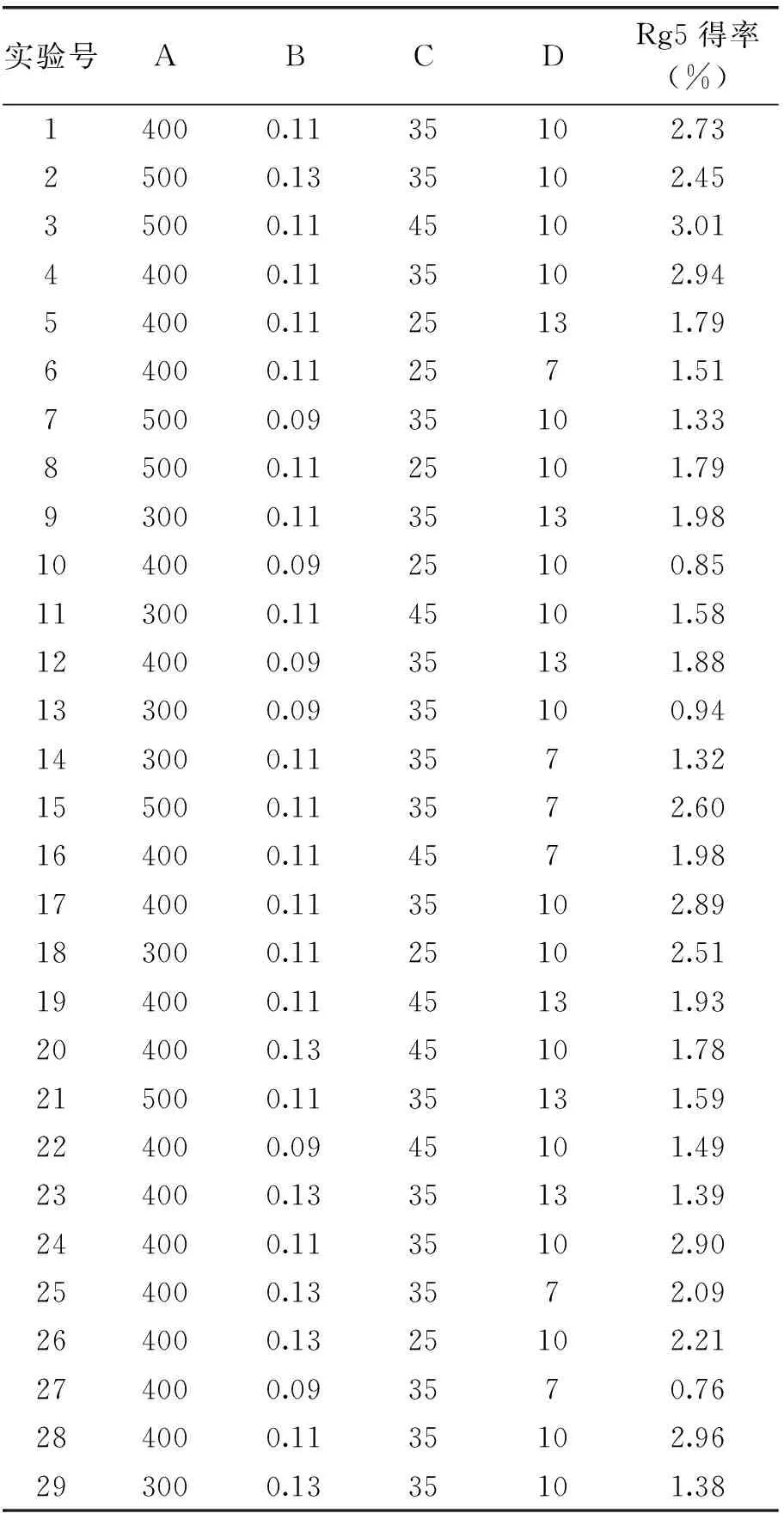
表2 实验设计及结果Table 2 Results of Box-Behnken design

表3 回归模型方差分析Table 3 The variance analysis of regression model
注:**为极显著(p<0.001);*为显著(p<0.05)。
将表3的实验数据利用ANOVA软件进行拟合,得到关于人参皂苷得率Y与提取功率等各因素之间的二阶多项式方程:
Y=0.288+0.26A+0.34B+0.093C+0.025D+0.17AB+0.54AC-0.42AD-0.27BC-0.45BD-0.083CD-0.39A2-0.88B2-0.39C2-0.60D2
式(2)

2.4.2 微波辅助提取人参须根粉中人参皂苷Rg5的响应曲面分析 为进一步研究提取功率、提取液酸浓度、固液比、提取时间及各因素之间的相互作用对人参皂苷Rg5得率的影响,根据二阶多项式方程做出响应面,结果见图7。

图7 各因素交互作用对人参须根粉中人参皂苷Rg5得率的影响Fig.7 The interaction of factors on the extraction yierld of ginsenoside Rg5 from ginseng fibrous root powder
由图7可直观看出各因素对人参皂苷Rg5得率的影响程度。提取液酸浓度对人参皂苷Rg5得率的影响较为显著,表现为曲线较陡;提取功率对人参皂苷Rg5得率有一定的影响,表现为曲线有一定的弯曲程度,而固液比和提取时间对人参皂苷Rg5的得率的影响较小,表现为曲线趋于平缓。
2.4.3 最佳提取工艺条件的确定及验证实验 运用Design-Expert.V8.0.6软件对人参皂苷Rg5的提取工艺进行优化,预测人参皂苷Rg5的最佳提取工艺条件为:提取功率500 W,提取液酸浓度0.12 mol·L-1,固液比1∶42.48 (g·mL-1),提取时间8.51 min,人参皂苷Rg5的最佳得率为3.16%。
为验证响应曲面法预测结果的可靠性,拟用实验中所得的最佳提取工艺重复验证实验。考虑到实际操作的便利,将最佳提取工艺条件进行修正,即提取功率500 W,提取液酸浓度0.12 mol·L-1,固液比1∶42 (g·mL-1),提取时间9 min。按照修正后的提取条件重复3次实验,得到人参皂苷Rg5的得率分别为3.12%、3.08%、3.19%,平均得率为3.14%(见图8),RSD值为1.53%,与理论值较为接近。本实验值是Soo Kyung Jo等[14]将白参于98 ℃下蒸75 h后,分离得到人参皂苷Rg5得率的1.80倍。因此,响应曲面法预测的最佳提取工艺准确可靠,具有实用价值。

图8 人参皂苷标准品及最佳条件下样品的HPLC谱图Fig.8 The HPLC chromatomap of ginsenoside standards and sample under the optimization condition注:A.人参皂苷标准品;B.样品。
3 结论
本文通过采用微波辅助法直接从人参须根粉中提取制备人参皂苷Rg5,在单因素实验基础上,采用RSM法优化了人参皂苷Rg5的提取工艺,建立回归模型方程,并通过响应曲面分析各因素及相互作用对人参皂苷Rg5得率的影响。各因素对人参皂苷Rg5得率的影响次序为提取液酸浓度>提取功率>固液比>提取时间;确定微波辅助提取人参须根粉中人参皂苷Rg5的最佳提取工艺条件,即提取功率500 W,提取液酸浓度0.12 mon·L-1,固液比1∶42 (g·mL-1),提取时间9 min,在最佳提取工艺条件下,人参皂苷Rg5的得率为3.14%。与传统提取方法相比,该方法大大提高了人参皂苷Rg5的提取效率,节省提取时间,弥补了传统方法中所存在的高温、时间长且得率低的缺点,为人参皂苷Rg5的制备提供了一种新的方法,同时为人参皂苷Rg5的药理活性研究提供了理论基础。
[1]窦德强,任杰,陈颖,等.商品人参根的化学成分研究[J].中国中药杂志,2003,28:522-524.
[2]张萍,张南平,肖新月,等.人参皂苷类成分的化学分析[J].药物分析杂志,2004,24:229-237.
[3]吴日辉.人参皂苷Rg3立体异构体对肝癌小鼠免疫功能影响及抗氧化作用的比较研究[D].武汉:江汉大学,2014.
[4]刘雅飞,崔玉娜,赵余庆.基于抗肿瘤活性的达玛烷型人参皂苷(元)结构修饰[J].中草药,2013,44(9):1203-1209.
[5]韩淑娴,游云.三七总皂苷心脑血管药理作用及其溶血反应[J].中国中药杂志,2016,41(5):818-822.
[6]贾继明,王宗权,吴立军,等.人参皂苷Rb1的药理活性研究进展[J].中国中药杂志,2008,33(12):1371-1376.
[7]Shin-Jung Kim,An Keun Kim. Anti-breast cancer activity of Fine Black ginseng(PanaxginsengMeyer)and ginsenoside Rg5[J].Journal of Ginseng Research,2015,39:125-134.
[8]Eun-Jin Kim,Il-Hoon Jung,Thi Kim Van Le,et al.Ginsenosides Rg5 and Rh3 protect scopolamine-induced memory deficits in mice[J].Journal of Ethnopharmacology,2013,146(1):294-299.
[9]张 晶,王世荣,陈全成,等.人参皂苷Rg3(R),Rg3(S),Rg5/Rk1对乙醇致小鼠记忆阻碍改善作用的影响[J].吉林农业大学学报,2006,28(3):283-284.
[10]关大朋,王欢,李伟,等.高温热裂解人参皂苷Rk1和Rg5的制备工艺优化[J].上海中医药杂志,2015,49(1):91-95.
[11]Zheng YX,Cui ZH,et al. A novel method for preparing of ginseng in order to obtain an increased content of ginsenoside:China,200680011768.[P]. 2006-04-11.
[12]Yang L,He KJ,Yang Y,et al. Method for preparing of ginsenoside RK1 and Rg5 by hydrolysis of protopanaxadiol type saponins through acid:China,CN02109790.9[P]. 2005-09-21.
[13]Yao H,Jin YR,Yang J,et al. Conversion Rule of Rare Ginsenosides Produced from Major Ginsenosides by Confined Microiwave Promoted Degradation Method[J]. Chem Chin Univ,2014,35:2317-2323.
[14]Soo Kyung Jo,In Sook Kim,Keon Sang Yoon,et al. Preparation of ginsenosides Rg3,Rk1,and Rg5-selectively enriched ginsengs by a simple steaming process[J].European Food Research and Technology,2015,240(1):251-256.
[15]金银萍,郑培和,郑斯文,等.人参皂苷20(S)-Rg3,20(R)-Rg3,Rg5,Rk1对照品的制备[J].吉林农业大学学报,2014,36(5):591-594.
[16]Ke LQ,Zhang DX,Xiao JD. Optimization of microwave-assisted enzyme extraction process of polysaccharide from Pleurotus eryngii stalk residue after deep treatment[J]. Trans Chin Soc Agric Eng,2014,30:332-338.
[17]Liu M,Mi Y. Application progress of microwave extraction in the field of traditional Chinese Medicine[J]. Tianjin Pharmacy,2009,21:62-64.
[18]成乐琴,刘治刚,孙成鹏.乳酸催化水解人参总皂苷制备抗癌活性物质人参皂苷Rg3工艺优化[J].亚太传统医药,2013,9(7):45-47.
Optimization of microwave assisted extraction of ginsenoside Rg5 from ginseng fibrous root powder by response surface methodology
GUO Dan-dan1,CHENG Le-qin1,*,LI Ling2,GAN Feng-qin2,YU Xiu-ru1
(1.Department of Pharmacy and Applied Chemistry,Jilin Institute of Chemical Technology,Jilin 132022,China;2.Tonghua Bai’aojinsen Biotechnology Co.,Ltd,Tonghua 134000,China)
To direct extraction of ginsenoside Rg5 from ginseng fibrous root powder(GFRP),solve the problem of long extraction time,low extraction rate,the microwave assisted extraction technology of ginsenoside Rg5 was carried out and optimized by response surface method based on single factor experiment,the extraction power,acid concentration of extraction solvent,solid-liquid ratio,extraction time and their interactions effected on the extraction yield of ginsenoside Rg5 were investigated. The results showed that the order of influence on the extraction yield of ginsenoside Rg5 was as follows:acid concentration of extraction solvent>extraction power>solid-liquid ratio>extraction time. The optimal condition obtained from RSM was as follows:extraction power of 500 W,acid concentration of extraction solvent of 0.12 mol·L-1,solid-liquid ratio of 1∶42(g·mL-1),extraction time of 9 min,the extraction yild of ginsenoside Rg5 can reach 3.14% under the optimal condition,which indicated the method could extrat Rg5 from GFRP effectively.
Ginsenoside-Rg5;microwave;extraction;response surface method;ginseng fibrous root powder
2016-12-02
郭丹丹(1991-),女,硕士研究生,研究方向:天然有机化合物的结构修饰和药物合成,E-mail:1878216422@qq.com。
*通讯作者:成乐琴(1969-),女,博士,教授,研究方向:天然有机化合物的结构修饰和药物合成,E-mail:chengleqin@hotmail.com。
吉林省科技厅科技厅公关项目(20140306003YY);吉林化工学院项目(吉化院合字[2015]第036号)。
TS255.1
B
1002-0306(2017)11-0229-07
10.13386/j.issn1002-0306.2017.11.035
