不同漂洗方式对高白鲑肌肉蛋白劣变影响的研究
2017-06-23高泽磊刘彩华朱新荣
高泽磊,刘彩华,彭 波,朱新荣,张 建
(石河子大学食品学院,新疆石河子 832000)
不同漂洗方式对高白鲑肌肉蛋白劣变影响的研究
高泽磊,刘彩华,彭 波,朱新荣*,张 建*
(石河子大学食品学院,新疆石河子 832000)
利用H2O2/Asc氧化系统模拟体外氧化,通过理化指标的检测,研究了不同漂洗方式对高白鲑肌肉蛋白劣变的影响。结果显示:浓度为0.3%没食子酸丙酯和0.5%盐水都具有防止蛋白质氧化的效果,但没食子酸丙酯的效果要优于盐水,而抗坏血酸钠虽然作为抗氧化剂,却有促进氧化的效果;通过单因素实验及响应面分析法对漂洗工艺进行了研究。结果表明,浓度为0.21% PG溶液、漂洗次数为2次、漂洗时间为6 min,此时蛋白质氧化抑制率为30.12%。结果说明,上述漂洗条件下能够有效防止高白鲑肌肉蛋白的劣变,增加高白鲑的品质。
高白鲑,漂洗方式,蛋白质氧化,响应面分析
高白鲑属硬骨鱼纲(Osteichthyes),是俄罗斯特有的一种高好氧冷水鱼,主要生活在俄罗斯范围内[1]。目前,新疆赛里木湖是高白鲑的主要养殖基地,高白鲑已经成为新疆冷水鱼养殖中的一个重要品种。研究发现高白鲑肌肉中的不饱和脂肪酸含量较高,其中的不饱和脂肪酸中高度不饱和脂肪酸含量较高[2]。而且鱼肉中含有约17种氨基酸,其中必需氨基酸占比较大,鲜味氨基酸的含量较高[3]。
高白鲑肉质鲜嫩,蛋白质极易氧化,而蛋白质氧化引起的物理化学变化会导致氨基酸破坏、蛋白质溶解性降低,氨基酸降解形成的衍生物包括羰基类化合物,会增加蛋白质的可消化性[4-6]。近年来,由蛋白氧化引起的食品功能性变化,已经得到人们的普遍关注,研究表明,蛋白质氧化引起的食物品质劣变略低于微生物引发的腐败变质[7-8]。氧化不仅可以降低肌肉蛋白的乳化性[9-11],而且当肉和肉制品暴露在强氧化条件时,会引起氨基酸的损失而降低其品质[12]。蛋白质氧化会使得肌肉蛋白质疏水性、溶解度、凝胶和乳化性能发生改变,从而破坏肉类产品的风味、色泽和质构等重要食用指标[13]。
目前国内对新疆冷水鱼的研究报告相对较少,而蛋白质氧化可以引起高白鲑鱼肌肉蛋白的劣变,造成鱼肉品质的下降。同时高白鲑作为新疆冷水鱼中的一大重要品种,对其进行研究与开发具有重要意义。因此,本实验以新疆赛里木湖高白鲑鱼为研究对象,利用氧化系统模拟体外氧化,研究几种不同漂洗方式下防止蛋白质氧化的最佳漂洗方式,同时利用单因素实验和响应面分析法对漂洗工艺进行了研究,并对优化的工艺参数进行实际实验考察以验证响应面模型的正确性。
1 材料与方法
1.1 材料与仪器
高白鲑鱼(1000~1500 g,体长30~35cm) 新疆赛湖渔业科技开发有限公司提供;2,4-二硝基苯肼(DPPH) 北京化工厂;乙酸乙酯 天津市登科化学试剂有限公司;乙醇 天津市富宇精细化工有限公司;氯化钠、氯化铁、盐酸胍、三氯乙酸 天津永晟精细化工有限公司;磷酸氢二钠、磷酸二氢钠、过氧化氢、抗坏血酸 天津市福晨化学试剂厂;其它试剂 均为国产分析纯。
85-1磁力搅拌器 江苏金坛市医疗仪器厂;BL-206-Ⅱ高速冷冻离心机 金坛市恒丰仪器厂;BS210S精密电子天平 北京赛多利斯仪器系统有限公司;DK-8B电热恒温水槽 上海精宏实验设备有限公司;PHS-3CpH计 上海精密科学仪器有限公司;Mini-protein Ⅲ紫外可见分光光度计 美国Bio-Rad公司。
1.2 实验方法
1.2.1 原料处理 将赛湖牌速冻高白鲑鱼解剖,用刀将鱼脊背肌肉分割成大小均匀的肉块(15 g),分装于塑料聚乙烯袋中,并于冰箱(-24 ℃)中保藏备用。
1.2.2 肌原纤维蛋白的提取 鱼背部肌肉中的肌原纤维蛋白的提取参考Chin[14]的方法并适当修改,提取液分别为磷酸盐缓冲液A(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,pH7.5),8000 r/min,15 min,4 ℃下提取2次,弃去上清液,保留沉淀,再用磷酸盐缓冲液B(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,0.6 mol/L NaCl,pH7.5),5000 r/min,15 min,4 ℃下提取2次,合并上清液,即为肌原纤维蛋白,用于测定蛋白质氧化后的理化特性的变化。
1.2.3 H2O2/Asc氧化系统 为探究蛋白质氧化造成的高白鲑肌肉蛋白劣变,且在相对较短的贮藏周期内达到蛋白质氧化的效果,参照田童童等[15]报道的方法,实验采用羟基自由基氧化体系(hydroxyl radical-generating system,简称为HRGS),即由0.1 mmol/L FeCl3,0.1 mmol/L抗坏血酸和20 mmol/L H2O2组成。将提取的肌原纤维蛋白溶解在含有以上氧化体系的 50 mmol/L磷酸盐缓冲液中(pH6.0),使得蛋白的最终浓度为20 mg/mL。然后将样品在4 ℃下放置5 h,使高白鲑鱼肌原纤维蛋白发生不同程度的氧化。通过添加BHA/Trolox/EDTA(使其最终浓度为1 mmol/L)来中止氧化反应,氧化产物经过磷酸盐缓冲液洗涤和离心处理去掉上清液,得到的沉淀用于测定理化指标。
1.2.4 不同漂洗方式对高白鲑肌原纤维蛋白的处理 将分割好的高白鲑鱼肉块,随机取20 g分成4份,分别按照以下条件进行漂洗:蒸馏水漂洗1次;0.5%盐水漂洗1次;0.5%抗坏血酸钠漂洗1次;0.3%没食子酸丙酯(以下简称PG)漂洗1次,分别包装,封口。所有样品放入-18 ℃冰箱中冷冻,经1、3、5、7和9 d冻藏后,在每个处理组中随机取3份,通过羟基自由基氧化系统(HRGS)处理,测定理化指标(羰基含量)从而确定最佳的漂洗方式。
1.2.5 单因素实验 称取分割好的鱼块样品20 g,参照1.2.4控制其他条件不变,选取漂洗液浓度、漂洗时间和漂洗次数作为三个单因素进行实验。将漂洗液浓度分别设定为0.1%、0.3%、0.5%、0.7%、0.9% 5个不同浓度梯度,漂洗时间分别设定为1.0、3.0、5.0、7.0、9.0 min 五个不同浓度梯度,漂洗次数分别设定为1次、2次、3次、4次、5次不同水平,所有实验进行3次平行实验。
1.2.6 响应面分析实验设计 应用Design-Expert 8.05软件,根据Box-Behnken中心组合设计原理,以蛋白质氧化抑制率为响应值,在单因素实验基础上,对抗氧化剂浓度、漂洗时间、漂洗次数三个因素进行响应曲面实验设计,利用Box-Behnken设计方法来优化高白鲑鱼漂洗的工艺条件。

表1 响应曲面实验设计因素水平表Table 1 The range of independent variables and their corresponding levels
1.3 羰基含量的测定方法
参照Oliver等方法略有改动[16],取5 mL的蛋白样品溶液放进离心管中,每管中加入5 mL 10 mmol/L的2,4-二硝基苯肼(DNPH),室温下反应1 h(每10 min 旋涡振荡一次)后,添加5 mL 20 % TCA,8 000 r/min离心5 min,弃清液,用5 mL体积比为1∶1的无水乙醇和乙酸乙酯混合溶液清洗沉淀3次除去多余的试剂,再向沉淀中加入3 mL 6 mol/L盐酸胍溶液后置于水浴锅中(37 ℃,15 min),将沉淀溶解,8000 r/min离心5 min除去不溶物质,取离心后的上清液用紫外分光光度计在370 nm处测吸光度。使用摩尔消光系数22000 L/(mol·cm)计算羰基含量。
1.4 总巯基含量的测定方法
参照Simplicio等[17]方法略有改动,方法如下:取1 mL的蛋白样品溶液,加入8 mL的Tris-甘氨酸(pH8,每升该溶液中含有10.4 g Tris,6.9 g甘氨酸,1.2 g EDTA,8 mol/L尿素),然后经均质,8000 r/min离心15 min,除去不溶蛋白,再在溶液中加入0.5 mL 10 mmol/L Ellman试剂,反应半小时后,用紫外可见分光光度计在412 nm处测定吸光值,使用摩尔消光系数13600 L/(mol·cm)计算总巯基含量,采用Biuret法测定蛋白质的含量。参照组除了不加蛋白溶液,其它处理方法均如上所述。
1.5 游离氨含量的测定方法
参照Brands等[18]方法略有改动,准确称取40 mg的OPA溶解于1 mL的甲醇中,分别加入2.5 mL 20%的SDS、25 mL 0.1 mol/L的硼砂和100 μLβ-巯基乙醇后用蒸馏水定容到50 mL。将200 μL蛋白样品液分别注入到含有4 mL空白液和4 mL OPA试剂的试管中,两者混合均匀后在35 ℃条件下反应2 min,在340 nm下测吸光度A340 nm,二者之差ΔA340 nm为游离氨基的净吸光度。氧化蛋白的吸光度值与未氧化蛋白的吸光度值相比所占百分比为游离氨的相对含量,计算公式如下,用游离氨基的相对含量进行作图。
1.6 表面疏水性的测定方法
参照Chelh等[19]方法略有改动,取1 mL的蛋白样品溶液加入200 μL 1 mg/mL的溴酚蓝(BPB),混匀,室温下搅拌10 min,然后8000 r/min离心15 min,取上清液在595 nm下测定吸光值,记作A。溴酚蓝空白样是用1 mL 20 mmol/mL的磷酸盐缓冲液(pH6.0)加200 μL溴酚蓝,磷酸盐缓冲液作空白样,在595 nm下测定吸光值,记作A0。计算公式如下:
1.7 蛋白质氧化抑制率的计算
蛋白质氧化抑制率(%)=(对照组的羰基含量-样品的羰基含量)/对照组的羰基含量×100
1.8 数据处理与统计分析
用Origin 7.5软件进行数据处理,并且用SPSS 17.0统计软件进行差异性显著性分析(p≤0.05),所有实验至少重复三次。
2 结果与分析
2.1 不同漂洗方式对高白鲑肌原纤维蛋白的变化

图1 不同漂洗处理后高白鲑肌原纤维蛋白中羰基含量的变化Fig.1 Changes of carbonyl content of different washed coregonus peled MP
2.1.1 羰基含量的变化 经过不同漂洗处理的样品中肌肉蛋白质羰基含量的变化如图1所示。从图1中可以看出,经过不同漂洗处理的高白鲑鱼肌原纤维蛋白的羰基含量随着贮藏时间的延长而增加,贮藏7 d时,对照组、添加盐漂洗组、添加抗坏血酸钠漂洗组、添加PG漂洗组的羰基含量分别增加了22.1%、19.5%、25.4%和13.5%,冻藏9 d时分别增加了45.2%、50.0%、67.8%和30.5%。说明各样品在贮藏过程中蛋白质发生氧化的程度不同,其中添加抗坏血酸钠漂洗的样品蛋白质发生氧化最严重,说明抗坏血酸钠虽是抗氧化剂,但是在漂洗后贮藏过程中却起到了促进氧化的作用,而且普通漂洗在冻藏过程中蛋白质的氧化程度高于未漂洗对照。这可能是由于漂洗过程破坏了蛋白质自身存在的氧化和抗氧化系统,因此引起鱼糜蛋白质在冻藏过程中发生氧化作用[10];四组样品中,添加PG漂洗的样品在贮藏过程中蛋白质的氧化程度最低,说明PG作为抗氧化剂起到了抑制蛋白质氧化的作用。
2.1.2 总巯基含量的变化 经过不同漂洗处理的样品中肌肉蛋白质总巯基含量的变化如图2所示。李学鹏等[20]研究发现氧化使蛋白质的巯基含量发生明显的改变。从图2中可以看出不同的漂洗方式和贮藏时间对肌原纤维蛋白的总巯基含量有显著的影响。未经贮藏时,对照组、盐漂洗组、抗坏血酸钠漂洗组、PG漂洗组高白鲑肌原纤维蛋白总巯基含量分别为70.37、65.32、63.28、68.73 μmol/mg,经过贮藏后,贮藏至第9 d时,对照组、5%盐漂洗组、添加抗坏血酸钠漂洗组、添加PG漂洗组样品的总巯基含量分别下降了39.96%、47.48%、54.79%、46.70%。在冻藏过程中肌原纤维蛋白巯基含量的下降可能是由于水形成冰结晶后,破坏肌原纤维蛋白的空间结构,使巯基暴露出来,进而被氧化成二硫键使巯基含量下降[21]。
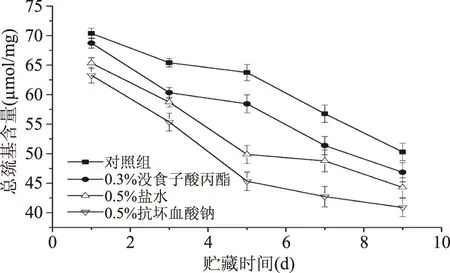
图2 不同漂洗处理后高白鲑肌原纤维蛋白中总巯基含量的变化Fig.2 Changes of total Sulfhydryl content of different washed coregonus peled MP
2.1.3 游离氨含量的变化 由图3可知,经过不同漂洗处理的样品在贮藏过程中肌原纤维蛋白游离氨含量都呈下降趋势。从中可以看出不同的漂洗方式和贮藏时间对肌原纤维蛋白的游离氨含量有显著的影响。未经贮藏时,对照组高白鲑鱼肌原纤维蛋白游离氨的含量是76.77%,经过贮藏后,至第9 d时,对照组、5%盐水漂洗组、添加抗坏血酸钠漂洗组、添加PG漂洗组样品的游离氨含量分别下降了43.76%、30.27%、28.89%、38.28%。游离氨基含量的下降可能是由于侧链中含有-NH或者是-NH2的氨基酸参与了羰基的形成[22]。

图3 不同漂洗处理后高白鲑肌原纤维蛋白中游离氨的变化Fig.3 Changes of free amines content of different washed coregonus peled MP
2.1.4 表面疏水性的变化 图4是经过不同漂洗处理的样品在贮藏过程中肌原纤维蛋白表面疏水性的变化。从中可以看出不同的漂洗方式和贮藏时间对肌原纤维蛋白的表面疏水性有显著的影响。未经贮藏时,对照组高白鲑鱼肌原纤维蛋白吸附溴酚蓝的量是42.54 μg,经过贮藏后至第9 d时,对照组、5%盐水漂洗组、添加抗坏血酸钠漂洗组、添加PG漂洗组样品的吸附溴酚蓝的量分别增加到了74.38、71.87、79.47、65.20 μg。

图4 不同漂洗处理后高白鲑肌原纤维蛋白中表面疏水性的变化Fig.4 Changes of surface hydrophobicity content of different washed coregonus peled MP
2.2 单因素实验
2.2.1 漂洗液浓度对蛋白质氧化抑制率的影响 由图5可见,蛋白质氧化抑制率随着PG浓度的增加有显著的增幅现象,但是这一现象在PG浓度为0.3%时发生变化,当PG浓度超过0.3%时,蛋白质氧化抑制率达到一种基本稳定的状态。这可能是由于当PG的浓度过低时,不能起到防止氧化的效果,而且漂洗过程本身会破坏蛋白质自身存在的氧化和抗氧化系统,导致氧化抑制率较低,而且漂洗过程还会降低鱼体本身的脂肪酸种类和含量[23];当随着PG浓度的增加,提取率会不断增大,说明一定浓度的PG起到了防止氧化的作用,当浓度继续增大时,抗氧化效果已达到最佳状态,则抑制率不会再继续增大,反而会浪费原料。综合考虑,选择蛋白质氧化抑制率的最佳PG浓度为0.3%。

图5 PG浓度对蛋白质氧化抑制率的影响Fig. 5 The influence of PG concentrations on protein oxidation inhibition rate
2.2.2 漂洗时间对蛋白质氧化抑制率的影响 由图6可知,漂洗时间在1~5 min之间时,高白鲑鱼肌肉蛋白中蛋白质氧化抑制率随着漂洗时间的增加而增加;当漂洗时间超过5 min时,蛋白质氧化抑制率随着漂洗时间的增加没有发生显著的变化,反而会有降低的趋势。产生这种现象的原因可能是漂洗时间过短,漂洗液中的抗氧化剂没能完全进入高白鲑鱼背部肌肉组织内,没有完全发挥防止氧化的作用,导致羰基的含量增加,从而降低了蛋白质氧化抑制率;而漂洗时间过长时,对蛋白质氧化抑制率已达到最高水平,继续漂洗只是时间的浪费,而且不利于抑制蛋白质的氧化。综合考虑,单因素实验中选择蛋白质氧化抑制率的最佳漂洗时间为5 min。

图6 漂洗时间对蛋白质氧化抑制率的影响Fig.6 The influence of rinse time on protein oxidation inhibition rate
2.2.3 漂洗次数对蛋白质氧化抑制率的影响 由图7可知,漂洗次数的增加对高白鲑鱼蛋白质氧化抑制率有一定的影响,当漂洗次数达到2次时,蛋白质氧化抑制率也达到最大值,能达到30.32%,此时高白鲑鱼贮藏期间蛋白质羰基含量为7.253 nmol/mg,各种蛋白质氧化反应过程中,许多都涉及了蛋白质羰基的生成,蛋白质羰基的产生是蛋白质分子被自由基氧化修饰的一个重要标记,会随着氧化程度的加重而增加[23]。而漂洗次数的继续增加不利于防止蛋白质的氧化,反而会使高白鲑贮藏期间蛋白质羰基的含量增加,这可能是由于多次的漂洗破坏了与肌肉组织的一些结构,加速了蛋白质的氧化,导致蛋白质氧化抑制率明显降低。综合考虑,单因素实验中选择蛋白质氧化抑制率的最佳漂洗次数为2次。

图7 漂洗次数对蛋白质氧化抑制率的影响Fig.7 The influence of rinse time on protein oxidation inhibition rate
2.3 响应面分析实验结果
以PG的浓度(A)、漂洗时间(B)和漂洗次数(C)为响应变量,以蛋白质氧化抑制率为响应值,利用Design-Expert 8.05软件,通过表2对实验数据进行多元回归拟合,获得蛋白质氧化抑制率多元线性回归方程:

表3 回归模型的方差和显著性分析结果Table 3 Coefficient and significance of regression model
注:*为显著(p<0.05),**为极显著(p<0.01)。
Y(蛋白质氧化抑制率)=31.36-0.55A+1.04B-1.33C-3.89AB-0.52AC+3.37BC-9.55A2-1.41B2-6.37C2

表2 Box-Behnken实验设计及结果Table 2 Box-Behnken experimental design and results
由表3可以看出,本实验所选用的二次多项模型具有高度显著性(p<0.0001),其R2为0.8893,这表明高白鲑鱼蛋白质氧化抑制率有88.93%来源于所选变量,即PG的浓度、漂洗时间、漂洗次数。因此,此模型拟合情况较好,可用该回归方程代替实验真实点对实验结果进行分析。回归方程的各项方差分析结果表明,一次项和二次项都有显著性因素,因此各实验因素对蛋白质氧化抑制率不是简单的线性关系。所以,可以利用该回归方程确定最佳工艺条件。根据回归模型做出相应的响应面图见图8。

图8 响应面分析法优化漂洗工艺曲面图Fig.8 The response surface on rinsing process注:A:PG浓度与漂洗次数对蛋白质氧化抑制率的影响;B:PG浓度与漂洗时间对蛋白质氧化抑制率的影响;C:漂洗时间与漂洗次数对蛋白质氧化抑制率的影响。
图8A、图8B、图8C分别显示了PG浓度与漂洗次数、PG浓度与漂洗时间、漂洗时间与漂洗次数对蛋白质氧化抑制率的交互影响。从图8A中可以看出,PG浓度与漂洗次数对蛋白质氧化抑制率的影响都显示出二次影响,随着漂洗次数的升高,蛋白质氧化抑制率呈现先增加后减少的趋势,随着PG浓度的增加,蛋白质氧化抑制率同样呈上升趋势,当达到某一值时,蛋白质氧化抑制率变化不大。图中的响应曲面的趋势比较陡。说明两者的交互作用对蛋白质氧化抑制率均有影响。从图8B中可以看出漂洗时间和PG浓度对蛋白质氧化抑制率的影响都呈现出线性关系,随着漂洗时间不断升高,蛋白质氧化抑制率表现出增加的趋势,而随着PG浓度的不断上升,蛋白质氧化抑制率也呈现出增加的趋势。从图C中可以看出,漂洗时间对蛋白质氧化抑制率的影响是呈现出线性关系,而漂洗次数显示出二次影响。随着漂洗时间的不断升高,蛋白质氧化抑制率没有表现明显的变化,而随着漂洗次数的不断上升,蛋白质氧化抑制率呈现出先增加后减少的趋势。
利用Design-Expert软件分析,模拟得出防止蛋白质氧化引起高白鲑肌肉劣变的漂洗条件为0.21% PG溶液、漂洗时间为5.8 min、漂洗次数为1.9次,蛋白质氧化抑制率最高预测值为31.42%。为检验响应曲面法所得的结果的可靠性,采取上述最优漂洗条件进行实验,同时考虑到实际操作的情况,将高白鲑鱼漂洗工艺的条件修正为0.21% PG溶液、漂洗时间为6 min、漂洗次数为2次,此时蛋白质氧化抑制率为30.12%。该值与理论最大值接近,说明采用响应曲面法优化防止蛋白质氧化引起高白鲑肌肉劣变的漂洗工艺可行。
3 结论
本实验研究了几种不同漂洗方式下高白鲑肌原纤维蛋白的氧化情况,结果表明,几种漂洗方式中添加PG可以防止高白鲑肌原纤维蛋白中的羰基含量的增加,浓度为0.3%为宜。
通过响应面实验对防止蛋白质氧化引起高白鲑肌肉劣变的漂洗工艺进行了优化,得出最佳的提取条件为:0.21% PG溶液、漂洗次数为2次、漂洗时间为6 min,此条件下蛋白质氧化抑制率为30.12%。
[1]张北平,杨文荣,张人铭,等.赛里木湖移植的高白鲑(Coregonus peled)生长发育[J].水产学杂志,2000(2):36-41.
[2]郭焱,马燕武,蔡林刚,等.赛里木湖高白鲑和凹目白鲑肌肉、卵的营养分析评价[J].水产学杂志,2004(1):62-67.
[3]郭焱,张北平,张人铭,等.赛里木湖高白鲑引种移植效应评价[J].水利渔业,2003(3):30-32.
[4]Agarwal S,Sohal R S.Aging and proteolysis of oxidized proteins[J].Archives of Biochemistry and Biophysics,1994,309(1):24-28.
[5]Meucci E,Mordente A,Martorana G.Metal-catalyzed oxidation of human serum albumin:conformational and functional changes-implications in protein aging[J].Journal of Biological Chemistry,1991,266(8):4692-4699.
[6]Stadtman E,Oliver C.Metal-catalyzed oxidation of proteins.Physiological consequences[J].Physiology Chemistry,1991,266(4):2005-2008.
[7]李艳青.蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D].哈尔滨:东北农业大学,2013.
[8]Lund M N,Heienonen M,Baron C P,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition Food Research,2011,55(1):83-95.
[9]Srinivasan S,Hultin H O.Chemical physical and functional properties of cod proteins modified by a nonenzymic free-radical-generating system[J].Journal of Agricultural and Food Chemistry,1997,45(2):310-320.
[10]Wan L,Xiong Y L,Decker E A.Inhibition of oxidation during washing improves the functionality of bovine cardiac myofibrillar protein[J].Journal of Agricultural and Food Chemistry,1993,41(12):2267-2271.
[11]Xiong Y L.Protein oxidation and implications for muscle food quality[J].Meat Science,2000,85:125-136.
[12]Aubourg S P,Rey-Mansilla M,Sotelo C G[J].European Food Research and Technology,1999,208(3):189-193.
[13]Martinaud A,Mercier Y,Marinova P T,et al.Comparison of oxidative processes on myofibrillar proteins from beef during maturation and by different model oxidation systems[J].Journal of Agricultural and Food Chemistry,1997,45(7):2481-2487.
[14]Chin Koo B,Go Mi Y,Xiong Y L.Konjac flour improved textural and water retention properties of transglutaminase-mediated,heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J].Meat Science,2009,81(3):565-572.
[15]田童童,巩子路,朱新荣,等.蛋白质氧化引起乳清蛋白理化性质变化的影响[J].江苏农业科学,2013(11):301-303.
[16]Oliver C N,Ahn B,Moerman E J,et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry,1987,262(12):5488.
[17]Di Simplicio P,Cheeseman K,Slater T.The reactivity of the SH group of bovine serum albumin with free radicals[J].Free Radical Research,1991,14(4):253-262.
[18]Brands C M,Van Boekel M A.Kinetic modeling of reactions in heated monosaccharide casein systems[J]. Journal of Agricultural and Food Chemistry,2002,50(23):6725-6739.
[19]Chelh I,Gatellier P,Sant-Lhoutellier V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science,2006,74(4):681-683.
[20]李学鹏,周凯,王金厢,等.羟自由基对六线鱼肌原纤维蛋白的氧化规律[J].中国食品学报,2014(6):19-27.
[21]Hamre K,Lie Ø,Sandnes K.Development of lipid oxidation and flesh colour in frozen stored fillets of Norwegian spring-spawning herring(Clupea harengus L.). Effects of treatment with ascorbic acid[J].Food Chemistry,2003,82(3):447-453.
[22]Eymard S,Baron C P,Jacobsen C.Oxidation of lipid and protein in horse mackerel(Trachurus trachurus)mince and washed minces during processing and storage[J].2009,114(1):57-65.
[23]文镜,张春华,董雨,等.蛋白质羰基含量与蛋白质氧化损伤[J].食品科学,2003,24(10):153-157.
Study on the effect of different rinsing on muscle protein deterioration of coregonus peled
GAO Ze-lei,LIU Cai-hua,PENG Bo,ZHU Xin-rong*,ZHANG Jian*
(Food College of Shihezi University,Shihezi 832000,China)
Using the H2O2/Asc oxidation system to simulate the vitro oxidation,through the detection of physicochemical indexes,to study the effect of coregonus peled muscle’deteriorating through using different rinsing methods. The results showed that both 0.3% PG and 0.5% saline water can prevent oxidation of the protein,but PG was better than saline water,although the sodium ascorbate was used as antioxygen,it has effects of promote oxidation. Single factor experiment and response surface analysis were used to study the rinsing process. It shows when the concentration of 0.21% PG,rinse times for twice,rinse time for 6 min. Under the condition,the protein oxidation inhibited rate was 30.12%.The above conditions could effectively prevent protein oxidation caused coregonus peled muscle and increased the quality of coregonus peled.
coregonus peled;rinse way;protein oxdation;response surface
2016-11-14
高泽磊(1992-),男,硕士研究生,研究方向:食品加工与安全,E-mail:1549838248@qq.com。
*通讯作者:朱新荣(1977-),女,硕士,讲师,研究方向:食品生物化学,E-mail:1678481898@qq.com。 张建(1979-),男,博士,副教授,研究方向:食品生物化学,E-mail:zhangjian041l@163.com。
石河子大学重大科技攻关计划项目(gxjs2015-zdgg06);国家自然科学基金项目(31460438)。
TS254.1
B
1002-0306(2017)11-0183-07
10.13386/j.issn1002-0306.2017.11.026
