基于DGGE方法分析低氯化钠浓度对发酵白菜原核微生物群落结构的影响
2017-06-23燕平梅张小冰乔宏萍赵文婧王丹丹
燕平梅,张小冰,柴 政,乔宏萍,赵文婧,王丹丹,王 琪
(1.太原师范学院生物系,山西太原 030012;2.山西大学生物学院,山西太原 030031)
基于DGGE方法分析低氯化钠浓度对发酵白菜原核微生物群落结构的影响
燕平梅1,张小冰1,柴 政1,乔宏萍1,赵文婧1,王丹丹1,王 琪2
(1.太原师范学院生物系,山西太原 030012;2.山西大学生物学院,山西太原 030031)
为了探究氯化钠浓度对发酵白菜体系中微生物群落结构的影响。以4%、6%和8%氯化钠浓度发酵白菜,通过DGGE(denaturing gradient gel electrophoresis)方法及Quantity One软件分析原核微生物群落结构;通过回收DGGE电泳中荧光强度强、不同时间差异的电泳带,经克隆后测定碱基序列、与GenBank 库序列对比鉴定。结果表明6%氯化钠浓度发酵白菜微生物多样性指数H(Shannon)、丰富度指数R(Species Richness)在发酵全过程中低于4%、8%组,均匀度指数E(Species Evenness)较4%、8%组的稳定。说明氯化钠浓度6%的发酵泡菜在整个发酵期微生物群落结构相对稳定且微生物种类小于氯化钠浓度4%、8%组。从DGGE电泳带荧光强度和存在的时间可知:在氯化钠浓度6%的发酵白菜体系中,Leuconostoccitreum(柠檬明串珠菌)、Unculturedbacterium(非培养细菌)、Leuconostocmesenteroides(肠系膜明串珠菌)是白菜发酵中期、后期的优势微生物,Leuconostoccitreum(柠檬明串珠菌)、Leuconostocmesenteroides(肠系膜明串珠菌)是乳酸菌。氯化钠浓度4%和8%发酵白菜中乳酸菌未成为优势微生物。说明氯化钠浓度6%较4%和8%发酵白菜原核微生物群落的变化接近于自然发酵蔬菜微生物变化规律,研究结果表明6%氯化钠浓度有利于白菜的发酵。
发酵,白菜,DGGE,原核微生物群落
蔬菜发酵体系是独特的微生物生态环境。其中的微生物与发酵蔬菜制品的品质和风味有直接的关系[1-3],对蔬菜发酵中微生物的多样性及其所扮演角色进行调查研究可为改进传统蔬菜发酵工艺、探究发酵蔬菜风味形成机理等方面提供参考数据。纯培养方法是研究蔬菜发酵体系微生物多样性传统的经典技术。但该方法需要人工配制培养基及设定环境条件,会对研究结果产生一定的影响[4-5],可能在蔬菜发酵体系中占主要地位或含量很高的菌群在培养基中无法培养或生长很差[6]。而用培养分离法从发酵蔬菜中分离出的优势的菌种经研究后却发现这些细菌仅仅是由于培养基上能大量被培养出来,从而被高估了它们的实际含量和作用[5]。此外,有研究表明在自然环境中有约90%~99%的菌种用传统方法是无法培养出来[7]。因此,纯培养技术有一定的局限性。
近年来,利用分子生物学的非培养方法认识食品发酵体系中微生物的多样性、微生物群落的研究显著增加,如发酵玉米团[8]、麦芽威士忌[9]、意大利香肠[10-11]、韩国泡菜[12]。梁新乐等[13]研究表明基于分子生物学的方法PCR-DGGE是研究发酵食品微生物组成的可行方法。李正国等[14]通过传统分离培养结合DGGE检测了榨菜腌制过程中的细菌群落。付琳琳[15]采用PCR-DGGE方法研究泡菜中乳酸菌的群落结构。泡菜发酵过程中除了乳酸菌外,还存在大量的细菌,影响着泡菜的品质。据报道在发酵蔬菜体系中高浓度食盐(10%~16%)有利于酵母菌生长,而低浓度食盐(5%~8%)则有利于乳酸菌生长[16-18]。本研究通过PCR-DGGE方法研究泡菜中细菌微生物的群落结构,为阐明泡菜的发酵机理提供研究方法和理论依据。
1 材料与方法
1.1 材料与仪器
白菜 来源于北京圆明园西路2号超市发超市,于2012年3月购买;DNA提取试剂盒、凝胶回收试剂盒 天根生化科技(北京)有限公司;X-gal、氨苄(Amp) 北京全式金生物技术有限公司;PCR引物 上海生工生物工程公司合成。
琼脂糖凝胶电泳仪、PCR仪、变性梯度凝胶电泳仪、NanoDrop2000DNA浓度仪、凝胶成像系统 均购自Bio-Rad公司。
1.2 实验方法
1.2.1 泡菜的制备和取样 发酵泡菜:发酵容器用干净的250 mL的三角瓶,瓶盖用纱布包裹的棉塞制成,将三角瓶和棉塞一起在湿热灭菌锅于121 ℃保温20 min,冷却后加入用无菌水洗干净的白菜和含不同浓度(4%、6%、8%)氯化钠煮沸后冷却的盐水(菜∶盐水为1∶2 m/v),塞上棉塞(以上操作在无菌的超净台上进行),放入干燥器中用真空泵抽气,在20 ℃恒温箱中厌氧发酵。取样:分别于发酵第1、3、5、7、9、11、13、15、17 d从干燥器取两瓶发酵白菜,在无菌的超净台用无菌的移液器取5 mL发酵白菜卤水,然后塞好棉塞,放入干燥器中用真空泵抽气,放回培养箱中继续发酵。
泡菜卤pH测定用数字pH计,pH计的校准用厂商供给的pH为4.0和7.0的标准缓冲溶液。
1.2.2 泡菜体系中所含微生物总DNA的提取 试剂盒(DNA提取试剂盒)给定步骤提取DNA。将不同取样时间的泡菜卤水作为基质提取发酵白菜卤中的DNA。DNA样品浓度利用Nanodrop分光光度计检测。
1.2.3 16S rDNA V3片段的PCR扩增 原核微生物的16S rDNA序列V3片段的通用引物为引物,即选用341f-GCCGCCCGCCGCGCGCGGCGGGCGGGGCG GGGGCACGGGGGGCCTACGGGAGGCAGCAG)和534r(ATTACCGCGGCTGCTGG)[14]引物,由上海生工生物工程技术服务有限公司合成。反应体系:PCR Master Mix 12.5μL,每种引物1 μL(10 pmol·μL-1),1.5 μL的发酵白菜总DNA,加ddH2O至终体积25 μL。反应程序:94 ℃预变性 5 min,94 ℃ 30 s,48.8 ℃ 30 s,72 ℃ 45 s,72 ℃ 8 min,35个循环。取PCR产物5 μL,以1.2%琼脂糖浓度的凝胶电泳检测,Bio-Rad 公司凝胶成像系统观察。
1.2.4 变性梯度凝胶电泳(DGGE) DGGE凝胶系统是由变性胶和上层胶组成的[19],具体配方见表1。
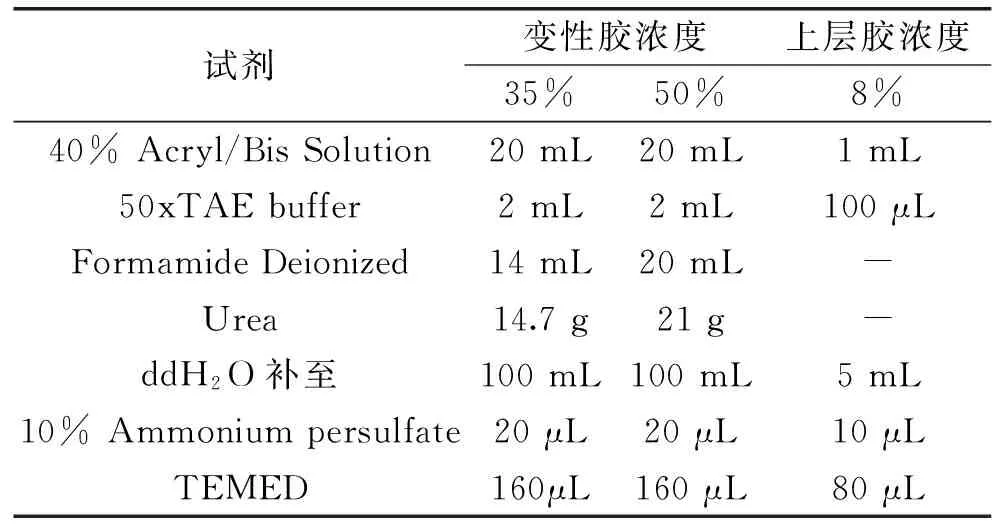
表1 变性梯度凝胶的配方Table 1 Denatured gradient gel formula
DGGE电泳结果在Bio-Rad公司的凝胶成像系统进行拍照、分析。并将特征条带切割回收,溶解后进行16S rDNA V3片段的二次PCR及产物回收,经纯化后的PCR产物与pGM-T Vector进行连接,在超净台内将10 μL连接产物转化感受态细胞,37 ℃倒置过夜培养。阳性克隆的菌落在华大基因公司进行基因序列测定。
1.2.5 DGGE图谱分析方法 DGGE指纹图谱分析借助于Bio-Rad公司的凝胶成像系统进行条带判读,并用Quantity One software进行分析。
1.2.5.1 DGGE条带多样性分析 用Quantity One软件进行DGGE条带分析,每个条带的位置和相对光密度值被该软件自动分析确定。为了最大程度的降低DGGE过程中不同样品间DNA上样浓度的差异,每个条带的光密度峰值除以该条带所在泳道所有条带光密度峰值的平均值进行数据的标准化处理。每条泳道内的条带数量用以评价物种丰富度(Species Richness),并通过条带相对密度值计算物种均匀度(Species Evenness)及物种多样性(Shannon)[20]。
多样性指数(H)、均匀度指数(E)及丰富度指数(R)的计算公式:
H=-∑(ni/N)Ln(ni/N)
式(1)
E=H/LnS
式(2)
R=S-1/LnN
式(3)
式中,ni为单一条带的峰面积,N为某一泳道所有峰面积,S为某一泳道的总条带数。
1.2.5.2 相似性聚类分析 使用Quantity One软件的UWPGA(Unweighted Pair Group Method using Arithmetic averages)方法对DGGE图谱进行相似性聚类分析。
1.2.5.3 系统发育分析方法 对测序结果进行去载体,得到目的片段序列提交到GenBank中进行BLAST比对,获得与目的片段相似度高的序列,通过MEGA4.0利用Neighbor-Joining法建立16S rDNA的系统发育树,对其进行系统发育分析。
1.2.6 发酵白菜中乳酸菌的分离与计数 用平板菌落计数方法,将样品液稀释到106,涂布于MRS固体培养基上,将涂布样品的 MRS固体培养基置于37 ℃培养箱,培养2 d 后计数。
2 结果与分析
2.1 泡菜发酵过程中pH随发酵时间的变化规律
用三种质量分数氯化钠浓度发酵白菜过程中pH变化(图1),在前 7 d 发酵液的pH不断下降,第9 d后变化缓慢,氯化钠浓度4%发酵液的pH于9~13 d缓慢上升、15 d下降、17 d上升;氯化钠浓度6%发酵液的pH于9~17 d保持在3.8左右,氯化钠浓度为6%的pH在第5 d后出现比较明显的下降。氯化钠浓度8%发酵液的pH在9~13 d保持在4.5~4.7,15 d上升。氯化钠浓度4%发酵液的pH 15 d之前高于8%发酵液的pH。

图1 发酵过程中pH的变化Fig.1 Variation of pH value in fermented cabbages
2.2 16S rDNA V3片段的PCR扩增
以发酵白菜体系中提取的DNA为模板,经过PCR扩增反应的结果如图2所示,PCR扩增产物大小在240 bp左右,条带清晰,且无杂带,可以用来进行后续的DGGE分析。经Nanodrop仪器测得PCR扩增产物的DNA含量,确定DGGE电泳实验的上样量。

图2 16S rDNA V3片段扩增琼脂糖凝胶电泳Fig.2 16S rDNA V3 sequence agarose gel electrophoresis amplificating as fermented vegetables total DNA template under 4% salt concentration注:M为DL2000标准分子量参照物,CK是阴性对照,泳道1~8分别代表取样时间1、3、5、7、9、11、13、15、17 d。
2.3 发酵白菜中乳酸菌数量的变化情况
三种质量分数氯化钠浓度发酵白菜乳酸菌数量随发酵时间的变化情况见图3,不同氯化钠浓度发酵白菜乳酸菌的数量变化趋势基本相同,前11 d乳酸菌数呈上升趋势,11 d以后乳酸菌数显示下降状态。氯化钠浓度8%的发酵白菜乳酸菌的数量最少;4%的乳酸菌的数量最多。

图3 三种浓度食盐下发酵白菜乳酸菌数量的变化Fig.3 Change in the number of lactic acid bacteria fermented cabbages
2.4 发酵白菜体系原核微生物16S rDNA V3片段的DGGE图谱分析
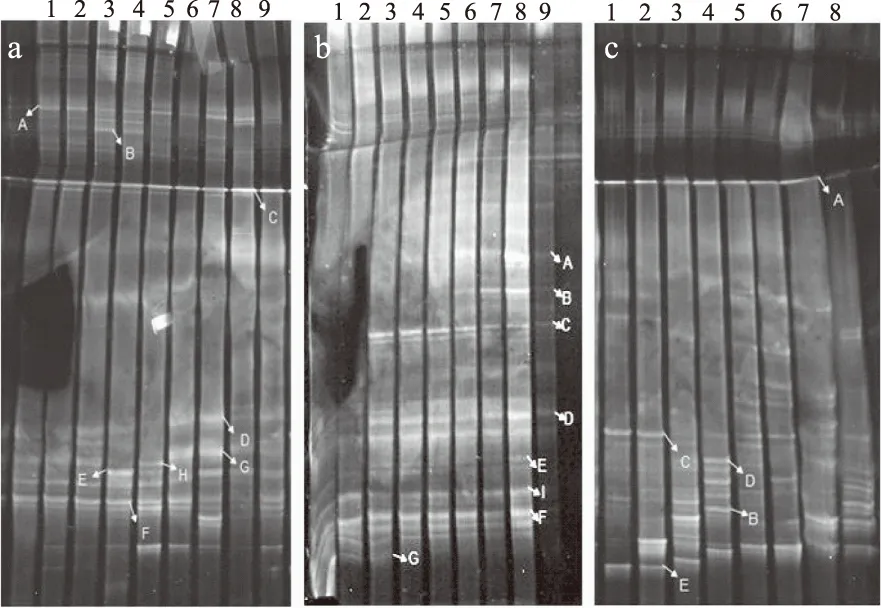
图4 发酵白菜微生物16S rDNA V3片段的DGGE图谱。Fig.4 DGGE of fermented vegetables 16S rDNA V3 gene注:A、B、C分别为4%、6%、8%氯化钠浓度发酵的白菜。1~9泳道依次代表取样时间:1、3、5、7、9、11、13、15、17 d。
2.4.1 回收DGGE电泳带的分析鉴定 氯化钠浓度4%的发酵泡菜样品DGGE电泳图谱如图4A所示,发酵不同时间样品的电泳带数量和迁移率均不同。每个发酵时间电泳带数量较多。为了研究发酵白菜体系中优势的微生物种类,实验中回收荧光强度强、不同时间差异的电泳带,通过基因扩增反应后测定碱基序列、与GenBank 库序列对比鉴定。鉴定结果见表2,电泳带A、B、D、E、F、G、H分别与Unculturedbacterium(非培养细菌)、Pseudomonassp.(假单胞菌属)、Pantoeadispersa(泛菌)、Serratiasp.(沙雷氏菌属)、Serratiasp.(沙雷氏菌属)、Staphylococcussciuri(松鼠葡萄球菌)、Rahnellasp(拉恩氏菌属)的相似度为95%、99%、95%、99%、99%、97%、96%,说明与之对应的菌是同一种属。而C条带与Staphylococcussciuri(松鼠葡萄球菌)相似度87%,说明不是同一种属。基因序列及参比序列构建的系统发育树得出(图5a所示):最大的类群为γ变形杆菌纲微生物Gamma proteobacteria,包括Rahnellasp.(H)、Pantoeadispersa(D)和Serratiasp.(E)、Pseudomonassp.(B)、Serratiasp.(F);放线菌目Actinomycetales为另一类群,包括Staphylococcussciuri(C)和Staphylococcussciuri(G)。

表2 发酵泡菜原核微生物的DGGE图谱条带测序结果Table 2 DGGE band sequencing results of fermented vegetables bacterial community
其中Rahnellasp.(H)存在发酵前期(5 d);Pantoeadispersa(D)、Serratiasp.(E)和Staphylococcussciuri(G)存在发酵后期;Unculturedbacterium(A),Pseudomonassp.(B)、Staphylococcussciuri(C)、Serratiasp.(F)贯穿发酵整个过程。
氯化钠浓度为6%的样品电泳图谱如图4B所示,电泳带A、B、C、D、E、F、G、I鉴定结果分别与Leuconostoccitreum(柠檬明串珠菌)、Unculturedbacterium(非培养细菌)、Leuconostocmesenteroides(肠系膜明串珠菌)、Unculturedgammaproteobacterium(非培养的菌)、Unculturedbacterium(非培养细菌)、UnculturedEnterobactersp.(非培养肠杆菌)、Enterobacteriaceaebacterium(肠杆菌科细菌)、Pantoeasp.(I)相似度为100%、100%、98%、99%、85%、100%、100%、98%(如表2所示)。基因序列及参比序列构建的系统发育树得出(如图5b所示):最大的类群为γ变形杆菌纲微生物Gammaproteobacteria,包括电泳带A、D、F、G、H;第二大类群为unknown cluster包括电泳带E、B。第一类群为Lactobacillables,其中包括条带A和条带C,其中Enterobacteriaceaebacterium(G)在发酵前期起作用。Leuconostocmesenteroides(C)、Unculturedgammaproteobacterium(D)、Unculturedbacterium(E)发酵的3 d后检测到。Leuconostoccitreum(A)、Leuconostocmesenteroides(C)、Unculturedbacterium(B)存在发酵后期。UnculturedEnterobactersp.(F)、Pantoeasp.(I)存在于发酵的全过程。A、B、C的荧光强度强于D、E、F、G、I,说明Leuconostoccitreum(A)、Unculturedbacterium(B)、Leuconostocmesenteroides(C)是泡菜发酵后期的优势微生物。

图5 氯化钠浓度4%(a)、6%(b)、8%(c)的发酵白菜细菌16S rDNA V3片段基因序列及参比序列构建的系统发育Fig. 5 Phylogenetic trees constructed 16S rDNA V3 gene sequence and the reference sequence of fermented cabbages under 4%,6%,8% salt concentration
氯化钠浓度为8%的样品电泳图谱如图4C所示,电泳带A、B、C、D、E鉴定结果分别与Staphylococcussciurisp.(松鼠葡萄球菌属)、Serratiasp.(沙雷氏菌属)、Staphylococcussciuri(松鼠葡萄球菌)、Rahnellasp.(拉恩氏菌属)、Serratiasp.(沙雷氏菌属)相似度为90%、99%、97%、96%、84%(如表2所示)。基因序列及参比序列构建的系统发育树得出(如图5c所示):γ变形杆菌纲微生物Gamma proteobacteria为一大类群微生物,包括Serratiasp.(B)、Rahnellasp.(D)和Serratiasp.(E),芽孢杆菌纲Bacili为另一类群,包括Staphylococcussciuri(C)和Staphylococcussciuri(A)。其中Serratiasp.(E)存在发酵前期。Serratiasp.(B)、Rahnellasp.(D)存在发酵后期。Staphylococcussciurisp.(A)、Staphylococcussciuri(C)存在于发酵的全过程。
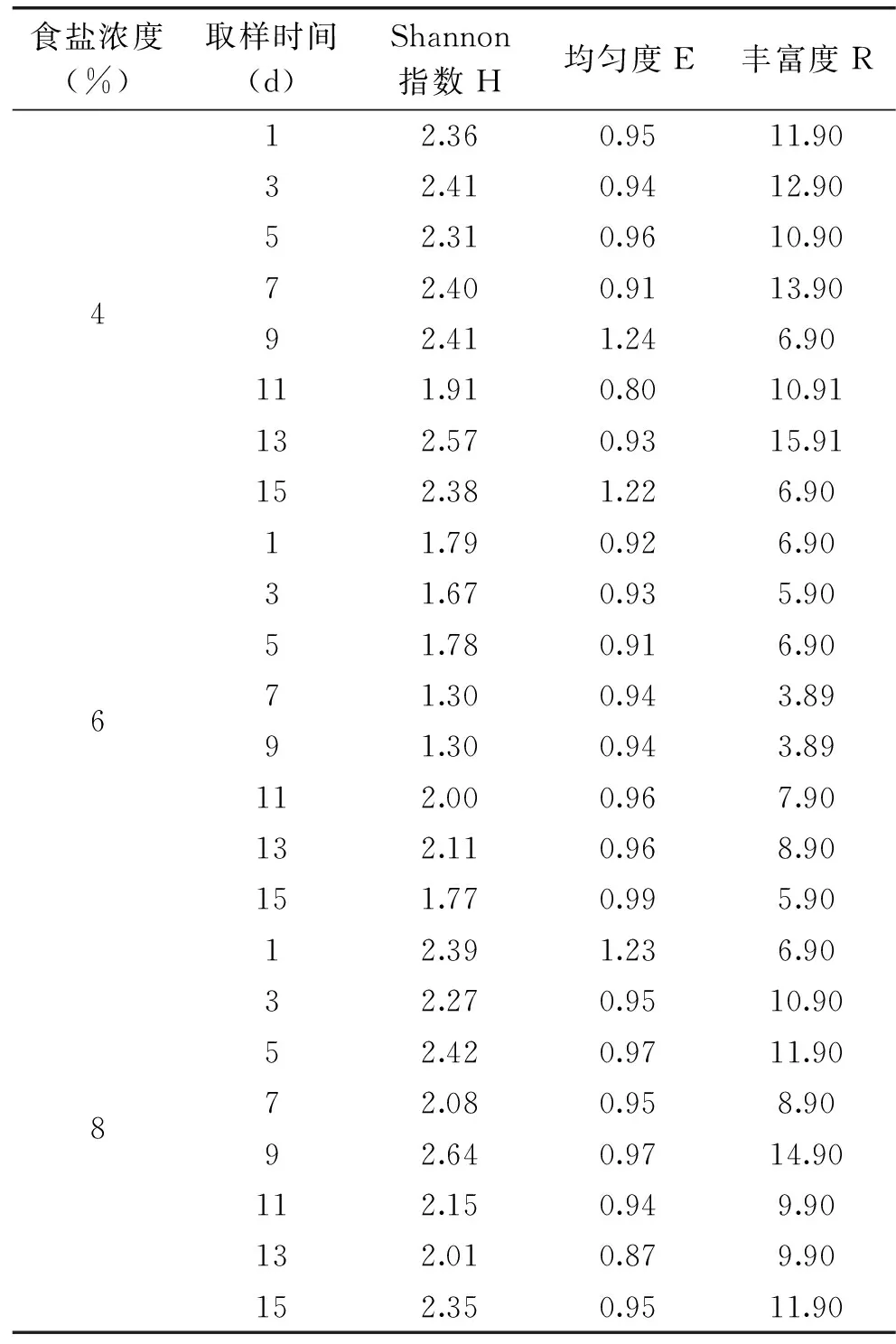
表3 发酵蔬菜微生物细菌群落结构特征Table 3 Bacterial community structure characteristic of fermented cabbages microorganism
2.4.2 发酵白菜原核微生物群落结构特征 物种多样性指数(H)、丰富度指数(R)和均匀度(E)是应用数学的方法来度量组成群落的种类数、个体总数以及各种群均匀程度的数量指标,从不同角度反映群落结构特征的量度值,表明群落的组织结构及其生态学特征,反映群落类型的不同,群落结构的差异,群落演替的动态变化[20]。使用Quantity One软件进行DGGE条带分析,每条泳道内的条带数量用以评价物种丰富度(Species Richness),并通过条带相对密度值计算物种均匀度(Species Evenness)及物种多样性(Shannon)。
如表3所示,随着发酵时间的延长,三种氯化钠浓度发酵泡菜微生物指数呈不规则变化。11 d 4%的H低于6%,其他时间氯化钠浓度6%的发酵泡菜H显著低于4%和8%的。说明6%氯化钠浓度发酵泡菜微生物多样性低于4%和8%的。三种氯化钠浓度发酵泡菜微生物均匀度指数(E)随着发酵时间呈不规则的变化,4%氯化钠浓度发酵泡菜微生物均匀度(E)呈上升趋势。6%氯化钠浓度发酵泡菜微生物均匀度(E)在发酵全过程中有较小幅度的上升趋势。8%氯化钠浓度发酵泡菜微生物均匀度(E)于发酵1 d较高,之后的3~15 d相近。说明6%氯化钠浓度发酵泡菜微生物均匀度指数(E)较4%和8%的稳定。8%氯化钠浓度发酵泡菜微生物均匀度指数(E)较4%的稳定。三种氯化钠浓度发酵泡菜微生物丰富度指数(R)随着发酵时间呈不规则变化,发酵全过程氯化钠浓度6%的发酵泡菜R显著低于4%和8%的。发酵初期4%发酵泡菜R高于8%的。
综上实验结果可知,6%氯化钠浓度发酵泡菜微生物多样性指数(H)、丰富度(R)指数在发酵全过程中低于4%和8%,均匀度(E)指数较4%和8%的稳定。说明氯化钠浓度6%的发酵泡菜在整个发酵期微生物群落结构相对稳定且微生物种类远不及氯化钠浓度4%和8%。
2.4.3 白菜发酵不同时间原核微生物类型的聚类分析 运用Quantity One软件的“phylogenetic analysis”方式分析DGGE图谱中电泳带,根据UWPGA算法对三种氯化钠浓度发酵泡菜的不同时间的原核微生物类群进行相似性聚类分析。图6a表示氯化钠浓度为4%的发酵泡菜不同时间样品的DGGE电泳图谱DNA条带的聚类分析结果,发酵全过程聚为两大类:发酵第1、3、5、7、9 d的发酵泡菜DNA条带聚为一类,发酵第11、13、15、17 d的发酵泡菜DNA条带聚为一类,说明原核微生物群落大致归属于两大类群。白菜发酵根据微生物类群可分为两个发酵阶段,即发酵前期(1~9 d)和发酵后期(11~17 d)。
如图6b所示,氯化钠浓度为6%的发酵泡菜不同时间样品的DGGE电泳图谱DNA条带的聚类分析结果,发酵全过程聚为两大类:发酵第1、3、5、7、9、11 d的发酵泡菜DNA条带聚为一类,发酵第13、15、17 d的发酵泡菜DNA条带聚为一类,说明原核微生物大致归属于两大类群。泡菜发酵根据微生物类群可分为两个发酵阶段。即发酵前期(1~11 d)和发酵后期(13~17 d)。
图6c表示氯化钠浓度为8%的发酵泡菜不同时间样品的DGGE电泳图谱DNA条带的聚类分析结果,发酵全过程聚为两大类:发酵第1、3、5、7、9 d的发酵泡菜DNA条带聚为一类,发酵第11、13、15 d的发酵泡菜DNA条带聚为一类,说明原核微生物群落大致归属于两大类群。泡菜发酵根据微生物类群可分为两个发酵阶段。即发酵前期(1~9 d)和发酵后期(11~17 d)。

图6 氯化钠浓度4%、6%、8%的发酵泡菜16S rDNA V3片段的DGGE条带相似性聚类图Fig.6 DGGE stripe similarity clustering figure of fermented cabbages 16S rDNA V3 gene under 4%,6%,8% salt concentration
3 讨论
蔬菜发酵初期首先是附着在原料表面的杂菌不断生长繁殖,主要有肠道菌属、酵母菌属等,同时乳酸菌也随之增殖[1]。随着发酵的进行,杂菌的种类和数量减少,乳酸菌数量迅速增加,占细菌总数的比例不断增加。发酵后期,泡菜中的微生物主要是乳酸菌[21-22]。邱致广等[23]指出,发酵泡菜酸味与风味物质的形成主要取决于乳酸菌。乳酸菌对于发酵泡菜的发酵成熟起着至关重要的作用[24- 25],乳酸菌代谢作用对泡菜发酵有积极的作用[26]。如果泡菜发酵后期乳酸菌不是优势微生物,将引起发酵泡菜腐败,导致泡菜发酵失败[24]。本实验在氯化钠浓度6%的发酵泡菜体系中Leuconostoccitreum、Unculturedbacterium、Leuconostocmesenteroides是泡菜发酵中期、后期的优势微生物。乳酸菌不仅有利于泡菜的正常发酵,而且导致发酵体系pH下降,从本实验的结果证实了氯化钠浓度6%的发酵泡菜体系中pH下降。在pH较低条件下,可能抑制一些不耐酸微生物类群的生长繁殖,导致发酵泡菜微生态体系中微生物物种的丰富度、多样性下降,此结果从DGGE图谱分析计算的6%氯化钠浓度发酵泡菜微生物多样性指数(H)、丰富度(R)指数低于4%和8%得到证实。因为6%氯化钠浓度发酵白菜中后期主要是乳酸菌类群,所以均匀度(E)指数较4%和8%的稳定。氯化钠浓度为6%样品的PCR-DGGE电泳带鉴定结果可知Enterobacteriaceaebacterium在发酵前期起作用,Leuconostoccitreum、Leuconostocmesenteroides存在发酵中、后期,Unculturedbacterium存在发酵后期,UnculturedEnterobactersp.、Pantoeasp. 存在发酵的全过程。Leuconostoccitreum、Unculturedbacterium、Leuconostocmesenteroides是泡菜发酵中期、后期的优势微生物。电泳带基因鉴定的微生物随着发酵时间的变化规律与蔬菜发酵微生物变化的一般规律相符。运用培养计数的方法统计不同氯化钠浓度乳酸菌菌落数量结果可知,氯化钠浓度为6%的白菜发酵体系中乳酸菌菌落数量高于4%和8%,说明氯化钠浓度6%适合于白菜的发酵。
燕平梅[27]以不同时间的发酵甘蓝液为材料,采用细菌和乳酸菌培养基平板分离细菌,从中挑取共50株形态不同的菌株进行属水平的鉴定,结果得出发酵甘蓝液中有假单孢菌Pseudmonas、肠杆菌Escherichiacol、微球菌属Micrococcus、葡萄球菌属Staphylococcus、明串珠菌属Leuconostoc及乳杆菌属Lactobacillus。说明DGGE电泳中回收电泳带的分析鉴定与传统的微生物分离鉴定结果一致。韩国的Lee[15]用聚合酶链式反应结合变性梯度凝胶电泳的方法鉴定了韩国发酵白菜中主要的微生物为Weissellaconfusa、Leuconostoccitreum、Lactobacillussakei和Lactobacilluscurvatus。本实验在氯化钠浓度6%的发酵泡菜体系中也发现了肠膜明串珠菌(lencuconostocmesenteroides),但未发现其他的乳酸菌,可能是由于韩国泡菜与我国泡菜的加工方法不同。
4 结论
6%氯化钠浓度发酵泡菜微生物多样性指数(H)、丰富度(R)指数在发酵全过程中低于4%和8%,均匀度(E)指数较4%和8%的稳定。说明氯化钠浓度6%的发酵泡菜在整个发酵期微生物群落结构相对稳定且微生物种类少于氯化钠浓度4%和8%。
[1]Yan PM,Xue WT. Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control,2008,12:50-55.
[2]Cheigh HS,Park KY. Biochemical microbiological and nutritional aspects of kimchi(Korean fermented vegetable products)[J]. Critical Reviews in Food Science and Nutrition,1994,34(2):175-203.
[3]Lee CW,Koc Y,Ha DM,et al. Microfloral changes of the lactic acid bacteria during kimchi fermentation and identification of the isolates[J]. Korean Journal of Applied Microbiology and Biotechnology,1992,20(1):102-109.
[4]Mheen TI,Kwon TW. Effect of temperature and salt concentration on kimchi fermentation[J]. Korean Journal of food Science and Technology,1984,16:443-450.
[5]Desouza MP,Amini A,Dojka MA,et al. Identification and characterization of bacteria in a selenium-contaminated hypersaline evaporation pond[J]. Applied Environmental Microbiology,2001,67(9):3785-3794.
[6]Burgmann H,Pesaro M,Widmer FA. Strategy for optimizing quality and quality of DNA extracted from soil[J]. Journal of Microbiological Methods,2001,45(1):7-20.
[7]Cullen DW,Hirsch PR. Simple and rapid method for direct extraction of microbial DNA from soil for PCR[J]. Soil Biol Biochem,1997,30(8):983-993.
[8]Adelfo E,Carmen W,Amelia F,et al. Lactic acid bacterial diversity in the traditional Mexican fermented dough pozol as determined by 16S rDNA sequence analysis[J]. International Journal of Food Microbiology,2001,64(1):21-31.
[9]Beek SV,Prist FG. Environ of the lactic acid bacterial community during malt whisky fermentation:a polyphasic study[J]. Applied and Environmental Microbiology,2002,68(1):297-305.
[10]Cocolin L,Manzano M,Cantoni C,et al. Development of a rapid method for the identification of Lactobaillus spp. Isolated from naturally fermented Italian sausages using a polymerase chain reaction-temperature gradient gel electrophoresis[J]. Letters in Applied Microbiology,2000,30(2):126-129.
[11]Cocolin L,Manzano M,Cantoni C,et al. Denaturing gradient gel electrophoresis analysis of the 16S rRNA gene V1 region to monitor dynamic changes in the bacterial population during fermentation of Italian sausages[J]. Applied and Environmental Microbiology,2001,67(11):5113-5121.
[12]Lee JS,Heo GY,Lee JW,et al. Analysis of kimchi microflora using denaturing gradient gel electrophresis[J]. International Journal of Food Microbiology,2005,102(2):143-150.
[13]梁新乐,朱扬玲,蒋予箭,等. PCR-DGGE法研究泡菜中微生物群落结构的多样性[J].中国食品学报,2008,8(3):133-137.
[14]李正国,付晓红,邓伟,等. 传统分离培养方法结合DGGE法检测榨菜腌制过程的细菌多样性[J]. 微生物学报,2009,36(3):371-376.
[15]付琳琳,曹郁生,李海星,等. PCR-DGGE技术分析泡菜中乳酸菌的多样性[J].食品与发酵工业,2005,31(12):103-105.
[16]张素华,葛庆丰,曹晓霞. 全面提高腌泡菜质量的研究[J]. 江苏农业科学,2001,22(2):72-75.
[17]牟君富. 盐渍酸白菜的加工原理和加工技术[J]. 中国食品信息,1990(3):17-18.
[18]陈惠音,杨汝德. 超低盐多菌种快速腌菜技术[J]. 食品科学,1994(5):18-22.
[19]Lee JS,Heo GY,Lee JW,et al. Analysis of kimchi microflora using denaturing gradient gel electrophresis[J]. International Journal of Food Micro Biology,2005,102(2):143-150.
[20]程新胜,杨建卿.熏蒸处理对土壤微生物及硝化作用的影响[J].中国生态农业学报,2007,15(6):51-53.
[21]关倩倩. 我国传统发酵泡菜菌系结构及其消长规律研究[D]. 南昌:南昌大学,2012.
[22]Endo A,Mizuno H,Okada S. Monitoring the bacterial community during fermentation of sunki,an unsalted,fermented vegetable traditional to the Kiso area of Japan[J]. Letters in Applied Microbiology,2008,47(3):221-226.
[23]邱致广. 酸菜腌制过程中微生物与风味物质的变化[D]. 台湾:国立中兴大学食品科学研究所,1993.
[24]燕平梅,薛文通,畅晓晖,等.自然发酵和接种发酵方法对白菜品质的影响[J]. 农业工程学报,2008,24(3):286-290.
[25]Park J M,Shin J H,Lee D W,et al. Identification of the lactic acid bacteria in kimchi according to initial and over ripened fermentation using PCR and 16S rRNA gene sequence analysis[J].Food Science and Biotechnology,2010,19(2):541-546.
[26]Shin M S,Han S K,Ryu J S,et al. Isolation and partial characterization of a bacteriocin produced by Pediococcus pentosaceus K23-2 isolated from Kimchi[J]. Journal of Applied Microbiology,2008,105(2):331 -339.
[27]燕平梅. 发酵蔬菜中亚硝酸盐含量及优良发酵菌种筛选的研究[D].北京:中国农业大学,2007.
Effect of concentration of sodium chloride in Chinese paocai on prokaryotic microbial community based on DGGE
YAN Ping-mei1,ZHANG Xiao-bing1,CHAI Zheng1,QIAO Hong-ping1, ZHAO Wen-jing1,WANG Dan-dan1,WANG Qi2
(1.Department of Biology,Taiyuan Normal University,Taiyuan 030012,China; 2.College of Life Science,Shanxi University,Taiyuan 030031,China)
In order to explore the impacts of microbial communities in fermented pickle system,the experiment was conducted by taking 4%,6% and 8% as sodium chloride concentration to ferment pickle. Using DGGE(denaturing gradient gel electrophoresis)method and software of Quantity One to analyse Prokaryotic microbial community structure. And recycling the electrophoretic bands with strong fluorescence intensity and different time difference in DGGE which is measured to base sequence after cloning to be compared and identified with GeneBank sequence.The results showed that microbial diversity index(H),richness index(R)of sauerkraut fermented by 6% sodium chloride concentration in the fermentation process was lower than 4%’s and 8%’s,the index of evenness(E)was more stable than 4%’s and 8%’s. It showed the microbial community structure of sauerkraut fermented by 6% sodium chloride concentration in the fermentation period of microbial community structure was relatively stable and its microbial species is far less than 4% and 8% ‘s. From the DGGE electrophoretic band fluorescence intensity and the time of existence,it was found thatLeuconostoccitreum,Unculturedbacterium,Leuconostocmesenteroidesare dominant bacteria in the fermented cabbage system with 6% sodium chloride concentration.LeuconostoccitreumandLeuconostocmesenteroidesbelong to lactic acid. The lactic acid bacteria with 4% and 8% sodium chloride concentration in fermented cabbage did not become a dominant microorganism. It shows that the changes of prokaryotic microbial community in fermented cabbage with 6% concentration sodium chloride are closer to natural fermented vegetables’ microbial variation comparing with 4% and 8% concentration sodium chloride,so the research indicated that 6% sodium chloride concentration is more beneficial to the fermentation of cabbage.
fermentation;cabbage;DGGE;prokaryotic microbial communities
2016-10-19
燕平梅(1968-), 女,博士, 教授, 主要从事微生物生态学方面的研究,E-mail:yanpingmei1968@163.com。
国家自然基金项目(31171743);山西省基础条件平台项目(2014091003-0107)。
TS201.3
A
1002-0306(2017)11-0144-08
10.13386/j.issn1002-0306.2017.11.019
