缺氧诱导因子-2α和多药耐药基因1在乳腺癌中的表达及相关性
2017-06-23张哲莹赵二趁
李 娜 张哲莹 赵二趁
(新乡医学院,河南 新乡 453003)
缺氧诱导因子-2α和多药耐药基因1在乳腺癌中的表达及相关性
李 娜 张哲莹 赵二趁
(新乡医学院,河南 新乡 453003)
目的 探讨缺氧诱导因子(HIF)-2α和多药耐药基因(MDR)1在乳腺癌中的表达及相关性。方法 采用免疫组化和RT-PCR法检测47例乳腺癌组织和30例癌旁正常乳腺组织中的HIF-2α和MDR1蛋白和mRNA的表达及其相关性。低氧培养建立乳腺癌MCF-7细胞缺氧模型,应用荧光定量PCR和Western印迹分别检测每组缺氧模型细胞中HIF-2α和MDR1蛋白和mRNA的表达及其相关性。 结果 在乳腺癌组织中HIF-2α蛋白的阳性表达率(76.7%)和MDR1蛋白的阳性表达率(80.0%)均显著高于正常乳腺组织(P<0.05);在乳腺癌组织中HIF-2α mRNA的表达水平(0.896±0.012)和MDR1 mRNA的表达水平(0.884±0.016)均显著高于正常乳腺组织(P<0.05);乳腺癌组织中HIF-2α及MDR1蛋白及mRNA的表达均呈正相关(P均<0.05)。在缺氧组,随着缺氧时间的延长MCF-7细胞中MDR1的表达均逐渐增高,且MDR1的表达升高与HIF-2α的表达呈同步化改变。结论 缺氧可通过核转录因子HIF-2α上调乳腺癌细胞内MDR1的表达,从而使乳腺癌细胞获得多药耐药性。HIF-2α和MDR1将可能成为逆转乳腺癌耐药的新的分子靶点。
乳腺癌;缺氧诱导因子-2α;多药耐药基因
化疗耐药是导致恶性肿瘤治疗失败的重要原因,也是困扰恶性肿瘤治疗的难题之一。在乳腺癌的治疗中也不可避免地会遇到化疗耐药的问题。因此寻求有效的耐药逆转剂及探索乳腺癌的耐药逆转机制具有重要的研究价值。实体肿瘤微环境局部缺氧是普遍存在的一种现象〔1〕。缺氧诱导因子(HIF)是与细胞缺氧有关的重要转录调节因子,近年来与肿瘤发生、发展的关系倍受关注,而关于肿瘤化疗耐药与HIF-2α的关系,国内外相关报道较少。本研究分别以乳腺癌组织和细胞为研究对象,从mRNA及蛋白水平研究MDR1与HIF-2α的表达变化及相关性,进而部分阐明乳腺癌多药耐药的形成机制,为逆转乳腺癌的化疗耐药提供新的靶点。
1 材料与方法
1.1 材料 收集新乡医学院第三附属医院2008年10月至2011年10月手术切除且经病理确诊的乳腺浸润性导管癌标本47例,均为女性,年龄33~82(中位57)岁。术前均未经放、化疗及内分泌治疗,其中伴腋窝淋巴结转移27例。另取30例癌旁组织(距癌灶边缘5 cm)作为对照,年龄32~76(中位54)岁。新鲜标本由DEPC处理后冻存管分装、液氮运送并立即冻存于-80℃冰箱待用。病例均经两位以上病理医师确诊。
1.2 主要试剂及细胞系 HIF-2α兔抗人多克隆抗体购自武汉博士德生物工程有限公司;鼠抗人P-糖蛋白(P-gP)多克隆抗体购自深圳晶美生物公司,SuperScriptTM First-Strand Synthesis System for RT-PCR 试剂盒、PCR试剂盒和TRIzol试剂等均购自美国Invitrogen公司;β-actin 抗体购自美国Santa Cruz公司,引物均由上海英骏生物技术有限公司合成;MCF-7细胞株由本实验室保存。
1.3 免疫组化染色及结果判定 采用EnVisin两步法,高温高压进行抗原修复, 37℃孵育1 h,二氨基联苯胺(DAB)显色,苏木素复染。PBS代替一抗作为阴性对照。HIF-2α和P-gP阳性显色均为棕黄色颗粒,HIF-2α主要位于肿瘤细胞质和细胞核,以核周胞质中表达较强。P-gP主要位于肿瘤细胞质和细胞膜,在10×40倍视野下随机选取8~10个视野,计数棕黄色染色细胞所占的百分数,≥10%者为阳性,<10%者为阴性。
1.4 RT-PCR 采用TRIzol裂解组织提取RNA,根据Invitrogen cDNA合成试剂盒说明逆转录合成cDNA。本研究所用的引物序列如下:HIF-2α正义链:5′-tgaaaacgagtccgaagcc-3′,反义链:5′-gtggctgacttgaggttga-3′;MDR1 正义链:5′-accaagcggctccgataca-3′,反义链:5′-tcattggcgagcctggtagtc-3′;GAPDH正义链:5′-attcatc tctcctctccca-3′,反义链:5′-gttggtggttggtactgt-3′,预期扩增片段大小分别为342,110和580 bp。取反应产物5 μl用1.5%琼脂糖凝胶电泳,在凝胶成像仪上成像并测定分析。
1.5 缺氧模型的建立 将生长状态良好的人乳腺癌细胞系MCF-7细胞置于三气培养箱(2%O2,5%CO2,93%N2)中低氧培养。分别缺氧12 h,24 h,48 h,缺氧48 h/复氧3 h,根据缺氧时间设立4组,以常规培养(5%CO2,95%空气)的MCF-7细胞作为对照。每组平行设置3瓶,重复3次。
1.6 荧光定量RT-PCR 按照Trizol 试剂说明书抽提细胞内的总RNA及逆转录为cDNA,总反应体系为50 μl:10×PCR缓冲液 2.5 μl,Taq酶 0.25 μl,25 mmol/L MgCl21.5 μl,35 pmol/L 5′和3′引物各1 μl,dNTP混合物0.5 μl,cDNA 模板2.5 μl,去离子水15.75 μl,sybrGreen 染料25 μl。反应条件:94℃×5 min,94℃×1 min、50℃×1 min,72℃延伸5 min,共40个循环。根据Ct值通过公式2-ΔΔCt进行相对定量分析计算可得HIF-2α和MDR1 mRNA相对表达量。
1.7 Western 印迹 按照试剂盒说明书提取细胞总蛋白,按BCA蛋白含量检测试剂盒步骤制作标准曲线,计算样品蛋白浓度,蛋白上清经SDS-聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜,用含1%脱脂奶粉的TBST封闭30 min,加入Ⅰ抗于37℃孵育2 h;加入Ⅱ抗于室温孵育37℃孵育1 h,电化学发光(ECL)显色。显色结果用软件Quantity One进行灰度分析,并计算蛋白的相对表达水平。
1.8 统计学方法 应用SPSS13.0软件进行χ2、t检验,相关性采用Spearman分析。
2 结 果
2.1 HIF-2α和P-gP蛋白在正常乳腺组织和乳腺癌组织中的表达 在乳腺癌组织中HIF-2α蛋白的阳性表达率〔23例(76.7%)〕均显著高于正常乳腺组织中的表达〔22例(46.8%),χ2=6.722,P=0.010〕;在乳腺癌组织中的P-gP蛋白阳性表达率〔24例(80.0%)〕亦显著高于正常乳腺组织中的表达〔27例(57.4%),χ2=4.165,P=0.041〕,见图1。
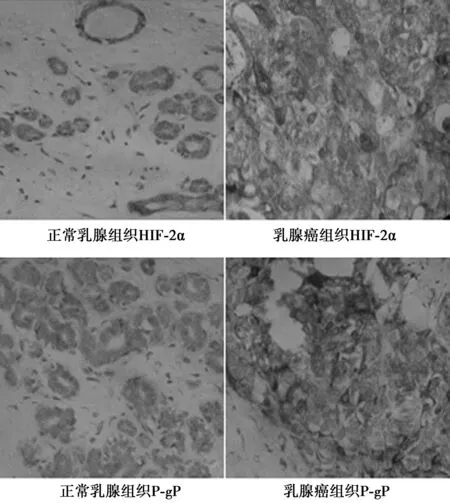
图1 HIF-2α和P-gP蛋白在不同组织中的表达(DAB,×200)
2.2 乳腺癌组织中HIF-2α和P-gP蛋白表达的相关性 乳腺癌组织中HIF-2α蛋白和P-gP蛋白的表达呈正相关(r=7.873,P=0.005)。
2.3 HIF-2α和MDR1 mRNA在乳腺癌组织和正常乳腺组织中的表达 在乳腺癌组织中HIF-2α mRNA的表达水平(0.896±0.012)显著高于其在正常乳腺组织中的表达(0.664±0.006,t=9.578,P=0.001);在乳腺癌组织中MDR1 mRNA的表达水平(0.884±0.016)亦显著高于在正常乳腺组织中的表达(0.626±0.007,t=9.692,P=0.001),见图2。

图2 RT-PCR检测HIF-2α和MDR1 mRNA的表达
2.4 乳腺癌组织中HIF-2α和MDR1 mRNA表达的相关性 乳腺癌组织中HIF-2α mRNA和MDR1 mRNA的表达呈正相关(r=5.487,P=0.019)。
2.5 MCF-7细胞株常氧与缺氧条件下HIF-2α和MDR1 mRNA的表达情况 随着缺氧时间的延长,HIF-2α和MDR1的表达呈逐渐升高趋势(P<0.05);复氧后它们的表达又不同程度地减弱(P<0.05)。由此可见,HIF-2α和MDR1的表达之间呈现同步改变。见表1。
表1 在不同缺氧时间点HIF-2α和MDR1 mRNA的 相对表达差异
与对照组比较:1)P<0.05;与前一缺氧时间点比较:2)P<0.05;与复氧3 h组比较:3)P<0.05,下表同
2.6 MCF-7细胞株常氧与缺氧条件下HIF-2α和P-gP蛋白的表达情况 Western印迹结果显示,随着缺氧时间的延长,HIF-2α和P-gP蛋白的相对表达量也逐渐增高;但在恢复供氧仅3 h后HIF-2α和P-gP蛋白的表达即开始下降。P-gP蛋白的表达增高与HIF-2α的表达呈同步改变,见表2。
表2 在不同缺氧时间点HIF-2α和P-gP 蛋白的相对表达量
3 讨 论
绝大多数实体肿瘤包括乳腺癌在内存在缺氧微环境。在缺氧微环境中肿瘤的新生血管生成、能量代谢、细胞增殖和转移等相关基因的表达受到缺氧诱导因子的调节〔2,3〕。缺氧也同时加剧了肿瘤细胞的基因不稳定性,一些肿瘤生存因子被激活,造成了肿瘤细胞的化疗耐受,促进了肿瘤细胞的转移,进而影响了患者的预后〔4〕。因此,肿瘤的缺氧微环境与肿瘤的发生发展、转移和预后之间关系密切,这一领域也将成为寻找肿瘤新治疗方法的研究热点。
MDR是肿瘤患者进行有效化疗的主要障碍之一,也是肿瘤患者化疗急需解决的难题。MDR1编码的P-gP过度表达是产生耐药的主要机制,其可将进入细胞内的抗癌药物主动泵出细胞外,细胞内的药物积聚被减少,使大多数实体肿瘤,如结肠癌、乳腺癌、肝癌、肺癌等产生耐药〔5〕。
HIF-2α是调节肿瘤血管形成、增殖凋亡、糖代谢及化疗耐药等多种相关基因表达的重要转录因子,与HIF-1α具有48%的结构同源性,受氧水平调节〔6〕;低氧微环境导致肿瘤对化疗药物耐药的机制仍不清楚。本研究发现在乳腺癌组织中HIF-2α和P-gP蛋白及mRNA的表达均显著高于正常乳腺组织,且二者表达正相关。吴倩等〔7〕研究结果显示,靶向HIF-2α的siRNA表达载体能够有效阻遏HIF-2α基因的表达,抑制P-gP蛋白的表达,从而逆转肺腺癌A549细胞对顺铂的化疗耐药性。Chen等〔8〕在对结肠癌的研究中发现,抑制HIF-1α 通过下调MDR1/P-gP表达逆转多药耐药。由此可见,HIFs可能通过上调P-gP表达,在包括乳腺癌在内的多种恶性肿瘤化疗耐药机制及进展中发挥重要作用,其确切机制尚不完全清楚,有待于深入研究。
本研究表明在缺氧环境中,随着缺氧时间的延长,人乳腺癌MCF-7细胞的HIF-2α和多药耐药相关基因MDR1的蛋白和mRNA水平的表达量均逐渐增高,但二基因的表达在恢复供氧仅3 h后即开始下降。这些现象提示乳腺癌细胞高表达MDR1基因可受周围环境缺氧的诱导,而MDR1的表达直接参与了乳腺癌多药耐药表型的形成已被证实,因而我们可得出结论:乳腺癌生长局部微环境的缺氧可诱导其MDR的产生,乳腺癌在其生长微环境因素的影响下,由于细胞内MDR相关基因的表达升高而获得了MDR的表型。另外在本研究中多药耐药相关基因MDR1的表达增高与HIF-2α的表达亦呈同步性变化,这提示细胞内多药耐药相关基因表达受核转录因子HIF-2α的调控。以上结果表明,在缺氧环境中核转录因子HIF-2α可受缺氧这一物理因素的影响来调控MDR基因的表达,从而使乳腺癌表现出了化疗耐药的特性。Rognon等〔9〕已证实MDR1基因是缺氧反应性基因,在该基因启动子上存在着缺氧反应原件(HRE),进一步从基因水平上为此结论提供了确凿的证据。
综上,乳腺癌产生MDR的重要原因之一是受其生长的缺氧微环境所诱导。缺氧可通过核转录因子HIF-2α来调控乳腺癌细胞内MDR1基因的表达,从而使乳腺癌出现以基因水平改变为基础的获得性耐药。同时这也提示HIF-2α和多药耐药基因将可能成为临床上逆转乳腺癌化疗耐药的新的分子靶点;设计可特异性阻断其表达的小分子,并与化疗药物联合应用,将有望成为实现乳腺癌有效化疗的重要手段。
1 Hu Y,Wang J,Tao H,etal.Association analysis between MDR1 genetic variant and breast cancer risk factors in Chinese Han population〔J〕.Med Oncol,2013;30(3):683.
2 He C,Sun XP,Qiao H,etal.Downregulating hypoxia-inducible factor-2α improves the efficacy of doxorubicin in the treatment of hepatocellular carcinoma〔J〕.Cancer Sci,2012;103(3):528-34.
3 Christiaansen CE,Sun Y,Hsu YC,etal.Alterations in expression of HIF-1α,HIF-2α,and VEGF by idiopathic overactive bladder urothelial cells during stretch suggest role for hypoxia〔J〕.Urology,2011;77(5):1266.e7-11.
4 Zhao D,Zhai B,He C,etal.Upregulation of HIF-2α induced by sorafenib contributes to the resistance by activating the TGF-α/EGFR pathway in hepatocellular carcinoma cells〔J〕.Cell Signal,2014;26(5):1030-9.
5 Huang F,Wu XN,Chen J,etal.Resveratrol reverses multidrug resistance in human breast cancer doxorubicin-resistant cells〔J〕.Exp Ther Med,2014;7(6):1611-6.
6 Rundqvist H,Johnson RS.Tumour oxygenation:implications for breast cancer prognosis〔J〕.J Intern Med,2013;274(2):105-12.
7 吴 倩,袁 凯,钱 成,等.HIF-2α基因与人肺腺癌A549细胞株对顺铂耐药性的关系〔J〕.中国临床医学,2013;20(6):772-5.
8 Chen J,Ding Z,Peng Y,etal.HIF-1α inhibition reverses multidrug resistance in colon cancer cells via downregulation of MDR1/P-Glycoprotein〔J〕.PLoS One,2014;9(6):e98882.
9 Rognon B,Kozovska Z,Coste AT,etal.Identification of promoter elements responsible for the regulation of MDR1 from Candida albicans,a major facilitator transporter involved in azole resistance〔J〕.Microbiology,2006;152(Pt 12):3701-22.
〔2016-04-01修回〕
(编辑 曹梦园)
河南省自然科学基金面上项目(162300410220);河南省教育厅高等学校重点科研项目(16A310002);河南省高校青年骨干教师资助项目(2012GGJS-136);新乡医学院联合培育基金资助项目(2014QN113)
李 娜(1977-),女,博士,副教授,主要从事恶性肿瘤分子病理学研究。
R73-37
A
1005-9202(2017)11-2638-03;
10.3969/j.issn.1005-9202.2017.11.016
