抗Aβ抗体清除Aβ寡聚体后BV2细胞对SH-SY5Y细胞损伤的影响及机制
2017-06-23曹云鹏
李 芳 曹云鹏
(中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
抗Aβ抗体清除Aβ寡聚体后BV2细胞对SH-SY5Y细胞损伤的影响及机制
李 芳 曹云鹏
(中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
目的 研究抗 Aβ1~42抗体清除Aβ1~42寡聚体后的BV2细胞对SH-SY5Y细胞损伤的影响及机制。方法 2 μmol/L Aβ1~42寡聚体处理BV2细胞为激活组,2 μmol/L Aβ1~42寡聚体处理BV2细胞6 h后加入12 μl抗Aβ1~42抗体清除Aβ1~42为抗体组,对照组加入等量的生理盐水,各组培养24 h。将各组收集的条件培养液分别处理SH-SY5Y细胞24 h,MTT法检测神经细胞活力。ELISA法检测BV2细胞上清液肿瘤坏死因子(TNF)-α水平,Western印迹法检测磷酸化p38 MAPK的表达情况。结果 抗体组对神经细胞的损伤较激活组严重(P<0.01),抗体组TNF-α的释放水平与激活组相当(P>0.05),且抗体组中磷酸化p38 MAPK蛋白仍能持续表达。结论 抗 Aβ抗体清除Aβ寡聚体后神经退行性变依然存在,而这种退行性变可能由p38 MAPK通路激活引起的免疫炎症介导。
抗 Aβ1~42抗体;阿尔茨海默病;小胶质细胞;神经退行性变
阿尔茨海默病(AD)是中枢神经系统变性疾病,是造成痴呆最常见原因。目前关于AD病因的主要假说是淀粉样蛋白级联假说〔1〕,这一理论认为Aβ,尤其是高毒性的低聚形式是促发疾病发生的主要原因。最近研究表明,Aβ1~42寡聚体对神经元的毒性及诱导胶质细胞的炎症反应最强,且被认为是AD炎症病理生理发生发展的早期始发因子〔2,3〕。AD免疫治疗旨在清除脑内Aβ的沉积,从而减轻中枢神经系统退行性改变来改善AD患者症状。临床研究显示,用抗Aβ抗体清除Aβ后AD患者认知及脑脊液中tau蛋白水平并没有改善〔4〕。因此,本研究以小鼠BV2小胶质细胞及神经母细胞瘤细胞(SH-SY5Y)为实验对象,应用抗Aβ1~42抗体清除Aβ1~42寡聚体后预处理小胶质细胞,观测其条件培养液对SH-SY5Y神经细胞的影响,探讨抗Aβ抗体清除Aβ后对细胞损伤的影响及机制。
1 材料与方法
1.1 细胞株 小鼠BV2小胶质细胞(购自中国协和医科大学细胞库),神经母细胞瘤细胞SH-SY5Y(中科院上海细胞库)。
1.2 主要试剂和仪器 Aβ1~42粉,二甲基亚砜(DMSO)和四甲基偶氮唑蓝(MTT)(Sigma公司),抗Aβ1~42抗体(Abcam公司),六氟异丙醇(HFIP)(上海紫一试剂厂),DMEM/F12培养基、胎牛血清(HyClone公司)。Ham.s F-12培养基(BioSource公司),p38 MAPK,磷酸化p38 MAPK及α-tubulin抗体(Cell Signaling公司),二喹啉甲酸(BCA)蛋白定量试剂盒,Western印迹化学发光检测试剂盒(碧云天生物技术公司),肿瘤坏死因子(TNF)-α ELISA试剂盒(RD公司)。
1.3 Aβ1~42寡聚体的制备 按Klein WL(2002)方法制备Aβ1~42寡聚体,冻干Aβ1~42粉经化学试剂HFIP处理后风干,用少量DMSO溶解后,重悬于Ham.s F-12培养基,配成50 μmol/L的母液,4℃孵育24 h备用。
1.4 BV2小胶质细胞实验分组及条件培养液的制备 激活组:向BV2细胞培养液中加入2 μmol/L Aβ1~42寡聚体,抗体组:向BV-2细胞培养液中加入2 μmol/L Aβ1~42寡聚体后6 h再加入12 μl抗Aβ1~42抗体形成抗原抗体复合物,清除Aβ1~42。对照组:BV2小胶质细胞加入等量生理盐水各组培养24 h后,取上清离心后备用。
1.5 SH-SY5Y细胞处理及MTT测细胞存活率 SH-SY5Y细胞以每孔10×105/ml细胞密度于前夜接种于96孔板中(每孔200 μl),培养过夜后更换上述收集的3组条件培养液继续培养24 h。每孔加入5 g/L MTT溶液20 μl,37℃孵育4 h后,加入DMSO 150 μl并震荡15 min,于570 nm波长处测定各孔A570值。细胞存活率=(实验组OD值-调零OD值)/(对照组OD值-调零OD值),实验重复3次。
1.6 ELISA测定BV2细胞上清液TNF-α ①加样:向反应板相应孔依次加入不同浓度的标准品及待测样本各100 μl;②反应板加盖覆膜,37℃温育1 h;③洗涤:弃去反应板孔内液体,用洗涤液充分洗涤3次,用滤纸吸干;④显色:每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,振荡混匀,37℃避光显色10 min;⑤显色:每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,振荡混匀,37℃避光显色10 min;⑥终止:每孔加入终止液50 μl,终止反应;⑦测定:加终止液后10 min,以空白孔调零,450 nm处测量各孔OD值。
1.7 Western 印迹法检测磷酸化p38 MAPK表达水平 将收集的BV2细胞用细胞裂解缓冲液裂解后,用蛋白定量分析(BCA法)测定细胞蛋白浓度。蛋白加样量为50 μg,经10%SDS-PAGE电泳分离后转膜,置膜于5%BSA封闭液中封闭1 h,加入兔抗鼠磷酸化p38 MAPK,总p38 MAPK一抗(1∶1 000),4℃孵育过夜。加入辣根过氧化物酶标记的二抗(1∶5 000)2 h,化学发光显色。实验重复3次。
1.8 统计学方法 采用SPSS15.0统计软件进行t检验。
2 结 果
2.1 SH-SY5Y细胞存活率检测结果 与对照组(100%)相比,激活组和抗体组的细胞存活率明显下降,分别为(61.65±3.04)%和(13.55±3.04)%,提示Aβ1~42寡聚体诱导的小胶质细胞培养液可引起神经元损伤。抗体组的神经细胞存活率明显低于激活组(P<0.01)。
2.2 细胞因子TNF-α检测结果 激活组〔(263.4±13.38)ng/L〕和抗体组〔(268.6±12.10)ng/L〕均可引起TNF-α的释放且水平明显高于对照组〔(124.3±7.43)ng/L,P<0.05〕。激活组和抗体组引起的TNF-α升高水平相当,二者比较差异无统计学意义(P>0.05),提示加入抗体清除Aβ后由小胶质细胞介导的炎症反应仍然存在。
2.3 磷酸化p38 MAPK蛋白的检测结果 Aβ1~42寡聚体可以诱导磷酸化p38 MAPK的表达且作用6 h后达高峰,从而激活p38 MAPK通路介导炎症反应。在上述通路激活后加入抗体清除Aβ后,p38 MAPK通路依然持续激活。见图1。
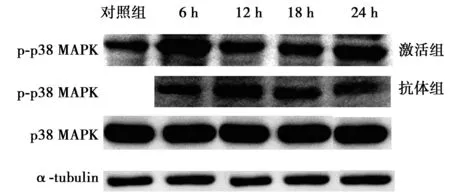
图1 各组作用于小胶质细胞磷酸化p38 MAPK蛋白的表达水平
3 讨 论
免疫炎症是AD的一个重要发病机制,在AD患者脑中可以观察到炎症过程的激活和自身免疫反应〔5〕。有研究表明,Aβ寡聚体可以激活小胶质细胞中的特定信号通路,如p38 MAPK〔6〕,释放炎症介质如TNF-α从而引起细胞凋亡。本研究利用Aβ寡聚体作用于小胶质细胞6 h后p38 MAPK通路激活并达高峰,并且与对照组相比TNF-α水平显著增高,且其条件培养液作用于神经细胞后可引起神经细胞显著损伤。AD的免疫治疗旨在清除患者脑内的Aβ,从而阻止神经退行性变的进展。一些主动和被动免疫方法正在临床试验阶段〔7~9〕。然而,有临床研究显示,用抗Aβ抗体清除Aβ后AD患者的认知及脑脊液中tau蛋白水平并没有改善,且某些免疫治疗甚至可引起脑膜脑炎及血管性水肿等不良反应〔8,10〕。本研究利用抗Aβ抗体清除Aβ后,神经细胞损伤并没有减轻反而加重,提示神经退行性变依然存在。本实验证实Aβ激活小胶质细胞中的p38 MAPK信号通路启动神经炎症后清除Aβ,此通路仍持续激活并介导炎症反应损伤神经细胞,参与神经退行性变,提示在Aβ产生之前对其干预或对小胶质细胞中p38 MAPK信号通路及所释放的炎症介质进行干预可能是治疗AD的有效方法。
1 Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics〔J〕.Science,2002;297(5580):353-6.
2 Dahlgren KN,Manelli AM,Stine WB Jr,etal.Oligomeric and fibrillar species of amyloid-beta peptides differentially affect neuronal viability〔J〕.Biol Chem,2002;277(35):32046-53.
3 Tamagno E,Bardini P,Guglielmotto M,etal.The various aggregation states of beta-amyloid 1-42 mediate different effects on oxidative stress,neurodegeneration,and BACE-1 expression〔J〕.Free Radic Biol Med,2006;41(2):202-12.
4 Siemers ER,Friedrich S,Dean RA,etal.Safety,tolerability and biomarker effects of an Abeta monoclonal antibody administered to patients with Alzheimer’s disease〔J〕.Alzheimers Dement,2008;4(Suppl 2):T774.
5 Wyss-Coray T,Mucke L.Inflammation in neurodegenerative disease:a double edged sword〔J〕.Neuron,2002;35(3):419-32.
6 Picone P,Carrotta R,Montana G,etal.Aβ oligomers and fibrillar aggregates induce different apoptotic pathways in LAN5 neuroblastoma cell cultures〔J〕.Biophys J,2009;96(10):4200-11.
7 Frisardi V,Solfrizzi V,Imbimbo BP,etal.Towards disease-modifying treatment of Alzheimer′s disease:drugs targeting beta-amyloid〔J〕.Curr Alzheimer Res,2010;7(1):40-55.
8 Wisniewski T,Konietzko U.Amyloid-beta immunisation for Alzheimer′s disease〔J〕.Lancet Neurol,2008;7(9):805-11.
9 Panza F,Frisardi V,Imbimbo BP,etal.Bapineuzumab:anti-beta-amyloid monoclonal antibodies for the treatment of Alzheimer’s disease〔J〕.Immunotherapy,2010;2(6):767-82.
10 Salloway S,Sperling R,Gilman S,etal.A phase 2 multiple ascending dose trial of bapineuzumab in mild to moderate Alzheimer disease〔J〕.Neurology,2009;73(24):2061-70.
〔2016-02-09修回〕
(编辑 苑云杰/曹梦园)
曹云鹏(1963-),男,教授,博士,博士生导师,主要从事阿尔茨海默病的发病与治疗研究。
李 芳(1989-),女,在读硕士,主要从事阿尔茨海默病的发病与治疗研究。
R742
A
1005-9202(2017)11-2624-02;
10.3969/j.issn.1005-9202.2017.11.010
