ClassⅡ细菌素乳酸菌的筛选与定性及群体感应系统鉴定
2017-06-19吴林昊钱宇汪慧超薛秀恒
吴林昊,钱宇,汪慧超,薛秀恒
(安徽农业大学 茶与食品科技学院,安徽农产品加工工程实验室,安徽 合肥,230036)
ClassⅡ细菌素乳酸菌的筛选与定性及群体感应系统鉴定
吴林昊,钱宇,汪慧超,薛秀恒*
(安徽农业大学 茶与食品科技学院,安徽农产品加工工程实验室,安徽 合肥,230036)
筛选具有ClassⅡ细菌素群体感应系统广谱抑菌作用的乳酸菌并进行鉴定,为产ClassⅡ细菌素乳酸菌的研究应用奠定基础。将排除过氧化氢和有机酸干扰作用的10株乳酸菌,经胰蛋白酶、胃蛋白酶和蛋白酶K处理,采用牛津杯法筛选具有分泌细菌素广谱抑菌效果的乳酸菌和最小抑菌实验检测其最小抑菌浓度,通过16S rDNA同源性分析构建系统发育树,设计合成乳杆菌ClassⅡ细菌素5个操纵子plnEFI、plnJKLR、plnGHSTUV、plnABCD和plnMNOP的特异性引物,PCR和电泳鉴定L-4分泌ClassⅡ细菌素基因群体感应系统,通过UPLC和尿素-SDS-PAGE确定细菌素的分子质量。L-4为可能具有广谱抑菌作用革兰氏阳性植物乳杆菌,它对指示菌产生的抑菌圈分别为(18.83±0.39) mm和(19.96±0.49) mm,最小抑菌浓度分别为55 μg/mL和57 μg/mL;L-4具有分泌Class Ⅱ细菌素群体感应基因系统,能够分泌分子质量为10 ku蛋白类细菌素且符合ClassⅡ细菌素分子量大小范围。L-4是1株具广谱抑菌作用且能分泌10 ku Class Ⅱ细菌素的植物乳杆菌。
乳酸菌;细菌素;16S rDNA鉴定;系统进化树;Class Ⅱ细菌素群体感应系统
乳酸菌能够产生有机酸如乳酸、丁酸和乙酸等以及过氧化氢和细菌素等化合物,这些物质不仅能保持食品的风味和良好的组织状态,还可以抑制腐败菌和病原菌的生长,从而防止腐败并延长食品的保藏期[1]。
根据细菌素分子量大小和化学结构将其分为Ⅳ类:I类细菌素为羊毛硫细菌素,他们是经过大量翻译后修饰的核糖体合成的分子质量小的多肽,长度为19~25个氨基酸;Ⅱ类细菌素为小分子、热稳定的核糖体合成多肽;Ⅲ类细菌素为分子量大,对热不稳定的蛋白质;Ⅳ类细菌素为含有脂肪或者碳水化合物部分组成的复杂大分子。
在细菌素的应用方面,目前仅有Nisin被联合国粮农组织和美国食品药品管理局所认可,批量商业化生产,作为一种天然防腐剂被广泛应用于食品加工业[2]。但Nisin仅对蜡状芽孢杆菌(Bacilluscereus)、产气荚膜杆菌(Clostridiumperfringens)、金黄色葡萄球菌(Staphylococcusaureus)和单增李斯特氏菌(Listeriamonocytogenes)等革兰氏阳性菌有抑制作用,对革兰氏阴性菌没有抑制作用。而Ⅱ类乳酸菌细菌素具有较好的理化性质但且研究相对较少,前鉴定产Ⅱ类细菌素乳酸菌的步骤繁琐、需要耗费大量的人力、物力和时间。用于产细菌素乳酸菌生长的天然培养基是非常复杂的,因为乳酸菌是非常苛刻的微生物,它的生长需要各种氨基酸、维生素和矿物质等,这些营养元素一般是通过大豆粉、酵母提取物、肉提取物等来供给。所有这些原料就组成了乳酸菌所需要的氨基酸来源的蛋白质和肽,这些蛋白质和肽与细菌素的分子量及性质是极其相近的。因此导致乳酸菌细菌素分离纯化步骤繁琐、抑菌活性大量损失、细菌素回收率低、很难纯化为纯体。
本文通过筛选出1株具有广谱抑菌作用并具有产Ⅱ类细菌素的乳酸菌,从菌株鉴定,菌株抑菌活性检测及最终对该菌株分泌Ⅱ类细菌素分离纯化进行了研究。从而鉴别出1株具有广谱抑菌作用、分泌Ⅱ类细菌的植物乳杆菌,从而在后续的研究中用于食品工业。
1 材料与方法
1.1 试验材料
菌株:10株乳酸菌L-1、L-2、L-3、L-4、L-5、L-6、L-7、S-1、S-2、S-3,来源于南京农业大学,于2014年平板画线法分离纯化,冷冻干燥法保藏菌种。指示菌株为大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus),来自安徽农业大学畜产品加工实验室。
试剂:过氧化氢酶、胰蛋白酶、胃蛋白酶、蛋白酶K,购自阿拉丁;DNA提取试剂盒TAKARA MRS、LB购自国药集团化学有限公司。
1.2 方法
株活化及保藏→牛津杯[8-12]法筛选产抑菌物质乳酸菌→产细菌素乳酸菌的鉴定→乳酸菌DNA提取→16S rDNA同源性分析及系统发育进化树构建→特异性引物设计→群体感应系统鉴定。
1.2.1 牛津杯法筛选具有抑菌作用[13-14]的乳酸菌
将目标菌株与指示菌置于MRS液体培养基活化3次备用。将10 mL灭菌营养琼脂培养基倾注于直径90 mm培养皿中凝固后作底层,每皿放入4个牛津杯,0.1 mL指示菌液(1×108CFU/mL)加入5 mL冷却至45 ℃的LB培养基,使其凝固作为菌层。向牛津杯形成直径10 mm圆孔孔洞内加入待检测抑菌活性菌液,接种量为1×106CFU/mL,适宜温度下培养18 h后,测量抑菌圈直径。金黄色葡萄球菌、大肠杆菌作为指示菌,挑选抑菌圈最大的乳酸菌株后续研究。
1.2.2 有机酸、过氧化氢抑菌作用
将1.2.1抑菌圈最大的乳酸菌菌株经10 000 r/min、2 min离心取发酵上清液,2 mol/L NaOH溶液中和到pH为5.0后,牛津杯法抑菌实验,并设pH为5.0的乙酸和乳酸、未调pH值的发酵上清液作为对照,检测抑菌活性并测量其抑菌圈直径。
将菌接种于MRS液体,10 000 r/min离心2 min,取过氧化氢酶溶液100 μL,加入0.9 mL pH为5.0的发酵上清液中使过氧化氢酶终浓度为50 U/mL,并设未加过氧化氢酶的pH为5.0发酵上清液和产细菌素菌株为对照,牛津杯法检测抑菌活性。
1.2.3 抑菌物质的蛋白酶水解作用
将1.2.1抑菌圈最大的乳酸菌菌株,调节pH为不同蛋白酶的最适作用pH,按1.0 mg/mL分别加入胰蛋白酶、蛋白酶K和胃蛋白酶,37 ℃下温育1 h,将pH值调回到细菌素pH=5牛津杯抑菌试验,重复3次。发酵上清液作为对照,验证乳酸菌发酵上清液的抑菌活性是否为蛋白质。
1.2.4 MIC试验
将1.2.1抑菌圈最大的乳酸菌菌株,利用96孔微量滴定板,分别测定上述牛津杯试验中发酵上清、无有机酸的发酵上清、无过氧化氢的发酵上清及蛋白酶处理的发酵上清对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度的变化。
1.2.5 产细菌素乳酸菌菌体的形态特征
将1.2.1抑菌圈最大的乳酸菌菌株在MRS固体培养基上平板四区划线,37 ℃培养24 h后,挑取大小适中单一菌落进行革兰氏染色观察菌体形态。
1.2.6 乳酸菌菌株的菌种鉴定[15]
将1.2.1抑菌圈最大的乳酸菌菌株进行细菌基因组DNA提取,参照细菌DNA提取试剂盒(德国 QIAGEN)说明书步骤进行。
1.2.7 16S rDNA基因保守序列扩增
根据文献中乳酸菌上、下游通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA基因[16]。PCR反应体系25 μL:模板DNA 2.0 μL,Mix(2×TaqDNA Polymerase,2×PCR Buffer,2×dNTP)12.5 μL,上下游引物各1.0 μL,ddH2O 8.5 μL。PCR反应:94 ℃预变性300 s;94 ℃变性30 s,56 ℃退火60 s,72 ℃延伸120 s,循环30次;72 ℃终延伸600 s。5 μL扩增片段电泳观察结果。
1.2.8 菌种鉴定并构建系统进化树
将1.2.1抑菌圈最大的乳酸菌菌株,PCR扩增结果16S rDNA基因电泳检测,将PCR产物送上海生工测序。将菌株序列结果与GenBank数据库中已知菌株序列比对,通过MEGA4软件序列分析目的基因序列的同源性,构建系统发育树[17]。
1.2.9 Class Ⅱ细菌素群体感应系统的鉴定
根据系统进化树同源性比对结果,设计乳杆菌ClassⅡ细菌素5个操纵子plnEFI、plnJKLR、plnGHUV、plnABCD和plnMNOP的特异性引物见表1。
反应体系25 μL:2×TapPCR Master Mix 12.5 μL,上、下游引物1.0 μL,DNA 2.0 μL,ddH2O 8.5 μL,设置空白对照。PCR反应条件:94 ℃变性5 min; 94 ℃变性30 s,退火温度采用各引物要求温度、72 ℃延伸2 min,30个循环;最后72 ℃延伸10 min。琼脂糖凝胶电泳在标准条件下检测并送至上海生工测序比对。
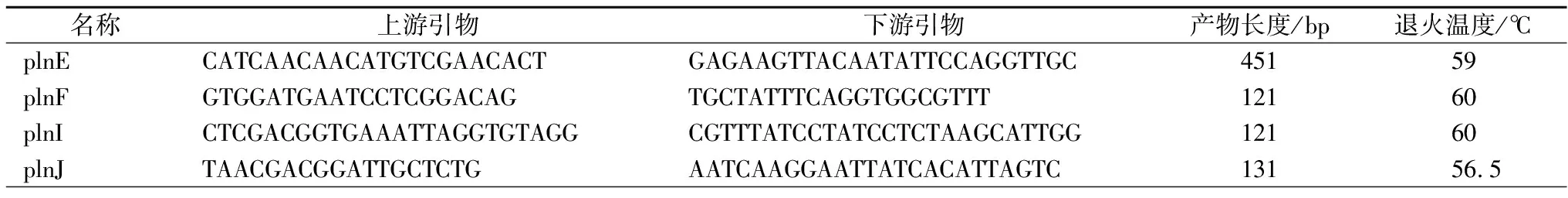
表1 Class II细菌素特异性引物
续表1

名称上游引物下游引物产物长度(bp)退火温度/℃plnkCTGTAAGCATTGCTAACCAATCACTGCTGACGCTGAAAAG141575plnLAGATGCCGCTCCGTAAAGTAGTGCATCGTATTTGCGTGTC26160plnRCCCATCACTAAGCCCTTGATGCTTGCTGGTAGCGCTTATT10159plnGTGCGGTTATCAGTATGTCAAAGCCTCGAAACAATTTCCCCC141575plnHTCTTACACGATCAAGGCAACTGTGCCACTTACCTGTTTC131585plnUCTCGGCCATGGTTATCAGTTGACATCCCATTGCGGTACTC66157plnVCGGAGAATGTTGCTGACTTGGAAGAAATTGCCGCGAATAA57157plnAGTAGGTGGAAAGAGTAGTGCGTAACAGTTTCTTTACCTGTTTAATTGC141595plnBTTCAGAGCAAGCCTAAATGACGCCACTGTAACACCATGAC111615plnCAGATGAAATTCGGCAGCAGTATAATCCAACGGTGCAATCC12160plnDTGAGGACAAACAGACTGGACGCATCGGAAAAATTGCGGATAC10158plnMTAAACAGGTAAAGCAGGTTGGAAGATAATCCTGACCAGACACC48157plnNCCGGGTTAGGTATCGAAATGCACTCGAAGTTCCCTCTGCT12159plnOGGCTGAAGGAGCATCAGTGTTTTGCAGTATCCGCCTTTCT22160plnPTTTGCAAGTGGTCTGCTTTGATTAATTGAGGGCGGGTAGG12160
1.2.10 ClassⅡ细菌素分子量测定
乳酸菌株37 ℃下静置培养传代至第3代,4 ℃、8 000 r/min离心10 min取上清液。细菌素初提液水系0.22 μm滤处理上清,超滤系统(50 ku)超滤细菌素,截取分子量1~50 ku的物质,进一步通过UPLC H-Class系统分离纯化细菌素,检测方法:C18柱,V(水)∶V(乙腈)∶V(乙酸)=95∶4∶1,流速为0.1 mL/min,紫外波长218 mm,上样量0.1 μL,采用Tricine-SDS-PAGE电泳来确定其分子质量大小,并通过牛津杯法确定该细菌素的蛋白性质。
2 结果与分析
2.1 产抑菌物质的乳酸菌筛选
10株乳酸菌分别命名:L-1、L-2、L-3、L-4、L-5、L-6、L-7、S-1、S-2、S-3。经牛津杯法筛选后,图1、图2和图3表明,这10株菌对2株指示菌均具有良好抑菌效果。
图1 十株乳酸菌对大肠杆菌抑菌效果Fig.1 The antimicrobial effect of 10 strains of lactic acid bacteria against E.coli
图2 十株乳酸菌对金黄色葡萄球菌抑菌效果Fig.2 The antimicrobial effect of 10 strains of lactic acid bacteria against S.aureus
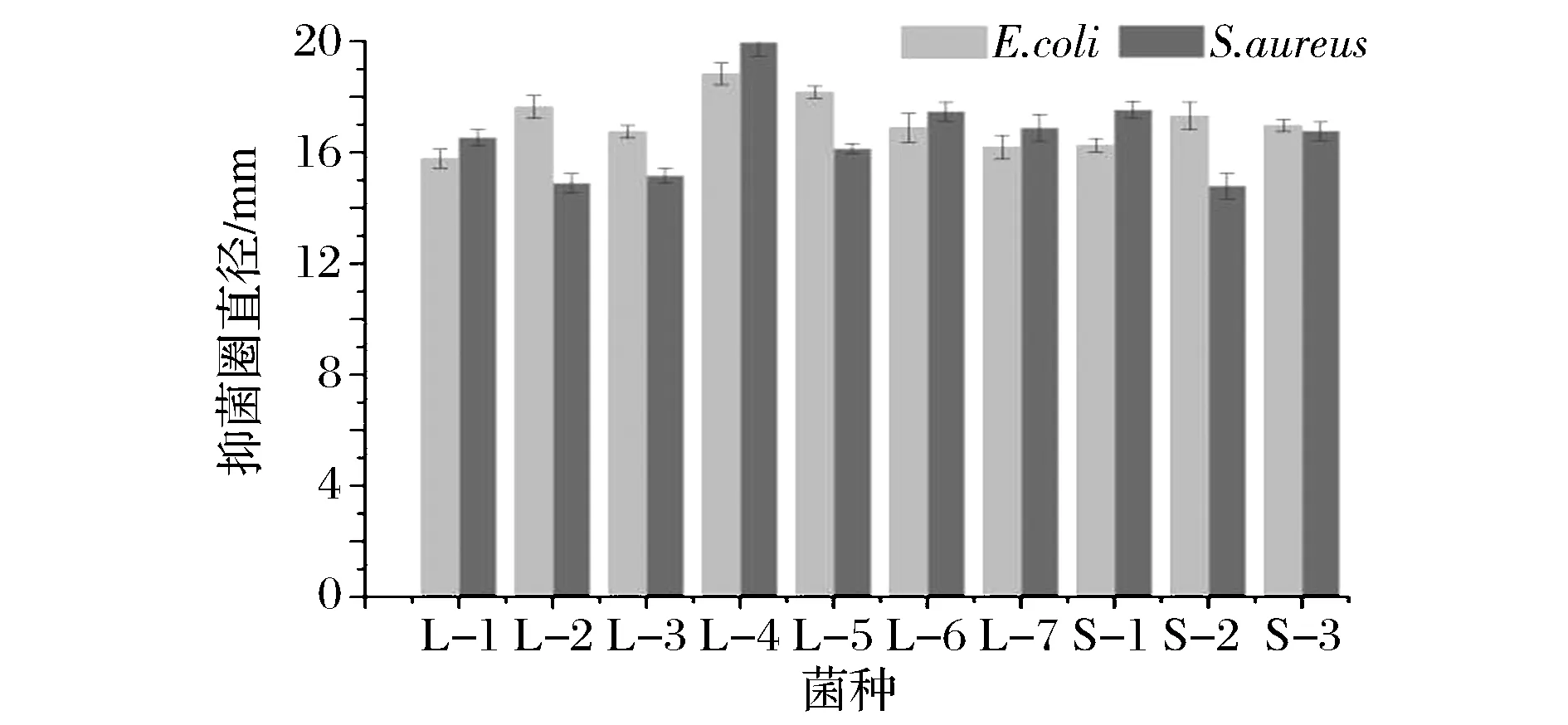
图3 十株乳酸菌的抑菌效果Fig.3 The antibacterial effect of the 10 strains of lactic acid bacteria
2.2 有机酸抑菌试验[18]
乳酸菌发酵液对指示菌抑制作用,可能是代谢合成的细菌素或酸性末端产物如乙酸、乳酸及其他有机酸作用的结果。图4说明,pH=5的L-4发酵上清液与发酵原液抑菌效果相近,与发酵上清液pH值相同的乳酸、乙酸实验组对2种指示菌的抑菌效果明显较小,这说明在排除酸性末端产物的抑菌干扰后,发酵液中还存在其他抑菌活性物质,L-4的发酵上清液产生的主要抑菌物质并非有机酸。
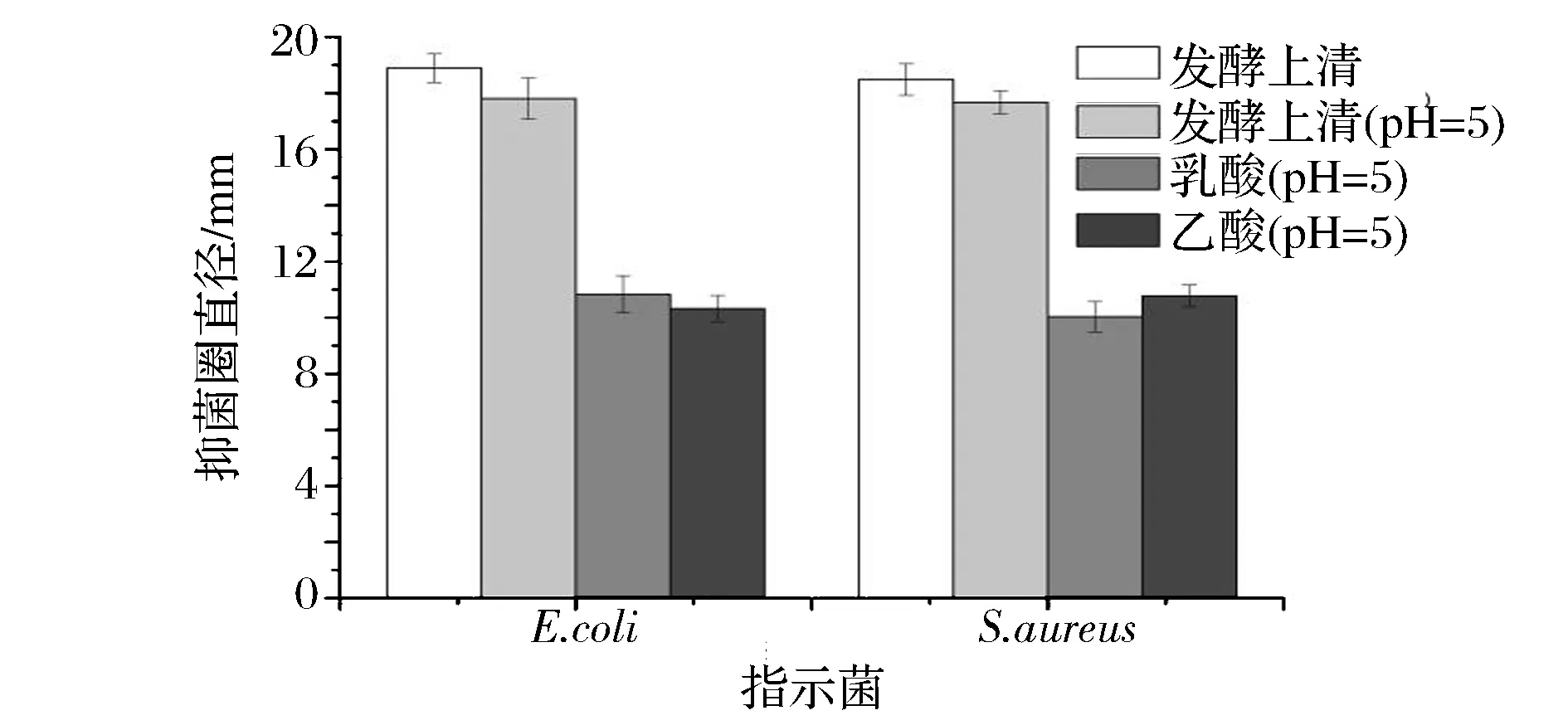
图4 排除有机酸抑菌实验结果Fig.4 Results of antibacterial by supernatant without organic acid
2.3 过氧化氢抑菌试验
乳酸菌代谢过程中的过氧化氢也可抑制指示菌生长。过氧化氢酶处理发酵上清,以未经过氧化氢酶处理的乳酸菌原液、发酵上清液为对照,结果见图5。图5可以看出,L-4菌株发酵液经过氧化氢酶处理后,抑菌圈直径与发酵上清原液、细菌原液的抑菌圈直径相比变化不大,活性下降了9.5%,从而可以证明L-4菌株发酵液中抑菌物质不完全是过氧化氢,有其他抑菌物质对指示菌起抑制作用。
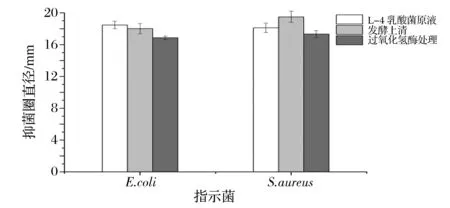
图5 过氧化氢酶处理后的抑菌活性Fig.5 Results of antibacterial after treated with catalase
2.4 细菌素的蛋白酶敏感性试验
为确定抑菌物质是否具有蛋白质性质,用胰蛋白酶、胃蛋白酶和蛋白酶K对发酵液处理。从图6可以看出,发酵液经胰蛋白酶、胃蛋白酶和蛋白酶K处理后,抑菌圈直径显著减小,经胰蛋白酶处理后活性分别下降58.9%、61.4%,经胃蛋白酶处理后活性分别下降62.1%、61.3%,蛋白酶K处理后活性分别下降63.4%、66.9%。可见抑菌物质对胰蛋白酶、胃蛋白酶和蛋白酶K敏感。初步确定这种抑菌物质具有蛋白性质,是一种细菌素。
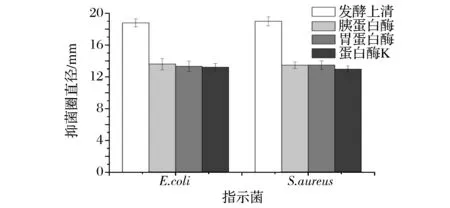
图6 胰蛋白酶、胃蛋白酶和蛋白酶K处理后抑菌实验结果Fig.6 Results of antibacterial after treated with trypsin,pepsin and proteinase K
2.5 MIC试验
MIC试验结果与牛津杯抑菌试验结果相符,L-4未经处理的发酵上清(图7-A)最小抑菌浓度为36、37 μg/mL;与发酵上清液经过排除有机酸(图7-B)、过氧化氢(图7-C),蛋白酶(图7-D)处理后的抑菌作用相比,最小抑菌浓度分别为45、48、55和57 μg/mL。L-4最小抑菌浓度均有所上升,抑菌活性均有所减小,蛋白酶处理后L-4发酵上清液(图7-D)基本无抑菌作用,说明发酵上清液中起主要抑菌作用的是L-4分泌的蛋白类细菌素。
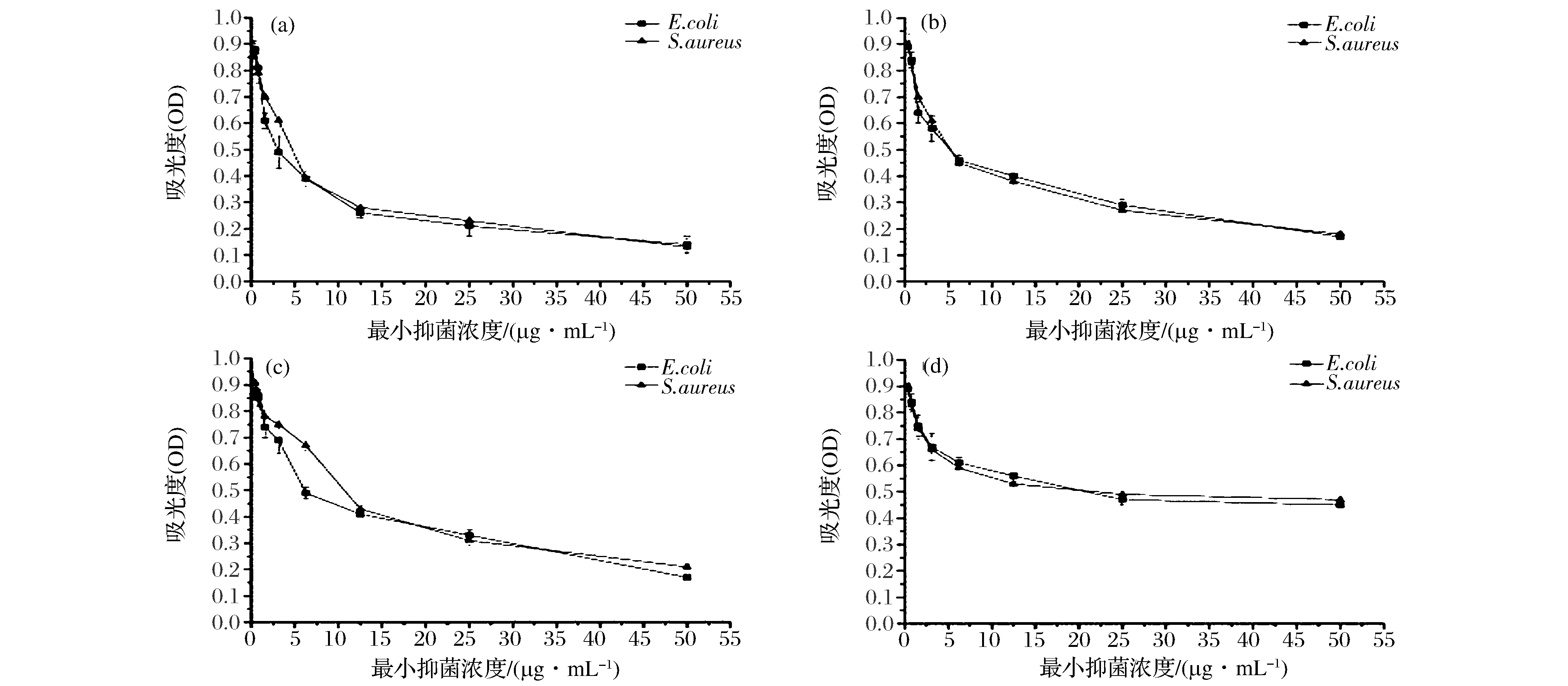
图7 MIC试验结果Fig.7 Results of MIC
2.6 乳酸菌形态观察
图8为革兰氏染色镜检结果,L-4为革兰氏阳性棒状乳杆菌。

图8 L-4革兰氏染色镜检结果Fig.8 Microscopic examination resuLts of Gram staining
2.7 同源性分析及系统发育树构建
乳酸菌L-4基因组经16S rRNA基因PCR 扩增后,其条带大小为1 500 bp。经上海生工测序比对基因序列为1 409 bp。菌株L-4的16S rDNA基因序列与GenBank比对结果表明,菌株L-4与其他植物乳杆菌有较高同源性。为比较菌株L-4与其菌种之间亲缘关系及其系统地位,使用生物信息学软件Clustal X和MEGA 4.0 中的邻接法进行序列同源性比对构建系统进化树[19-20],结果如图9所示。从图9可以看出,菌株L-4与植物乳杆菌有亲缘关系,相似性达到98%。使用DNAMAN软件比对同一菌属符合上述结果,说明菌株L-4在分类学地位上归属于乳杆菌属,为植物乳杆菌。
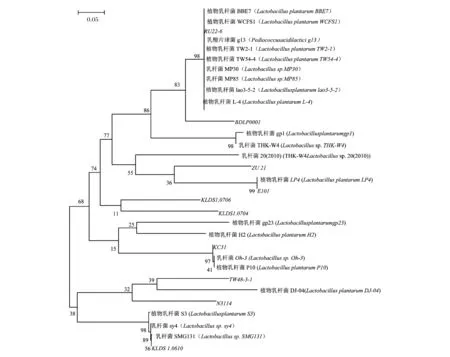
图9 L-4菌株系统发育树Fig.9 The phylogenetic trees of L-4注:水平距离与虚拟的进化变化成正比,树上的分支数是验证信誉度。
2.8 ClassⅡ细菌素基因分析
ClassⅡ类细菌素5操纵子plnEFI,plnJKLR,plnGHUV,plnABC和plnMNOPPCR扩增电泳结果见图10。植物乳杆菌WCFS1具有ClassⅡ细菌素5操纵子基因,根据菌株系统发育树的结果,设计出5个操纵子的特异引物并通过电泳测序结果比对序列。说明L-4与WCFS1具有相似的ClassⅡ细菌素群体感应系统,且每个基因的表达量不一样导致电泳条带明暗程度不一,因为群体系统中不同基因操纵子表达调控的功能作用不一样,由于相互之间有协同与滞后作用导致基因的表达量不一样。
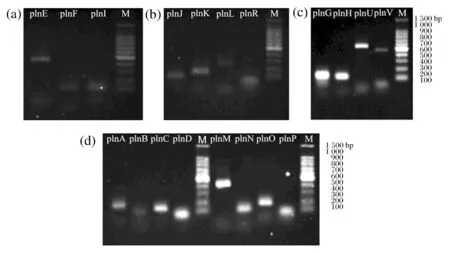
M-100 bp DNA梯度分子marker图10 群体感应基因表达结果Fig.10 The quorum sensing gene expression
2.9 ClassⅡ细菌素分子质量确定
将L-4发酵上清液通过超滤系统截留下1~50 ku的小分子蛋白后,UPLC检测结果如图11所示,分别收集图中A、B、C、D后,经过Tricine-SDS-PAGE,结果显示发酵上清液(图12-A)中含有多种蛋白分子条带,说明L-4分泌的细菌素中含有多种小分子蛋白,并且有2条条带小于10 ku的小分子蛋白;图12-B主要含有20 ku蛋白类物质,还含有30~40 ku蛋白,可能是因为在收集A峰蛋白物质拖尾导致参入其他蛋白;图12-C主要含有10 ku蛋白类物质;图11-D峰无条带。牛津杯法显示峰C的具有抑菌活性,对两株指示菌的抑菌直径分别为(7.13±0.23) mm和(6.61±0.17) mm经蛋白酶处理后无抑菌性,说明收集的图11峰C是均有抑菌作用分子质量为10 ku蛋白类物质。
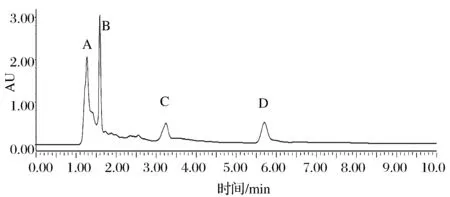
图11 UPLC检测结果Fig.11 Results of UPLC
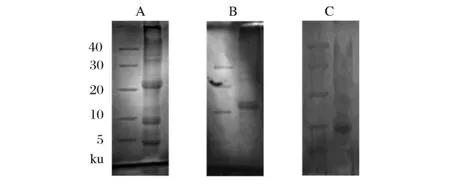
图12 蛋白电泳结果Fig.12 Results of protein electrophoresis
3 结论
由于乳酸菌菌种繁多,传统的鉴定方法比较繁琐、低效,存在一定的缺陷。近来许多研究人员将眼光放在了分子水平上,从环境微生态系统中直接分离提取16S rRNA或DNA并进行序列分析。16S rRNA是原核生物糖体小亚单位上的一个RNA分子,分子质量约为0.6×106u,由1 500多个核苷酸组成。16S rRNA的一级结构非常保守,而决定其一级结构的16S rRNA基因序列也非常保守。随着16S rRNA基因库的建立,可以发现同届或同种微生物16S rDNA序列之间保持很高的同源性。这种同源性与物种间的亲缘关系有着密切的对应关系。一般来讲,在种这个分类等级上,如果2个分类单位区间的16S rRNA序列同源性大于95%,则认为它们属于同一个属[21]。
本文以分子鉴定为主,理化鉴定为辅,分子鉴定和理化鉴定相结合来鉴定筛选出的产细菌素的L-4乳酸菌。革兰氏染色显微镜检结果说明,L-4菌为革兰氏棒状乳杆菌;牛津杯法排酸、排过氧化氢抑菌,细菌素蛋白酶敏感性试验和MIC试验,确定该菌株所产生的抑菌物质是蛋白类细菌素;后经16S rDNA 序列分析和同源性比对,综合鉴定L-4菌为革兰氏阳性棒状植物乳杆菌。通过PCR基因表达鉴定,该菌株含有分泌Ⅱ类细菌素的群体感应系统,超滤系统、UPLC和蛋白电泳鉴定显示L-4分泌的细菌素中的确含有10 ku小分子蛋白Ⅱ类细菌素。
[1] 侯亚文,易华西,杨艳艳,等.产细菌素乳酸菌筛选方法的研究进展[J].食品与发酵工业,2013,39(3):129-133.
[2] 樊星,张昊,郭慧媛,等.乳酸菌抑菌功能的研究进展[J].中国乳业,2012(9):52-54.
[3] NISSEN-M J,OPPEG R C,ROGNEP,et al.The two-peptide(Class-IIb) bacteriocins: genetics,biosynthesis,structureand mode of action[J]. Prokaryotic Antimicrobial Peptides,2011(21):197-212.
[4] DE KWAADSTENIET M,TODOROV S D,KNOETZEH,et al.Characterization of a 3944 Da bacteriocin,produced by Enterococcus mundtiiST15with activity against Gram-positive and Gram-negative bacteria[J]. International Journal of Food Microbiology,2005,105(3):433-444.
[5] STEIN T,HEINZMANN S,SOLOVIEVAI,etal.Function of Lactococcuslactisnisinimmunity genes nisI and nisFEG after coordinated expression in the surrogate hostBacillussubtilis[J].Journal of Biological Chemistry,2003,278(1):89-94.
[6] ENNAHAR S,SASHIHARA T,SONOMOTOK,et al.ClassII abacteriocins:Biosynthesis structure and activity[J].FEMS Microbiology Reviews,2000,24:85-106.
[7] HOLZAPFEL W H,HABERER P,SNELJ,et al.Overview of gut flora and probiotics[J].International Journal of Food Microbiology,1998,41(2):85-101.
[8] IVANOVA I, MITEVA V, STEFANOVATS, et al.Characterization of a bacteriocin produced byStreptococcusthermophilus81[J].International Journal ofFood Microbiology,1998,42(3):147-158.
[9] WHITFORD M F,MCPHERSON M A,FORSTER R J,et al.Identification of bacteriocin-like inhibitors from rumen Streptococcus spp. and isolation and characterization of bovicin 255[J].Applied and Environmental Microbiology, 2001,67(2):569-574.
[10] SCHILLINGER U,LUCKEFK.Antibacterial activity of Lactobacillus sake isolated frommeat[J].Applied and Environmental Microbiology, 1989,55(8):1 901-1 906.
[11] 易兰花.西乡浆水产细菌素乳酸菌的分离及细菌素的纯化[D].杨凌:西北农林科技大学,2014.
[12] 刘国荣,周康,李平兰.传统干酪中一株产Ⅱa类细菌素乳酸菌的分离与鉴定[J].食品科学,2007,28(5):185-189.
[13] Motta A S,BRANDELLIA.Influence of growth conditions on bacteriocin production by Brevibacteriumlinens[J].Applied Microbiology and Biotechnology,2003,62(2-3):163-167.
[14] 都立辉,刘芳.16S rRNA基因在细菌菌种鉴定中的应用[J].乳业科学与技术, 2006 (11):15-18.
[15] 曾静,窦岳坦,王磊,等. 新疆地区盐湖的中度嗜盐菌16S rDNA全序列及DNA同源性分析[J].微生物学报, 2002( 2):133-137.
[16] 杨颖,陈卫,田丰伟.产抑菌物质乳杆菌的筛选及性质的研究[J].工业微生物, 2006,36(3):13-17.
[17] 张彤,方汉平.微生物分子生态技术:16S rRNA/DNA方法[J].微生物学通报,2003,30(2):97-101.
[18] 李永峰,任南琪,杨传平,等.一株产氢产酸厌氧细菌的16SrDNA序列分析[J].东北林业大学学报,2005(2):65-67.
[19] 韦革宏,陈文新,朱铭莪.西北半干旱地区黄芪根瘤菌 DNA 同源性及 16S rDNA全序列分析[J].中国农业科学, 2001,34(4):410-415.
Identification and screening of Class II bacteriocins of lactic acid bacteria and quorum sensing system
WU Lin-hao, QIAN Yu, WANG Hui-chao, XUE Xiu-heng*
(Engineering Laboratory of Agricultural Products Processing of Anhui, Shool of Tea and Food Science & Technology, Anhui Agriculture University, Hefei 230036,China)
The lactic acid bacteria with broad-spectrum antimicrobial effect of Class II bacteriocin quorum sensing system were screened and identified. After exclusion of hydrogen peroxide and organic acid interference and treatment with trypsin, pepsin and proteinase K, lactic acid bacteria secreting bacteriocin with broad-spectrum antibacterial effect was screened by Oxford cup method. The minimal inhibitory concentration was detected by assay on minimal inhibitory activity. Phylogenetic tree was constructed based on 16S rDNA homology analysis. The primers specific for five operon plnEFI, plnJKLR, plnGHSTUV, plnABCD, and plnMNOP of the class II bacteriocins were designed. Class II bacteriocin genes of quorum sensing system were identified by PCR and electrophoresis. The molecular size of bacteriocin was determined by UPLC and urea-sds-page. L-4 was a kind of gram positive bacteria with broad spectrum antimicrobial activity. The diameters of inhibition zones for indicator bacteria were (18.83±0.39) mm and (19.96±0.49) mm, with the minimal inhibitory concentrations of 55.68 μg/mL and 57.31 μg/mL. L-4 had Class II bacteriocin gene of quorum sensing system. It could secrete a bacteriocin with molecular weight of 10 ku in the molecular range of Class II bacteriocin. L-4 was a strain ofLactobacillusplantarumsecreting 10 ku of Class II bacteriocin with broad-spectrum antimicrobial activity.
lactic acid bacteria; bacteriocin;16S rDNA identification; phylogenetic tree; Class II bacteriocin quorum sensing system
10.13995/j.cnki.11-1802/ts.201704003
硕士研究生(薛秀恒教授为通讯作者,E-mail:358896335@qq.com)。
2016-09-29,改回日期:2017-01-03
