胶质瘤U251细胞外源基因瞬时转染方法的选择
2017-06-19呼格吉乐高乃康刘秉春袁建龙
呼格吉乐,高乃康,刘秉春,袁建龙
(内蒙古医科大学附属医院,呼和浩特010050)
胶质瘤U251细胞外源基因瞬时转染方法的选择
呼格吉乐,高乃康,刘秉春,袁建龙
(内蒙古医科大学附属医院,呼和浩特010050)
目的 选择一种将外源基因瞬时转入胶质瘤细胞的高效转染方法。方法 以去内毒素真核表达载体DsRed2为外源基因,分别采用脂质体Lipofectamine2000转染法、脂质体Viafect转染法以及电转染法,将不同浓度的DsRed2质粒(0.25、0.5、1.0 μg)转染入胶质瘤U251细胞(以下称胶质瘤细胞,细胞数量均为1.0×105个)。荧光显微镜下采用可见光、红色荧光滤镜观察细胞形态及红色荧光蛋白表达,紫外光滤镜下观察细胞核Hocest33342染色情况,计算转染效率。结果 三种方法均能将质粒转染至胶质瘤细胞中,红色荧光蛋白表达效果均良好。转染后的细胞形态基本正常,但表达红色荧光蛋白与未表达红色荧光蛋白的细胞形态差异较大。相同质粒浓度下,电转染法转染后表达红色荧光蛋白的细胞数量多于脂质体Lipofectamine2000转染法、脂质体Viafect转染法。随着质粒浓度的升高,脂质体Viafect转染法和电转染法对胶质瘤细胞的转染效率逐渐升高。相同质粒浓度下,电转染法对胶质瘤细胞的转染效率均高于脂质体Lipofectamine2000转染法和脂质体Viafect转染法(P均<0.01)。结论 电转染法对外源基因瞬时转染胶质瘤细胞的转染效率较高,并呈质粒浓度依赖性。
胶质瘤细胞;质粒;转染方法;电转染法;转染效率
胶质瘤是成人颅内最常见的恶性肿瘤,占颅内肿瘤的50%~60%,患者预后较差,生存时间短[1,2]。随着医疗技术的发展,靶向治疗尤其是基因治疗成为当今胶质瘤治疗的研究热点[3,4]。基因靶向治疗基础研究中需要将外源目的基因导入细胞或者细胞基因组,基因转染效率决定了后续实验能否顺利进行[5,6]。若转染效率低,必须对转染后的细胞进行进一步筛选,获得纯度较高的转基因细胞,以减少未转染细胞对实验结果的干扰。常用的外源基因导入方法有脂质体转染法、电转染法、慢病毒转染法等,各种方法均有较好的转染效果;其中慢病毒转染的转染效率最高[7,8],但其试剂及耗材较昂贵,且需要特殊的安全等级实验室,以及生物安全性问题,限制了该方法在一般生物学实验室的应用。2015年12月~2016年3月,本研究观察了脂质体转染法和电转染法对胶质瘤细胞外源基因瞬时转染的效果。现将结果报告如下。
1 材料与方法
1.1 材料 细胞:人胶质瘤U251细胞(以下称胶质瘤细胞)购自中科院上海细胞库,保存于液氮中。含有红色荧光蛋白真核表达载体的DsRed2菌株由郭旭东教授馈赠,表达载体含有巨细胞病毒(CMV)启动子,可以驱动红色荧光蛋白基因组成型表达[9]。主要试剂:DMEM/F12、D-PBS、无血清MEM培养基及0.05%胰蛋白酶、抗生素等细胞培养试剂均购自上海Gibco公司,标准FBS购自天津TBD公司,Qiagen去内毒素提试剂盒购自北京强欣博瑞生物技术有限公司,脂质体Lipofectamine2000购自美国Invitrigen公司,脂质体Viafect购自美国Promega公司。主要仪器:倒置荧光显微镜(Ti200)、体视镜(SMZ1500)均购自日本Nikon公司,CO2培养温箱购自德国Binder公司,电转染仪(Nepa21 typeⅡ)购自日本Nepa Gene公司。
1.2 外源基因瞬时转染
1.2.1 DsRed2质粒提取 参照去内毒素提试剂盒说明书提取DsRed2质粒,采用Thermo Nanodrop分光光度计检测光密度(OD)值,采用2%琼脂糖凝胶电泳分析质粒的纯度与完整性。结果显示,提取的DsRed2质粒OD260/OD280为1.81,DNA浓度为625 ng/μL,符合基因转染条件。
1.2.2 胶质瘤细胞解冻与复苏 将液氮中冻存的胶质瘤细胞迅速放入37 ℃水浴锅中,持续晃动细胞冻存管,使细胞液体迅速解冻;没有冰晶以后,将细胞以500 r/min离心5 min,去上清。将细胞沉淀用含有10% FBS的DMEM/F12培养基进行重悬,将细胞悬液加入90 mm细胞培养皿中,培养基补齐至10 mL。37 ℃、饱和湿度条件下进行培养,次日更换液体。结果显示胶质瘤细胞解冻复苏后细胞状态、增殖速度等均正常,可用于以下转染实验。
1.2.3 DsRed2质粒转染 ①脂质体Lipofectamine 2000转染法:将胶质瘤细胞进行传代培养,转染前1天接种至24孔板,调整细胞密度为1×105个/孔。细胞融合至约80%时进行转染,具体步骤如下:将240 μL无血清MEM培养基与10 μL Lipofectamine2000混合,室温孵育5 min;将250 μL无血清MEM培养基与DsRed质粒(质粒用量分别为0.25、0.5、1.0 μg/孔)充分混合,室温静置5 min;将二者混合均匀,室温下静置30 min。采用PBS溶液将24孔板中的待转染细胞清洗3次,然后将混合液慢慢逐滴加入24孔板中,上下摇动培养板,轻轻混匀。在37 ℃、5% CO2、饱和湿度条件下孵育6 h,吸出原先的培养液,缓缓加入新鲜的DMEM/F12+10%FBS培养基。②脂质体Viafect转染法:参照①的方法接种胶质瘤细胞,按照脂质体Viafect使用说明书进行转染,脂质体Viafect的转染步骤与脂质体Lipofectamine2000相同,转染时使用24孔板,每孔所用脂质体体积为10 μL,DsRed2质粒用量分别为0.25、0.5、1.0 μg/孔。③电转染法:将胶质瘤细胞传代培养48 h后,消化、收集细胞。进行细胞计数,采用不无血清MEM培养基重悬细胞沉淀,最终细胞密度调整为1×106个/mL。将其分为三组,每组DsRed2质粒用量分别为2.5、5.0、10 μg。将细胞与质粒混合液100 μL转移至电转杯中,此时每1×105个细胞的DsRed2质粒用量分别为0.25、0.5、1.0 μg。用手指轻轻敲击电转杯,确保细胞均匀分布于电转杯中,注意不要产生气泡。根据以往研究中的转染条件[10],调整参数为电压200 V、脉冲时间5 ms、脉冲次数2次,进行转染操作。转染完毕,电转杯内加入适量完全培养基,轻轻吹吸3次,将细胞再次混匀。将悬液完全吸出,接种到6孔板中,补加含有血清的培养基。以上实验均重复3次。
1.3 转染效果观察 转染48 h后,将采用脂质体转染法转染的细胞接种于24孔板,电转染法转染的细胞接种于6孔板,每孔分别加入1、5 μL Hocest33342染料(5 mg/mL),37 ℃孵育30 min。分别于100倍倒置荧光显微镜下使用可见光、红色荧光滤镜、紫外光滤镜进行观察,每孔选择5个视野。可见光下观察细胞状态,红色荧光滤镜下观察红色荧光荧光蛋白表达情况,紫外光滤镜下观察细胞核Hocest33342染色情况,并进行染色细胞计数,计算转染效率。

2 结果
2.1 细胞形态及红色荧光蛋白表达 三种方法均能将质粒转染至胶质瘤细胞中,红色荧光蛋白表达效果均良好。转染后的细胞形态基本正常,但表达红色荧光蛋白与未表达红色荧光蛋白的细胞形态差异较大。随着转染质粒浓度的升高,三种方法转染后表达红色荧光蛋白的细胞数量均逐渐增多,以电转染法增多最明显。相同质粒浓度下,电转染法转染后表达红色荧光蛋白的细胞数量多于脂质体Lipofectamine2000转染法、脂质体Viafect转染法。
2.2 转染效率 随着质粒浓度的升高,脂质体Viafect转染法和电转染法对胶质瘤细胞的转染效率逐渐升高,脂质体Lipofectamine2000转染法对胶质瘤细胞的转染效率先升高后降低。相同质粒浓度下,电转染法对胶质瘤细胞的转染效率均高于脂质体Lipofectamine2000转染法和脂质体Viafect转染法(P均<0.01)。见表1。
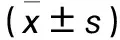
表1 三种方法对胶质瘤细胞的转染效率比较
注:与电转染法比较,*P<0.01。
3 讨论
目前癌症的靶向药物研究方向主要为小分子、单克隆抗体、基因药物等[11]。人胶质瘤U251细胞被广泛应用于脑部肿瘤尤其是神经肿瘤的基础研究[6,12],采用转染法将外源基因转入细胞对于研究胶质瘤的分子机制具有重要意义[13,14]。脂质体转染法为目前使用最多的方法,无需特殊设备,但是一次性转染的细胞数量较少,需要大量转染时耗费脂质体较多,成本大大提高。电转染法一次转染的细胞数量多,成本相对较低,但是需要前期购买昂贵的电转染仪。不论是电转染还是脂质体转染都需要摸索合适的转染条件,尤其是在进行基因瞬时转染或者基因表达干扰实验时,必须以较高的转染效率为主要目标。
本研究脂质体Lipofectamine2000转染法、脂质体Viafect转染法以及电转染法使用的DNA总量不同。由于电转染法一次所需细胞较多,我们在进行电转染时使用的是6孔板进行培养,每孔细胞密度为1×106个/mL,是脂质体转染法使用细胞总量的10倍,因此转染用的DsRed2质粒用量也相应增加了10倍,但是根据细胞浓度进行计算后,每1×105个细胞质粒用量均分别控制为0.25、0.5、1.0 μg。本研究中表达红色荧光蛋白与未表达红色荧光蛋白的细胞形态差异较大,可能与外源基因的转入对细胞本身造成一定影响有关。因此,为了保证实验结果的准确性,在转染目的基因质粒的时候,必须以转染空白骨架质粒的细胞作为对照组,而不是以非处理过的细胞作为对照组。
Hocest33342染色可使所有的细胞核在紫外激发下显示出蓝色荧光,便于对细胞数量进行统计。本研究结果显示,随着质粒浓度的升高,脂质体Viafect转染法和电转染法对胶质瘤细胞的转染效率逐渐升高,脂质体Lipofectamine2000转染法对胶质瘤细胞的转染效率先升高后降低。相同质粒浓度下,电转染法对胶质瘤细胞的转染效率均高于脂质体Lipofectamine2000转染法和脂质体Viafect转染法。脂质体转染法对胶质瘤细胞的转染效率较低,可能与本研究使用的脂质体不适合转染胶质瘤细胞有关,与张禾璇等[15]报道相似。在进行转染时细胞状态会影响转染效率,细胞解冻后最好进行2次传代后再行电转染。同时质粒浓度和纯度也非常重要,需要使用去内毒素质粒提取试剂盒提取和纯化质粒(建议使用Qiagen去内毒素提取试剂盒),质粒提取完毕后不但要使用分光光度计测定质粒DNA浓度,更需要进行琼脂糖凝胶电泳检测质粒的纯度与完整性。细胞转染后要根据具体数量将细胞铺到细胞板中,切忌细胞密度过高或者过低。优化脂质体转染条件的过程中,本研究并未对脂质体用量进行调整,仅对质粒浓度进行了优化。主要是因为对于贴壁细胞而言,按照说明书选择脂质体浓度进行实验也可得到良好的效果,但是脂质体在一定程度上对细胞具有毒性作用,增加脂质体用量并不能显著提高外源基因的转染效率[16],反而会加大实验成本。
综上所述,外源基因瞬时转染胶质瘤细胞的方法中以电转染法的转染效率较高,并呈质粒浓度依赖性,为后续实验选择高效的外源基因瞬时转染方法提供依据。
[1] 戴宜武,王振光,秦家振.脑胶质瘤治疗进展[J].中华临床医师杂志(电子版), 2013,7(14):6225-6228.
[2] Van der sanden B, Ratel D, Berger F, et al. Glioma recurrence following surgery: peritumoral or perilesional[J]. Front Neurol, 2016,7(26):52.
[3] Mittal S, Pradhan S, Srivastava T. Recent advances in targeted therapy for glioblastoma[J]. Expert Rev Neurother, 2015,15(8):46-935.
[4] 徐国政,袁先厚.脑胶质瘤靶向治疗新进展[J].中国临床神经外科杂志,2011,16(9):568-572.
[5] Kang CS, Zhang ZY, Jia ZF, et al. Suppression of egfr expression by antisense or small interference rna inhibits U251 glioma cell growth in vitro and in vivo[J]. Cancer Gene Ther, 2006,13(5):538-530.
[6] Du HQ, Wang Y, Jiang Y, et al. Silencing of the tpm1 gene induces radioresistance of glioma U251 cells[J]. Oncol Rep, 2015,33(6):2814-2807.
[7] 兰海霞,呼格吉乐.应用干扰RNA慢病毒技术抑制人脑胶质瘤细胞中红细胞生成素受体mRNA的表达[J].中华妇幼临床医学杂志(电子版),2015,11(6):752-756.
[8] 呼格吉乐.促红细胞生成素受体干扰RNA慢病毒表达载体的构建及干扰细胞的筛选[J].中华危重症医学杂志(电子版),2015,8(6):347-350.
[9] 郭旭东,尹俊,杨东山,等.IGF-1毛囊特异表达载体的构建以及转染绒山羊胎儿成纤维细胞的研究[J].畜牧兽医学报,2009,40(10):1460-1467.
[10] 阿力玛,高原,苏小虎,等.CRISPR/Cas9编辑绒山羊FGF5基因细胞株的建立[J].中国生物工程杂志,2016,36(7):41-47.
[11] Stevens EA, Rodriguez CP. Genomic medicine and targeted therapy for solid tumors[J]. J Surg Oncol, 2015,111(1):38-42.
[12] Chen Z, Li D, Cheng Q, et al. Microrna-203 inhibits the proliferation and invasion of U251 glioblastoma cells by directly targeting pld2[J]. Mol Med Rep, 2014,9(2):503-508.
[13] 梁兵,袁芳,杨宁,等.3种不同类型基因导入系统转染类神经元细胞的效率比较[J].重庆医学,2012,41(18):1792-1794,1798.
[14] 牛丽丽,王秀娟,张传领,等.电穿孔法高效转染脑胶质瘤细胞U251的条件优化研究[J].内蒙古医学杂志,2016,48(1):20-23.
[15] 张禾璇,单可人,何燕,等.脂质体法与电穿孔法转染两种细胞效率的比较[J].重庆医学,2014,43(33):4432-4433.
[16] Malecki M, Swoboda P, Pachecka J. Recombinant adeno-associated virus derived vectors (raav2) efficiently transduce ovarian and hepatocellular carcinoma cells--implications for cancer gene therapy[J]. Acta Pol Pharm, 2009,66(1):93-99.
内蒙古医科大学科技百万工程(YKD2015KJBW010);内蒙古医科大学青年创新基金资助项目(YKD2012QNX009)。
袁建龙(E-mail: yjllj123@qq.com)
10.3969/j.issn.1002-266X.2017.16.013
R34
A
1002-266X(2017)16-0044-03
2016-06-09)
