雷帕霉素联合阿霉素对人骨肉瘤MG-63细胞增殖的影响及其机制
2017-06-19崔明星詹新立刘冲邓黎熊春翔刘会江
崔明星,詹新立,刘冲,邓黎,熊春翔,刘会江
(1新乡医学院第一附属医院,河南新乡453100;2广西医科大学第一附属医院)
雷帕霉素联合阿霉素对人骨肉瘤MG-63细胞增殖的影响及其机制
崔明星1,詹新立2,刘冲2,邓黎2,熊春翔2,刘会江2
(1新乡医学院第一附属医院,河南新乡453100;2广西医科大学第一附属医院)
目的 探讨雷帕霉素联合阿霉素对人骨肉瘤MG-63细胞(以下称骨肉瘤细胞)增殖的影响及其作用机制。方法 取对数生长期骨肉瘤细胞,分别加入不同浓度的阿霉素(0.125、0.25、0.5、1.0、2.0 mg/L)和雷帕霉素(20、50、100 nmol/L)单独及联合作用,采用MTT法检测作用48 h的细胞增殖抑制率,并计算两药相互作用指数(CDI),评价两药相互作用性质。结果以100 nmol/L雷帕霉素与0.5 mg/L 阿霉素联合作用后的细胞增殖抑制率最高,此时CDI<0.7,两种药物表现为显著协同作用。将对数生长期的骨肉瘤细胞分为五组,阿霉素组、雷帕霉素组分别加入0.5 mg/L阿霉素、100 nmol/L雷帕霉素,联合用药组加入0.5 mg/L阿霉素和100 nmol/L雷帕霉素,DMSO溶媒组加入等量DMSO,空白对照组不予处理。采用MTT法检测各组细胞增殖能力,连续记录5天。采用Real-time PCR法检测各组处理48 h缺氧诱导因子1α(HIF-1α)、血管内皮生长因子(VEGF)、基质金属蛋白酶2(MMP-2) mRNA 相对表达量。结果 各组作用第1、2天细胞增殖能力比较差异均无统计学意义(P均>0.05)。作用第3~5天,联合用药组细胞增殖能力均明显低于空白对照组、DMSO溶媒组、阿霉素组及雷帕霉素组(P均<0.05)。联合用药组HIF-1α、VEGF、MMP-2 mRNA相对表达量均明显低于空白对照组、DMSO溶媒组、阿霉素组、雷帕霉素组(P均<0.05)。结论 雷帕霉素联合阿霉素可以协同抑制骨肉瘤细胞增殖;降低HIF-1α、VEGF、MMP-2表达可能是其作用机制。
骨肉瘤;细胞增殖;雷帕霉素;阿霉素;药物敏感性
骨肉瘤是一种好发于长骨干骺端的原发性恶性肿瘤,在青少年人群中多发。骨肉瘤发病机制尚不十分清楚,患者的5年生存率为60%~75%[1],超过30%的患者发生远处转移。基于阿霉素的联合化疗方案为目前骨肉瘤的主要治疗方法,但阿霉素的耐药问题却大大降低了其临床效果。研究发现,雷帕霉素可特异性阻断mTOR信号通路,从而发挥抑制骨肉瘤细胞增殖的作用[2,3]。但关于雷帕霉素联合阿霉素对骨肉瘤细胞增殖的影响及其相关机制的研究鲜见报道。为此,我们于2012年9月~2014年3月进行了如下研究。
1 材料与方法
1.1 材料 细胞:人骨肉瘤细胞株MG-63(以下称骨肉瘤细胞)购自中国科学院昆明细胞库。主要试剂及仪器:DMEM高糖培养液、阿霉素购自美国Gibco公司,雷帕霉素购自美国Gene Operation公司,二甲亚砜(DMSO)购自北京索莱宝科技有限公司;引物由上海生工生物工程有限公司设计合成,逆转录试剂盒与Real-time PCR试剂盒均购自日本TaKaRa公司。7500型实时荧光定量分析系统购于美国ABI公司。
1.2 雷帕霉素与阿霉素的联合作用观察
1.2.1 细胞培养及干预 将骨肉瘤细胞置于含10%灭活胎牛血清、10 000 U/mL青霉素和10 000 mg/mL链霉素的DMEM高糖培养液中,37 ℃、5% CO2、饱和湿度条件下传代培养,根据培养瓶中的细胞生长情况,2~3天更换一次培养液。将对数期生长的骨肉瘤细胞接种于96孔培养板,调整细胞密度为2×104个/mL,于37 ℃、5% CO2、饱和湿度条件下培养12 h。待细胞贴壁后,分别加入0.125、0.25、0.5、1.0、2.0 mg/L阿霉素与20、50、100 nmol/L雷帕霉素单独及联合作用,每孔终体积为200 μL,每个浓度设3个复孔。
1.2.2 雷帕霉素和阿霉素浓度筛选 药物作用48 h,于全自动酶标仪570 nm波长处测定各孔光密度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=[1-(样品组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。结果显示,在相同阿霉素浓度下,随着雷帕霉素浓度的升高,两药联合应用后骨肉瘤细胞增殖抑制率呈升高趋势(P均<0.05)。以100 nmol/L雷帕霉素与0.5 mg/L 阿霉素联合作用后对骨肉瘤细胞的增殖抑制率最高(上述浓度用于以下研究)。见表1。
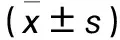
表1 骨肉瘤细胞经阿霉素、雷帕霉素单独与联合作用后的细胞增殖抑制率
1.2.3 药物作用性质判断 采用相互作用指数(CDI)评价两药相互作用性质。CDI=AB/(A×B)。AB为阿霉素和雷帕霉素联合作用时与空白对照细胞OD值的比值;A、B为阿霉素或雷帕霉素单独作用时与空白对照细胞OD值的比值。CDI<1说明两药具有协同作用,CDI<0.7说明两药协同作用非常显著,CDI=1说明两药具有相加作用,CDI>1说明两药具有拮抗作用。结果显示,阿霉素浓度<0.5 mg/L时,两药联合作用后CDI<1;其中100 nmol/L雷帕霉素与0.5 mg/L 阿霉素联合作用后CDI<0.7。阿霉素浓度>0.5 mg/L时,两药联合作用后CDI>1。见表2。
1.3 阿霉素联合雷帕霉素对骨肉瘤细胞增殖影响的观察
1.3.1 细胞分组及干预 将对数期生长的骨肉瘤

表2 骨肉瘤细胞经阿霉素、雷帕霉素联合作用后的CDI
细胞接种于96孔培养板,调整细胞密度为2×104个/mL, 将细胞随机分为空白对照组、 DMSO 溶媒组、阿霉素组、雷帕霉素组以及联合用药组。阿霉素组、雷帕霉素组分别加入0.5 mg/L阿霉素、100 nmol/L雷帕霉素,联合用药组加入0.5 mg/L阿霉素和100 nmol/L雷帕霉素,DMSO溶媒组加入等量DMSO,空白对照组不予处理。每孔终体积为200 μL,每组设3个复孔。
1.3.2 相关指标检测
1.3.2.1 细胞增殖能力 取各组处理48 h的细胞,采用MTT法检测各组全自动酶标仪570 nm波长处的OD值,代表细胞增殖能力。连续记录5天。
1.3.2.2 缺氧诱导因子1α(HIF-1α)、血管内皮生长因子(VEGF)、基质金属蛋白酶2(MMP-2) mRNA 相对表达量 采用Real-time PCR法。取各组处理48 h的细胞,TRIzol法提取总RNA,紫外分光光度计检测总RNA的浓度及纯度合格,利用逆转录试剂盒将其逆转录为cDNA。采用7500型实时荧光定量分析系统,以β-actin为内参基因进行Real-time PCR反应。引物序列:HIF-1α上游引物:5′-TGCACAGGCCACATTCACG-3′,下游引物:5′-GTTCACAAATCAGCACCAA-
GC-3′;VEGF上游引物:5′-TGCTGTGGACTTGAGTTG-
GG-3′,下游引物:5′-GGCTGGGTTTGTCGGTGTT-3′;MMP-2上游引物:5′-TACAGGATCATTGGCTACACAC-
C-3′,下游引物:5′-GGTCACATCGCTCCAGACT-3′;β-actin 上游引物:5′-TGACGTGGACATCCGCAAAG-3′,下游引物:5′-CTGGAAGGTGGACAGCGAGG-3′。反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s,共40个循环。以2-ΔΔCT法计算HIF-1α、VEGF、MMP-2 mRNA相对表达量。

2 结果
2.1 各组细胞增殖能力比较 随着作用时间的延长,各组细胞增殖能力逐渐升高。各组作用第1、2天细胞增殖能力比较差异均无统计学意义(P均>0.05)。作用第3~5天,联合用药组细胞增殖能力均明显低于空白对照组、DMSO溶媒组、阿霉素组及雷帕霉素组(P均<0.05)。见表3。
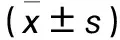
表3 各组细胞增殖能力比较
注:与空白对照组比较,*P<0.05;与DMSO溶媒组比较,#P<0.05;与阿霉素组比较,△P<0.05;与雷帕霉素组比较,▽P<0.05。
2.2 各组HIF-1α、VEGF、MMP-2 mRNA 相对表达量比较 阿霉素组、雷帕霉素组及联合用药组HIF-1α、VEGF、MMP-2 mRNA相对表达量均低于空白对照组及DMSO溶媒组,但联合用药组降低更明显(P均<0.05)。见表4。
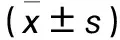
表4 各组HIF-1α、VEGF、MMP-2 mRNA相对表达量比较
注:与空白对照组比较,*P<0.05;与DMSO溶媒组比较,#P<0.05;与阿霉素组比较,△P<0.05;与雷帕霉素组比较,▽P<0.05。
3 讨论
雷帕霉素是36元环含氮三烯大环内酯类抗菌药物,广泛用于器官移植术后的抗排斥反应。雷帕霉素通过抑制mTOR蛋白的激酶活性,发挥抗菌、免疫抑制和抗肿瘤作用。mTOR是哺乳动物雷帕霉素靶蛋白,是一种丝氨酸/苏氨酸激酶。在细胞中,mTOR以mTORC1和mTORC2的催化亚基形式存在,其活性调控机制比较复杂,受多种调节信号蛋白参与,其中最主要的是PI3K/Akt/mTOR和Akt/TSC1-TSC2/mTOR/S6K通路。
近年研究发现,雷帕霉素可通过对肿瘤细胞mTOR通路的作用,发挥抑制骨肉瘤细胞增殖和诱导其凋亡的作用[4~6]。Campone等[7]建立了一个对阿霉素耐药的、以Akt通路为主要存活机制的B细胞淋巴瘤小鼠模型,通过雷帕霉素抑制Akt活性,使肿瘤细胞恢复对阿霉素的敏感性。徐国才等[8]报道,雷帕霉素通过诱导肿瘤细胞的自噬,促进其凋亡发生,进而提高对顺铂的敏感性。雷帕霉素联合顺铂作用于喉癌Hep-2细胞时,可明显提高其细胞凋亡率,表明二者存在明显的协同作用[9]。本研究结果显示,在相同阿霉素浓度下,随着雷帕霉素浓度的升高,两药联合应用后骨肉瘤细胞增殖抑制率呈升高趋势;以100 nmol/L雷帕霉素与0.5 mg/L 阿霉素联合作用后对骨肉瘤细胞的增殖抑制率最高,此时CDI<0.7,两种药物表现为显著协同作用。表明雷帕霉素可增强骨肉瘤细胞对阿霉素的敏感性,两药联合具有协同作用。
HIF-1α被认为是肿瘤缺氧适应性反应的中心启动因子,是惟一可以决定HIF-1活性的氧调节亚基,通过直接或者间接调控多种靶基因的表达,使肿瘤细胞对缺氧产生生理适应,并参与肿瘤的生长、浸润和转移等生物学行为。Zhang等[10]发现,抑制HIF-1α表达可明显抑制乳腺癌原发灶的生长,并减少转移到肺组织的肿瘤细胞。肿瘤细胞可以合成、分泌VEGF,在肿瘤组织中的表达水平高于正常组织。研究表明,抑制VEGF表达可以对肿瘤新生血管、淋巴管的形成以及肿瘤的发生、发展、转移产生明显的抑制作用[11~14]。基质金属蛋白酶(MMPs)是一种几乎能降解细胞外基质中各种蛋白成分的酶,可破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭和转移中起关键性作用。Park等[15]报道,通过抑制PI3K/Akt/mTOR通路可下调MMP-2基因的转录及翻译。本研究结果显示,各组作用第3~5天,联合用药组细胞增殖能力及HIF-1α、VEGF、MMP-2 mRNA相对表达量均明显低于空白对照组、DMSO溶媒组、阿霉素组、雷帕霉素组。说明雷帕霉素联合阿霉素可抑制骨肉瘤细胞的增殖,其机制可能与抑制HIF-1α、VEGF、MMP-2 mRNA表达有关。
综上所述,雷帕霉素可增强骨肉瘤细胞对阿霉素的敏感性;抑制HIF-1α、VEGF、MMP-2表达可能是其作用机制。mTOR信号通路在体内广泛存在,雷帕霉素联合阿霉素提高骨肉瘤细胞靶向特异性的具体机制仍有待进一步研究。本研究的不足是未从细胞周期及蛋白水平等方面进行深入研究。
[1] Xie ZG, Xie Y, Dong QR. Inhibition of the mammalian target of RAPAmycin leads to autophagy activation and cell death of MG63 osteosarcoma cells[J]. Oncol Lett, 2013,6(5):1465-1469.
[2] Liu PY,Zhang WB,Wang J, et al. Inhibitory effect and significance of RAPAmycin on the mammalian target of RAPAmycin signaling pathway inosteosarcoma stem cells and osteosacoma cells[J]. Zhonghua Zhong Liu Za Zhi, 2013,35(3):175-180.
[3] Balamuth NJ, Womer RB. Ewing′s sarcoma[J]. Lancet Oncol, 2010,11(2):184-192.
[4] Liu PY, Zhang WB, Wang J, et al. Inhibitory effect and significance of RAPAmycin on the mammalian target of RAPAmycin signaling pathway in osteosarcoma stem cells and osteosarcoma cells[J]. Zhonghua Zhong Liu Za Zhi, 2013,35(3):175-180.
[5] Liu PY, Zhang WB, Wei YY. Targeting the mammalian target of RAPAmycin pathway in osteosarcoma using combinative chemotherapy[J]. Chin Med J, 2013,126(10):1978-1981.
[6] 金凤,刘延庆,钱亚云.哺乳动物雷帕霉素靶蛋白与恶性肿瘤上皮间质转化研究进展[J].医学综述,2016,22(5):896-899.
[7] Campone M, Levy V, Bourbouloux E, et al. Safety and pharmacokinetics of paclitaxel and the oral mTOR inhibitor everolimus in advanced solid tumours[J]. Br J Cancer, 2009,100(2):315-321.
[8] 徐国才,张莘,相媛媛,等.雷帕霉素联合顺铂对卵巢癌细胞株SKOV3凋亡和自噬的影响[J].医药导报,2013,32(4):446-449.
[9] Lei W, Jia T, Su Z, et al. Combined effect of RAPAmycin and cisplatin on survival of Hep-2 cells in vitro[J]. Oncol Res, 2009,18(2-3):73-81.
[10] Zhang H, Wong CC, Wei H, et al. HIF-1-dependent expression of angiopoietin-like 4 and L1CAM mediates vascular metastasis of hypoxic breast cancer cells to the lungs[J]. Oncogene, 2012,31(14):1757-1770.
[11] O′Sullivan C, Edgerly M, Velarde M, et al. The VEGF inhibitor axitinib has limited effectiveness as a therapy for adrenocortical cancer[J]. J Clin Endocrinol Metab, 2014,99(4):1291-1297.
[12] Zhao S, Lu N, Chai Y. RAPAmycin inhibits tumor growth of human osteosarcomas[J]. J BUON, 2015,20(2):588-594.
[13] Zhao J, Zhang ZR, Zhao N, et al.VEGF silencing inhibits human osteosarcoma and promotes cell apoptosis via PI3K/AKT signaling pathway[J]. Cell Biochem Biophys, 2015,73(2):519-525.
[14] Peng N, Gao S, Guo X, et al. Silencing of VEGF inhibits human osteosarcoma anqioqenesis and promotes cell apoptosis via VEGF/PI3K/AKT Signaling Pathway[J]. Am J Transl Res, 2016,8(2):1005-1015.
[15] Park CM, Park MJ, Kwak HJ, et al. Ionizing radiation enhances matrix metalloproteinase-2 secretion and invasion of glioma cells through Src/epidermal growth factor receptor-mediated p38/Akt and phosphatidylinositol 3-kinase/Akt signaling pathways[J]. Cancer Res, 2006,66(17):8511-8519.
·作者·编者·读者·
携手《山东医药》 共创品牌形象
《山东医药》创刊于1957年,是山东省卫生厅主管的医学类学术期刊,国内外公开发行。本刊是中国学术期刊综合评价数据库来源期刊,是广大医务人员进行学术交流的主要阵地,在全国有较大影响。本刊注重理论与实践相结合,医药学术研究与医疗临床实践相结合,面向广大医疗单位及医药科研与生产单位。欢迎各级各类卫生单位和医疗器械、医用软件等生产单位与《山东医药》合作,宣传管理经验,树立品牌形象。
联系电话:0531-88957404
Effects of Rapamycin and Adriamycin on proliferation of osteosarcoma MG-63 cells
CUIMingxing1,ZHANXinli,LIUChong,DENGLi,XIONGChunxiang,LIUHuijiang
(1TheFirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453100,China)
Objective To investigate the effects of Rapamycin (RAPA) and Adriamycin (ADM) on proliferation of osteosarcoma MG-63 cells and their mechanisms. Methods Human osteosarcoma MG-63 cells in logarithmic growth phase was treated with ADM solution of different concentrations (0.125, 0.25, 0.5, 1.0, 2.0 mg/L) and RAPA solution of different concentrations (20, 50, 100 nmol/L) alone or in combination. Then the cell inhibition rate was determined by MTT after 48 hours, and Coefficient of drug interaction (CDI) was calculated to evaluate the nature of the interaction between the two drugs. The cell inhibition rate was the highest when MG-63 cells were treated with 100 nmol/L RAPA combined with 0.5 mg/L ADM. At this moment, CDI was less than 0.7 and the two drugs showed a significant synergistic effect. According to the optimal combination concentration, we randomly divided MG-63 cells in logarithmic growth phase into five groups: ADM group (treated with 0.5 mg/L ADM), RAPA group (treated with 100 nmol/L RAPA), the combination group (treated with 0.5 mg/L ADM and 100 nmol/L RAPA), DMSO solvent group (treated with the same concentration of DMSO) and the blank control group (without any treatment). The cell proliferation ability was detected by MTT for 5 days. The expression levels of hypoxia-inducible factor-1α (HIF-1α), vascular endothelial growth factor (VEGF) and matrix metalloproteinase 2 (MMP-2) mRNA were analyzed by real-time PCR at 48 h. Results There was no significant difference in cell proliferation ability among these groups on day 1 and 2 (allP>0.05). The cell proliferation ability of the combination group was lower than those of the blank control group, DMSO solvent group, ADM group and RAPA group on day 3-5 (allP<0.05). The relative expression of HIF-1α, VEGF and MMP-2 mRNA in the combination group was significantly lower than that in the blank control group, DMSO solvent group, ADM group and RAPA group (allP<0.05). Conclusion RAPA combined with ADM may synergistically inhibit the proliferation of human osteosarcoma MG-63 cells by decreasing the expression of HIF-1α, VEGF, MMP-2 mRNA.
osteosarcoma; cell proliferation; Rapamycin; Adriamycin; drug sensitivity
广西自然科学基金资助项目(2012GXNSFAA05314、2014GXNSFAA118173);广西高校科学技术研究项目(YB2014073)。
崔明星(1988-),男,住院医师,研究方向为骨外科疾病的诊断与治疗。E-mail: cuimingxing1226@163.com
詹新立(1968-),男,主任医师、教授、博士生导师,研究方向为脊柱骨科疾病的诊断与治疗。E-mail: 3cstar@163.com
10.3969/j.issn.1002-266X.2017.16.003
R738.1
A
1002-266X(2017)16-0008-04
2016-06-30)
