补肾活血舒筋方含药血清对大鼠骨髓间充质干细胞增殖、迁移的影响及其机制
2017-06-19王彦超邓蓉蓉叶亚东席志鹏康然谢林
王彦超,邓蓉蓉,叶亚东,席志鹏,康然,谢林
(1南京中医药大学,南京210023;2南京中医药大学附属中西医结合医院;3泰州市中医院)
补肾活血舒筋方含药血清对大鼠骨髓间充质干细胞增殖、迁移的影响及其机制
王彦超1,2,邓蓉蓉2,叶亚东3,席志鹏2,康然2,谢林2
(1南京中医药大学,南京210023;2南京中医药大学附属中西医结合医院;3泰州市中医院)
目的 探讨补肾活血舒筋方含药血清对大鼠骨髓间充质干细胞(BMSCs)增殖、迁移的影响及其可能的作用机制。方法 采用全骨髓贴壁法分离提取大鼠BMSCs并进行验证。制备补肾活血舒筋方低、中、高浓度含药血清(1.1、2.2、4.4 g/mL)及空白血清,将大鼠BMSCs随机分为含药血清低、中、高浓度组和空白对照组,分别加入上述血清。采用CCK-8法检测各组增殖能力(以细胞生存率表示),Transwell小室试验检测细胞迁移能力(以细胞迁移数量表示),Western blotting法检测趋化因子受体4(CXCR4)和NF-κB信号通路p65蛋白表达。结果 各组间细胞生存率比较差异无统计学意义(P>0.05)。含药血清高、中浓度组细胞迁移数量均高于含药血清低浓度组、空白对照组,且含药血清高浓度组高于含药血清中浓度组(P均<0.05)。含药血清高、中、低浓度组与空白对照组p65、CXCR4蛋白表达依次降低,组间两两比较P均<0.05。结论 2.2、4.4 g/mL补肾活血舒筋方含药血清可促进BMSCs迁移,但对BMSCs增殖无影响;激活NF-κB信号通路可能是其作用机制。
骨髓间充质干细胞;补肾活血舒筋方;细胞迁移;核转录因子κB;趋化因子受体4;大鼠
间充质干细胞(MSC)来源于发育早期的中胚层和外胚层,具有多向分化潜能、自我复制、靶向归巢和损伤修复等特点。研究证实,基质细胞衍生因子1(SDF-1)等趋化因子具有调控MSC归巢的作用,其与趋化因子受体4(CXCR4)结合形成的SDF-1/CXCR4轴是促进MSC向损伤组织归巢的重要生物轴[1],同时该轴调控细胞归巢的作用受NF-κB信号通路的调节[2]。补肾活血舒筋方对于脊柱退行性变有一定疗效[3,4],且能够调节CXCR4表达[5],促进骨髓间充质干细胞(BMSCs)迁移[6]。前期研究显示,补肾活血舒筋方可通过调节NF-κB信号通路抑制炎症反应及椎间盘退变[7]。本研究观察了补肾活血舒筋方含药血清对大鼠BMSCs增殖、迁移的影响,现分析结果并探讨其相关机制。
1 材料与方法
1.1 材料 实验动物: 4周龄SD大鼠24只,SPF级,均为雌性,平均体质量80 g,由南京中医药大学附属中西医结合医院动物中心提供。主要试剂:MEM培养基、胎牛血清购于美国Gibco公司,兔抗大鼠NF-κB(p65)、CXCR4抗体/羊抗兔远红外二抗购于美国Abcam公司。主要仪器:流式细胞仪购于美国Millipore公司,多功能酶标仪购于瑞士Tecan公司,ODYSSEY双色红外荧光扫描成像系统购于美国LICOR公司。
1.2 大鼠BMSCs提取与鉴定 取4周龄SD大鼠4只,分离双侧股骨和胫骨,采用全骨髓贴壁法[8]提取BMSCs:将细胞放置于完全培养基(含有10%胎牛血清、1%青霉素-链霉素溶液的MEM培养基)中,于5% CO2、37 ℃培养箱中进行培养,每3天换液1次。待细胞在T25培养瓶中生长融合至80%~90%时,以1∶3进行传代,传至第3代时倒置显微镜观察细胞形态及生长情况。结果显示,第3~5代细胞纯化程度高,细胞增殖能力强;传代后的细胞呈纺锤形或梭形,细胞数目多、排列紧密时可呈漩涡状。取第3代细胞,采用流式细胞仪检测其表面抗体CD29、CD34、CD45、CD90表达,结果显示其阳性率分别为91.77%、85.40%、0.22%、2.20%,证实该细胞为BMSCs。
1.3 补肾活血舒筋方含药血清制备 补肾活血舒筋方中药组成参照谢林等[3]的研究,取其方药以纯净水煎煮,将药液过滤、浓缩,调配至1.1、2.2、4.4 g/mL(以生药量计算),分别记为低、中、高浓度。将20只SD大鼠随机分为四组,每组5只,分别以1.1、2.2、4.4 g/mL药液及纯净水灌胃,剂量为2 mL。连续灌胃14天后采血,血样静置2 h后3 000 r/min离心20 min,取上清。
1.4 含药血清对大鼠BMSCs增殖、迁移能力影响的观察
1.4.1 细胞培养及干预 取生长状态良好的第3代BMSCs,用含10%胎牛血清的MEM培养基制成细胞悬液,以5×103个/孔接种于96孔板。将细胞分为含药血清低、中、高浓度组及空白对照组,每组设3个复孔。培养24 h后更换为MEM培养基继续培养24 h。含药血清低、中、高浓度组每孔分别加入低、中、高浓度含药血清10 μL,空白对照组加入等量空白血清。
1.4.2 细胞增殖能力 采用CCK-8法。取各组干预后细胞,5% CO2、37 ℃培养箱中培养24 h,每孔加入CCK-8溶液10 μL后继续孵育4 h。采用酶标仪在460 nm波长处测定光密度(OD)值,用不含细胞的完全培养基做空白对照,计算细胞生存率。细胞生存率=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。实验重复3次。
1.4.3 细胞迁移能力 采用Transwell小室试验。取处理48 h的各组细胞,消化后进行计数,调整细胞密度为1×106个/mL,悬于含2%胎牛血清的MEM培养基中。将Transwell装置置于培养箱中平衡30 min,上室接种1×105个细胞(体积为100 μL),下室为含100 ng/mL SDF-1α、2%胎牛血清的MEM培养基(体积为500 μL),置于CO2培养箱中12 h。弃去培养液,PBS清洗后4%中性甲醛固定15 min;结晶紫染色15 min,弃染色液, PBS清洗2次。用棉签小心擦掉上室上侧细胞,再用小刀取下小室的聚碳酯膜,于倒置相差显微镜下对Transwell上室下侧细胞进行计数,即细胞迁移数量。
1.5 NF-κB信号通路p65蛋白、CXCR4蛋白表达检测 采用Western blotting法。取生长良好的第3代BMSCs,消化处理后以1×105个/孔接种于6孔板,予MEM培养基饥饿处理8 h,使其生长同步化。参照1.4.1的方法进行分组处理48 h后收集细胞。加入含蛋白酶抑制剂的RIPA裂解液,收集并提取细胞总蛋白。采用BCA法测定各组蛋白质浓度,使用含蛋白酶抑制剂的RIPA裂解液调整至统一的蛋白质浓度,以每道10 μL蛋白上样。80 V电压电泳10 min,观察到溴酚兰进入分离胶后,电压改为120 V,继续电泳80 min。使用甲醇化的硝酸纤维素(PVDF)膜在350 mA电流下转膜120 min,5%脱脂牛奶封闭。分别加入兔抗大鼠p65、CXCR4蛋白抗体,置于水平摇床4 ℃孵育过夜。用TBST对PVDF膜漂洗3次,每次10 min,加入二抗IgG(羊抗兔红外二抗),室温避光孵育1 h;再用TBST对PVDF膜漂洗3次,每次10 min。使用ODYSSEY双色红外荧光扫描成像系统对目的条带进行扫描,并采用Image-Pro Plus6.0软件分析灰度值,以GAPDH作为内参。目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH条带灰度值。

2 结果
2.1 各组细胞生存率比较 含药血清高、中、低浓度组与空白对照组细胞生存率分别为(99.80±1.23)%、(102.92±1.49)%、(102.65±1.43)%、(101.71±0.91)%,多组间比较P>0.05。
2.2 各组细胞迁移数量比较 含药血清高、中、低浓度组与空白对照组细胞迁移数量分别为(95.00±1.78)、(69.75±1.89)、(17.25±0.95)、(16.50±0.65)个,含药血清高、中浓度组均高于含药血清低浓度组、空白对照组,且含药血清高浓度组高于含药血清中浓度组(P均<0.05);空白对照组与含药血清低浓度组比较差异无统计学意义(P>0.05)。
2.3 各组p65、CXCR4蛋白表达比较 各组p65、CXCR4蛋白相对表达量比较P<0.05,组间两两比较P均<0.05。见表1。
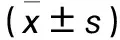
表1 各组p65、CXCR4蛋白相对表达量
3 讨论
2009年Krap等[9]建议将MSC归巢定义为:MSC在目标组织的脉管系统里被捕获,随后跨越血管内皮细胞迁移至目标组织的过程。对于归巢机制,尤其是干细胞的动员,目前仍无法准确阐述,大部分研究文献基于白细胞迁移、人类干细胞以及转移肿瘤细胞研究干细胞的迁移行为,针对各种细胞表面受体及细胞因子进行探索。SDF-1又称CXCL12,是趋化因子家族中的CXC亚族。CXCR4是目前研究最多的SDF-1受体,可同时在多种细胞表面表达,包括血液细胞、造血干细胞(HSCs)、胚胎干细胞(ES)[10]。研究表明,趋化因子家族及其受体不但能介导白细胞迁移,同时在MSC归巢中也发挥着重要作用,其中SDF-1/CXCR4轴的主要功能之一就是调节前体细胞的趋化及归巢至受伤部位[11]。
当组织受到损伤时,局部SDF-1表达上调,营造出一个SDF-1高浓度环境,随着距离的增加,SDF-1浓度梯度递减,而趋化表达CXCR4的MSC沿着这个浓度梯度到达组织损伤部位,参与组织的修复与重建。亦有学者认为,SDF-1α/CXCR4趋化信号轴是进化上高度保守的介导干细胞迁移、分布的关键信号[12],在MSCs募集和定向迁移中发挥关键性作用。Pereira等[13]将SDF-1注射入髓核中,发现MSCs能够穿越软骨终板,向髓核迁移。CXCR4是决定MSCs归巢能力的主要效应分子,其表达水平将直接影响MSCs的迁移能力。Wei等[14]研究发现,过表达CXCR4的BMSCs向SDF-1的迁移能力增强,其在椎间盘组织存活时间更久,对椎间盘组织的再生和修复能力更强。SDF-1/CXCR4信号轴可激活多重信号通道,包括MAPK p42/44、Jak/STAT和PI3K-AKT-NF-κB信号通道[15]。NF-κB是细胞内最重要的核转录因子,在许多细胞刺激介导细胞信息的转录调控中起核心作用,参与调节炎症反应,是细胞激活的标志,参与正常细胞和肿瘤细胞的生长和增殖[16]。NF-κB可通过调节SDF-1/CXCR4信号轴参与细胞的迁移、侵袭等过程,CXCR4表达是NF-κB和CXCR4基因启动子通过调节p50/p65结合位点来实现的[15]。
研究发现,部分中药对干细胞归巢具有一定的调节作用[17,18],尤其是补肾活血类中药,不但能够调节CXCR4表达[5],还能促进BMSCs的迁移[6]。前期研究显示,补肾活血舒筋方可以通过调节NF-κB信号通路,抑制椎间盘的退变[7]。本研究各组间细胞生存率比较差异无统计学意义,而含药血清高、中浓度组细胞迁移数量均高于含药血清低浓度组、空白对照组,说明补肾活血舒筋方对BMSCs增殖无明显影响,但中、高浓度时可促进其迁移。考虑补肾活血舒筋方影响细胞迁移时存在一定的药物浓度阈值,需要达到一定的药物浓度,细胞才可能被动员,发生迁移。本研究结果显示,补肾活血舒筋方含药血清可促进p65、CXCR4蛋白表达,并呈浓度依赖性;说明补肾活血舒筋方可能通过NF-κB信号通路调节CXCR4蛋白表达,进而促进BMSCs迁移。
综上所述,2.2、4.4 g/mL补肾活血舒筋方含药血清可促进BMSCs迁移,但对BMSCs增殖无影响;激活NF-κB信号通路可能是其作用机制。
[1] Kitaori T, Ito H, Schwarz EM, et al. Stromal cell-derived factor 1/CXCR4 signaling is critical for the recruitment of mesenchymal stem cells to the fracture site during skeletal repair in a mouse model[J]. Arthritis Rheum, 2009,60(3):813-823.
[2] Penzo M, Habiel DM, Ramadass M, et al. Cell migration to CXCL12 requires simultaneous IKKα and IKKβ-dependent NF-κB signaling[J]. Biochim Biophys Acta, 2014,1843(9):1796-1804.
[3] 谢林,王昆,康然,等.补肾活血舒筋方治疗颈椎病62例疗效观察[J].云南中医中药杂志,2008,29(8):10.
[4] 陈舰舰,周临东,谢林,等.补肾活血舒筋方治疗椎间盘源性颈痛临床疗效观察[J].黑龙江中医药,2012,41(5):9-10.
[5] 臧文华,李冰冰,唐德才,等.补气活血药对急性心肌梗死模型大鼠梗死心肌边缘区域SDF-1, CXCR4蛋白及mRNA表达的影响[J].世界科学技术:中医药现代化,2014,16(6):1377-1383.
[6] 张金生,张宝霞.三论活血化瘀治法理论—“干细胞循环理论”与“活血化瘀治法理论”研究相关性[J].中国实验方剂学杂志,2012,18(2):248-251.
[7] 谢林,王明绪,施杞.基于“肝主筋”组方治疗颈型颈椎病临床疗效观察[J].甘肃中医,2011,24(6):54-55.
[8] Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Haematol, 1976,4(5):267-274.
[9] Karp JM, Leng Teo GS. Mesenchymal stem cell homing:the devil is in the detaiIs[J]. Cell Stem Cell, 2009,4(3):206-216.
[10] Moll NM, Ransohoff RM. CXCL12 and CXCR4 in bone marrow physiology[J]. Expert Rev Hematol, 2010,3(3):315-322.
[11] Ghadge SK, Mühlstedt S, Özcelik C, et al. SDF-1αas a therapeutic stem cell homing factor in myocardial infarction[J]. Pharmacol Ther, 2011,129(1):97-108.
[12] 孟晨,吴小涛.SDF-1/CXCR4信号轴在调节干细胞迁移及发育中的作用[J].东南大学学报(医学版),2011,30(4):625-629.
[13] Pereira CL, Gonçalves RM, Peroglio M, et al. The effect of hyaluronan-based delivery of stromal cell-derived factor-1 on the recruitment of MSCs in degenerating intervertebral discs[J]. Biomaterials, 2014,35(28):8144-8153.
[14] Wei JN, Cai F, Wang F, et al. Transplantation of CXCR4 overexpressed mesenchymal stem cells augments regeneration in degenerated intervertebral discs[J]. DNA Cell Biol, 2016,35(5):241-248.
[15] Helbig G, Christopherson KW, Bhat-Nakshatri P, et al. NF-kappa B promotes breast cancer cell migration and metastasis by inducing the expression of the chemokine receptorCXCR4[J]. J Biol Chem, 2003,278(24):21631-21638.
[16] Hayden MS, Ghosh S. Shared principles in NF-kappa B signaling[J]. Cell, 2008,132(3):344-362.
[17] 欧阳长生,王云开,苏海,等.丹参及血府逐瘀汤含药血清与兔骨髓间充质干细胞的体外迁移:促进还是抑制[J].中国组织工程研究与临床康复,2009,13(40):7847-7851.
[18] 戴儒丽,闫福曼,周乐全,等.川芎嗪对大鼠骨髓间充质干细胞SDF-1表达的影响[J].中药药理与临床,2012,27(5):29-31.
江苏省自然科学基金资助项目(BK20151064)。
谢林(E-mail: xielin117@126.com)
10.3969/j.issn.1002-266X.2017.16.011
R329
A
1002-266X(2017)16-0038-03
2016-10-15)
