西藏地区牦牛瘤胃中兼性厌氧纤维素降解菌的分离鉴定
2017-06-19李君风原现军董志浩SeareTajebeDesta陈雷白晰白云峰邵涛
李君风,原现军,董志浩,Seare Tajebe Desta,陈雷,白晰,白云峰,邵涛*
西藏地区牦牛瘤胃中兼性厌氧纤维素降解菌的分离鉴定
李君风1,原现军1,董志浩1,Seare Tajebe Desta1,陈雷1,白晰1,白云峰2,邵涛1*
(1.南京农业大学饲草调制加工与贮藏研究所,江苏 南京 210095;2.江苏省农业科学院,江苏 南京 210014)
本研究旨在从西藏地区牦牛瘤胃中分离出具有分解纤维素能力的兼性厌氧菌,为青贮饲料微生物添加剂的研制提供支持。试验采集了西藏那曲地区成年牦牛的新鲜瘤胃液,经刚果红染色初筛,滤纸降解复筛,获得分解纤维素能力强的菌株,对菌株生长速率及酶活力进行测定,经形态学、生理生化特性和16S rRNA序列分析对菌株进行鉴定,并分析了菌株对水稻秸秆的降解效果。试验分离出一株兼性厌氧纤维素降解菌,属于肠球菌属,即粪肠球菌(Enterococcusfaecalis) JF85。菌株JF85在15~55 ℃,pH 3.0~7.0及3.0%和6.5% NaCl培养基中生长良好。接种JF85,36 h后可获得最大内切葡聚糖酶活力(0.41 U/mL)和滤纸酶活力(0.13 U/mL)。在模拟发酵试验中,接种菌株JF85,14 d后水稻秸秆干物质、纤维素和半纤维素含量与对照组相比显著降低(P<0.05);在发酵第7天,JF85处理组显示最高的可溶性碳水化合物含量,整个发酵过程中木质素含量变化不显著(P>0.05)。菌株JF85具有分解纤维素、耐酸、耐盐特性,在青贮饲料生产中具有较好的应用前景。
牦牛;瘤胃液;纤维素降解菌;分离;鉴定;水稻秸秆
我国农作物秸秆资源丰富,年总产量达5.5~5.7亿多吨,其中水稻秸秆1.8亿t,玉米秸秆1.3亿t,小麦秸秆1.3亿t;虽然农作物秸秆产量巨大,但利用率低[1]。据统计目前我国仅有20%~30%的农作物秸秆用于家畜的饲料,45%~47%左右的秸秆作为生活燃料,15%在田间被直接焚烧,因此只有少部分过腹还田或直接还田[2]。如何充分合理有效地利用农作物秸秆资源,使环境不受污染,是当前农业生产中面临的一个重大研究课题。农作物秸秆一般营养价值低、适口性差,其粗蛋白含量仅为3%~6%,干物质消化率30%~40%。为了改善农作物秸秆的饲用价值,一般采用物理、化学和生物学等加工处理方法,其中生物学处理方法在未来最具有发展前景。青贮是生物学处理方法之一,但农作物秸秆青贮发酵品质常常不理想,主要原因是其水溶性碳水化合物含量低,不能为乳酸菌提供充足的发酵底物。近年来随着生物降解技术研究的不断深入,发现利用纤维素降解菌不仅能够分解农作物秸秆的纤维产生水溶性碳水化合物,提高青贮发酵品质,而且还能提高蛋白质含量、适口性和消化率[3]。
目前关于纤维素降解菌的研究报道较多,集中于研究土壤、动物粪便、堆肥、废纸浆、温泉等分离出来的纤维素降解菌,主要有好氧性和厌氧性两大类纤维素降解菌[4]。由于青贮要经历从有氧期进入厌氧期的过程,因此筛选与研究兼性厌氧性纤维素降解菌作为青贮微生物添加剂更具有实际应用价值。反刍动物瘤胃具有高效降解纤维素的能力,被喻为丰富的纤维素降解菌资源库[5]。迄今为止,分离到的瘤胃纤维降解细菌有白色瘤胃球菌(Rumincoccusalbus)、黄色瘤胃球菌(R.flavefaciens)、产琥珀酸丝状杆菌(Fibrobactersuccinogenes)和溶纤维丁酸弧菌(Butyrivibriofibrisolvens)等,但这些细菌需要在严格厌氧和低氧化还原电位下才能生长[6]。王炳晓等[7]从奶牛瘤胃液中分离出具有分解纤维素能力的兼性厌氧细菌,如苏云金芽孢杆菌(Bacillusthuringiensis)、巨大芽孢杆菌(Bacillusmegaterium)和蜡状芽孢杆菌(Bacilluscereus) 等,但其仅对致病性和酶活进行了研究,而对农作物秸秆的降解作用未见报道。国内外有关瘤胃纤维素降解菌的研究大多集中于绵羊、水牛、肉牛和奶牛中,而从牦牛瘤胃中分离兼性厌氧性纤维素降解菌的报道很少。牦牛素有“高原之舟”的美称,对青藏高原严寒、缺氧、强紫外辐射等恶劣自然条件具有超强的适应能力;在青藏高原特殊的生态环境和长期的自然选择下,使牦牛形成了耐粗饲的生态生理特性[8],研究发现,牦牛瘤胃中的纤维素降解菌种类更丰富,纤维素降解能力更强[9]。曹阳春等[10]从牦牛瘤胃中筛选到1株能分泌高活性的纤维降解酶的厌氧真菌Neocallimastixfrontalis,该菌株羧甲基纤维素酶和微晶纤维素酶的酶活性分别达到83和16 mU/L。虽然瘤胃真菌分泌的纤维素酶活性在所有瘤胃微生物中较高,但是真菌生长过程中会产生大量的孢子,降低饲料的适口性,不宜作为微生物添加剂。因此从牦牛瘤胃中筛选具有纤维素降解能力强的兼性厌氧性细菌具有重要的理论和实际意义。本研究旨在从西藏地区牦牛瘤胃中筛选出兼性厌氧纤维素降解菌,为青贮添加剂的研发与应用提供理论依据。
1 材料与方法
1.1 样品来源
本试验于2014年10月从西藏那曲牦牛屠宰场随机采集3头年龄在4~5周岁,体重为250~300 kg的健康牦牛瘤胃液,并将其放入预先充有氮气的灭菌瓶内,装入保温盒中6 h内带到实验室。牦牛主要以采食天然草地牧草为主,放牧管理。那曲地区地处西藏北部,位于青藏高原腹地,地理位置为31.47 N,92.1 E,平均海拔4500 m以上,属高原亚寒带季风半湿润气候区。
1.2 培养基及药品
富集培养基[11],羧甲基纤维素钠(CMC-Na)10.0 g,KH2PO42.0 g,MgSO40.3 g,(NH4)2SO41.4 g,CaCl20.3 g,无细胞瘤胃液100 mL,痕量营养液1 mL,半胱氨酸1 g,纤维二糖2 g,酵母膏0.5 g,蛋白胨0.5 g,蒸馏水1000 mL。
筛选培养基[12],CMC-Na 10.0 g,KH2PO42.0 g,MgSO40.3 g,(NH4)2SO41.4 g,CaCl20.3 g,无细胞瘤胃液100 mL,痕量营养液1 mL,琼脂20 g,半胱氨酸1 g,蒸馏水1000 mL。
复筛培养基,将筛选培养基中的CMC-Na用Whatman NO.1滤纸代替,无琼脂。滤纸条先用1%稀醋酸浸泡24 h,用碘液检查是否有淀粉,若已去除完全,则用2%苏打水冲洗至中性,灭菌后备用。
液体培养基,CMC-Na 10.0 g,酵母膏10 g,蛋白胨10 g,NaCl 5 g,蒸馏水1000 mL。
液体产酶培养基,CMC-Na 5 g,NH4NO31.0 g,MgSO4·7H2O 0.5 g,K2HPO41.0 g,CaCl20.02 g,FeCl3·6H2O 0.05 g,蛋白胨1.0 g,蒸馏水1000 mL。
痕量营养液,FeSO40.2 g,MnSO40.15 g,ZnCl20.3 g,CoCl20.4 g,于1 L容量瓶定容后,封装4 ℃保存备用。
盐液,尿素0.3 g、硫酸铵1.4 g、KH2PO42.0 g、CaCl20.3 g、MgSO4·7H2O 0.3 g、酵母膏0.25 g、蛋白胨0.75 g、FeSO4·7H2O 5 mg、CoCl220 mg、MnSO4·7H2O 1.6 mg、ZnSO4·7H2O 1.4 mg、蒸馏水1000 mL,以上培养基pH调为6.5,均在121 ℃灭菌15 min后使用。水稻秸秆经自然风干后磨成粉灭菌后使用。
酶制剂(纤维素酶),江苏锐阳生物有限公司产品(纤维素酶酶活:5万U/g),添加量参照使用说明。
1.3 试验方法
1.3.1 纤维素降解菌的筛选 采集西藏地区牦牛瘤胃液于无菌瓶中厌氧密封并将其放于保温盒内,迅速带回实验室,用快速混匀器匀浆10 s,3层纱布过滤去掉残渣,取滤液1 mL于装有50 mL富集培养基的血清瓶中密封,39 ℃下厌氧振荡培养1~3 d后,按2%的接种量,转接至新的富集培养基中进行第2次富集培养。将富集培养后的菌液接种到筛选培养基中做平板稀释涂布法分离,待纯化出单菌株,点种在筛选培养基的平板上厌氧培养2~3 d后,用1 mg/mL的刚果红浸染30 min,倾去染液,再以1 mol/L的氯化钠水溶液脱色,观察水解圈大小。挑取透明圈较大的菌落,进行多次划线纯化,并再次进行点种和刚果红染色,观察透明圈的大小,挑取透明圈大的菌株接入到复筛培养基中厌氧培养7 d,观察滤纸的崩解效果,直至得到稳定的具有降解纤维素能力的纯菌株[13]。
1.3.2 菌落形态与染色特征观察 挑取分离纯化后透明圈较大,且能有效降解滤纸的单菌落进行形态观察,并对培养24~48 h的菌落涂片,革兰氏染色,油镜下镜检。
1.3.3 菌株的生理生化特性检测 不同温度水平生长试验,将配制好的液体培养基以每试管5 mL的量分装好,在121 ℃高压条件下灭菌15 min,将待测菌株培养液,以相同的接种量(0.1 mL)接入液体培养基中摇匀,塞子封口,分别置于15,25,35,45和55 ℃恒温培养箱中培养3~5 d后,观察菌株的生长情况。
不同pH水平生长试验,用盐酸或氢氧化钠将液体培养基pH调至3.0,4.0,5.0,6.0和7.0五个水平,同上述步骤,将待测菌株培养液以相同的接种量(0.1 mL)接入已灭菌的液体培养基中,置于39 ℃恒温培养箱厌氧培养2 d后,观察菌株的耐酸碱能力。
不同盐浓度水平生长试验,用分析纯 NaCl 将液体培养基的盐浓度调至3.0%,6.5%和10%三个水平,同上述步骤,将待测菌株培养液以相同的接种量(0.1 mL)接入已灭菌培养液中,置于39 ℃恒温培养箱厌氧培养2 d后,观察菌株的耐盐能力。
糖发酵试验,使用包含49种不同碳水化合物和一个对照的API 50 CHL进行不同糖、醇发酵鉴定,将菌株在39 ℃条件下培养48 h后制成菌悬液接种于试验条的每一个管中。培养期间,糖发酵产酸致使pH下降,以指示剂的颜色变化予以表示。结果组成该菌株的生化图谱,并依据说明书来鉴定或分型。
1.3.4 分子生物学鉴定 取39 ℃条件下培养24 h的培养液2 mL,13000 r/min离心10 min,沉淀物用于DNA提取,使用细胞破碎仪(Biospec公司),按照Zoetendal描述的酚-氯仿法提取样品DNA[14]。 PCR反应体系包括:2xPCR Master Mix 25 μL,引物各2 μL,DNA模板2 μL,ddH2O 19 μL。PCR反应程序为:预变性,94 ℃,5 min;变性,94 ℃,30 s;退火,55 ℃,30 s;延伸,72 ℃ 2 min,共30个循环[15]。PCR纯化产物送样测序(上海英潍捷基生物科技有限公司)。用BLAST将所测定菌株的16S rRNA序列与GenBank/EMBL/DDBJ数据库中已知细菌的16S rRNA序列进行比对,寻找与目的基因序列同源性最高的已知分类地位的菌种,分析相似性。然后用MEGA6.0中的Clustal W对最近类群的序列进行多重比较分析,并通过该软件的邻近法(Neighbor Joining)构建系统发育树。
1.3.5 酶活力的测定 纤维素酶活力的测定采用3,5-二硝基水杨酸(DNS)法。液体产酶培养条件下,取新鲜培养液10 mL,12000 r/min离心15 min,上清液即为粗酶液[16]。酶活力单位定义:在pH 4.8条件下每min产生1 μmol还原糖的酶量为1个酶活力单位(U)。
内切葡聚糖酶(CMCase)活测定[17],取0.5 mL适当稀释的粗酶液于25 mL具塞刻度试管中,加入含1%CMC-Na的磷酸氢二钠-柠檬酸缓冲液1.5 mL(pH 4.8),混匀后将试管于50 ℃水浴30 min,结束立即加入1.5 mL DNS溶液以终止酶反应,充分摇匀后沸水浴10 min,冷却定容后在540 nm波长下测定吸光值(A540)。
滤纸酶活(FPase)测定,将去除淀粉后的Whatman NO.1滤纸(1 cm×6 cm)放进25 mL具塞刻度试管,加入0.5 mL粗酶液和1.5 mL磷酸氢二钠-柠檬酸缓冲液(pH 4.8),试管在50 ℃水浴1 h后取出立即向试管中加入1.5 mL DNS溶液以终止酶反应,沸水浴10 min,冷却定容后在540 nm下测定吸光值(A540)。
1.3.6 水稻秸秆纤维降解试验 将所筛的菌株接种到液体培养基中39 ℃,150 r/min振荡培养2 d后,4200 r/min离心,然后用磷酸缓冲液(PBS)清洗2~3次,最后用PBS溶液调菌体OD600值为1.0,然后按0.2 mL/g的接种量(活菌数量为5.2×108cfu/mL)将菌株接种到模拟水稻秸秆发酵的微型发酵罐中混合均匀培养。试验设对照组、酶制剂处理组(E:按0.02 g/kg添加)和菌株JF85处理组,每个处理组5个重复,各组加入等量已灭菌的盐液,室温条件下厌氧培养,分别在培养2、7和14 d后开罐取样分析。将样品烘干称重,干物质(dry matter,DM)采用AOAC方法测定、水溶性碳水化合物(water soluble carbohydrate,WSC)采用蒽酮—硫酸比色法测定,按照Ververis等[18]的方法,测定不同处理的纤维素、半纤维素以及木质素含量。
2 结果与分析
2.1 菌株的筛选与纯化
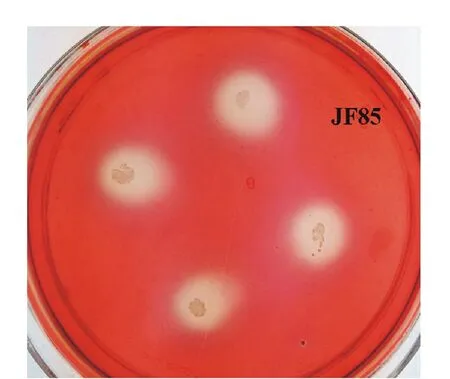
图1 菌株JF85刚果红染色Fig.1 Clearing zone of cellulolytic bacterium JF85 on CMC-Na selective media
经富集培养、筛选培养基平板筛选、多次划线分离纯化及滤纸复筛后得到1株能以羧甲基纤维素钠(CMC-Na)为唯一碳源生长的菌株JF85,此菌株经刚果红染色后在菌落周围出现明显透明圈(图1)。
2.2 纤维素降解菌JF85的鉴定
2.2.1 形态观察及菌株生理生化特性 将培养了48 h的菌落进行观察,菌落特征一致为圆形,边缘整齐,表面光滑,扁平隆起,凸显的菌落大小为1~2 mm,乳白色、不透明,表面黏稠湿润。经过革兰染色并镜检,观察到所分离的菌株为革兰氏阳性菌,形态为椭圆球形、呈单个、成对或短链状排列,无鞭毛、无芽胞。将待测菌株JF85通过生理生化测定,其具体试验结果见表1和表2。菌株JF85在15~55 ℃,pH 3.0~7.0范围内及3.0%和6.5%NaCl条件下生长良好,表明菌株JF85具有耐酸、耐盐特性。糖发酵结果表明,菌株JF85不能利用赤藓糖醇,D-阿拉伯糖,D-木糖,蜜二糖,D-棉籽糖和D-松二糖,从利用纤维二糖和水杨苷情况来看,菌株JF85可利用其产酶。
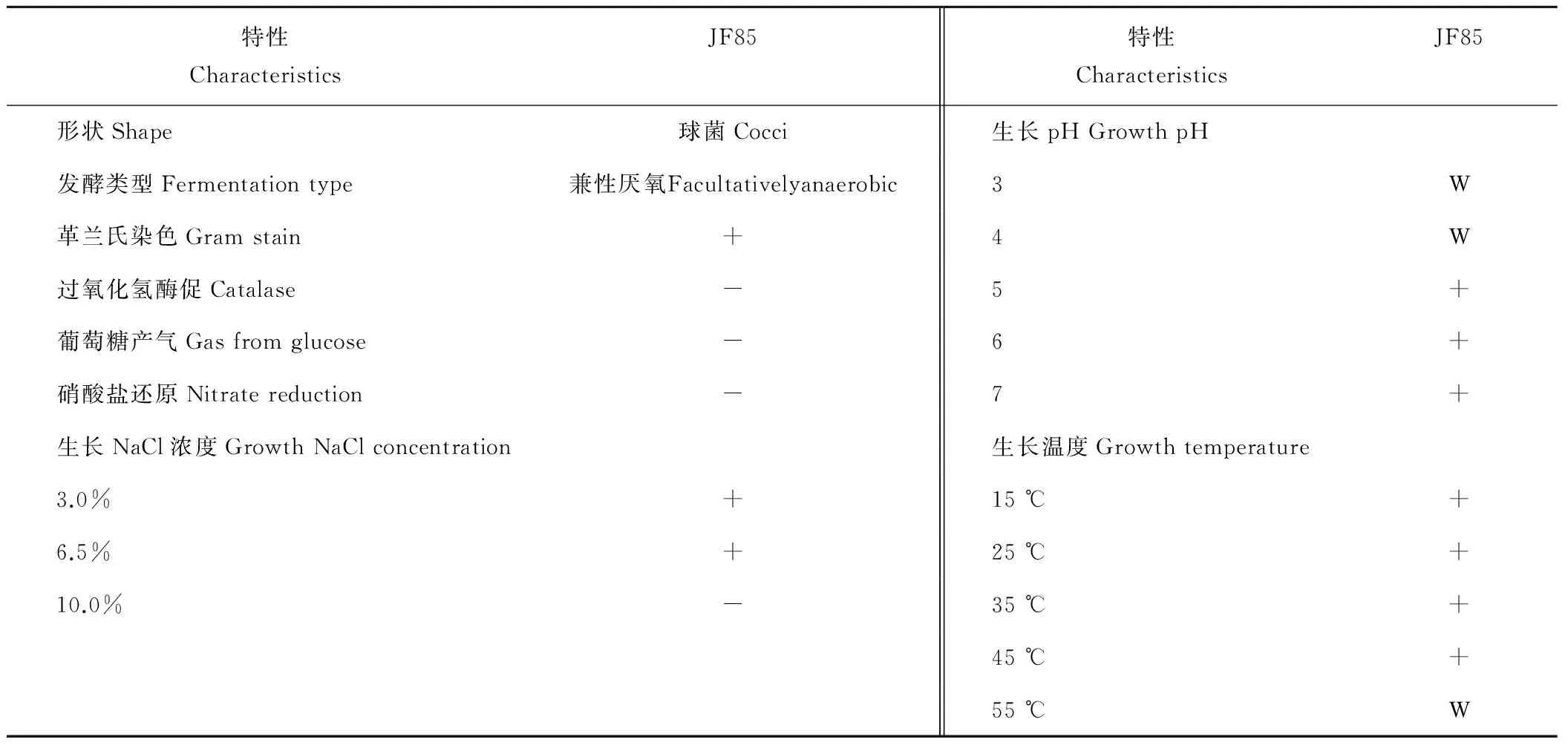
表1 菌株JF85生长和生化的特性Table 1 The physiological characteristics of cellulolytic bacterium (JF85)
注:“+”表示阳性,“-”表示阴性,“W”表示弱阳性。下同。
Note:“+”means positive;“-”means negative;“W” means weakly positive.The same below.
2.2.2 分子生物学鉴定 经上海英潍捷基生物科技有限公司序列测定,确定扩增的16S rRNA片段长度1457 bp,BLAST序列比较发现该菌株的16S rRNA序列与多株肠球菌属细菌的16S rRNA 相似,故Genbank命名为Enterococcussp.JF85,并与粪肠球菌(E.faecalis)序列相似性为99%。调出其中已鉴定菌株的16S rRNA,用Clustal W进行多重序列对比,并按Neighbor-Joining法构建系统发育树(图2)。
2.3 纤维素降解菌JF85的生长曲线和产酶曲线
以2%的接种量将JF85菌液接种到液体培养基中进行培养,按时间编号取样测定OD600值,得到JF85的生长曲线,试验结果见图3。从图3中可以明显看出,JF85在液体培养基中生长的延滞期(调节期)是0~4 h,对数生长期是4~24 h,24~40 h为稳定期。因此在制备此菌株种子液时收集时间应控制在12~24 h之间,此段时间菌株的生长速率快、菌体浓度高。对菌株JF85不同培养时间点取样测定酶活,其内切葡聚糖酶活力和滤纸酶活力从6 h开始都呈明显的上升趋势,36 h后内切葡聚糖酶活力(0.41 U/mL)和滤纸酶活力(0.13 U/mL)都达到了最大值。从图3还可以观察出,JF85的产酶与菌株生长密切相关。在培养初期营养丰富,菌株大量繁殖并代谢产酶;培养48 h后由于营养的限制,菌株生长受到抑制,酶活出现下降。
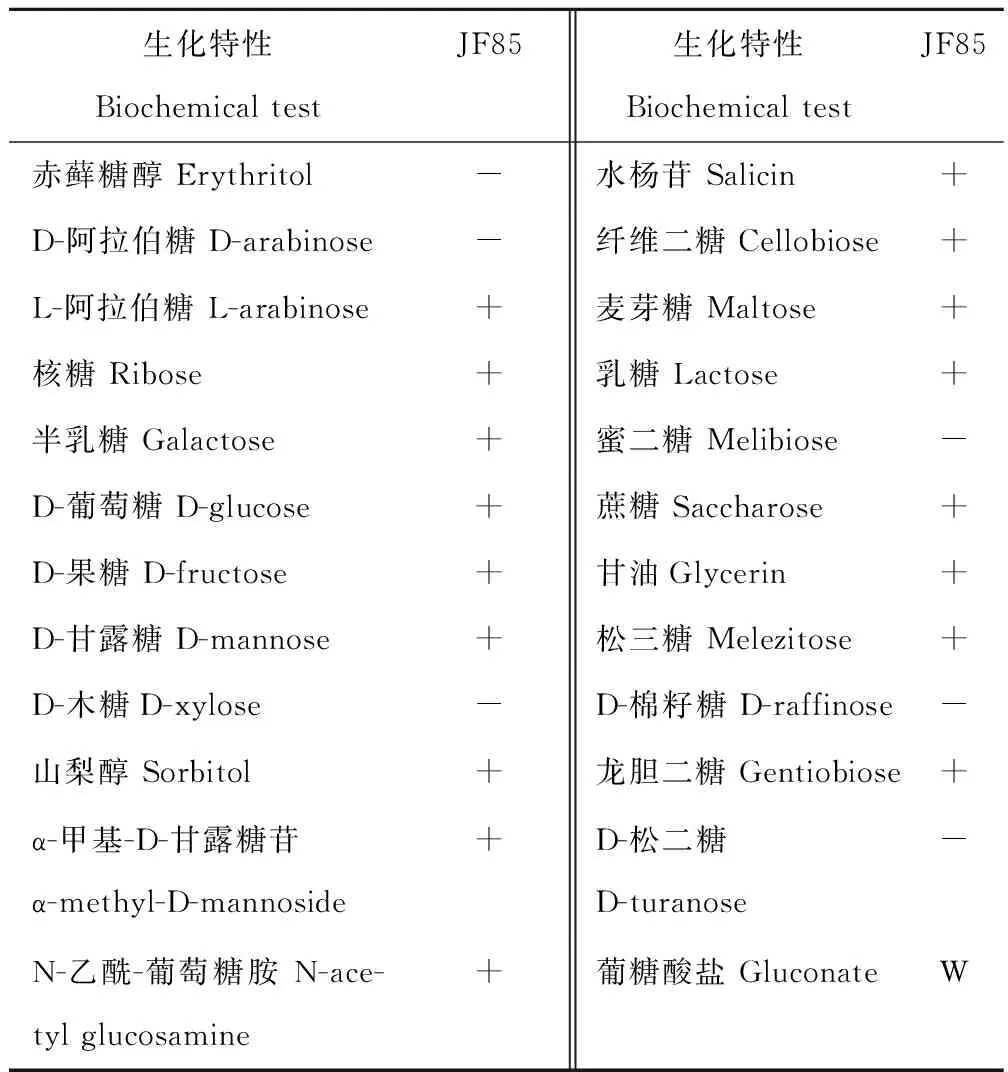
表2 菌株JF85糖发酵特性Table 2 Sugar fermentation profiles of cellulolytic bacterium (JF85)
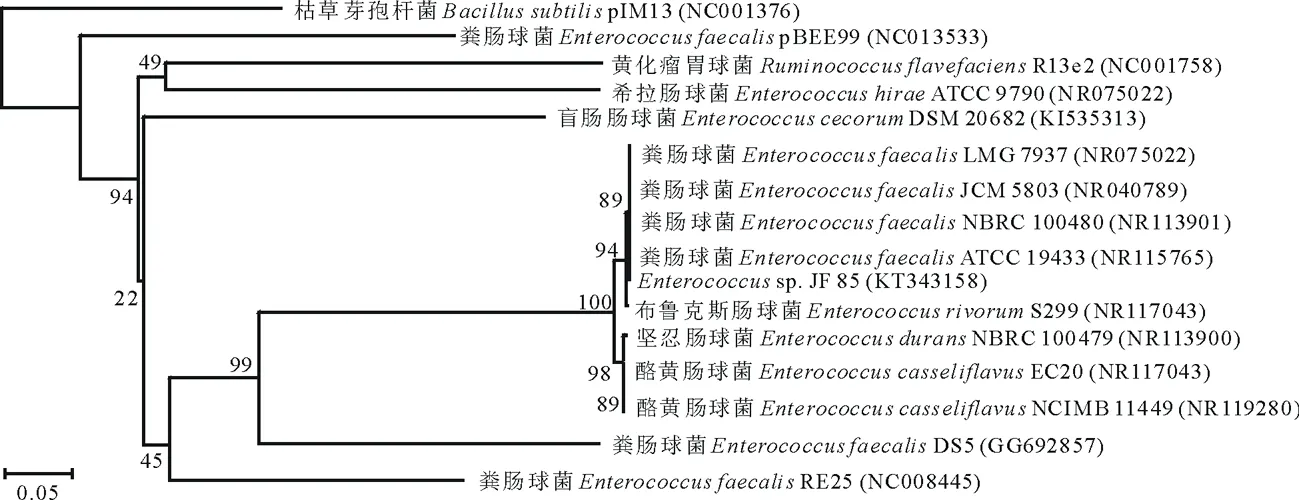
图2 纤维素分解菌的系统发育树Fig.2 Phylogenetic tree of 16S rRNA sequences of the cellulolytic bacterium
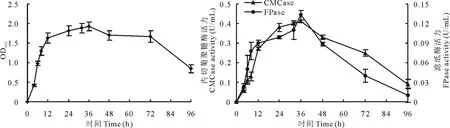
图3 纤维素降解菌JF85的生长曲线和产酶曲线Fig.3 Time course profiles of growth and enzyme production by cellulolytic bacterium (JF85) in liquid medium
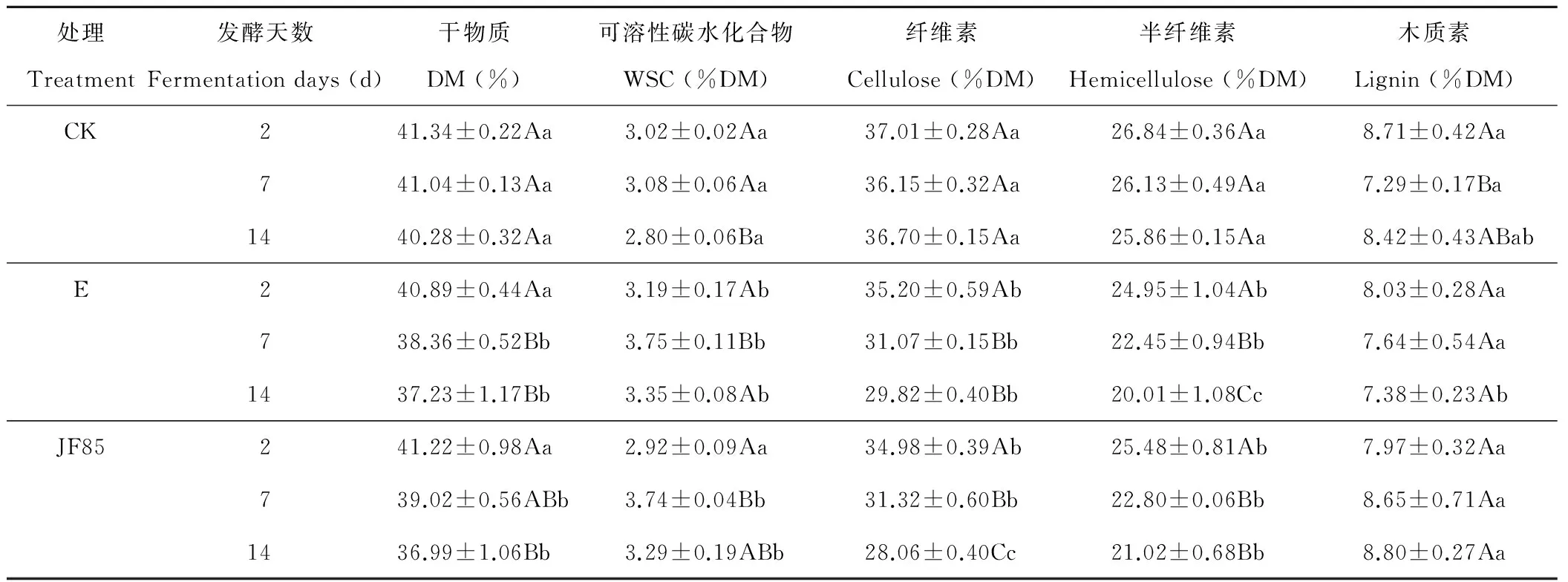
表3 水稻秸秆的降解动态Table 3 Dynamics degradation of rice straw
不同大写字母表示相同处理不同发酵天数间差异显著(P<0.05);不同小写字母表示相同发酵时间不同处理间差异显著(P<0.05);E为商品酶制剂。Values with different capital letters show significant differences among ensiling days in the same treatment (P<0.05);values with different small letters show significant differences among treatment in the same days (P<0.05).E for commercial enzyme preparation.WSC:Water soluble carbohydrate.
2.4 水稻秸秆纤维降解试验
将所筛选的纤维素降解菌株JF85接种到微型模拟水稻秸秆厌氧发酵罐中,通过测定不同发酵时间的干物质、可溶性碳水化合物、纤维素、半纤维素以及木质素等参数,研究菌株JF85对水稻秸秆纤维的降解效果。结果显示(表3),在整个发酵过程中,各组干物质逐渐下降,WSC含量整体上呈逐渐上升后又下降的趋势,其中发酵第7天,酶和菌株处理组WSC含量显著高于对照组(P<0.05)。随着发酵时间的延长,各组纤维素和半纤维素含量逐渐降低,其中酶和菌株处理组纤维素含量显著低于对照组(P<0.05),发酵第14天,菌株处理组纤维素含量达到最低(28.06% DM)。发酵7~14 d内,酶和菌株处理组半纤维素含量均显著低于发酵前期(P<0.05)。整个发酵过程中各组木质素含量无显著变化(P>0.05)。
3 讨论
肠球菌(Enterococcus)是一种兼性厌氧型乳酸菌,属于链球菌科肠球菌属,是人类和动物肠道正常菌群的一部分,在肠黏膜中具有较强的耐受力和定植能力,并且在不利的环境条件下具有较强的抗逆性如耐酸、耐高温、耐氧和耐干燥,比较适合作为益生菌在动物生产中应用[19]。Nocek等[20-21]报道,围产期奶牛饲喂含有屎肠球菌的添加剂能够促进饲草料在瘤胃中的消化,提高产奶量。还有研究表明,通过饲喂含有屎肠球菌的饲草料能够促进肉牛适应高精料日粮,防止酸中毒[22]。本试验所筛选的纤维素降解菌,具有较高的纤维素降解能力,经生理生化和16S rRNA序列鉴定,为肠球菌属的一个种,该菌与Enterococcusfaecalis的相似度极高。刘占英等[23]分离鉴定了一株能降解纤维素的粪肠球菌EnterococcusfaecalisCTB374-1,该菌株能以纤维素为底物产生L-乳酸。Nyonyo等[24]从牛瘤胃液中筛出一株具有较高滤纸酶活力的粪肠球菌(Enterococcusfaecalis)。Robert等[25]从人的大肠中分离出能降解纤维素的肠球菌,与本研究一致,这说明有些肠球菌存在产纤维素酶的基因,能够分泌纤维素酶降解纤维素。
青贮过程中添加乳酸菌能够快速产生乳酸,迅速降低pH值,从而抑制有害微生物的繁殖生长,提高青贮发酵品质。但是乳酸菌通常不具备纤维降解能力,若将纤维素降解菌和乳酸菌组合应用于青贮饲料生产中,一方面纤维素降解菌可分解纤维素为乳酸菌提供可利用的单糖,另一方面乳酸菌能加速乳酸发酵,从而进一步提高青贮饲料发酵品质。一般青贮微生物添加剂应具有耐酸性,生长速度快,还能充分利用各种发酵底物,在较大的温度范围内以及多种条件下均可生长。本试验分离到的菌株JF85能在12~24 h内快速达到对数期,且能在pH 3.0~6.0,15~35 ℃条件下生长,满足了青贮接种剂的要求。买尔哈巴·艾合买提等[26]从新疆细毛羊、牛和骆驼瘤胃液中分离出2株高产纤维素降解酶的菌,并将其应用到棉花秸秆青贮中,结果表明,两株菌株均能降低青贮饲料的中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和半纤维素(HC)的含量,提高水溶性碳水化合物含量,不同程度地提高了棉花秸秆青贮发酵品质。冯怀蓉等[27]在玉米(Zeamays)和苜蓿(Medicagosativa)青贮中添加含有乳酸菌和产纤维素酶的枯草芽抱杆菌,青贮后各项营养指标均优于对照组,明显地提高了粗蛋白,降低了粗纤维含量。筛选兼性厌氧纤维素降解菌能适应青贮过程中前期有氧,后期无氧的环境,发挥其应有的功能。
本试验测定了菌株JF85不同生长期的内切葡聚糖酶活力和滤纸酶活力,并分析了其对水稻秸秆天然纤维素的降解效果,结果表明:在产酶试验中接种菌株JF85,36 h后可获得最大内切葡聚糖酶活力(0.41 U/mL)和滤纸酶活力(0.13 U/mL),但仅仅测定了菌株JF85在通用产酶液体培养基中的产酶曲线,并没有优化其产酶条件,今后有待进一步研究。虽然菌株JF85的内切葡聚糖酶活力和滤纸酶活力并非很强,但其可以明显加速水稻秸秆中纤维素的降解,增加水溶性碳水化合物的含量。在发酵14 d内,菌株JF85处理组纤维素含量降低了19.78%,半纤维素含量降低了17.50%,而酶处理组纤维素含量降低了15.2%。因此,菌株处理组对纤维素的降解程度要优于酶制剂处理组。有研究报道从青藏高原野牦牛粪中筛选出3株产纤维素酶活较高的芽孢杆菌属细菌,并将其与乳酸菌按一定比例混合添加到全株玉米青贮中,发酵30 d后,其中性洗涤纤维和酸性洗涤纤维含量分别降低了16.63%和15.85%[28]。本试验菌株对秸秆的降解结果表明,仅仅以测定纤维素酶活来衡量菌株的纤维分解能力是不全面的,纤维素的降解可能还存在一些其他因素。Glyn等[29]研究指出,多糖单加氧酶(PMO)也是纤维素分解过程中的一个重要的酶系,它可通过从多糖链葡萄糖单体的C-4端夺取H原子形成非还原性末端而被氧化成醛酮糖;而Beeson等[30]报道指出,PMO先从多糖链葡萄糖单体的C-1端获取H原子后形成内酯糖,接着转化为醛糖酸,被磷酸化后通过磷酸戊糖途径被代谢,进而实现对纤维素的降解。菌株JF85是否存在这些纤维素的分解机制,还有待深入的研究。
4 结论
本研究采用刚果红染色初筛,滤纸降解复筛等方法,从西藏地区牦牛瘤胃液中分离获得一株具有较高纤维素酶活力的纤维素降解菌。模拟厌氧发酵试验结果表明菌株JF85对水稻秸秆天然纤维素有一定程度的降解效果,为生产优质青贮饲料添加剂的研发与应用提供了理论依据。
References:
[1] Han L J,Yan Q J,Liu X Y,etal.Straw resources and their utilization in China.Transactions of the CSAE,2002,18(3):87-91.韩鲁佳,闫巧娟,刘向阳,等.中国农作物秸秆资源及其利用现状.农业工程学报,2002,18(3):87-91.
[2] Yang Q L,Yao T,Wang D W,etal.Screening of lignocellulose degrading microbial communities for their ability to deodorize livestock and poultry wastes.Acta Prataculturae Sinica,2015,24(1):196-203.杨巧丽,姚拓,王得武,等.木质纤维分解菌群筛选及其对秸秆分解与畜禽粪便除臭能力评价.草业学报,2015,24(1):196-203.
[3] Bi Y Y.Study on Straw Resources Evaluation and Utilization in China[D].Beijing:Chinese Academy of Agricultural Sciences,2010.毕于运.秸秆资源评价与利用研究[D].北京:中国农业科学院,2010.
[4] Wang D W,Yao T,Yang Q L,etal.Screening and degradation characterization of efficient and stable cellulose degrading microbial communities.Acta Prataculturae Sinica,2014,23(2):253-259.王得武,姚拓,杨巧丽,等.高效稳定纤维素分解菌群筛选及其分解特性研究.草业学报,2014,23(2):253-259.
[5] An D D.Progression the ruminant fermentation regulation.Journal of Gansu Agricultural University,2002,37(1):10-15.安登第.瘤胃发酵调控研究进展.甘肃农业大学学报,2002,37(1):10-15.
[6] Sun Y Z,Mao S Y,Yao W,etal.The dynamics of microorganism populations and fermentation characters of co-cultures of rumen fungi and cellulolytic bacteria on different substrates.Acta Microbiologica Sinica,2006,46(3):422-426.孙云章,毛胜勇,姚文,等.不同精粗比底物下瘤胃真菌和纤维降解细菌共培养发酵特性及菌群变化.微生物学报,2006,46(3):422-426.
[7] Wang B X,Chai T J,Su P C,etal.Isolation and identificat ion of cow ruminal facultatively anaerobic cellulolytic bacteria.Journal of Northwest A &F University: Natural Science Edition,2009,37(3):35-42.王炳晓,柴同杰,苏鹏程,等.奶牛瘤胃兼性厌氧纤维素分解茵的分离鉴定.西北农林科技大学学报:自然科学版,2009,37(3):35-42.
[8] Dong Q M,Zhao X Q,Shi J J,etal.Effect of dietary composition on the digestive and energy metabolisms of yak calves.Acta Prataculturae Sinica,2012,21(3):281-286.董全民,赵新全,施建军,等.日粮组成对牦犊牛消化和能量代谢的影响.草业学报,2012,21(3):281-286.
[9] Han X T,Han X T,Xie A Y,etal.Effects of high altitude and season on fasting heat production in the yakBosgrunniensorPoephagusgrunniens.British Journal of Nutrition,2002,88(2):189-197.
[10] Cao Y C,Yang H J,Shen B T.Screening and identification of high activity cellulolytic anaerobic fungi from rumen of yak.Journal of China Agricultural University,2010,15(3):70-74.曹阳春,杨红建,沈博通.高产纤维降解酶牦牛瘤胃厌氧真菌分离株的筛选与鉴定.中国农业大学学报,2010,15(3):70-74.
[11] Nyonyo T,Shinkai T,Tajima A,etal.Effect of media composition,including gelling agents,on isolation of previouly uncultured rumen bacteria.Letters in Applied Microbiology,2013,56(1):63-70.
[12] Bryant M P,Burkey L A.Cultural methods and some characteristics of some of the more numerous groups of bacteria in the bovine rumen.Journal of Dairy Science,1953,36(3):205-217.
[13] Teather R M,Wood P J.Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from bovine rumen.Applied &Environmental Microbiology,1982,43(4):777-780.
[14] Zoetendal E G,Akkermans A D,DeVos W M.Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria.Applied &Environmental Microbiology,1998,64(10):3854-3859.
[15] Liang Y L,Zhang Z,Wu M,etal.Isolation,screening,and identification of cellulolytic bacteria from natural reserves in the subtropical region of China and optimization of cellulase production byPaenibacillusterraeME27-1.Biomed Research International,2014,(5):2003-2017.
[16] Huang Q L,Zhong Z M,Huang X S,etal.Screening of cellulose-degrading bacteria and evaluation of silage performance ofPennisetum.Acta Prataculturae Sinica,2016,25(4):197-203.黄勤楼,钟珍梅,黄秀声,等.纤维素降解菌的筛选及在狼尾草青贮中使用效果评价.草业学报,2016,25(4):197-203.
[17] Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar.Analytical Chemistry,1959,31(3):426-428.
[18] Ververis C,Georghiou K,Danielidis D,etal.Cellulose,hemicelluloses,lignin and ash content of some organic materials and their suitability for use as paper pulp supplements.Bioresource Technology,2007,98(2):296-301.
[19] Ford M,Perry J D,Gould F K.Use of cephalexin-aztreonam-arabinose agar for selective isolation ofEnterococcusfaecium.Journal of Clinical Microbiology,1994,32(12):2999-3001.
[20] Nocek J E,Kautz W P,Leedle J A Z,etal.Direct-fed microbial supplementation on the performance of dairy cattle during the transition period.Journal Dairy Science,2003,86(1):331-335.
[21] Nocek J E,Kautz W P.Direct-fed microbial supplementation on ruminal digestion,health,and performance of pre-and postpartum dairy cattle.Journal Dairy Science,2006,89(1):260-266.
[22] Beauchemin K A,Yang W Z,Morgavi D P,etal.Effects of bacterial direct fed microbials and yeast on site and extent of digestion,blood chemistry,and subclinical ruminal acidosis in feed lot cattle.Journal Animal Science,2003,81(6):1628-1640.
[23] Liu Z Y,Ma H F,Duan S,etal.Improving L-lactic acid yield ofEnterococcusfaecalisby ultraviolet mutation.Journal of Inner Mongolia Agricultural University,2013,34(6):5-8.刘占英,马慧芳,段申,等.紫外诱变提高一株粪肠球菌产L-乳酸的能力.内蒙古农业大学学报,2013,34(6):5-8.
[24] Nyonyo T,Shinkai T,Mitsumori M.Improved culturability of cellulolytic rumen bacteria and phylogenetic diversity of culturable cellulolytic and xylanolytic bacteria newly isolated from the bovine rumen.Fems Microbiology Ecology,2014,88(3):528-537.
[25] Robert C,Bernalier-Donadille A.The cellulolytic microflora of the human colon:evidence of microcrystalline cellulose-degrading bacteria in methane-excreting subjects.Fems Microbiology Ecology,2003,46(1):81-89.
[26] Maierhaba Aihemaiti,Fan Z,Li Y Z,etal.Isolation and identification of rumen bacteria for cellulolytic enzyme production.Acta Microbiologica Sinica,2013,53(5):470-478.买尔哈巴·艾合买提,樊振,李越中,等.瘤胃中纤维素分解菌的分离、鉴定及其酶活研究.微生物学报,2013,53(5):470-478.
[27] Feng H R,Long T,Cui W D,etal.The effect of using compound inoculant bacteria on ensilage of corn and alfalfa.Xinjiang Agricultural Sciences,2006,43(1):75-77.冯怀蓉,龙涛,崔卫东,等.利用青贮复合菌剂制作青贮饲料的效果测定.新疆农业科学,2006,43(1):75-77.
[28] Shi W.Studies on Screening of Cellulase High Produeing Baeteria and Applying to the Silage[D].Xi’an:Northwestern University,2008.石伟.高产纤维素酶菌株的筛选及其在青贮饲料中的应用研究[D].西安:西北大学,2008.
[29] Glyn R,Edward J,Robbert Q,etal.The copper active site of CBM33 polysaccharide oxygenases.Journal of the American Chemical Society,2013,135(16):6069-6077.
[30] Beeson W T,Phillips C M,Cate J H,etal.Oxidative cleavage of cellulose by fungal copper-dependent polysaccharide monooxygenases.Journal of the American Chemical Society,2012,134(2):890-892.
Isolation and identification of facultatively anaerobic cellulolytic bacterium in the rumen of Tibetan yaks (Bosgrunniens)
LI Jun-Feng1,YUAN Xian-Jun1,DONG Zhi-Hao1,Seare Tajebe Desta1,CHEN Lei1,BAI Xi1,BAI Yun-Feng2,SHAO Tao1*
1.InstituteofEnsilingandProcessingofGrass,NanjingAgriculturalUniversity,Nanjing210095,China;2.JiangsuAcademyofAgriculturalScience,Nanjing210014,China
This study aimed to isolate and identify facultatively anaerobic cellulolytic bacterium in the rumen of yaks and to provide a basis for studying new types of silage additives.Fresh ruminal fluid was collected from Tibetan yaks and highly cellulolytic facultatively anaerobic bacteria were screened out by using Congo red staining and liquid secondary screening culture media.Cellulolytic bacteria strains were identified based on their morphological,physiological and biochemical characteristics,as well as by 16S rRNA analysis.Time course profile of growth and enzyme production by strain JF85 was obtained.The degradation efficiency of rice straw was examined by evaluating cellulose,hemicellulose and lignin contents under a range of condition.Strain JF85 was identified asEnterococcusfaecalis.This strain grew well across a wide range of conditions:temperatures of 15-55 ℃,pH levels of 3.0-7.0 and NaCl levels of 3.0% and 6.5%.It exhibited the maximal endoglucanase activity (0.41 U/mL) and filter paper activity (0.13 U/mL) after 36 hours of incubation.In simulated fermentation,compared to the control,adding the JF85 strain significantly decreased the dry matter,cellulose and hemicellulose contents of rice straw after 14 days of inoculation (P<0.05).JF85-treated rice straw showed its highest water soluble carbohydrate content after 7 days of inoculation.However,there were no significant differences in lignin contents among all treatments.Applications of the JF85 strain,with its highly cellulolytic abilities and tolerance of acid and salt,have the potential to significantly improve the production of silage.
yak;ruminal fluid;cellulolytic bacteria;isolation;identification;rice straw
10.11686/cyxb2016315 http://cyxb.lzu.edu.cn
李君风,原现军,董志浩,Seare Tajebe Desta,陈雷,白晰,白云峰,邵涛.西藏地区牦牛瘤胃中兼性厌氧纤维素降解菌的分离鉴定.草业学报,2017,26(6):176-184.
LI Jun-Feng,YUAN Xian-Jun,DONG Zhi-Hao,Seare Tajebe Desta,CHEN Lei,BAI Xi,BAI Yun-Feng,SHAO Tao.Isolation and identification of facultatively anaerobic cellulolytic bacterium in the rumen of Tibetan yaks (Bosgrunniens).Acta Prataculturae Sinica,2017,26(6):176-184.
2016-08-19;改回日期:2016-10-09
江苏省自主创新项目“以秸秆饲料化、基料化利用为核心的技术方案”和江苏省自然基金青年基金项目“纤维素酶基因工程乳酸菌的构建及青贮表达效果研究”(BK20130694)资助。
李君风(1988-),女,甘肃临夏人,在读博士。E-mail:ljf126ff@126.com
*通信作者Corresponding author.E-mail:taoshaolan@163.com
