解淀粉芽孢杆菌复合菌剂对玉米秸秆的降解作用及表征
2017-06-19李红亚李文李术娜王树香李猛田苗苗朱宝成
李红亚,李文,李术娜,王树香,李猛,田苗苗,朱宝成
解淀粉芽孢杆菌复合菌剂对玉米秸秆的降解作用及表征
李红亚,李文,李术娜,王树香,李猛,田苗苗,朱宝成*
(河北农业大学生命科学学院,河北 保定 071000)
为获得能提高秸秆饲草品质的微生物发酵菌剂,本研究在前期获得2株具有木质素和纤维素降解能力的解淀粉芽孢杆菌菌株的基础上,将两者混配成复合菌剂,考察复合菌剂对玉米秸秆的降解作用,并通过傅立叶红外光谱(FTIR)、核磁共振氢谱(1H-NMR)、扫描电镜(SEM)及气质联用色谱(GC/MS)等技术对玉米秸秆的微观结构及降解产物进行表征。研究发现,复合菌剂可以有效降解玉米秸秆中的木质纤维素。在发酵24 d时,玉米秸秆中木质素、纤维素和半纤维素的降解率分别达到48.4%,30.5%和41.4%。FTIR和1H-NMR谱图中能观察到木质纤维素分子结构中主要连接共价键,如木质素单体间的β-O-4和β-β键、木质素与碳水化合物连接键以及碳水化合物中糖环内的价键等明显断裂,木质纤维素被部分降解;SEM扫描电镜图则显示发酵后秸秆的组织结构出现松散和破坏。发酵后秸秆中小分子物质的GC/MS分析结果显示,其中包含苯丙胺和苯丙酸等保留苯丙烷结构单元的木质素单体衍生物以及苄醇和苯甲酸酯类等木质素单体被进一步降解后的芳香族化合物。玉米秸秆中碳水化合物的GC/MS分析结果表明:复合菌剂可将玉米秸秆中的结构性多糖等大分子碳水化合物降解成葡萄糖、木糖、甘露糖及乳糖等还原性单糖。并利用这些还原性单糖生长代谢,进一步产生乙二醇、丙三醇及短链脂肪酸类等代谢产物。以上研究结果表明,解淀粉芽孢杆菌复合菌剂可有效降解玉米秸秆中的木质纤维素,在玉米秸秆饲草化利用中极具应用前景。
解淀粉芽孢杆菌;复合菌剂;玉米秸秆;降解;表征
农作物秸秆作为一种非常规的饲草资源,被广泛用于牲畜的饲喂。然而作物成熟收获籽实后,秸秆中动物生长所需的营养成分大量损失,此时秸秆的木质纤维化程度提高,可消化能降低[1]。因此,未经过处理的秸秆虽储存有光合作用一半以上的能量,但适口性差,营养价值和饲用价值低,严重限制了其在家畜养殖中的应用[2]。如何开发利用这一产量巨大的非竞争性的饲料资源,成为了畜牧、生态和农业等众多领域内急需解决的重大课题。
在众多的秸秆饲草化利用技术中[3-4],微生物发酵技术因其能耗低,对环境友好等优点及在木质纤维素的降解、菌体蛋白的富集以及有益代谢物的积累等方面的突出作用,近年来受到国内外科学工作者的广泛关注[5-7]。已有研究表明[8-9],通过微生物发酵可以不同程度地降低秸秆中木质纤维素含量、改善适口性,提高消化率,将其转化为家畜能够利用的饲料资源,是秸秆饲草化利用的有效途径。在已报道的发酵秸秆的功能菌株中以真菌和细菌最为常见,尤以对木质纤维素表现出强降解作用的真菌研究最多。其中能将木质素降解成CO2和H2O的白腐菌、褐腐菌、软腐菌以及能产生胞外纤维素酶的毛壳菌属(Chaetomium)、木霉菌属(Trichoderma)、青霉菌属(Penicillium)、漆斑菌属(Myrothecium)和根霉菌属(Rhizopus)等菌株均具代表性[10]。目前对真菌降解木质纤维素的报道很多,在降解酶系及合成调控[11-13]、降解酶基因工程[14-15]以及降解机理[16-17]等方面的研究较为深入。但真菌发酵秸秆的研究多停留在实验室阶段,在实际应用中还存在一些问题:真菌生长势弱、对环境敏感、不耐高温、在实际应用中难以保证活性等问题,限制了真菌在秸秆饲草化中的规模化应用[18]。相比之下,细菌对木质纤维素的降解能力虽然普遍弱于真菌,但细菌生物活性广泛,适应性强,在木质纤维素降解中有很强的实用性[19]。考虑到芽孢杆菌的抗逆性强、易于工业化生产等优点,本课题组近年来一直致力于发掘可高效降解木质纤维素的芽孢杆菌资源[20-21],以期获得可直接用于秸秆资源化利用的工业化菌株。本研究在前期获得了2株可降解木质纤维素的解淀粉芽孢杆菌(Bacillusamyloliquefaciens)MN-8和MN-13的菌株(NCBI登录号分别为KF312439和KP292553),在通过共存性实验发现两者不产生拮抗作用的基础上,拟进一步研究由2菌株组成的复合菌剂对玉米秸秆的降解作用,并通过傅立叶红外光谱(FTIR)、核磁共振氢谱(1H-NMR)、扫描电镜(SEM)以及气质联用(GC/MS)等技术对其作用下玉米秸秆的微观结构及降解产物进行表征。旨在明确复合菌剂对玉米秸秆木质纤维素的降解作用,为其在秸秆饲料化利用中的应用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源 解淀粉芽孢杆菌(Bacillusamyloliquefaciens)MN-8和MN-13:均由河北农业大学生命科学学院制药工程系筛选并保存。复合菌剂(芽孢粉剂,总生物量为1.0×109芽孢/g,菌株MN-8和MN-13比例为1∶1)由河北农业大学农牧微生物科技创新平台生产。
1.1.2 玉米秸秆材料 干玉米秸秆取自河北农业大学教学试验场第二分厂,品种为郑单958。采集时间为2014年10月,玉米收获籽实后田间留置1个月后收集,粉碎至1~2 mm左右,经苯醇溶液抽提脱脂后,干燥备用。
1.1.3 培养基 无机盐培养基:(NH4)2SO42.0 g,KH2PO42.0 g,MgSO40.3 g,CaCl20.3 g,NaCl 0.5 g,FeSO40.005 g,MnSO40.016 g,ZnCl20.017 g,CoCl20.002 g,蒸馏水1000 mL。
秸秆粉-无机盐培养基:秸秆粉与无机盐培养基分别灭菌后,以1.0∶1.5的质量比混合。
1.2 方法
1.2.1 秸秆发酵 称取秸秆粉30.0 g,置于250 mL三角瓶中,121 ℃灭菌30 min,备用。在无菌操作台中,精确称取复合菌剂3.0 g,置于45 mL灭菌的无机盐培养基中,充分振荡。将制得的菌悬液加入到装有秸秆粉的灭菌三角瓶中,充分混匀后置于恒温培养箱,37 ℃静置培养24 d。设置不接菌试验组为对照,每组3个重复。发酵过程中固定时间间隔振荡。培养结束后,发酵秸秆粉置于60 ℃干燥箱内烘干至恒重,待检测。试验时间为2014年11月至2015年4月。
1.2.2 木质纤维素含量及降解率的测定 取干燥后的发酵玉米秸秆粉3.0 g,置于烧杯中,用适量的蒸馏水充分浸取。抽滤,反复洗涤烧杯及滤纸上的秸秆3次,合并滤液。将滤液转移入50 mL容量瓶中,蒸馏水定容。木质素、纤维素和半纤维素含量测定参考王玉万等[22]的系统分析程序,具体操作步骤见文献[21]。
1.2.3 发酵前后玉米秸秆的红外光谱(FTIR)特征 将干燥后的发酵玉米秸秆粉加入KBr做稀释剂,在玛瑙研钵里研磨至颗粒小而均匀,压片成型。采用Nicolet iS10傅里叶变换红外光谱仪(美国)测定其红外吸收光谱。
1.2.4 核磁共振氢谱(1H-NMR)的测定 取干燥后的发酵玉米秸秆粉10.0 g,用200 mL氯仿分3次浸提。玉米秸秆粉经氯仿浸提后,用300 mL蒸馏水洗涤3次后,置于80 ℃烘箱内干燥。干燥后的秸秆粉用100 mL DMSO浸提、过滤,得DMSO提取液。向DMSO提取液中加入500 mL蒸馏水,7500 r/min离心得沉淀。沉淀经干燥后溶解于20 mL二氯乙烷和乙醇(2∶1,V∶V)混合液中。7500 r/min离心,取上清液。往上清液中滴加乙醚,有絮状沉淀产生,再离心,得沉淀,干燥后以DMSO-D6为溶剂,瑞士Bruker-AVANCE 400核磁共振仪(300 MHz,TMS为内标)测其氢谱。
1.2.5 扫描电镜(SEM)的表征 1)将适量的秸秆粉放在称量纸上均匀铺开,用带导电胶样品台粘粉,稍稍压紧,多余的轻叩掉,并用洗耳球吹掉,用棉签擦拭样品台,去除未黏住的粉末。2)镀膜:将样品台放进HITACHI E-1010型离子溅射镀膜仪再镀一层15 nm厚的金膜。3)将镀膜后的样品放入样品室中待测[23]。4)电镜观察:日本HITACHI S-3400N扫描电子显微镜,加速电压15.00 kV,工作距离11.0~16.7 mm。
1.2.6 木质素降解产物的气相色谱—质谱(GC/MS)(NIST05.L数据库)分析 取新鲜的发酵秸秆粉分别用氯仿、乙酸乙酯和正丁醇(对照组直接用正丁醇)进行回流提取,提取液用无水硫酸钠干燥、旋转蒸发仪浓缩至2.0 mL,经0.45 μm滤膜过滤后,气质联用色谱进行分析。气-质色谱条件见文献[24]。
1.2.7 发酵秸秆中碳水化合物的GC/MS(NIST05.L数据库)分析 取新鲜的发酵秸秆粉5.0 g,用适量蒸馏水分3次浸提,合并浸提液,旋转蒸发浓缩至近干。将浓缩后的提取液转移至反应瓶中,加入盐酸羟胺100.0 mg和吡啶5.0 mL,90 ℃水浴中振荡加热30 min,冷却至室温,加入醋酸酐5.0 mL,85 ℃继续加热30 min。将反应产物浓缩至干,加入5.0 mL氯仿溶解。溶液经0.45 μm滤膜过滤后,采用气质联用色谱进行分析,色谱条件见文献[24]。
1.3 数据统计分析
试验数据采用SPSS 18.0软件进行单因素方差统计分析(One way ANOA),试验结果以平均值±标准差表示。
2 结果与分析
2.1 菌剂发酵秸秆中木质纤维素的含量变化
从图1中可以看出,经过复合菌剂的降解作用,玉米秸秆中的木质纤维素均有一定程度的降解。发酵24 d时,纤维素、半纤维素和木质素分别由最初的47.2%,26.6%和12.6%下降到32.8%,15.6%和6.5%,降解率分别达30.5%,41.4%和48.4%。从降解趋势来看在发酵10~16 d期间,木质纤维素的降解最为显著,16 d后,纤维素和木质素的降解不再明显。
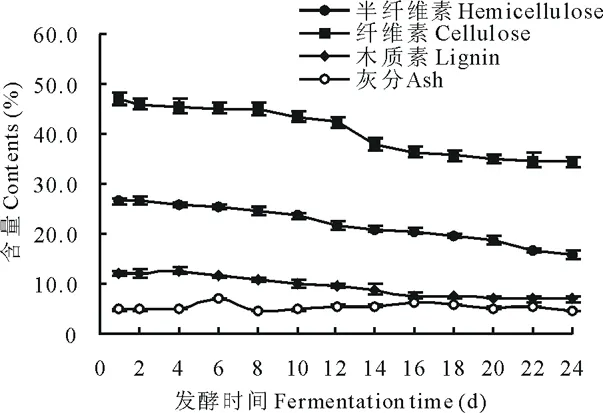
图1 发酵过程中秸秆木质纤维素的含量变化Fig.1 Change of lignocellulose content in the process of fermentation
2.2 菌剂发酵秸秆的FTIR表征
接菌试验组和未接菌对照组秸秆粉的FTIR光谱如图2所示。从图2中可以看出试验组与对照组秸秆在官能团区4000~1500 cm-1吸收峰的峰型基本相似,仅有强度差别。其中3380~3340 cm-1处的吸收峰为羟基伸缩振动峰,主要包括秸秆中碳水化合物糖基上的羟基和秸秆样品中水分子的羟基。2930~2920 cm-1处为多糖类、木质素和脂肪族化合物中的甲基和亚甲基吸收峰;1735~1725 cm-1处的吸收峰为木聚糖中非共轭C=O伸缩振动。1660~1650 cm-1则认为是木质素中与芳香环产生共轭的C=O伸缩振动的特征吸收谱带;1520~1500 cm-1的吸收峰是芳环骨架振动,来源有木质素和其他含苯环的化合物;1430~1420 cm-1处的吸收峰为木质素和脂肪族化合物中的双键或羰基相连的-CH2的变形振动;1385~1370 cm-1处的吸收归属于-CH3和-CH2的伸缩振动;1247 cm-1附近吸收峰代表着连接木质素苯丙烷单体间的醚键C-O-C的反对称振动峰以及有机硅化合物中Si-C的伸缩振动峰;在1175~1050 cm-1处的强吸收峰则表明秸秆中纤维素和半纤维素的C-O-C键的存在,他们适合在总体上表示中性多糖的存在[25]。900~890 cm-1代表了碳水化合物中C-C的伸缩振动峰及芳环上C-H面外弯曲振动。其中在898~895 cm-1的峰带则为半纤维素中糖环振动产生的C-H变形峰,对于β-键尤为特征[26]。
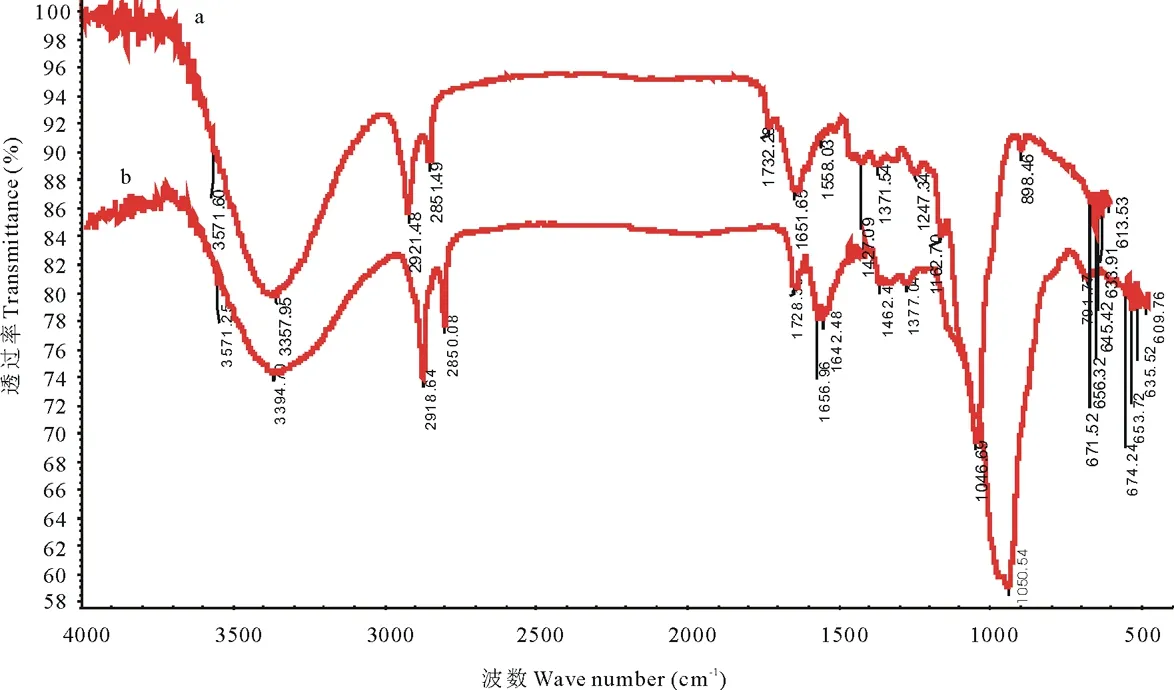
图2 对照组和试验组玉米秸秆的FTIR谱图Fig.2 FTIR spectrum of corn straw in the control and test groupsa:对照组Control;b:试验组Test group.
与对照组秸秆粉的FTIR谱图相比,试验组中3357 cm-1处的羟基吸收峰、2921 cm-1处甲基和亚甲基吸收峰、1728和1656 cm-1处羰基的振动峰以及1430~1420 cm-1处的吸收峰强度均有所降低,说明秸秆中的木质纤维素被解聚。再者,试验组中1520~1500 cm-1的吸收峰强度也明显弱于对照组,证明木质素除被解聚之外,还发生了部分苯环降解;1247 cm-1吸收峰的减弱,则表明木质素单体间醚键的断裂及有机硅化物的分解转化。此外,对照组中1162和1050 cm-1处的振动峰强度明显减弱,表明秸秆中纤维素和半纤维素被部分降解;895 cm-1处的吸收峰强度弱至不易辨识,说明半纤维素除了被降解外,还可能被发酵菌剂中的功能菌株利用,发生了糖环开裂。
2.3 秸秆发酵前后的1H-NMR的变化
秸秆粉样品经苯醇溶液、CHCl3和H2O充分浸提后,可将小极性的有机物及可溶性糖类物质去除。再利用DMSO将其中的木质素或木质素-碳水化合物复合体提取和纯化出来,通过1H-NMR对其进行检测分析,结果如图3和图4所示。通过谱图中不同类型氢质子的分布和数目的变化,可反映出木质素的降解情况。
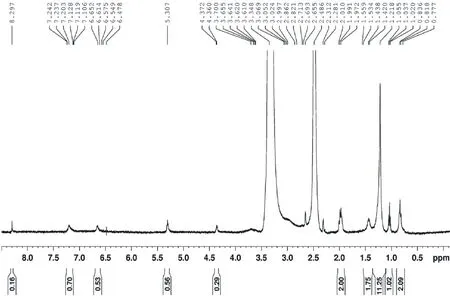
图3 发酵后玉米秸秆DMSO提取液的1H-NMR谱图Fig.3 1H-NMR spectrum of DMSO extraction of corn straw inoculated with complex microbial inoculants
采用区域积分的方法[27],对样品的1H-NMR谱图进行解析。谱图中不同类型氢质子的归属情况见表1。
化学位移位于6.5~8.5 ppm 处为木质素基本结构单元中的芳氢质子信号峰。其中未接菌对照组中6.66、6.79和7.26 ppm处的质子信号分别为紫丁香基、愈创木基和对羟基苯基上的芳氢质子。从峰面积上看,玉米秸秆木质素的基本结构单元中对羟基苯基所占的比例大于紫丁香基和愈创木基。试验组在6.48~6.65 ppm和7.10~7.24 ppm有两处信号峰,而6.79 ppm处的愈创木基信号峰则没有出现,极有可能是因为复合菌剂的降解作用使得木质素愈创木基中苯环开环所导致。此外,在试验组中此范围内芳氢质子的峰面积明显大于对照组,分析这一现象的原因,可能是由于木质素中苯丙烷结构单元间的连接键及木质素与碳水化合物之间的连接键经复合菌剂发酵处理时断裂造成的。
化学位移位于5.0~5.5 ppm处的信号峰代表了苄基芳基醚中的Hα和聚糖分子中H1~3等氢质子。从图3,4和表1中可以看出,发酵后的信号峰面积较发酵前增加了一倍多。而聚糖分子中C1~C3上的氢质子数目在糖链断裂时一般不受影响。因此可认为经复合菌剂发酵后,木质素结构中的苄基部位的连接键断裂而引起。化学位移位于4.0~4.5 ppm处的信号峰代表了β-β结构中的Hα,β-O-4结构中的Hβ、β-1、β-5、β-O-4和β-β结构中的Hγ,肉桂醇单元中的Hγ;连在苯环或酯基上的-OCH3-H。与发酵前的氢谱相比,发酵后秸秆谱图中此化学位移峰面积增加了4倍之多。由此可以认为经复合菌剂发酵后,与此相关的连接键断裂导致氢信号增强所致。化学位移处于2.5 ppm和3.0~3.5 ppm范围内的氢质子信号分别为溶剂DMSO和水的信号峰。化学位移在0.5~2.1 ppm处的信号峰为糖链、苯丙侧链或苯基上取代的甲基或亚甲基中氢质子信号。此类氢质子数目庞大,其与秸秆结构间的变化的对应情况需进一步分析确证。
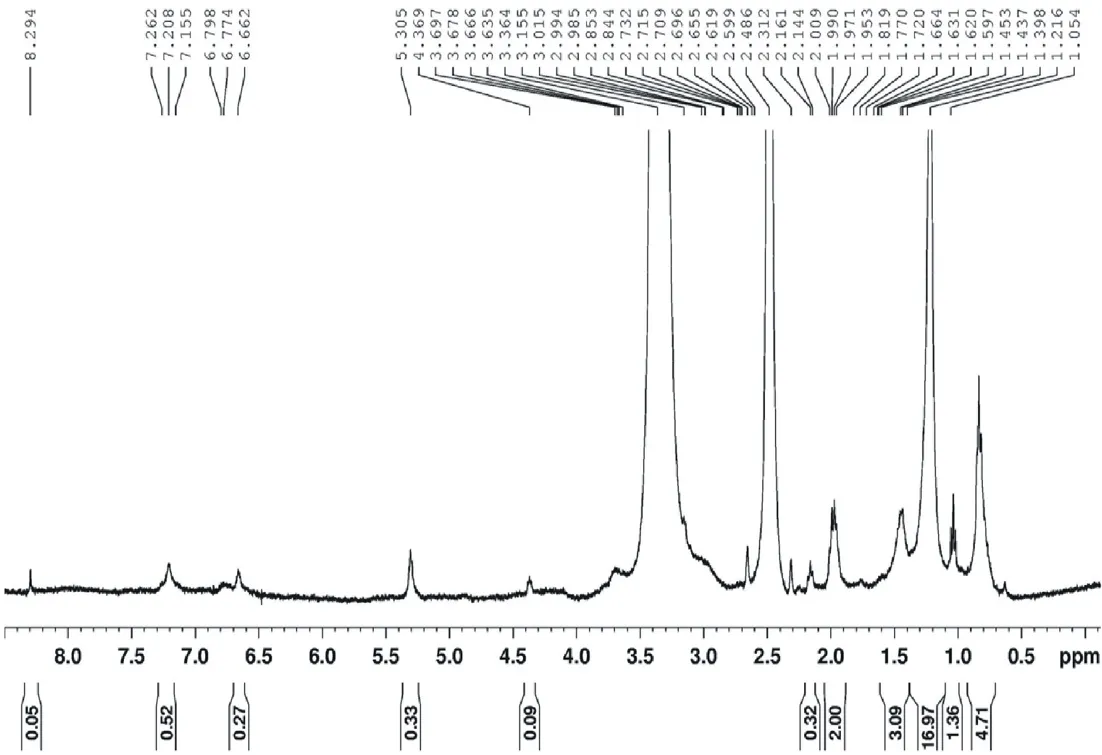
图4 发酵前玉米秸秆的1H-NMR谱图Fig.4 1H-NMR spectrum of corn straw uninoculated with complex microbial inoculants
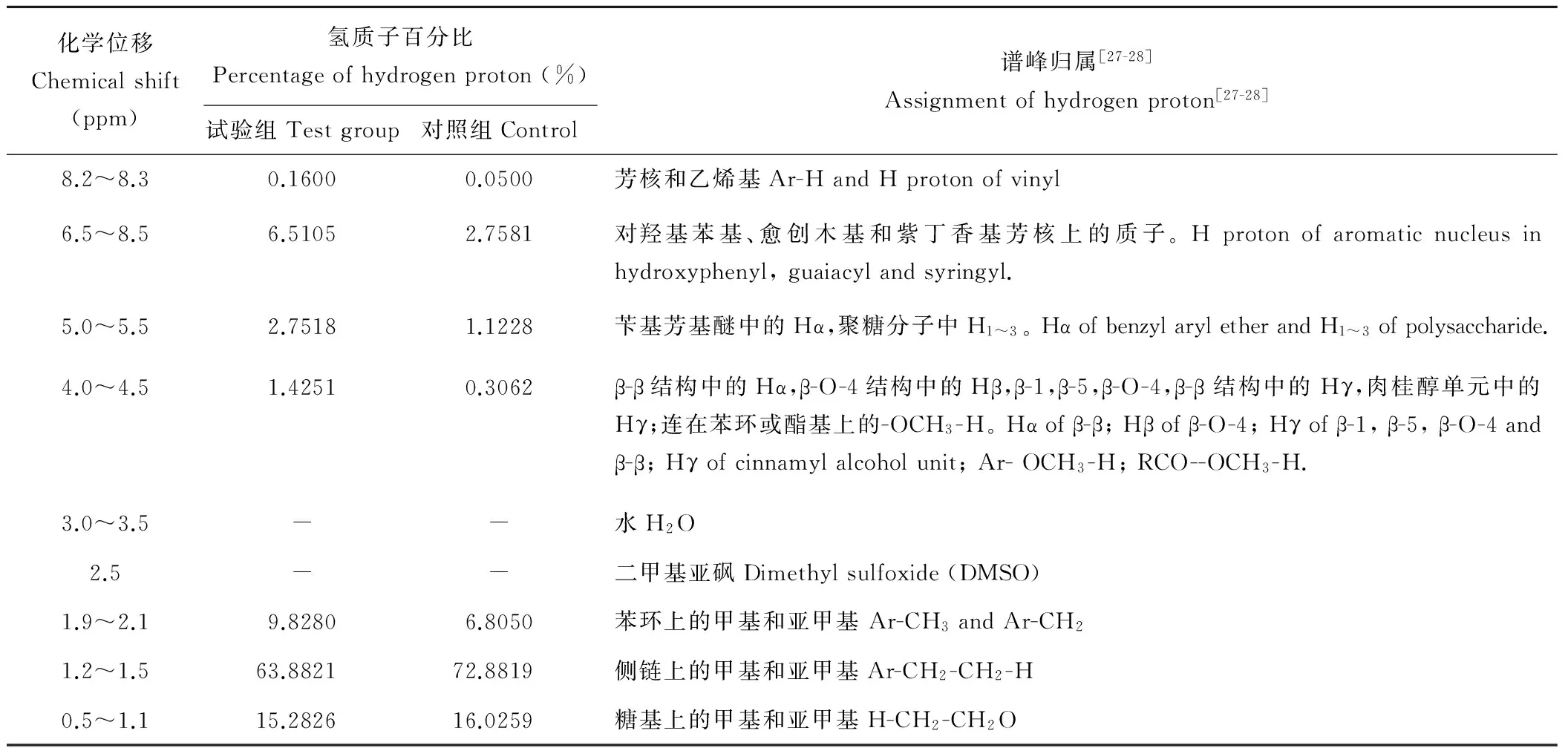
表1 玉米秸秆降解产物的1H-NMR波谱归属Table 1 Assignment of 1H-NMR spectrum of compounds from degradation of corn straw
2.4 玉米秸秆的扫描电镜观察
利用扫描电子显微镜对对照组和接种复合菌剂试验组的玉米秸秆粉进行了观察,结果见图5和图6。从图5未接菌对照组玉米秸秆的微观结构中可以清晰地看出,秸秆茎外层的表皮细胞中的气孔器及表皮附属物等排列规律,外表皮最外层存在一层类似瘤状物的蜡质-硅化层,表皮毛状体完整镶嵌在硅质之间,而维管束则整齐排列。以上特征说明未接菌对照组中秸秆的表皮组织、机械组织和维管束等未见明显破坏,仍保留着完整的组织结构。而在图6中则可明显看到,经复合菌剂发酵后玉米秸秆的表皮组织大部分被破坏,仅残留部分完整的长细胞。螺纹导管也已松散,并从组织中剥离。表皮毛亦明显脱落。而最后两张电镜图则可明显看到玉米秸秆的基本组织已经完全被破坏。
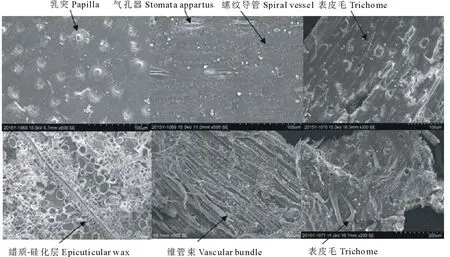
图5 对照组玉米秸秆粉的微观结构电镜图Fig.5 Photograph of SEM of straw powder in control groupbar=100 μm
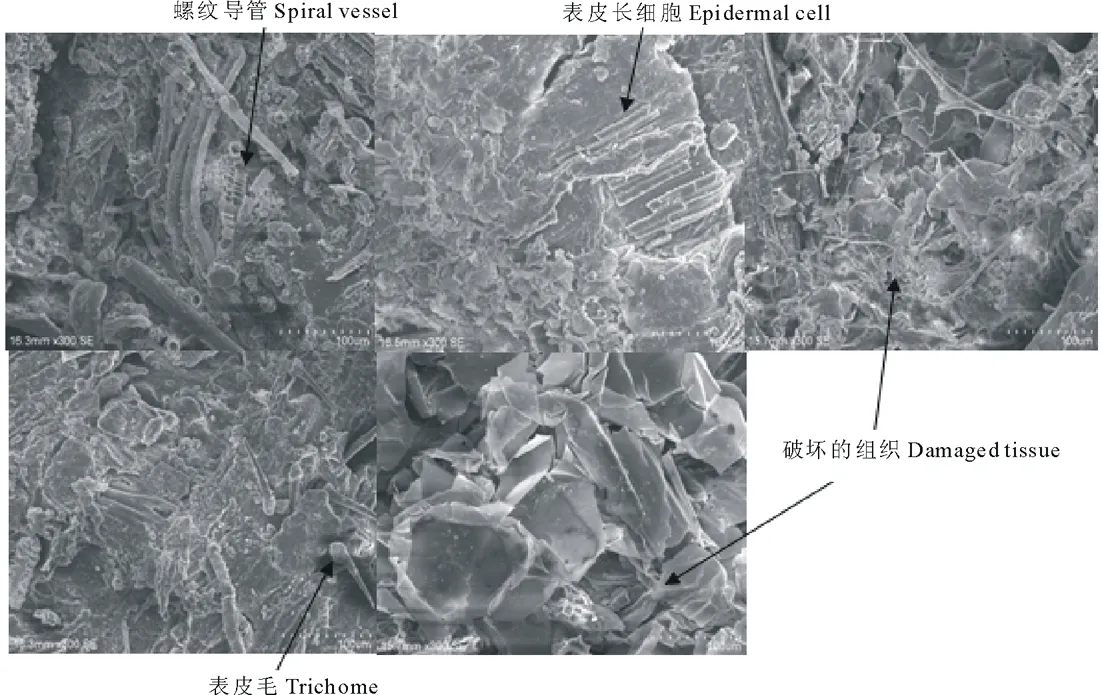
图6 接菌组发酵后秸秆粉的微观结构电镜图Fig.6 Photograph of SEM of straw powder in test groupbar=100 μm
2.5 木质纤维素降解产物分析
2.5.1 发酵秸秆中木质素降解产物GC/MS分析结果 秸秆中的木质素在微生物作用下会发生降解,形成芳香族类化合物。GC/MS联用技术是目前用来检测木质素降解产物最为常用的一种手段。复合菌剂降解秸秆木质素的产物的GC/MS分析结果如图7和表2所示。
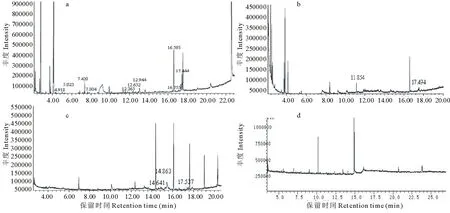
图7 不同有机溶剂提取液及对照组正丁醇提取液的TIC图Fig.7 TIC of compounds extracted with different solvent from fermented straw and compounds extracted with n-butanol from controla:氯仿提取物 Chloroform extract;b:乙酸乙酯提取物Ethyl acetate extract;c:正丁醇提取物n-butanol extract;d:对照组正丁醇提取物n-butanol extract in control group
从图7中可以看出,试验组中不同极性的有机溶剂提取液中低沸点组分较对照组明显增多,这说明接种复合菌剂后,秸秆中的某些大分子化合物被降解成了小分子的低沸点物质。不同溶剂提取液中各组分的MS分析结果如表2所示。由表2中可以看出,接种复合菌剂的试验组中出现了苯丙胺类(氯仿提取液中RT为4.918、7.420、12.365、12.652、12.944、16.755;乙酸乙酯提取液中RT为17.494;正丁醇提取液中14.641、14.863、17.537)、苄醇类(氯仿提取液中RT为5.023;乙酸乙酯提取液中RT为11.854)、苯丙酸类(氯仿提取液中RT为7.804)以及邻苯二甲酸酯类(氯仿提取液中RT为16.595、17.444、17.537、22.572;正丁醇提取液中RT为22.609)等芳香族类化合物,此类化合物在对照组提取液中均未出现,因此可以认为是复合菌剂降解秸秆木质素的产物。在这些化合物中,苯丙胺类及苯丙酸类为保留苯丙烷结构的木质素单体衍生物,而苄醇和苯甲酸酯类则认为是单体衍生物的进一步降解产物。以上化合物中的苯丙胺[(S)-2-Butanamine]、苄醇[benzenemethanol,α-(1-aminoethyl)-2,5-dimethoxy-]和苯丙酸(benzenepropanoic acid,α-(1-aminoethyl)-,[R-(R*,R*)]-)以及苯甲酸酯类等化合物已在解淀粉芽孢杆菌MN-8菌株的木质素降解产物中进行过报道[24],说明在复合菌剂发酵秸秆过程中,MN-8和MN-13两株菌共同发挥着对木质素的降解作用。


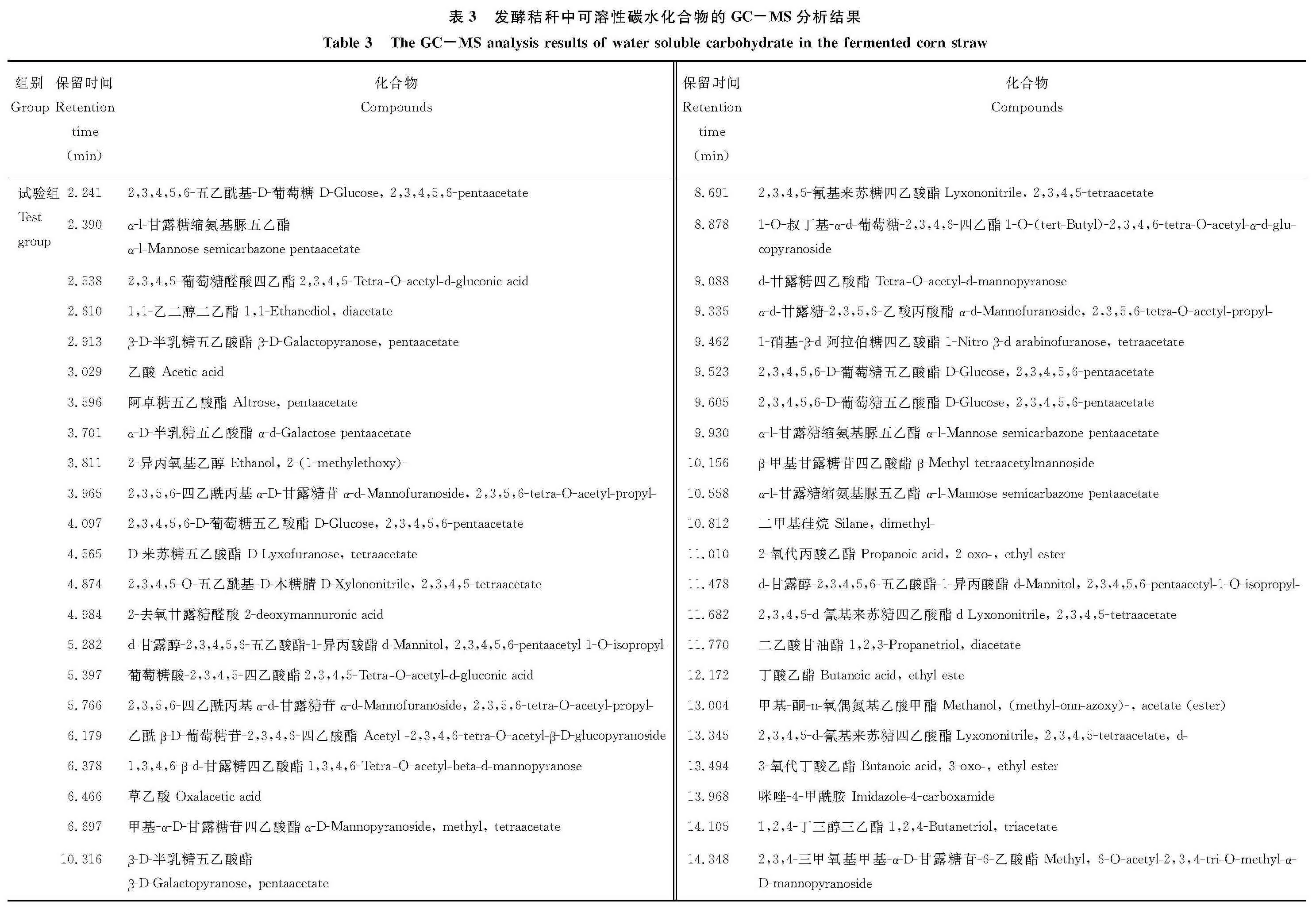
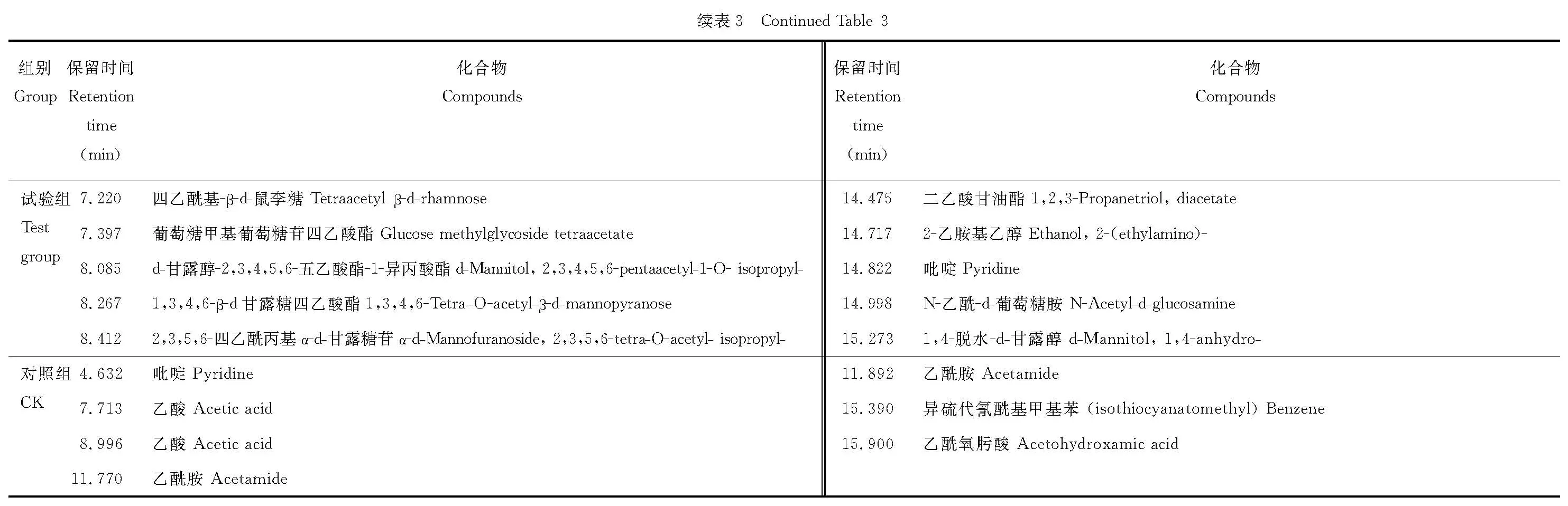
2.5.2 发酵秸秆中可溶性碳水化合物的GC/MS分析 采用糖腈乙酰化对碳水化合物降解产物进行了衍生化处理,处理后样品的氯仿提取液利用GC/MS进行检测。对照组和试验组样品中各组分的TIC和定性分析结果如图8和表3所示。
从图8和表3可以看出,经复合菌剂发酵后的秸秆水提液的糖腈乙酰化产物中,除了包含有葡萄糖、木糖、半乳糖、甘露糖、来苏糖、葡糖糖醛酸和阿洛糖的衍生物之外,还有乙二醇、甘露醇、丙三醇以及短链脂肪酸类物质。其中葡萄糖被认为是纤维素降解产物,木糖、甘露糖及半乳糖等则被认为是杂多糖半纤维素等大分子碳水化合物的降解产物。而乙二醇、丙三醇及短链脂肪酸类物质则可以看作是复合菌剂中利用纤维素和半纤维素降解产物的进一步代谢产物。
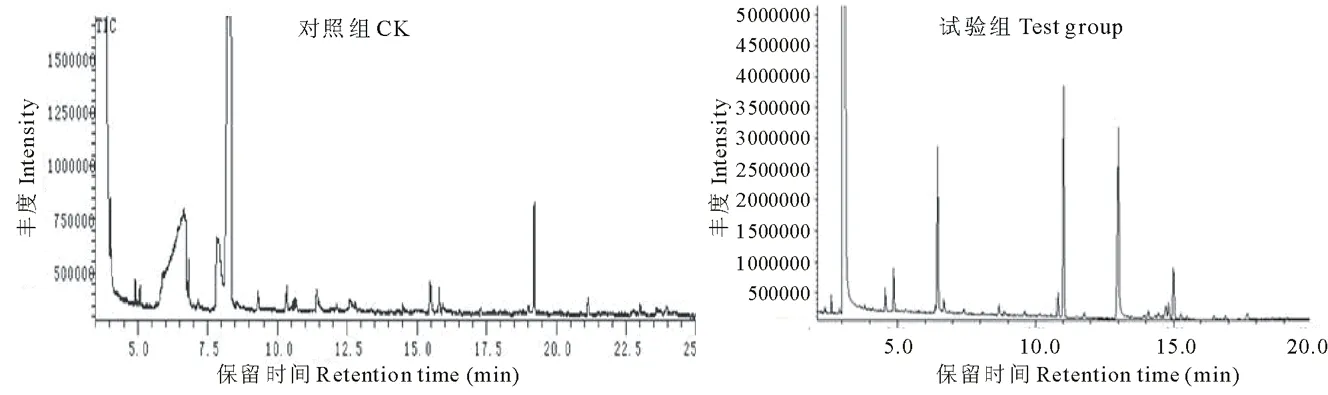
图8 发酵秸秆中可溶性碳水化合物的气-质联用色谱离子流图Fig.8 The TIC of water soluble carbohydrate in the fermented corn straw
3 讨论
获得可高效降解秸秆木质纤维素的微生物菌剂是开发微生物发酵秸秆饲草化技术中的一关键环节。为考察由课题组前期获得的2株木质纤维素降解菌——解淀粉芽孢杆菌MN-8和MN-13混配后组成的复合菌剂对秸秆的降解效果,本研究通过检测经复合菌剂发酵24 d后玉米秸秆中的木质纤维素含量,发现该复合菌剂对秸秆木质纤维素表现出较强的降解作用。经复合菌剂发酵24 d后,秸秆中的木质素、纤维素和半纤维素的降解率分别为48.4%、30.5%和41.4%,优于课题组之前研究中采用解淀粉芽孢杆菌MN-8单菌株发酵时的效果[22]。这说明两菌株之间具有较强的协同作用,复合发酵时有利于秸秆中木质纤维素的降解。
在接菌试验组秸秆的FTIR谱图中,表征木质素中芳环骨架振动、连接木质素苯丙烷单体间的醚键C-O-C的反对称振动及碳水化合物中C-C的伸缩振动等木质纤维素特征吸收峰强度均低于未接菌对照组,证明了以上共价键被部分断裂,木质纤维素被破坏。1H-NMR谱图中也呈现出因接种复合菌剂,秸秆木质素及木质纤维素中的共价键也有断裂,相应的氢质子增加,即木质纤维素被降解的特征。同样,在秸秆微观结构的SEM表征结果亦能清楚地看出,经复合菌剂发酵后的玉米秸秆中表皮毛明显脱落,螺纹导管松散并从组织中剥离,仅残留部分完整的长细胞以及基本组织已被破坏的特征。在GC/MS对木质纤维素降解产物分析结果中,可以看出复合菌剂可以将秸秆中的木质素降解成两类芳香族类化合物:一为苯丙胺和苯丙酸类等保留苯丙烷结构的化合物;二是苄醇和苯甲酸酯类等芳香族化合物。我们认为苯丙胺和苯丙酸类化合物是木质素解聚后的单体衍生物,而苄醇和苯甲酸酯类等化合物则为木质素单体被进一步降解后的产物。以上部分化合物及其降解途径也已在解淀粉芽孢杆菌MN-8菌株的木质素降解产物中进行过报道[29],说明在复合菌剂发酵秸秆过程中,MN-8和MN-13两株菌共同发挥着对木质素的降解作用。在可溶性糖的糖腈乙酰化衍生物的GC/MS检测结果中除发现有多种单糖乙酰化衍生物外,还有醇及短链脂肪酸等物质,说明复合菌剂可以将秸秆中纤维素和半纤维素等结构性碳水化合物降解成葡萄糖、木糖、甘露糖及乳糖等还原性单糖。在此基础上还可利用这些还原性单糖生长代谢,进一步产生乙二醇、丙三醇及短链脂肪酸类等代谢产物。以上GC/MS分析结果与FTIR、1H-NMR和SEM表征结构基本一致。
4 结论
解淀粉芽孢杆菌复合菌剂可有效地将秸秆中的木质素解聚成小分子芳香类化合物,并将结构性碳水化合物降解成可溶性糖类,从而有效提高了秸秆饲草的消化率。加之其功能菌株均为抗逆性强,易于工业化生产的芽孢杆菌,在秸秆饲草化利用中极具应用价值。
References:
[1] Feng Y L,Zhang Z Y.The nutritive value of low-quality roughage and its rational use.Chinese Journal of Animal Science,2001,37(6):3-5.冯仰廉,张子仪.低质粗饲料的营养价值及合理利用.中国畜牧杂志,2001,37(6):3-5.
[2] Hu S F,Gao B D,Chen J.Research progress of micro-organism degradation crop straw for producing single cell protein feed.China Animal Husbandry &Veterinary Medicine,2008,35(4):8-12.胡仕凤,高必达,陈捷.利用微生物技术生产秸秆蛋白质饲料的研究进展.中国畜牧兽医,2008,35(4):8-12.
[3] Alvira P,Tomás-Pejó E,Ballesteros M,etal.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis.Bioresource Technology,2010,(101):4851-4861.
[4] Yan G L.Botanical Factors Affecting the Nutritional Value of Crop Residues and the Effectiveness of Their Treatment with Chemical Combinations[D].Beijing:China Agricultural University,2005: 10-17.闫贵龙.影响秸秆营养价值的作物学因素及复合化学处理的效果研究[D].北京:中国农业大学,2005:10-17.
[5] Wang L X,Zhang H X,Li H Q,etal.Study on improving roughage availability by multi-culture dual fermentation.Feed Research,2005,(5):30-32.王立新,张红肖,李华启,等.多菌种双重发酵粗饲料提高其利用率的研究.饲料研究,2005,(5):30-32.
[6] Li R Q.Study on the solid-state fermentation of waste straw to produce feeding-protein by using some fungal strains.Acta Ecologica Sinica,2001,21(9):1512-1518.李日强.不同菌株固态发酵玉米秸秆生产饲料蛋白的比较研究.生态学报,2001,21(9):1512-1518.
[7] Pan F,Shi X L,Yang S L,etal.Studies on the production of protein feed from straw through co-fermentation by multi-strains.Cereal &Feed Industry,2001,(8):25-26.潘锋,史小丽,杨树林,等.多菌种混合发酵稻草生产蛋白饲料的研究.粮食与饲料工业,2001,(8):25-26.
[8] Wang R F.Effects of living dry bacteria treated straw on finishing cattle.Pratacultural Science,2001,18(2):36-38.王汝富.发酵活干菌处理秸秆育肥肉牛效果研究.草业科学,2001,18(2):36-38.
[9] Zadrazil F,Karma N D,Isikhuemhen O S,etal.Bioconversion of lignocellulose into ruminal feed with white-rot fungi.Journal of Applied Animal Research,1996,(10):105-124.
[10] Liu G L,Yang Z,Wang N,etal.Research advances in microbial bioconversion of straw feed.Guangdong Agricultural Sciences,2014,41(1):110-114.刘国丽,杨镇,王娜,等.微生物转化秸秆饲料研究进展.广东农业科学,2014,41(1):110-114.
[11] Karp S G,Faraco V,Amore A,etal.Characterization of laccase isoforms produced byPleurotusostreatusin solid state fermentation of sugarcane bagasse.Bioresource Technology,2012,(114):735-739.
[12] Mikiashvili N,Wasser S P,Nevo E,etal.Effects of carbon and nitrogen sources onPleurotusostreatusligninolytic enzyme activity.World Journal of Microbiology Biotechnology,2006,(22):999-1002.
[13] Tien M,Kirk T K.Lignin-degrading enzyme from the HymenomycetePhanerochaetechrysosporiumBurds.Science,1983,(221):661-663.
[14] Dashtban M,Schraft H,Syed T A,etal.Fungal biodegradation and enzymatic modification of lignin.International Journal of Biochemistry and Molecular Biology,2010,(1):36-50.
[15] Chen F R,Zhu Y X,Dong X Z,etal.Progresses in the research in lignocellulose degrading bacteria and their genes encoding cellulase/hemicellulase in rumen-a review.Acta Microbiologica Sinica,2010,50(8):981-987.陈福荣,朱雅欣,东秀珠,等.瘤胃中木质纤维素降解菌及降解酶基因的研究进展.微生物学报,2010,50(8):981-987.
[16] Arora D S,Chander M,Gill P K.Involvement of lignin peroxidase,manganese peroxidase and laccase in degradation and selective ligninolysis of wheat straw.International Biodeterioration and Biodegradation,2002,(50):115-120.
[17] Schilling J S,Ai J,Blanchette R A,etal.Lignocellulose modifications by brown rot fungi and their effects as pretreatments on cellulolysis.Bioresource Technology,2012,(116):147-154.
[18] Yan X P,Li J.Study and application of white rot fungi in stalk composting.Feed Industry,2008,29(14):54-57.闫鑫鹏,李杰.白腐真菌在农作物秸秆中的研究与应用.饲料工业,2008,29(14):54-57.
[19] Raj A,Krishna Reddy M M,Chandra R.Identification of low molecular weight aromatic compounds by gas chromatography-mass spectrometry (GC-MS) from kraft lignin degradation by threeBacillussp.International Biodeterioration &Biodegradation,2007,(59):292-296.
[20] Zhang L J,Li S N,Zhu B C.Screening,identification and degradation conditions of cellulose decomposing bacteriaBacilluspumilusT-7.Chinese Agricultural Science Bulletin,2011,27(7):112-118.张立静,李术娜,朱宝成.高效纤维素降解菌短小芽孢杆菌(Bacilluspumilus)T-7的筛选、鉴定及降解能力的研究.中国农学通报,2011,27(7):112-118.
[21] Li H Y,Li S N,Wang S X,etal.Screening,identification of lignin-degradatingBacillusMN-8 and its characteristics in degradation of maize straw lignin.Scientia Agricultura Sinica,2014,47(2):324-333.李红亚,李术娜,王树香,等.产芽孢木质素降解菌MN-8的筛选及其对木质素的降解.中国农业科学,2014,47(2):324-333.
[22] Wang Y W,Xu W Y.Quantitative analysis of hemicellulose,cellulose and lignin in the solid substrate fermentation of lignocellulose.Microbiology China,1987,4(2):81-84.王玉万,徐文玉.木质纤维素固体基质发酵物中半纤维素﹑纤维素和木质素的定量分析程序.微生物学通报,1987,4(2):81-84.
[23] Xie J Y,Dong G J,Liu Z Y.Method of preparation of microbiological specimen for scanning electron microsope.Journal of Chinese Electron Microscopy Scoiety,2005,24(4):440-441.谢家仪,董光军,刘振英.扫描电镜的微生物样品制备方法.电子显微学报,2005,24(4):440-441.
[24] Li H Y,Li S N,Wang S X,etal.Degradation of lignocellulose in the corn straw byBacillusamyloliquefaciensMN-8.Chinese Journal of Applied Cology,2015,26(5):1404-1410.李红亚,李术娜,王树香,等.解淀粉芽孢杆菌MN-8对玉米秸秆木质纤维素的降解.应用生态学报,2015,26(5):1404-1410.
[25] Cao Y,Lu Y L,Huang Y.NIR FT-raman study of biomassTriticumaestivumtreated with cellulase.Journal of Molecular Structure,2004,(693):87-93.
[26] Michell A J.Second-derivative FT-IR spectra of native cellulose.Carbohydrate Reseatch,1990,(197):53-60.
[27] Guo F H.Mechanism Studies on the Wheat Straw Lignin Acidolyzed with Formic Acid[D].Beijing:Beijing Forestry University,2006:33-35.郭奉华.麦草木素的甲酸分解机理研究[D].北京:北京林业大学,2006:33-35.
[28] Shen Y N.Decomposition Mechanism in Formic Acid of Wheat Straw Lignin-carbohydrate Complex[D].Beijing:Beijing Forestry University,2008:28-38.沈艳尼.麦草LCC的甲酸分解机理研究[D].北京:北京林业大学,2008:28-38.
[29] Zhan H Y,Pu Y Q,Yue B Z,etal.Structural changes in lignin druring extended delignification kraft cooking of pinus elliottii (II)-Structrual changes in residual lignin of pulps.Paper Science &Technology,2001,20(1):8-16.詹怀宇,蒲云桥,岳保珍,等.湿地松深度脱木素硫酸盐法蒸煮过程中木素结构的变化(1)一纸浆中残余木素结构的变化.造纸科学与技术,2001,20(1):8-16.
Analysis of the degradation of corn stalk fermented by complex bacteria composed of twoBacillusamyloliquefaciensstrains
LI Hong-Ya,LI Wen,LI Shu-Na,WANG Shu-Xiang,LI Meng,TIAN Miao-Miao,ZHU Bao-Cheng*
CollegeofLifeScience,HebeiAgriculturalUniversity,Baoding071000,China
In order to obtain a complex bacteria agent that can be used in the fermentation of corn stalk and improve its quality as silage,twoBacillusamyloliquefaciensstrains with high lignocellulose-degrading ability were mixed to make a complex agent whose degradation effect could be studied.The microstructure and degradation products of corn stalk inoculated with the complex bacteria agent were analyzed using FTIR,1H-NMR,SEM and GC/MS.Fermentation tests showed that the microbial agent efficiently degraded lignocellulose in corn straw.When the agent was inoculated for 24 days,the degradation rate of lignin,cellulose and hemicellulose reached 48.4%,30.5% and 41.4% respectively.FTIR and1H-NMR spectrum analysis showed that the main linking covalent bonds,such as β-O-4 and β-β linkages between the lignin monomers,the bonds connecting the lignin to cellulose and the carbohydrate bonds in lignocellulose’s molecular structure,were all broken.The complete destruction of plant tissue structure was also observed with electron microscope scanning.GC/MS analysis of low-molecule substances in the fermented corn stalk showed that the lignin was degraded into small molecular aromatic compounds,including amphetamine and phenylpropionic acid,monomers produced by the depolymerization of lignin,and benzyl alcohol and benzoic acid esters,which are degradation products of lignin phenyl propane monomers.GC/MS analysis of carbohydrate degradation products showed that the complex bacteria could not only convert cellulose,hemicellulose and other macromolecule carbohydrates into reducing monosaccharides,such as glucose,xylose,mannose and galactose,but that it could also metabolize these monosaccharides into glycol,glycerol and short-chain fatty acids.In conclusion,these results show that the complex bacteria agent effectively degrades lignocellulose and could be widely used to convert corn stalk into high quality forage.
Bacillusamyloliquefaciens;complex bacteria;corn stalk;degradation;characterization
10.11686/cyxb2016498 http://cyxb.lzu.edu.cn
李红亚,李文,李术娜,王树香,李猛,田苗苗,朱宝成.解淀粉芽孢杆菌复合菌剂对玉米秸秆的降解作用及表征.草业学报,2017,26(6):153-167.
LI Hong-Ya,LI Wen,LI Shu-Na,WANG Shu-Xiang,LI Meng,TIAN Miao-Miao,ZHU Bao-Cheng.Analysis of the degradation of corn stalk fermented by complex bacteria composed of twoBacillusamyloliquefaciensstrains.Acta Prataculturae Sinica,2017,26(6):153-167.
2016-12-26;改回日期:2017-03-13
河北省科技支撑计划项目(12226605)和河北省教育厅科学技术研究项目(2011232)资助。
李红亚(1977-),女,河北蠡县人,副教授,博士。E-mail:lihy77@sina.com
*通信作者Corresponding author.E-mail:zhu2222@126.com
