低氧对人牙囊细胞生物学特性的影响
2017-06-19梁熙陈国庆田卫东
梁熙陈国庆田卫东
1.口腔疾病研究国家重点实验室,国家口腔疾病临床研究中心,
四川大学华西口腔医院创伤与整形外科;
2.口腔再生医学国家地方联合工程实验室 华西口腔医院(四川大学),成都 610041
低氧对人牙囊细胞生物学特性的影响
梁熙1,2陈国庆2田卫东1,2
1.口腔疾病研究国家重点实验室,国家口腔疾病临床研究中心,
四川大学华西口腔医院创伤与整形外科;
2.口腔再生医学国家地方联合工程实验室 华西口腔医院(四川大学),成都 610041
目的 研究低氧对人牙囊细胞(hDFCs)生物学特性的影响。方法 利用组织块酶消化法从年轻恒牙中分离培养hDFCs;采用免疫荧光技术检测细胞表面标志物,多向诱导实验检测细胞多向分化潜能;模拟体外低氧微环境,将细胞分为常氧组(20%O2)和低氧组(2%O2),分别对两组细胞行Transwell小室试验检测低氧对细胞迁移的影响,采用CCK-8法检测低氧对细胞增殖的影响。通过实时定量聚合酶链反应(qRT-PCR)和Western blot分别从基因和蛋白水平检测hDFCs多能性相关标志物于不同氧体积分数下的表达;分别对两组细胞进行成骨诱导,qRT-PCR检测成骨相关基因,茜素红染色评估矿化结节的形成。结果 hDFCs具有较强的干细胞特征,具有成骨、成脂及成神经多向分化能力,符合间充质干细胞基本标准,能够满足牙组织工程构建对种子细胞的需求。低氧有利于hDFCs多能性的保持,同时促进了hDFCs的迁移和增殖。hDFCs于低氧中进行诱导时,其成骨分化能力得到增强。结论 低氧微环境对维持hDFCs多能性,促进hDFCs增殖、迁移和分化有重要作用。
低氧; 人牙囊细胞; 增殖; 迁移; 分化
牙囊是牙萌出之前包绕牙胚的一层疏松结缔组织,该组织被认为含有干细胞和形成牙周组织的前体细胞亚群[1]。在一定的条件下,牙囊细胞(dental follicle cells,DFCs)可分化为牙周膜细胞、成牙骨质细胞及成骨细胞,分别形成牙周膜、牙骨质和牙槽骨[2]。目前认为,DFCs具有强大的多向分化能力,可以促进牙组织结构和功能的修复,因而备受关注。人DFCs(human DFCs,hDFCs)可从临床年轻患者拔除的第三磨牙中分离获得,培养至多代后仍然具有强大的组织再生能力[3],而且因其来源于自体组织,可以避免产生免疫排斥反应,因而hDFCs被认为是应用于牙本质、牙周再生最合适的种子细胞之一。
目前体外培养牙源性细胞时,多是在氧体积分数为20%的常氧环境下进行,但牙源性细胞在体内微环境中的氧体积分数大大低于此水平。组织病理状态如牙髓钙化、牙周炎等可引起组织缺血缺氧,同样会使局部细胞处于低氧环境中。大量研究[4-7]表明,低氧环境可以明显影响细胞的生物学特性和功能,对细胞增殖、调亡、分化等方面的影响尤为明显。近年来对低氧的研究[8-12]多集中在牙髓细胞上,而低氧对hDFCs的影响还少有报道。本实验的目的即是研究低氧环境对hDFCs基本生物学特性的影响,包括细胞多能性,以及细胞增殖、分化、迁移等特性。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清、α-MEM培养基(Gibco公司,美国),Ⅰ型胶原酶、胰蛋白酶、青链霉素混合液(Sigma公司,美国),体视显微镜、倒置显微镜(Leica公司,德国),三气培养箱(SANYO公司,日本),Transwell小室(Corning公司,美国),细胞增殖活性检测试剂盒(Dojindo公司,日本),RNAiso Plus RNA提取试剂及逆转录试剂盒(Takara公司,日本),实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪(Applied Biosystems公司,美国),二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(Pierce Biotechnology公司,美国),细胞角蛋白14(cytokeratin 14,CK14)抗体(M illipore公司,美国,货号MAB3232),波丝蛋白(Vimentin)抗体(Thermo公司,美国,货号OMA1-06001),Nanog抗体(Santa Cruz公司,美国,货号sc-33760),Sox-2抗体(Abcam公司,英国,货号ab97959),Oct-4抗体[生工生物工程(上海)股份有限公司,货号D121072],β-actin抗体(Abcam公司,英国,货号ab3280),βⅢ-微管蛋白(βⅢ-tubulin)抗体(M illipore公司,美国,货号MAB1637)。
1.2 实验方法
1.2.1 hDFCs分离与培养 收集16~22岁患者因第三磨牙阻生而需要拔除的健康完整的第三磨牙。用组织块酶消化法获得hDFCs[13-15]。待原代细胞长满瓶底的80%时,常规传代并扩大培养。后续所有实验均使用第3~5代细胞。低氧组细胞置于2%O2、5%CO2、93%N2的37 ℃的三气培养箱中模拟体外培养的缺氧环境。
1.2.2 细胞免疫荧光染色 hDFCs悬液接种于6孔板,待细胞生长至50%~60%后,多聚甲醛固定20 m in;3%BSA封闭20 m in,加入一抗Vimentin(1∶400稀释)和CK14(1∶400稀释),恒温孵育2 h后4 ℃湿盒中过夜;次日复温30 m in,PBS洗3次,加入合适的IgG二抗(1∶200稀释),37 ℃湿盒中孵育1 h,1 μg·m L-1的4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)溶液浸染1 m in后置于荧光显微镜下观察。
1.2.3 hDFCs增殖检测 以每孔2 000个细胞接种于96孔板,分为常氧组(O2体积分数为20%)和低氧组(O2体积分数为2%),分别接种hDFCs培养1、2、3、4、5、6、7 d,每孔加CCK-8溶液10 μL,在37 ℃下孵育1.5 h,用酶标仪在450 nm测定各孔吸光度(optical density,OD)值。每组设5个复孔。
1.2.4 Transwell细胞迁移试验 取对数生长期的细胞,加入无血清培养基培养24 h使细胞同步,胰酶消化细胞。Transwell小室的上室加入50 000个细胞,下室加入低血清(2%胎牛血清)培养基,分别置于低氧和常氧环境下继续培养24 h,甲醛固定,0.1%结晶紫染色,倒置显微镜下观察并进行分区细胞计数。每组设3个复孔,每孔计算5个随机视野的细胞数均值。
1.2.5 hDFCs多向分化诱导及检测 1)成骨诱导。hDFCs接种(10 000个·cm-2)于6孔板,置于普通培养基中正常培养至60%~70%融合后,更换成骨分化诱导培养基分别在常氧和低氧环境下进行成骨分化诱导,此时设为0 d;成骨诱导液每隔3 d换液1次,分别诱导培养7、14、21 d。诱导后PBS缓冲液漂洗3次,4%多聚甲醛室温固定20 m in,茜素红室温染色5 min,倒置显微镜下观察矿化结节形成情况。2)成脂诱导。hDFCs培养至60%~70%融合后,更换成脂诱导液诱导21 d,每隔3 d换液1次。将细胞用PBS洗涤,4%多聚甲醛固定20 m in后,油红染色30 m in以检测细胞内脂滴的形成。3)成神经诱导。hDFCs培养至60%~70%融合后,更换成神经诱导液诱导2 h,PBS洗涤,4%多聚甲醛固定20 m in,然后参照1.2.2方法用βⅢ-tubulin抗体(1∶200稀释)进行免疫荧光染色。
1.2.6 qRT-PCR 采用RNAiso Plus提取细胞总RNA,检测总RNA纯度和浓度。使用逆转录试剂盒将提取的总RNA逆转录为cDNA。qRT-PCR反应条件为:95.0 ℃,30 s;95.0 ℃,5 s,40个循环;60.0 ℃,30 s;95.0 ℃,15 s;60.0 ℃,1 min;95.0 ℃,15 s。采用β-actin作为内参。目的基因有两种:细胞多能性相关基因,包括Nanog、Oct-4和Sox-2;成骨相关基因,包括成骨基因特异性转录因子2(Runt-related transcription factor 2,Runx2)、锌指结构转录因子(Osterix,OSX)、骨涎蛋白(bone sialoprotein,BSP)和骨桥蛋白(osteopontin,OPN)。所用引物序列见表1。

表 1 qRT-PCR各引物序列Tab 1 Primer sequences used for qRT-PCR
1.2.7 Western blot检测 加入放射免疫沉淀试验(radio immunoprecipitation assay,RIPA)裂解液,裂解提取两组细胞的总蛋白,并用BCA蛋白定量试剂盒测定蛋白质质量浓度。每个样本取30 μg的蛋白量,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecyl sulfate-polyacrylam ide gel electrophoresis,SDSPAGE)将其分离并转至膜上,质量分数为5%的脱脂奶粉室温封闭2 h,分别加入一抗β-actin(1∶2 000稀释)、Nanog(1∶200稀释)、Sox-2(1∶2 000稀释)、Oct-4(1∶500稀释),4 ℃孵育过夜后,用TBST(Tris-HCl缓冲盐溶液+Tween)于摇床洗膜10 m in,3次,加入合适的二抗IgG(均1∶10 000稀释)室温孵育2 h,用TBST于摇床上洗膜10 m in,3次,最后进行化学发光反应显影。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,计量资料用均数±标准差表示,两独立样本均数比较采用t检验,检验水准为双侧α=0.05。
2 结果
2.1 hDFCs的鉴定
经免疫荧光染色检测,牙囊组织分离培养的细胞CK14染色阴性,Vimentin染色阳性,表明本研究培养的细胞为间充质来源。hDFCs经过成骨诱导后行茜素红染色,倒置显微镜下可见块状矿化结节生成;经成脂诱导后行油红染色,光镜下可见脂滴状结构生成;经成神经诱导后行βⅢ-tubulin细胞免疫荧光染色,荧光显微镜下可见类神经细胞树状突起形成(图1)。
2.2 低氧影响hDFCs多能性的维持
在低氧环境中培养1 d后,hDFCs的Nanog、Oct-4、Sox-2基因表达较常氧组均明显升高,差异有统计学意义(P<0.05);低氧环境中培养7 d后,Nanog、Oct-4、Sox-2基因表达同样均高于常氧组(P<0.05)。在低氧条件下,细胞多能性相关(Nanog、Oct-4、Sox-2)蛋白的表达显示出与基因表达一致的上调趋势(图2)。
2.3 低氧影响hDFCs的增殖
CCK-8检测结果见图3:hDFCs接种1~3 d,低氧组OD值与常氧组差异无统计学意义(P>0.05);4~7 d,低氧组OD值高于常氧组,差异有统计学意义(P<0.05)。
2.4 低氧影响hDFCs的迁移
Transwell细胞迁移试验结果见图4:培养24 h,低氧组hDFCs穿出孔的细胞数量明显高于常氧组,数量约为常氧组的2倍,两组差异有统计学意义(P< 0.05)。
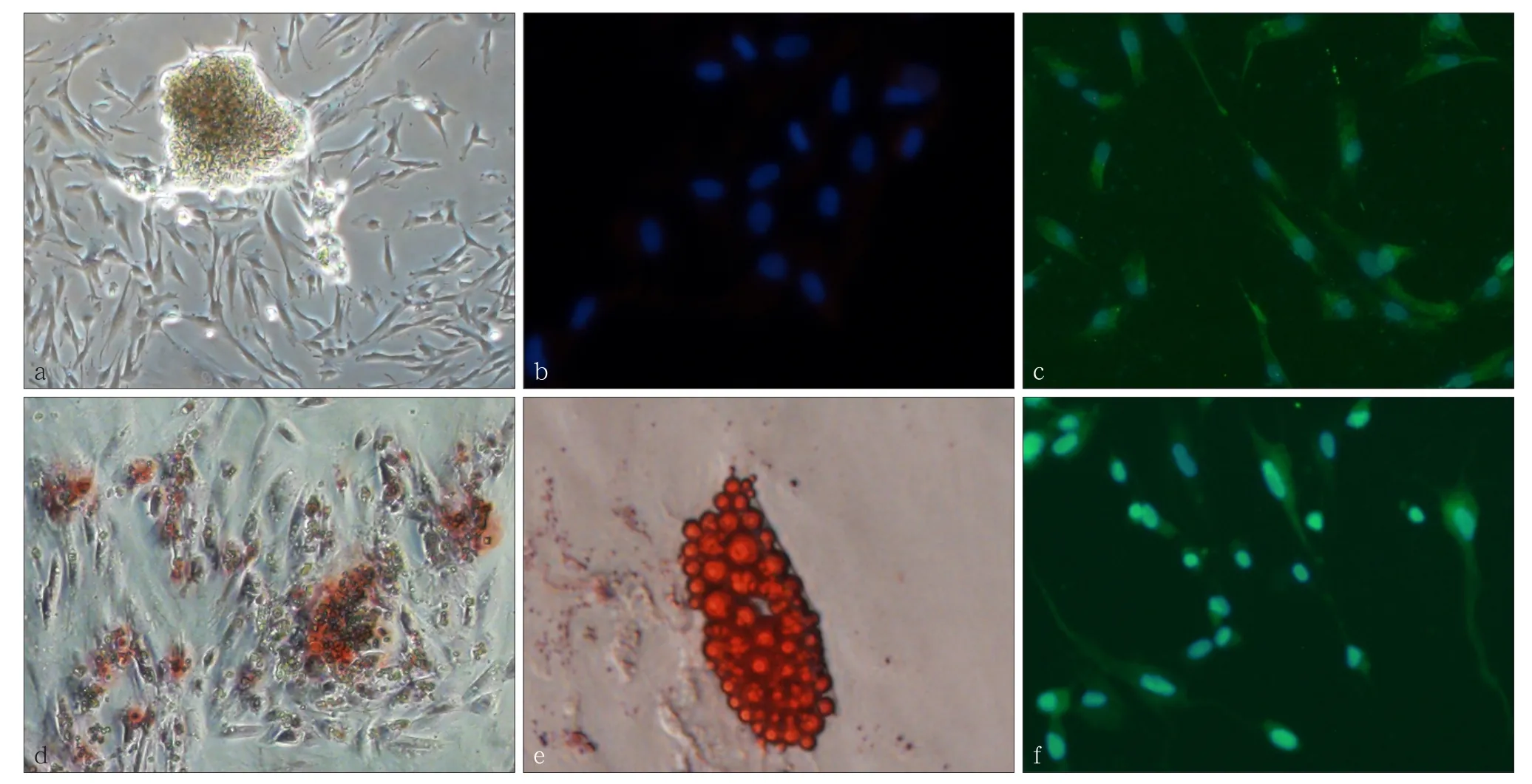
图 1 体外培养hDFCs的生物学特征Fig 1 Characteristics of cultured hDFCs in vitro
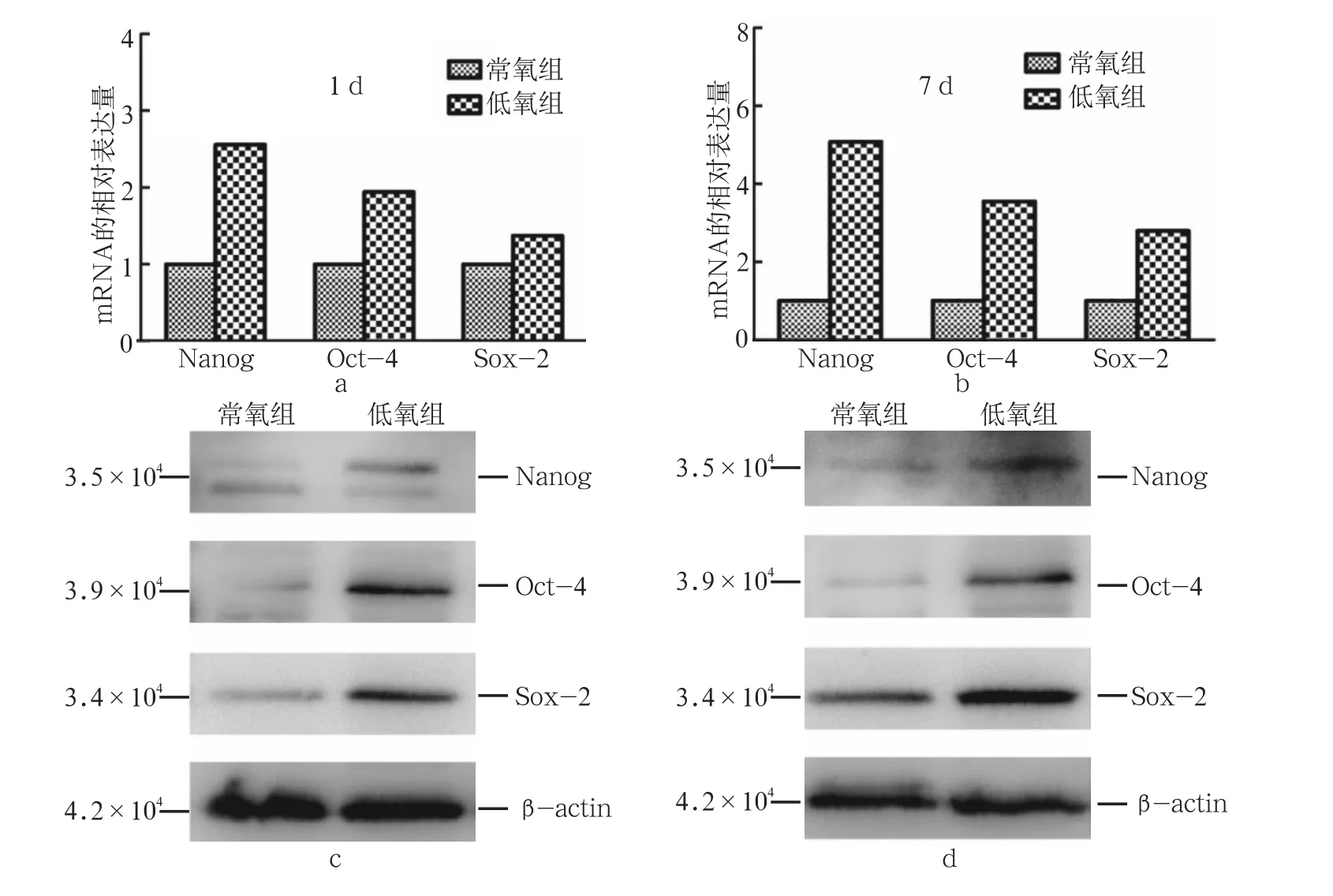
图 2 低氧对hDFCs表达Nanog、Oct-4和Sox-2的mRNA及蛋白的影响Fig 2 Effect of hypoxia on the mRNA and protein expression levels of Nanog, Oct-4, and Sox-2 in hDFCs
2.5 低氧影响hDFCs的成骨分化
低氧环境下hDFCs成骨分化能力增强。成骨诱导7、14、21 d后进行茜素红染色,低氧组hDFCs可观察到较常氧组更多的矿化结节(图5);qRT-PCR结果也显示,hDFCs在成骨诱导7、14、21 d后,低氧组成骨相关基因Runx2、OSX、BSP、OPN的相对表达量均较常氧组明显高(图6),差异有统计学意义(P<0.05)。
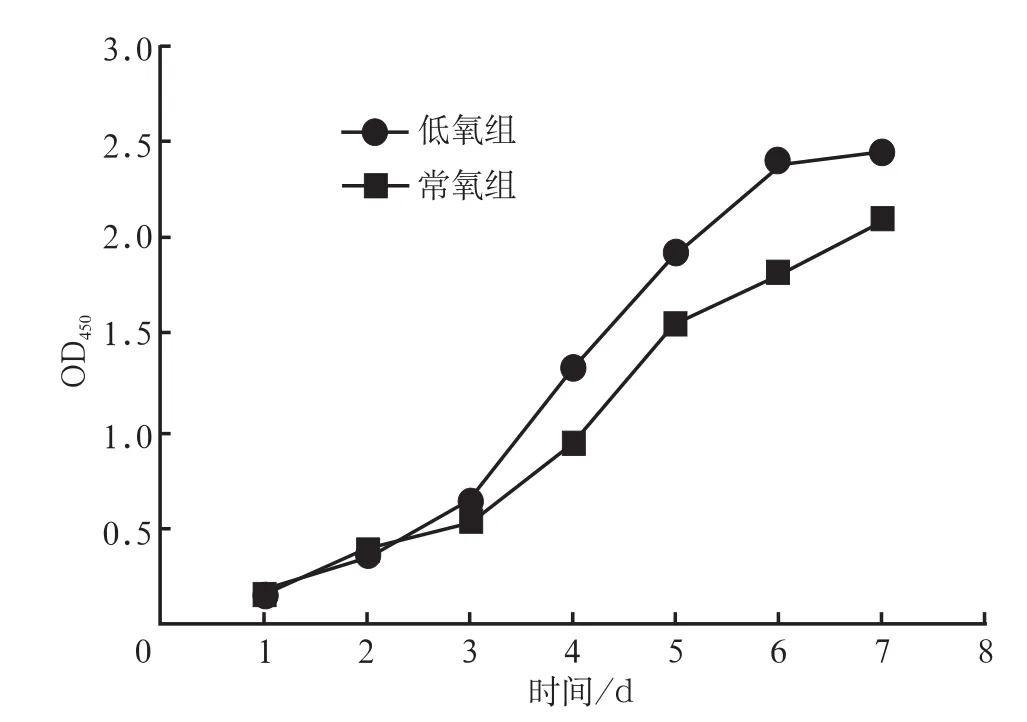
图 3 常氧和低氧培养下hDFCs的生长曲线Fig 3 Grow th curves of hDFCs cultured in normoxia and hypoxia plotted
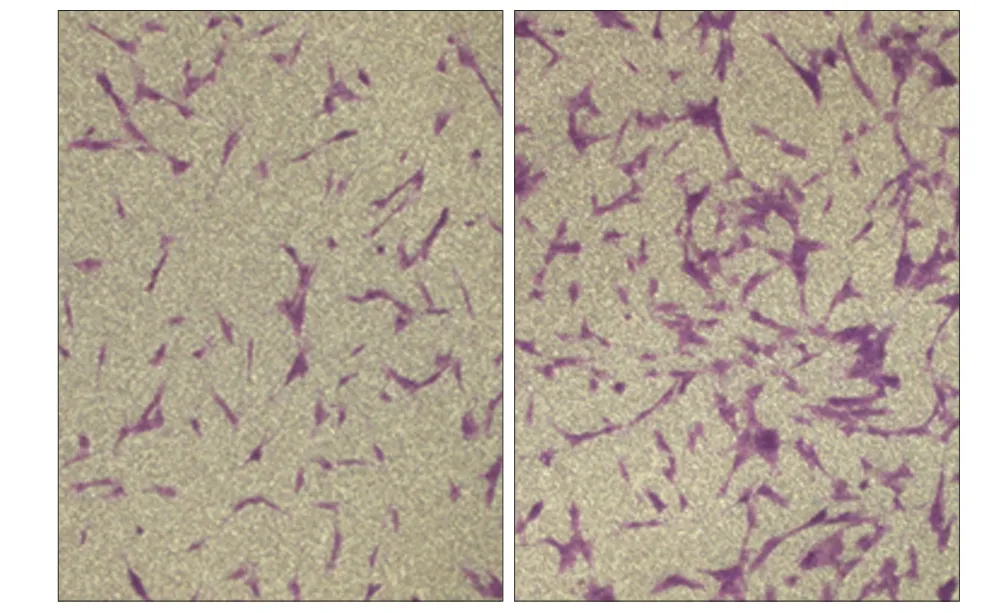
图 4 低氧对hDFCs迁移的影响 倒置显微镜 × 200Fig 4 Effect of hypoxia on the migration of hDFCs inverted mic- roscope × 200

图 5 低氧对hDFCs成骨分化的影响Fig 5 Effect of hypoxia on the osteogenic differentiation of hDFCs
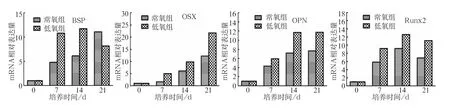
图 6 低氧对hDFCs成骨分化相关基因的影响Fig 6 Effect of hypoxia on the osteogenic differentiation related genes of hDFCs
3 讨论
作为一群具有较强增殖和多向分化能力的前体细胞,DFCs除了在成牙方面具有突出优势外,在组织工程与再生医学研究领域还可作为重要的种子细胞,在条件性诱导环境下分化成为多种不同类型的细胞。有研究[16]表明,在肝细胞生长因子重组蛋白存在的条件下对DFCs进行诱导,DFCs可分化为肝细胞样细胞,并具有肝细胞功能,包括糖原存储及尿素生成。还有研究[17]发现,体外羟肟酸可以成功诱导DFCs心肌向分化,并且分化的类心肌细胞不会引起免疫排斥及炎症反应,表明DFCs在心肌细胞再生领域具有相应的潜力。
hDFCs在体外扩增过程中如何保持细胞多能性是其应用于临床前必须解决的问题。Nanog、Oct-4、Sox-2转录因子是细胞转录调节系统的重要部分,已被证实在干细胞的自我更新及多能性维持过程中起到关键作用[18]。过表达Nanog、Oct-4、Sox-2的成体细胞能够恢复多能干细胞的特性[19]。研究[20]发现,低氧可激活Oct-4的表达,Oct-4可作为细胞多能性动态变化的关键诱导物。然而,目前就低氧环境对hDFCs细胞多能性的维持及相关标志物表达的影响,尚未见有深入研究。本实验发现,低氧培养可使hDFCs的Nanog、Oct-4、Sox-2基因表达增加,蛋白表达也相对上调,提示在触发这些干细胞标志物表达来保持成体干细胞特性的过程中,尽管相关的分子信号通路并不清楚,但低氧环境可能是关键的影响因素之一。研究[21-23]发现,在包括牙源性间充质干细胞在内的大多数多功能干细胞中,这3种转录因子呈现出相似的功能及调控作用。Sheik Mohamed等[24]指出,Oct-4和Nanog之间可相互影响,Nanog的表达部分依赖Oct-4的表达。本实验中,此3种转录因子蛋白及基因水平的表达特征进一步证实hDFCs强大的多能性,也为hDFCs中存在多能性细胞群提供了证据;同时可推测Nanog、Oct-4、Sox-2这3种转录因子并不是孤立的发挥作用,而是三者之间相互作用、相互影响。
过度缺氧引起的细胞毒性会导致大量的细胞死亡[25],欲获得足够数量的细胞用于组织再生,低氧条件下的细胞增殖备受关注。Sakdee等[9]发现,低氧条件(3%O2)下培养人牙髓细胞比常氧条件(20% O2)下的增殖速率快了约1倍;Iida等[8]将人牙髓细胞置于不同体积分数氧气中连续培养7 d后发现,与21%O2组相比较,3%O2组增殖能力提升,而1%O2组和10%O2组增殖能力无明显变化。Zhou等[26]则发现,2%O2的低氧条件并不能对人牙周膜细胞和牙髓细胞的增殖造成影响。上述研究结果不一致,原因可能在于低氧对牙源性细胞增殖的影响取决于细胞类型、氧气体积分数、处理时间甚至检测方法等多种因素。本实验结果2%O2低氧促进hDFCs增殖,推测原因是低氧降低了细胞内DNA的氧化损伤[27]。
迁移是细胞参与组织损伤修复的重要生物学特性,对于组织的修复治疗具有重要意义。Gong等[10]将人牙髓细胞置于低氧(1%O2)和常氧(20%O2)条件下分别培养18 h后,于常氧环境中检测两组细胞的迁移能力,结果可见1%O2低氧组牙髓细胞迁移能力明显增强。 Kanafi等[28]采用牙髓细胞在2.3%O2低氧条件下直接进行划痕试验,发现低氧条件较常氧下迁移的细胞数目更多。本实验直接在2%O2低氧和20%O2常氧条件下进行迁移相关试验,结果发现,直接培养于2%O2低氧环境中可显著提升hDFCs的迁移能力,与上述研究结果一致。
低氧可以提升人牙髓细胞、牙周膜细胞[10]和大鼠hDFCs[29]的成骨分化能力。本研究结果也发现,低氧可明显促进hDFCs的成骨分化能力。hDFCs暴露于低氧环境后,成骨相关基因如Runx2、OSX、BSP、OPN表达均上调。Runx2是成骨分化的决定性因子并在DFCs中表达[30-31];OSX是骨生成的晚期标志基因,也是Runx2下游调控基因[31-32];BSP一直被认为是成骨分化的早期标志基因[33];OPN是一种分泌性钙结合磷酸化糖蛋白,在骨重塑中起到关键作用,并且被认为是骨中的一种基本成分。上述成骨分化标志物随时间的表达变化趋势在hDFCs中基本一致。成骨分化早中期(7 d)即可以检测到上述成骨标志物的表达上调,而低氧组与常氧组基因表达量有明显差异的为早期成骨标志物Runx2和BSP。低氧组OSX在成骨分化中晚期(14 d)较常氧组明显上调;而低氧组BSP于成骨分化中晚期(14 d)表达降低,可见低氧在成骨分化早、中期可明显促进BSP表达,而晚期对其表达的影响微弱。
早在2003年,Annabi等[34]就发现,低氧环境下小鼠骨髓基质细胞在基质胶上形成三维毛细血管状结构并产生更多的血管内皮生长因子。2014年Leijten等[35]发现,在低氧条件下培养的间充质干细胞(mesenchymal stem cells,MSCs)中,成软骨化关键基因及与合成代谢相关基因的表达均上调,可以促进MSCs成软骨分化。此外,有学者[36]证明,低氧环境下用成脂培养基培养的MSCs脂滴数目是常氧条件下的5~6倍;还有研究[37]表明,在5%O2中培养MSCs可增加细胞中骨形态发生蛋白2、Runx2、OSX的表达,同时也可以增加骨细胞成熟标志蛋白OPN的表达。此外,与常氧组相比,在5%O2中培养的MSCs基质中钙的沉积量可增加2倍[38]。低氧微环境可有效调控细胞进程,如增殖、分化、凋亡等,其作用机制主要是通过激活低氧诱导因子-1α(hypoxia inducible factor-1 alpha,Hif-1α)及其介导的基因转录、信号转导来操控各种细胞的生物学特性[39]。比如Hif-1α可诱导MSCs的成骨细胞基因过度表达。另外,过表达Hif-1α可以促进MSCs活性及迁移,并有利于治疗缺氧缺血的脑部损伤疾患[40]。低氧可以通过促进MSCs表达Hif-1α来调控其生物学特性,由此可以推测低氧同样可通过促进hDFCs表达Hif-1α来改变其潜能,但还需要进一步的体外共培养及体内实验等来验证。
综上所述,体外持续低氧培养可以显著地促进hDFCs增殖和迁移,并有利于hDFCs多能性的维持,对成骨分化也有明显提升作用。本研究结果提示,低氧环境是hDFCs用于牙组织工程的关键调控因素之一。
[1] Morsczeck C, Götz W, Schierholz J, et al. Isolation of precursor cells (PCs) from human dental follicle of w isdom teeth[J]. Matrix Biol, 2005, 24(2):155-165.
[2] Saito M, Handa K, Kiyono T, et al. Immortalization of cementoblast progenitor cells with Bmi-1 and TERT[J]. J Bone M iner Res, 2005, 20(1):50-57.
[3] Guo W, Gong K, Shi H, et al. Dental follicle cells and treated dentin matrix scaffold for tissue engineering the tooth root [J]. Biomaterials, 2012, 33(5):1291-1302.
[4] Grayson WL, Zhao F, Izadpanah R, et al. Effects of hypoxia on human mesenchymal stem cell expansion and plasticity in 3D constructs[J]. J Cell Physiol, 2006, 207(2):331-339.
[5] Bosch P, Pratt SL, Stice SL. Isolation, characterization, gene modification, and nuclear reprogramm ing of porcine mesenchymal stem cells[J]. Biol Reprod, 2006, 74(1):46-57.
[6] Mazumdar J, Dondeti V, Simon MC. Hypoxia-inducible factors in stem cells and cancer[J]. J Cell Mol Med, 2009, 13(11/12):4319-4328.
[7] Webb JD, Coleman ML, Pugh CW. Hypoxia, hypoxia-inducible factors (HIF), HIF hydroxylases and oxygen sensing [J]. Cell Mol Life Sci, 2009, 66(22):3539-3554.
[8] Iida K, Takeda-Kawaguchi T, Tezuka Y, et al. Hypoxia enhances colony formation and proliferation but inhibits differentiation of human dental pulp cells[J]. Arch Oral Biol, 2010, 55(9):648-654.
[9] Sakdee JB, White RR, Pagonis TC, et al. Hypoxia-amplified proliferation of human dental pulp cells[J]. J Endod, 2009, 35(6):818-823.
[10] Gong QM, Quan JJ, Jiang HW, et al. Regulation of the stromal cell-derived factor-1alpha-CXCR4 axis in human dental pulp cells[J]. J Endod, 2010, 36(9):1499-1503.
[11] Aranha AM, Zhang Z, Neiva KG, et al. Hypoxia enhances the angiogenic potential of human dental pulp cells[J]. J Endod, 2010, 36(10):1633-1637.
[12] Agata H, Kagami H, Watanabe N, et al. Effect of ischemic culture conditions on the survival and differentiation of porcine dental pulp-derived cells[J]. Differentiation, 2008, 76(9):981-993.
[13] Guo L, Li J, Qiao X, et al. Comparison of odontogenic differentiation of human dental follicle cells and human dental papilla cells[J]. PLoS ONE, 2013, 8(4):e62332.
[14] Guo S, Guo W, Ding Y, et al. Comparative study of human dental follicle cell sheets and periodontal ligament cell sheets for periodontal tissue regeneration[J]. Cell Transplant, 2013, 22(6):1061-1073.
[15] Li R, Guo W, Yang B, et al. Human treated dentin matrix as a natural scaffold for complete human dentin tissue regeneration[J]. Biomaterials, 2011, 32(20):4525-4538.
[16] Patil R, Kumar BM, Lee WJ, et al. Multilineage potential and proteomic profiling of human dental stem cells derived from a single donor[J]. Exp Cell Res, 2014, 320(1):92-107.
[17] Sung IY, Son HN, Ullah I, et al. Cardiomyogenic differentia-tion of human dental follicle-derived stem cells by suberoylanilide hydroxamic acid and their in vivo hom ing property [J]. Int J Med Sci, 2016, 13(11):841-852.
[18] Kashyap V, Rezende NC, Scotland KB, et al. Regulation of stem cell pluripotency and differentiation involves a mutual regulatory circuit of the NANOG, OCT4, and SOX2 pluripotency transcription factors with polycomb repressive complexes and stem cell m icroRNAs[J]. Stem Cells Dev, 2009, 18(7):1093-1108.
[19] Park IH, Zhao R, West JA, et al. Reprogramming of human somatic cells to pluripotency with defined factors[J]. Nature, 2008, 451(7175):141-146.
[20] Mathieu J, Zhang Z, Zhou W, et al. HIF induces human embryonic stem cell markers in cancer cells[J]. Cancer Res, 2011, 71(13):4640-4652.
[21] M iura M, Gronthos S, Zhao M, et al. SHED: stem cells from human exfoliated deciduous teeth[J]. Proc Natl Acad Sci USA, 2003, 100(10):5807-5812.
[22] Tamaki Y, Nakahara T, Ishikawa H, et al. In vitro analysis of mesenchymal stem cells derived from human teeth and bone marrow[J]. Odontology, 2013, 101(2):121-132.
[23] Kerkis I, Kerkis A, Dozortsev D, et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers [J]. Cells Tissues Organs, 2006, 184(3/4):105-116.
[24] Sheik Mohamed J, Gaughw in PM, Lim B, et al. Conserved long noncoding RNAs transcriptionally regulated by Oct4 and Nanog modulate pluripotency in mouse embryonic stem cells[J]. RNA, 2010, 16(2):324-337.
[25] Brunelle JK, Shroff EH, Perlman H, et al. Loss of Mcl-1 protein and inhibition of electron transport chain together induce anoxic cell death[J]. Mol Cell Biol, 2007, 27(4):1222-1235.
[26] Zhou Y, Fan W, Xiao Y. The effect of hypoxia on the stemness and differentiation capacity of PDLC and DPC[J]. Biomed Res Int, 2014:890675.
[27] Keith B, Simon MC. Hypoxia-inducible factors, stem cells, and cancer[J]. Cell, 2007, 129(3):465-472.
[28] Kanafi MM, Ramesh A, Gupta PK, et al. Influence of hypoxia, high glucose, and low serum on the grow th kinetics of mesenchymal stem cells from deciduous and permanent teeth [J]. Cells Tissues Organs, 2013, 198(3):198-208.
[29] Dai Y, He H, W ise GE, et al. Hypoxia promotes grow th of stem cells in dental follicle cell populations[J]. J Biomed Sci Eng, 2011, 4(6):454-461.
[30] Komori T. Runx2, a multifunctional transcription factor in skeletal development[J]. J Cell Biochem, 2002, 87(1):1-8.
[31] Matsubara T, Kida K, Yamaguchi A, et al. BMP2 regulates Osterix through Msx2 and Runx2 during osteoblast differentiation[J]. J Biol Chem, 2008, 283(43):29119-29125.
[32] Nakashima K, Zhou X, Kunkel G, et al. The novel zinc fingercontaining transcription factor osterix is required for osteoblast differentiation and bone formation[J]. Cell, 2002, 108 (1):17-29.
[33] Huang W, Yang S, Shao J, et al. Signaling and transcriptional regulation in osteoblast commitment and differentiation[J]. Front Biosci, 2007, 12:3068-3092.
[34] Annabi B, Lee YT, Turcotte S, et al. Hypoxia promotes murine bone-marrow-derived stromal cell m igration and tube formation[J]. Stem Cells, 2003, 21(3):337-347.
[35] Leijten J, Georgi N, Moreira Teixeira L, et al. Metabolic programm ing of mesenchymal stromal cells by oxygen tension directs chondrogenic cell fate[J]. Proc Natl Acad Sci U S A, 2014, 111(38):13954-13959.
[36] Ren H, Cao Y, Zhao Q, et al. Proliferation and differentiation of bone marrow stromal cells under hypoxic conditions[J]. Biochem Biophys Res Commun, 2006, 347(1):12-21.
[37] Prado-Lòpez S, Duffy MM, Baustian C, et al. The influence of hypoxia on the differentiation capacities and immunosuppressive properties of clonal mouse mesenchymal stromal cell lines[J]. Immunol Cell Biol, 2014, 92(7):612-623.
[38] Lee JS, Park JC, Kim TW, et al. Human bone marrow stem cells cultured under hypoxic conditions present altered characteristics and enhanced in vivo tissue regeneration[J]. Bone, 2015, 78:34-45.
[39] Grayson WL, Zhao F, Bunnell B, et al. Hypoxia enhances proliferation and tissue formation of human mesenchymal stem cells[J]. Biochem Biophys Res Commun, 2007, 358 (3):948-953.
[40] Lin D, Zhou L, Wang B, et al. Overexpression of HIF-1α in mesenchymal stem cells contributes to repairing hypoxicischemic brain damage in rats[J]. C R Biol, 2017, 340(1): 18-24.
(本文编辑 吴爱华)
Effect of hypoxia on the biological characteristics of hum an dental follicle cells
Liang Xi1,2, Chen Guoqing2, Tian Weidong1,2. (1. State Key Laboratory of Oral Diseases, National Clinical Research Center for Oral Diseases, Dept. of Oral and Maxillofacial Trauma and Plastic Surgery, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China; 2. National Engineering Laboratory for Oral Regenerative Medicine, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
ObjectiveThis study aimed to investigate the effects of hypoxia on the characteristics of human dental follicle cells (hDFCs). Methods The tissue explant collagenase method was used to isolate hDFCs from young permanent teeth. The immunofluorescence technique was used to detect cell surface markers, and the multi-differentiation potential was detected by multilineage differentiation induction assay. Then, the hypoxic microenvironment was physically mimicked, and the cells were divided into the normoxia group (20%O2) and the hypoxia group (2%O2). The effects of hypoxia on cell m igration and proliferation were exam ined by Transwell chamber test and CCK-8 assay, respectively. The gene and protein expression levels of stemness-related markers at both oxygen concentrations were measured by quantitative real-time polymerase chain reaction (qRT-PCR) and Western blot, respectively. A fter osteogenic induction of both groups, qRT-PCR was performed to evaluate the osteogenesis-related gene, and alizarin red staining was used to assess the formation of m ineralized nodules.Resultswith the multi-differentiation capacity of osteogenic cells, adipogenic cells, and nerves, hDFCs demonstrate strong stem cell characteristics and possess the criteria of mesenchymal stem cells, which can meet the requirements of seed cells in dental tissue engineering. Hypoxia was conducive to the maintenance of hDFC stemness. Hypoxia promoted the m igration and proliferation of hDFCs. The hDFCs were induced to osteogenic differentiation under hypoxic conditions, thereby enhancing osteogenesis.ConclusionHypoxic m icroenvironment plays an important role in maintaining the stemnessand promoting the proliferation, m igration, and differentiation of hDFCs. Thus, this m icroenvironment could also serve several important functions in future clinical applications.
hypoxia; human dental follicle cells; proliferation; m igration; differentiation
R 780.2
A
10.7518/hxkq.2017.03.004
Supported by: National Natural Science Foundation of China (81271119) . Correspondence: Tian Weidong, E-mail: drtwd @sina.com.
2016-12-15;
2017-03-20
国家自然科学基金(81271119)
梁熙,硕士,E-mail:307922567@qq.com
田卫东,教授,博士,E-mail:drtwd@sina.com
