RIP3介导的坏死性凋亡在HT-22细胞牵张损伤模型中的作用
2017-06-19于泽奇衣泰龙涂悦杨小飒江继鹏董晓煜张赛程世翔
于泽奇 衣泰龙 涂悦 杨小飒 江继鹏 董晓煜 张赛 程世翔
RIP3介导的坏死性凋亡在HT-22细胞牵张损伤模型中的作用
于泽奇1衣泰龙1涂悦1杨小飒1江继鹏1董晓煜2张赛1程世翔1
目的探讨受体相互作用蛋白3(RIP3)介导的坏死性凋亡在HT-22细胞牵张损伤模型中的作用及其机制。方法将HT-22细胞接种在Bioflex培养板,采用细胞损伤控制仪(CIC),设定损伤参数(阀门压力30 PSI、气体脉冲压力3.5~4.5 PSI、气体脉冲时间50 ms),建立HT-22细胞牵张损伤模型。分别采用数字全息显微镜(DHM)、乳酸脱氢酶(LDH)试剂盒、流式细胞术、western blot法检测牵张损伤后6 h Ctrl组、CIC组、GSK’872组间细胞形态差异,LDH浓度变化,细胞周期分布,RIP3/受体相互作用蛋白1(RIP1)/混合系列蛋白激酶样结构域(MLKL)、Akt/p-Akt/mTOR/p-mTOR、Caspase-8/X连锁凋亡抑制蛋白(XIAP)蛋白表达变化。结果与CIC组相比,应用GSK’872后细胞平均数量[(244.67±11.68)vs(190.67±15.28),t=4.865,P<0.01]、细胞平均面积[(260.14±16.81)μm2vs(175.91±15.00)μm2,t=6.476,P<0.01]有所增加,细胞平均厚度有所减小[(6.12±0.47)μm vs(8.04±0.48)μm,t=4.942,P<0.01];LDH浓度有所下降[(222.74±11.06)ng/l vs(275.93±12.26)ng/l,t=5.581,P<0.01];细胞周期有所恢复[Sub-G1:(0.33±0.15)%vs(6.51±0.63)%,t=16.530,P<0.01;G0/G1:(46.67±2.96)%vs(33.04±7.07)%,t=3.085,P<0.05];能够降低 RIP3[(0.73±0.04)vs(1.09± 0.09),t=6.239,P<0.01]、RIP1[(0.75±0.05)vs(0.91±0.05),t=4.211,P<0.05]、MLKL[(0.56±0.03)vs(0.70± 0.04),t=4.785,P<0.01]、Akt[(0.49±0.05)vs(0.77±0.05),t=6.763,P<0.01]、p-Akt[(0.88±0.05)vs(1.06± 0.05),t=4.509,P<0.05]、mTOR[(0.81±0.02)vs(0.90±0.05),t=2.813,P<0.05]、p-mTOR[(0.65±0.05)vs(1.00±0.05),t=8.413,P<0.01]、XIAP[(0.50±0.05)vs(0.73±0.05),t=5.814,P<0.01]蛋白表达,并可促进 Caspase-8蛋白表达持续升高[(0.96±0.05)vs(0.75±0.05),t=5.351,P<0.01],差异具有统计学意义。结论RIP3介导的坏死性凋亡在HT-22细胞牵张损伤模型中起到重要作用,应用GSK’872可减轻HT-22细胞牵张损伤的程度,提示RIP3有可能成为将来临床上治疗颅脑创伤新的靶点。
颅脑创伤; 牵张损伤; 坏死性凋亡; 受体相互作用蛋白3; GSK’872; HT-22细胞
颅脑创伤(traumatic brain injury,TBI)是临床上常见预后凶险的危重病,其高致死率和致残率给患者家庭和社会带来沉重的负担,现已成为全球较严重的公共卫生问题[1,2]。降低颅脑创伤死亡率、致残率以及提高患者的生存质量是目前神经外科领域的研究热点[3]。近年来,坏死性凋亡在多种疾病中的作用越来越受关注,比如细菌感染,胰腺炎,动脉粥样硬化,脑、心肌、肠道炎症等[4-9]。坏死性凋亡的发生、调节、诱导及阻断机制是一个复杂的过程,涉及多种分子的表达及调控。其中受体相互作用蛋白3(receptor-interacting protein 3,RIP3)是调控细胞坏死性凋亡的关键分子,可磷酸化混合系列蛋白激酶样结构域(mixed lineage kinase domain like,MLKL),并最终导致细胞膜通透性改变,甚至细胞膜破裂[10,11]。但RIP3介导的坏死性凋亡与颅脑创伤之间的详细机制仍未完全清楚,因此本实验采用细胞损伤控制仪(cell injury controller,CIC)建立细胞牵张损伤模型,以模拟临床上颅脑创伤的发生,从而进一步探讨RIP3介导的坏死性凋亡在颅脑创伤中的作用及其机制。
材料与方法
一、实验细胞
小鼠海马神经元HT-22细胞购自上海慧颖生物科技有限公司,用含10%胎牛血清的DMEM高糖培养基于培养箱(5%CO2,37℃)中常规培养。实验分组:Ctrl组(不予处理),CIC组(HT-22细胞CIC牵张损伤后,更换普通DMEM高糖培养基),GSK’872组 (HT-22细胞CIC牵张损伤后,更换含GSK’872浓度为3μmol/l的DMEM高糖培养基)。
二、仪器与试剂
CO2恒温三气培养箱(美国Thermo),细胞损伤仪 (美国Custom Design&Fabrication Ltd.),Bioflex细胞培养板(美国Flexcell),数字全息显微镜(digital holographic microscopy,DHM)(HoloMonitorTMM4,瑞典 Phiab),酶标仪 (美国 Thermo),乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(北京普利莱基因技术有限公司),流式细胞仪(FACSCallibur,美国BD),碘化丙啶(propidium iodide,PI)、Annexin V(美国 Life),垂直电泳槽(美国 Bio-Rad),半干转膜仪(美国Bio-Rad),化学发光成像系统 (AI600,美国GE),ECL显色试剂盒(美国GE),兔抗小鼠RIP3、RIP1、MLKL、Akt、p-Akt、mTOR、p-mTOR、X连锁凋亡抑制蛋白 (X-linked inhibitor of apoptosis protein,XIAP)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(美国Abcam),羊抗小鼠Caspase-8一抗(美国Santa Cruz),辣根过氧化物酶标记羊抗兔IgG抗体(美国KPL),辣根过氧化物酶标记兔抗羊IgG抗体(美国KPL),BCA蛋白定量试剂盒 (北京康为公司),GSK’872(美国Millipore)。
三、建立CIC致HT-22细胞牵张损伤模型
将HT-22细胞以3×105/ml密度接种于Bioflex硅胶培养板中,待细胞汇合度达到85%以上时,将CIC细胞损伤仪输出端与Bioflex培养板紧密相连,设定参数如下:阀门压力为30 PSI,气体脉冲压力为3.5~4.5 PSI,气体脉冲时间为50 ms。在CIC损伤后6 h进行后续实验,对照组不予处理。
四、DHM形态学观察
用DHM随机选取HT-22细胞某一视野,拍摄细胞损伤各组间的形态学变化,并使用HoloStudio 1.8软件计算细胞平均数量、平均面积和平均厚度,取3次结果的平均值作为测定结果。
五、LDH浓度的测定
分别于细胞牵张损伤6 h吸取Ctrl组、CIC组、GSK’872组细胞培养上清液各10μl,加入到96孔板中,再将底物缓冲液与11.3 mmol/l氧化型辅酶Ⅰ以5∶1的比例混匀,每孔加入60μl混合液,37℃水浴15 min。加入50μl 2,4-二硝基苯肼溶液,与样本充分混合,37℃水浴15 min。最后加入150μl终止试剂(0.6 mmol/l NaOH),室温条件下,静置3~5 min,酶标仪440 nm波长处测定吸光值,根据标准曲线计算各样品释放的LDH浓度。
六、流式细胞术检测细胞周期
收集细胞牵张损伤后 6 h Ctrl、CIC、GSK’872组细胞,离心5 min(1 200 r/min),掉倒上清,加入预冷磷酸盐缓冲液(phosphate buffer saline,PBS)4 ml,反复吹打,再以1 200 r/min离心5 min,掉倒上清,反复冲洗3次,用75%冰乙醇固定细胞,于-20℃冰箱中过液。次日,将固定好的细胞用预冷PBS洗涤3次,再用500μl PBS将细胞重悬后加入PI和RNase(终浓度分别为50、100μg/ml),于37℃条件下避光孵育30 min,最后用流式细胞仪进行检测。
七、Western blot
收集细胞牵张损伤后 6 h Ctrl、CIC、GSK’872组细胞,用RIPA蛋白裂解液裂解,收集上清液。采用BCA法测定蛋白浓度,根据各组蛋白浓度取等量蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(电压120 V),待目的条带分离出来,停止电泳。再用半干转膜仪将蛋白转至硝酸纤维素膜(nitrocellulose filter membrane,NC)上(电压15 V),待转膜后将NC膜取出,蛋白面朝上,加入含5%脱脂奶粉的TBST封闭1 h。再分别加入RIP3、RIP1、 MLKL、Akt、p-Akt、mTOR、p-mTOR、Caspase-8、XIAP一抗 (稀释比例均为1∶1 000),4℃孵育过夜。次日TBST洗膜3次,每次10 min,加入相应二抗(稀释比例均为1∶10 000),室温孵育1 h,再TBST洗膜3次,每次10 min。将ECL发光液A和B等体积混合,滴在NC膜上,用GE化学发光成像系统进行图像采集,GAPDH为内参,使用ScnImage软件对灰度值进行数据分析。
八、统计学分析
采用Graphpad Prism 6.0和SPSS 17.0软件进行数据分析,数据采用均数±标准差(x±s)表示,组间比较行非配对样本t检验,以P<0.05为差异有统计学意义。
结果
一、细胞牵张损伤后各组HT-22细胞形态学变化
光镜观察结果显示,Ctrl组细胞贴壁良好,结构正常呈梭形,生长密集并形成稠密的神经网络状分布;细胞牵张损伤后6 h,可见CIC组细胞皱缩,并出现脱落、漂浮现象。而应用GSK’872后,细胞形态较CIC组有所恢复,细胞形态较好,部分细胞重新伸展,详见图1。
DHM观察结果显示,与Ctrl组相比,细胞牵张损伤后细胞平均数量显著降低 [(190.67±15.28)vs(389.67±15.28),t=15.960,P<0.01],细胞平均面积显著变小[(175.91±15.00)μm2vs(394.99±21.20)μm2,t=14.612,P<0.01],细胞平均厚度显著升高 [(8.04± 0.48)μm vs(4.24±0.67)μm,t=8.006,P<0.01],差异有统计学意义;而应用GSK’872后,细胞平均数量(244.67±11.68,t=4.865,P<0.01)、 细胞平均面积[(260.14±16.81)μm2,t=6.476,P<0.01]、细胞平均厚度[(6.12±0.47)μm,t=4.942,P<0.01]较CIC组均有所恢复,差异有统计学意义,详见图2A~2D。
二、LDH浓度的变化
LDH主要存在于细胞内,当细胞膜破裂时,释放到外周,因此测定LDH浓度可间接反映细胞损伤程度。本实验结果显示,与Ctrl组相比,细胞牵张损伤后6 h,LDH浓度显著升高 [(275.93±12.26)ng/l vs(51.68±7.08)ng/l,t=27.450,P<0.01], 而应用GSK’872后LDH浓度有所下降[(222.74±11.06)ng/l,t=5.581,P<0.01],差异有统计学意义。表明RIP3特异性抑制剂GSK’872能在一定程度上减轻细胞损伤程度,详见图3。

图1 光镜观察细胞牵张损伤后6 h Ctrl组、CIC组、GSK’872组细胞形态学变化(×100)
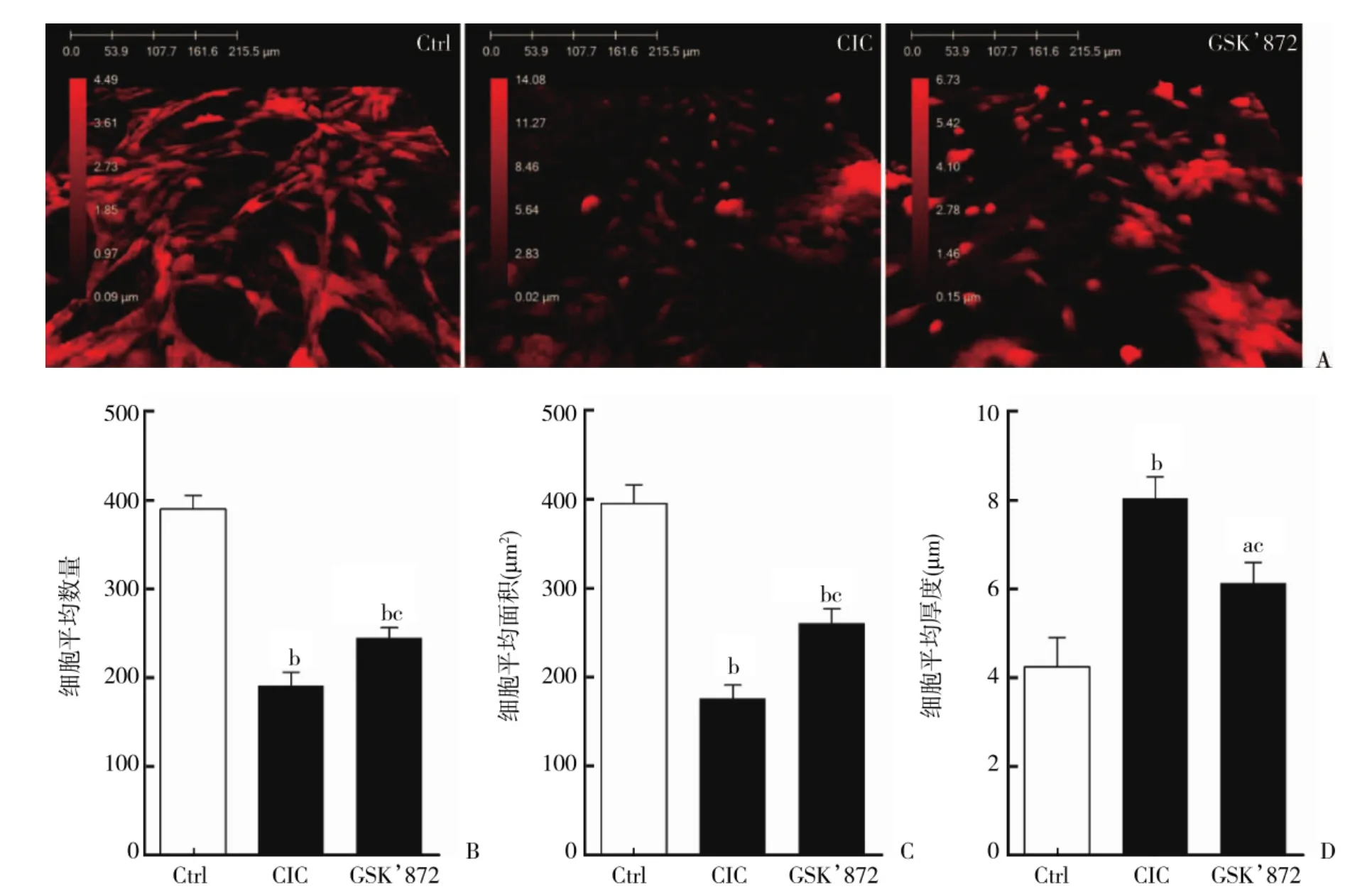
图2 数字全息显微镜观察细胞牵张损伤后6 h Ctrl组、CIC组、GSK’872组细胞形态学变化
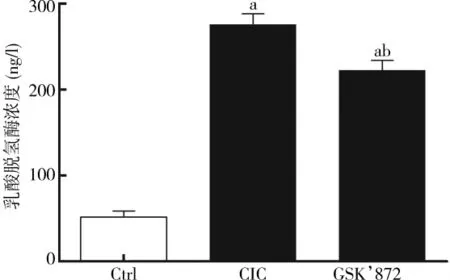
图3 细胞牵张损伤后6 h Ctrl组、CIC组、GSK’872组乳酸脱氢酶浓度变化
三、细胞周期变化
与Ctrl组相比,细胞牵张损伤后6 h CIC组 Sub-G1峰、G2/M峰明显升高,同时G0/G1峰、S峰比例显著降低,提示细胞坏死比例显著升高。而应用GSK’872后,可见细胞各周期均有所恢复,提示应用RIP3抑制剂GSK’872能够在一定程度上减轻细胞牵张损伤程度,详见图4、表1。
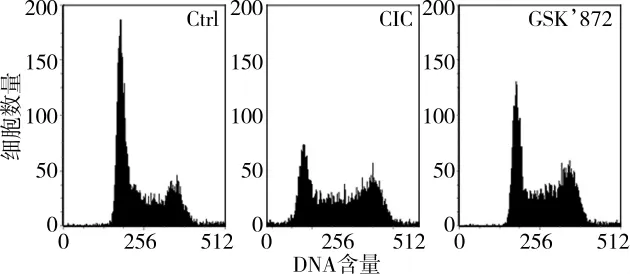
图4 流式细胞术检测细胞周期
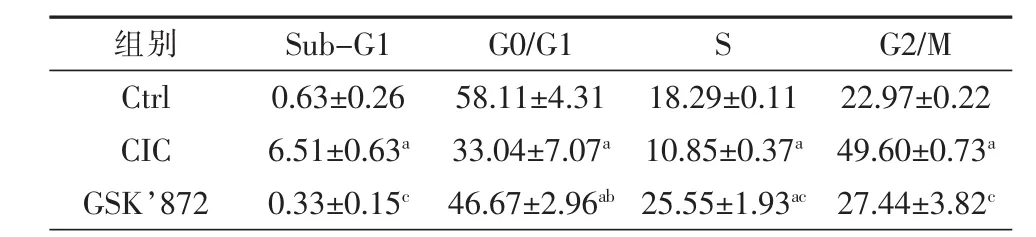
表1 细胞牵张损伤对HT-22细胞周期的影响(x±s,%)
四、Western blot结果
与Ctrl组相比,细胞牵张损伤后6 h CIC组RIP3、RIP1、MLKL表达显著升高[RIP3:(1.09±0.09)vs(0.60±0.04),t=8.532,P<0.01;RIP1:(0.91±0.05)vs(0.74±0.04),t=4.720,P<0.01;MLKL:(0.70±0.04)vs(0.55±0.03),t=5.390,P<0.01]。而应用GSK’872后,与CIC组相比,RIP3、RIP1、MLKL表达量均有所下降,分别为 [RIP3:(0.73±0.04),t=6.239,P<0.01;RIP1:(0.75±0.05),t=4.211,P<0.05;MLKL:(0.56± 0.03),t=4.785,P<0.01],详见图5。

图5 RIP3、RIP1、MLKL蛋白表达变化
与Ctrl组相比,细胞牵张损伤后6 h CIC组Akt、p-Akt、mTOR、p-mTOR表达显著升高[Akt:(0.77±0.05)vs(0.40±0.04),t=10.140,P<0.01;p-Akt:(1.06±0.05)vs(0.76±0.04),t=8.264,P<0.01;mTOR:(0.90±0.05)vs(0.78±0.04),t=3.258,P<0.05;p-mTOR:(1.00±0.05)vs(0.64±0.04),t=9.680,P<0.01]。而应用GSK’872后,与CIC组相比,Akt、p-Akt、mTOR、p-mTOR表达量均有所下降,分别为 [Akt:(0.49±0.05),t=6.763,P<0.01;p-Akt:(0.88±0.05),t=4.509,P<0.05;mTOR:(0.81±0.02),t=2.813,P<0.05;p-mTOR:(0.65±0.05),t=8.413,P<0.01],详见图6。

图6 Akt、p-Akt、mTOR、p-mTOR蛋白表达变化
与Ctrl组相比,细胞牵张损伤后6 h CIC组Caspase-8表达显著升高[(0.75±0.05)vs(0.46±0.04),t=7.985,P<0.01],XIAP表达显著下降 [(0.73±0.05)vs(0.96±0.04),t=6.255,P<0.01];而应用 GSK’872后,与CIC组相比,Caspase-8表达持续升高(0.96± 0.05,t=5.351,P<0.01),XIAP表达持续下降 (0.50± 0.05,t=5.814,P<0.01),详见图7。
讨论

图7 Caspase-8、XIAP蛋白表达变化
颅脑创伤是由机械力作用而导致的原发性脑组织损伤,在伤后的数分钟至数天内出现颅内压升高、脑水肿、脑血流改变等继发性损害,进而加重脑组织的损害程度[12]。在继发性脑损伤中,目前研究较多的是坏死性凋亡通路[13]。以往人们认为坏死是在物理、化学及病原体等因素作用下所致的非程序性细胞死亡。随着研究的深入,人们逐渐认识到细胞坏死实际上也是有序性的,即坏死性凋亡[14]。其中RIP3是该通路的关键分子,具有丝氨酸/苏氨酸蛋白激酶活性,可与 RIP1相互作用形成坏死复合体介导caspase非依赖性的细胞坏死。另一方面,RIP3的Ser227位点可通过磷酸化招募与活化其底物分子MLKL,磷酸化的MLKL募集PGAM5(线粒体中的一种蛋白)并使之磷酸化,最终作用于线粒体裂解蛋白Drp1,使其去磷酸化而激活,而后引发线粒体裂解以及活性氧的产生,导致细胞膜破裂、细胞坏死[15,16]。本实验中,HT-22细胞牵张损伤后,RIP3、RIP1、MLKL表达显著上升,而应用RIP3特异性抑制剂GSK’872,能够显著降低RIP3、RIP1、MLKL的表达,减轻细胞损伤程度,降低细胞死亡比例,提示RIP3特异性抑制剂GSK’872能够在一定程度上对神经细胞牵张损伤起到保护性作用,这为临床上治疗颅脑创伤提供了新的理论依据和目标靶点。
Akt是抑制神经元凋亡的一个关键激酶,mTOR是其下游激酶,调控蛋白的合成[17]。以往有研究指出,联合使用Akt和mTOR的抑制剂能够显著降低小鼠颅脑创伤模型中的细胞死亡,并改善小鼠的长期认知障碍[18]。在本研究中,笔者发现HT-22细胞牵张损伤后,Akt和mTOR发生磷酸化,同时表达量显著升高,而应用RIP3特异性抑制剂GSK’872后,Akt和mTOR的表达量有所减少,提示RIP3可能参与到Akt/mTOR信号途径中,并可对其进行调控[17]。
Caspase-8是细胞凋亡途径的核心分子,活化的Caspase-8会引起包括 Caspase-9在内的下游Caspase活化,进而导致凋亡的发生[19]。而XIAP是凋亡抑制剂,可抑制Caspase-8对下游Caspase活化过程中前结构域的去除,使下游Caspase不能活化从而抑制细胞凋亡的发生[20]。在本研究中,当HT-22细胞发生牵张损伤时,Caspase-8表达上调,XIAP表达减少。而值得注意的是,应用RIP3特异性抑制剂GSK’872后,一方面在一定程度上抑制细胞坏死性凋亡的发生,另一方面,明显地上调了Caspase-8的表达,并降低XIAP的表达,提示抑制RIP3的表达可在一定程度上抑制细胞坏死,并部分扭转到凋亡途径,这跟以往的研究不同[21]。
综上所述,RIP3介导的坏死性凋亡在HT-22细胞牵张损伤模型中起到重要作用,通过应用GSK’872阻断RIP3的表达可对神经元细胞牵张损伤起到一定的保护性作用。但临床上颅脑创伤与RIP3介导的坏死性凋亡之间的关系究竟如何,还有待进一步研究,这将为临床上治疗颅脑创伤提供新的研究方向和目标靶点。
[1] 涂悦,杨细平,商崇智.醒脑静对颅脑创伤的保护作用[J].中国应用生理学杂志,2014,30(3):230-232,236.
[2] Xu J,Liao W,Gu D,et al.Neural ganglioside GD2 identifies a subpopulation of mesenchymal stem cells in umbilical cord[J]. Cell Physiol Biochem,2009,23(4-6):415-424.
[3] Lim ST,Esfahani K,Avdoshina V,et al.Exogenous gangliosides increase the release of brain-derived neurotrophic factor[J]. Neuropharmacology,2011,60(7-8):1160-1167.
[4] Bleriot C,Lecuit M.The interplay between regulated necrosis and bacterial infection[J].Cell Mol Life Sci,2016,73(11-12):2369-2378.
[5] Takemoto K,Hatano E,Iwaisako K,et al.Necrostatin-1 protects against reactive oxygen species (ROS)-induced hepatotoxicity in acetaminophen-induced acute liver failure[J].FEBS Open Bio, 2014,4:777-787.
[6] Karunakaran D,Geoffrion M,Wei L,et al.Targeting macrophage necroptosis for therapeutic and diagnostic interventions in atherosclerosis[J].Sci Adv,2016,2(7):e1600224.
[7] Xu Y,Wang J,Song X,et al.RIP3 induces ischemic neuronal DNA degradation and programmed necrosis in rat via AIF[J].Sci Rep,2016,6:29362.
[8] Kitur K,Wachtel S,Brown A,et al.Necroptosis promotes staphylococcus aureus clearance by inhibiting excessive inflammatory signaling[J].Cell Rep,2016,16(8):2219-2230.
[9] Bozec D,Iuga AC,Roda G,et al.Critical function of the necroptosis adaptor RIPK3 in protecting from intestinal tumorigenesis[J].Oncotarget,2016,7(29):46384-46400.
[10] Xu B,Xu M,Tian Y,et al.Matrine induces RIP3-dependent necroptosis in cholangiocarcinoma cells[J].Cell Death Discov, 2017,3:16096.
[11] Kim SK,Yun M,Seo G,et al.Palmitate induces RIP1/RIP3-dependent necrosis via MLKL-mediated pore formation in the plasma membrane of RAW 264.7 cells[J].Biochem Biophys Res Commun,2017,482(2):359-365.
[12] Hackenberg K,Unterberg A.Traumatic brain injury[J]. Nervenarzt,2016,87(2):203-214;quiz 215-216.
[13] Liu T,Zhao DX,Cui H,et al.Therapeutic hypothermia attenuates tissue damage and cytokine expression after traumatic brain injury by inhibiting necroptosis in the rat[J].Sci Rep, 2016,6:24547.
[14] Edinger AL,Thompson CB.Death by design:apoptosis,necrosis and autophagy[J].Curr Opin Cell Biol,2004,16(6):663-669.
[15] Chen W,Zhou Z,Li L,et al.Diverse sequence determinants control human and mouse receptor interacting protein 3(RIP3) and mixed lineage kinase domain-like (MLKL)interaction in necroptotic signaling[J].J Biol Chem,2013,288(23):16247-16261.
[16] Wang Z,Jiang H,Chen S,et al.The mitochondrial phosphatase PGAM5 functions at the convergence point of multiple necrotic death pathways[J].Cell,2012,148(1-2):228-243.
[17] Liu Q,Qiu J,Liang M,et al.Akt and mTOR mediate programmed necrosis in neurons[J].Cell Death Dis,2014,5:e1084.
[18] Park J,Zhang J,Qiu J,et al.Combination therapy targeting Akt and mammalian target of rapamycin improves functional outcome after controlled cortical impact in mice[J].J Cereb Blood Flow Metab,2012,32(2):330-340.
[19] Liu L,Yim H,Choi JH,et al.ATM kinase promotes both caspase-8 and caspase-9 activation during TNF-α-induced apoptosis of HeLa cells[J].FEBS Lett,2014,588(6):929-935.
[20] Kaufmann T,Strasser A,Jost PJ.Fas death receptor signalling:roles of Bid and XIAP[J].Cell Death Differ,2012,19(1):42-50.
[21] Kaiser WJ,Sridharan H,Huang C,et al.Toll-like receptor 3-mediated necrosis via TRIF,RIP3,and MLKL[J].J Biol Chem, 2013,288(43):31268-31279.
(本文编辑:张丽)
于泽奇,衣泰龙,涂悦,等.RIP3介导的坏死性凋亡在HT-22细胞牵张损伤模型中的作用[J/CD].中华神经创伤外科电子杂志,2017,3(3):159-165.
·消息·
第十二届中国医师协会神经外科医师年会
12th Annual Meeting of Chinese Congress of Neurological Surgeons
尊敬的全国神经外科同仁:
中国医师协会神经外科医师分会从建立之日起,就把维护医师的合法权益和推进我国专科医师培训作为首要责任,也把全国神经外科医师群体真正地团结成为一个大家庭。一年一度的全国代表大会成了全国神经外科医师共同的节日!2017年6月23-25日,我们将在武汉欧亚会展国际酒店迎来第十二届全国年会!
在凸显中国医师协会神经外科医师分会“维权,自律,教育,交流”的宗旨下,此次大会将呈现给全国代表丰富多彩的内容。形式上,有会前多个亚专科实战解剖和操作学习班,大会邀请全国知名专家作精彩的大会报告,开设多个神经外科亚专科分会场,以及青年医生演讲比赛。在内容上,除了学术交流,还有政策解读,共识探讨,人文思考,历史回顾等。希望广大的代表踊跃投稿参会作报告!
会议举办地湖北武汉,九省通衢,交通便利。既可食武昌鱼,亦可万里长江横渡,还可一登黄鹤楼,极目楚天舒!湖北不仅有神秘恩施,雄伟三峡,巍峨武当等美不胜收的自然风光,同时人文荟萃,她是巴楚文化的发源地、禅宗文化的祖庭地、首义文化的承载地……届时您将有机会领略独具魅力的荆楚大地!
主办单位:中国医师协会
中国医师协会神经外科医师分会
承办单位:华中科技大学武汉协和医院
协办单位:首都医科大学宣武医院
刘承基中国神经外科医师基金
北京市王忠诚医学基金会
会议主席:凌锋
执行主席:赵洪洋
详情点击大会官网:http://ccns.cmdamt.org/2017/index
中国医师协会神经外科医师分会
Effects of necroptosis induced by RIP3 in stretch injury model of HT-22 cells
Yu Zeqi1,Yi Tailong1,Tu Yue1,Yang Xiaosa1,Jiang Jipeng1,Dong Xiaoyu2Zhang Sai1,Cheng Shixiang1.1Neurology and Neurosurgery Hospital,Affiliated Hospital of Logistics College of Chinese People’s Armed Police Force(PAP),Tianjin 300162,China;2Medical Unit of Three Detachment of Beijing Armed Police Corps, Beijing 100621,China
Cheng Shixiang,Email:shixiangcheng@vip.126.com
Objective To investigate the effects of necroptosis induced by receptor-interacting protein 3 (RIP3)on stretch injury model of HT-22 cells and its mechanisms.MethodsHT-22 cell lines were seeded with Bioflex cell plate,and stretch injuries with 30 psi for the regulator with a 50 msec pulse resulting in 3.5~4.5 peak injury pressure by cell injury controllerⅡ(CIC)instrument.The morphological changes of HT-22 cells were assessed by digital holographic microscopy(DHM),the degree of injury was detected by lactate dehydrogenase(LDH)assay,the cell cycle was detected withFlow cytometry and the expression of RIP3/RIP1/mixed lineage kinase domain like(MLKL),Akt/p-Akt/ mTOR/p-mTOR and Caspase-8/X-linked inhibitor of apoptosis protein(XIAP)were detected by Western Blot assay at 6 h post-CCI among Ctrl,CIC and GSK’872 groups.ResultsCompared with the CIC group,cells treated with GSK’872 exhibited an increase in number[(244.67±11.68)vs(190.67±15.28), t=4.865,P<0.01]and area [(260.14±16.81)μm2vs(175.91±15.00)μm2,t=6.476,P<0.01],however,a reduction in thickness[(6.12±0.47)μm vs(8.04±0.48)μm,t=4.942,P<0.01]with DHM.In the presence of GSK’872,the leakage of LDH was sharply decreased compared with the CIC group [(222.74±11.06) ng/l vs(275.93±12.26)ng/l,t=5.581,P<0.01].What’s more,GSK’872 could convert the alteration of cell cycle and cell death[Sub-G1:(0.33±0.15)%vs(6.51±0.63)%,t=16.530,P<0.01;G0/G1(46.67±2.96)%vs (33.04±7.07)%,t=3.085,P<0.05]compared to the CIC group.Furthermore,GSK’872 treatment could significantly decrease the levels of RIP3[(0.73±0.04)vs(1.09±0.09),t=6.239,P<0.01],RIP1[(0.75±0.05)vs (0.91±0.05),t=4.211,P<0.05],MLKL[(0.56±0.03)vs(0.70±0.04),t=4.785,P<0.01],Akt[(0.49±0.05) vs(0.77±0.05),t=6.763,P<0.01],p-Akt[(0.88±0.05)vs(1.06±0.05),t=4.509,P<0.05],mTOR[(0.81± 0.02)vs(0.90±0.05),t=2.813,P<0.05],p-mTOR[(0.65±0.05)vs(1.00±0.05),t=8.413,P<0.01],XIAP[(0.50± 0.05)vs(0.73±0.05),t=5.814,P<0.01],but increase the level of Caspase-8[(0.96±0.05)vs(0.75±0.05),t= 5.351,P<0.01]compared with CIC group.ConclusionNecroptosis induced by RIP3 may play an important role in stretch injury model of HT-22 cells,what’s more,GSK’872 could reduce the degree of injury after CIC,which reveals that RIP3 may be a new targetfor clinicaltreatmentof TBIin the future.
Traumatic brain injury; Stretch injury; Necroptosis; Receptor-interacting protein 3;GSK’872;HT-22 cells
2017-05-05)
10.3877/cma.j.issn.2095-9141.2017.03.008
国家自然科学基金项目(31200809);武警部队后勤科研项目(WJHQ2012-20);军队技术产品研究重大项目(AWS15J001);天津市科技计划项目(15ZXLCSY00040)
300162 天津,武警后勤学院附属医院脑科医院1;100621 北京,北京武警总队三支队卫生队2
程世翔,Email:shixiangcheng@vip.126.com
