基于花生四烯酸代谢通路研究水飞蓟素对脂多糖诱导炎症模型影响
2017-06-15麦旦提
麦旦提, 杨 婵, 薛 芸, 王 彦, 阎 超
(上海交通大学药学院, 上海 200210)
研究论文
基于花生四烯酸代谢通路研究水飞蓟素对脂多糖诱导炎症模型影响
麦旦提, 杨 婵, 薛 芸, 王 彦*, 阎 超*
(上海交通大学药学院, 上海 200210)
以脂多糖类似物(KLA)诱导的RAW264.7细胞为研究对象,采用代谢组学研究手段,研究水飞蓟素对脂多糖诱导炎症模型中花生四烯酸代谢通路的影响。以超高效液相色谱-三重四极杆质谱联用为平台,对不同浓度水飞蓟素作用下KLA诱导RAW264.7炎症细胞分泌的类二十烷酸代谢物进行定量分析,通过考察主成分分析(PCA)、正交偏最小二乘法判别分析(OPLS-DA)的VIP值和Kruskal-Wallis秩和检验结果显著性差异(P)值筛选代谢标记物。建立了59种类二十烷酸(含15种同位素内标)在5 min内实现快速分离的液相色谱-质谱联用方法;确定了细胞存活率在58%~80%的水飞蓟素浓度为50~150 μmol/L;筛选出数据处理结果同时满足变异权重参数(VIP)值>1且结果P值<0.05的类二十烷酸代谢标记物12-OxoLeukotriene B4(12-OxoLTB4);通过分析柱状图和炎症信号通路,确定水飞蓟素借助其抗氧自由基特性发挥抗炎作用,通过抑制脂氧合酶-5 (5-LOX)的活性及阻断5-LOX代谢通路中产生氧自由基的脂质过氧化反应来减少氧自由基及过氧化物的形成。综上所述,所建立的方法能快速准确地定量分析多种类二十烷酸,并从代谢组学角度解释了水飞蓟素的抗炎机制。
超高效液相色谱-串联质谱;类二十烷酸;同位素内标;水飞蓟素;代谢组学;炎症
炎症是人类多种疾病中最常见的一种病理过程,在机体的任何部位和任何组织均有可能发生,而花生四烯酸代谢网络是产生炎症介质的主要网络。类二十烷酸(eicosanoids),也称类花生酸,是一大类由二十碳的多不饱和脂肪酸氧化产生的具有生物活性的物质。类二十烷酸是体内重要的炎症因子,参与机体免疫及炎症反应过程,并在许多疾病的病理生理过程中起着重要的作用。
中药因其具有抗炎效果好、不良反应少、来源丰富等优势,在抗炎药物的开发中越来越受到人们的重视。水飞蓟(SilybummarianumL. Gaertn.)原产于南欧、北非[1],在欧洲是一种民间草药,用于肝胆疾病的治疗,并已成为世界各国使用的保肝植物药。水飞蓟素(silymarin, Sily)是从水飞蓟种子中提取的一种黄酮木脂素类化合物,是一种淡黄色粉末状物质,主要活性成分有水飞蓟宾(silybin)、异水飞蓟(isosilybin)、水飞蓟宁(silydianin)、水飞蓟亭(silychristin)。其中,以水飞蓟宾含量最高,活性也最强,具有保肝利胆、抗脂质过氧化、清除自由基、抗辐射、抗肿瘤、降血脂和抗胃溃疡等药理学效应[2]。此外水飞蓟素还具有抗炎和免疫调节作用。Fiebrich和Koch[3]报道了水飞蓟素的抗炎作用源于其抗氧自由基的作用,另外还有研究[4]采用动物实验证明了水飞蓟素可以通过抑制脂氧合酶-5 (5-LOX)通路的过氧化酶的活性发挥抗炎作用。
类二十烷酸的分析方法有酶免疫分析法、液相色谱分析法、色谱-质谱联用分析法等。三重四极杆质谱仪是类二十烷酸定量分析最常用的分析仪器,具有很好的灵敏度和专属性[5]。由于类二十烷酸的结构中存在一个羧基,在质谱电离过程中易带负电,因此,在液相色谱-质谱的联用分析中,通常选用负离子模式。三重四极杆质谱具有强大的定量能力,其多反应监测(multiple reaction monitoring, MRM)的采集模式通过选择性地采集母离子(precursor ion)和相对应的特征子离子(product ion),可以对共流出的不同种类的类二十烷酸和同分异构的类二十烷酸进行选择性检测[6]。故本次实验采用超高效液相色谱-三重四极杆质谱(UPLC-MS/MS)测定类二十烷酸。
脂质组学的概念于2003年首次被提出,它作为代谢组学的一个分支对所有脂类物质进行系统研究[7,8]。脂肪酸是脂质的一个重要组成部分,脂肪酸及其氧化代谢物(类二十烷酸)参与生命体内的多种生理调节过程。而组学作为一种系统的研究方法,能直接反映体内生物化学过程和状态变化[9],因此,针对炎症的研究,从组学角度对脂肪酸及其氧化代谢产物类二十烷酸进行研究,能直接反映并且更准确地解释抗炎成分在炎症中的作用机制,有助于对炎症发生、发展、治愈的认识。目前还没有从代谢组学的角度去解释和验证水飞蓟素抗炎作用的研究。本研究基于超高效液相色谱-三重四极杆质谱平台,优化质谱参数,建立了针对59种花生四烯酸代表性代谢物的定量分析方法;以Kdo2-Lipid A诱导下的RAW264.7细胞炎症模型为研究对象,优化中药活性作用炎症模型浓度,并采用目标组学方法,研究水飞蓟素影响脂多糖诱导炎症模型细胞中类二十烷酸的代谢变化,阐述水飞蓟素活性成分的抗炎活性作用机制。
1 实验部分
1.1 仪器与试剂
超高效液相色谱-三重四极杆质谱系统(ACQUITYTMUPLC,美国沃特世公司;SCIEX Triple QuadTM5500 System,美国爱博才思公司),低速离心机(上海安亭科学仪器厂), REACTI-THERM III氮气吹干仪(赛默飞世尔科技有限公司), SHB-III循环水式多用真空泵(郑州长城科工贸有限公司), SPE真空抽滤装置(德国CNW科技公司),倒置显微镜(奥林巴斯有限公司), CO2培养箱(赛默飞世尔科技有限公司), Costar六孔板培养皿和100 mm×20 mm培养皿(康宁公司),Strata-X固相萃取柱(美国菲罗门科学仪器有限公司)。
44种类二十烷酸及15种氘代类二十烷酸标准品均购自美国艾美捷公司,色谱级甲醇和乙腈购自德国默克化工,色谱级异丙醇、无水乙醇和乙酸购自德国CNW科技公司。水飞蓟素购自上海源叶生物科技有限公司(纯度≥80%, 批号65666-07-1)。胎牛血清(fetal bovine serum, FBS)、Gibco无酚红细胞培养基(Dulbecco’s Modified Eagle Medium, DMEM)、双抗(青霉素-链霉素)、磷酸盐缓冲液(PBS)购自赛默飞世尔科技有限公司,RAW264.7细胞购自中国科学院上海细胞库。
1.2 建立脂多糖类似物(KLA)诱导的炎症模型及水飞蓟素干预RAW264.7细胞的浓度筛选
使用含10%(v/v)FBS的DMEM高糖培养基,在37 ℃、5%(v/v) CO2培养箱中培养RAW264.7细胞。将处于对数生长期的细胞转入96孔板中,使每孔中的细胞数为1×104,待细胞贴壁后,分为正常组、炎症组、药物处理组5组,每组设置5个复孔。药物处理组加入不同浓度的含药培养基使其总体积达到100 μL,正常组和炎症组加入等体积空白培养基,1 h后,除正常组外,其他组均加入KLA致炎,终质量浓度为100 ng/mL,加药组的水飞蓟素终浓度分别为20、50、100、150、200 μmol/L。经过药物刺激24 h后,再在每孔中加入20 μL 5 mg/mL的四甲基偶氮唑盐(MTT)的PBS溶液,继续置于CO2培养箱中培养4 h。培养结束后,用2 mL的针头小心弃去孔板中的上清液,再在每孔中加入150 μL二甲基亚砜(dimethylsulfoxide, DMSO)充分振荡,溶解沉积在细胞中的蓝紫色结晶甲瓒(formazan),使用多功能酶标仪测定490 nm处的光密度(吸光度,OD值)。
1.3 水飞蓟素干预下的KLA诱导RAW264.7细胞中类二十烷酸的代谢分析
将处于对数生长期的细胞转入六孔板中,使每孔中的细胞数为5×105,待细胞贴壁后,分为正常组、炎症组、低浓度药物处理组、中浓度药物处理组、高浓度药物处理组,每组设置3个复孔。药物处理组加入不同浓度的含药培养基使其总体积达到2 mL,正常组和炎症组加入等体积空白培养基,放置在5% CO2、37 ℃恒温培养箱中培养,1 h后,除正常组外,其他组均加入KLA致炎,使终质量浓度为100 ng/mL,正常组加入等量磷酸盐缓冲液,此时加药组中水飞蓟素的终浓度为50、100和150 μmol/L。将以上各组样品放置在5% CO2、37 ℃恒温培养箱中继续培养24 h。
1.4 细胞培养基中类二十烷酸的提取方法
药物作用结束后,吸取细胞培养基,以800 r/min低速离心5 min,以去除培养基中的细胞残骸。吸取上清液,加入100 μL 0.1 ng/μL氘代类二十烷酸标准溶液,涡旋混匀后进行固相萃取。RAW264.7细胞用磷酸盐缓冲液清洗两遍,吹打,进行细胞计数。
固相萃取:分别使用3 mL甲醇和3 mL水对Strata-X固相萃取柱进行清洗和预平衡。上样后,加入2 mL 10%(v/v)的甲醇水溶液进行洗涤,以去除杂质,最后,使用1 mL甲醇对固相萃取柱上的类二十烷酸进行洗脱。收集洗脱液,氮气吹干,并用100 μL流动相A相复溶后进行UPLC-MS/MS分析。
1.5 UPLC-MS/MS条件
UPLC条件 ACQUITY UPLC BEH Shield RP18柱(100 mm×2.1 mm, 1.7 μm);流动相A相为乙腈-水-乙酸(60∶40∶0.02, v/v/v),流动相B相为乙腈-异丙醇(50∶50, v/v);柱温40 ℃;流速0.4 mL/min。洗脱梯度:0~0.7 min, 0.1%B~20%B; 0.7~4.0 min, 20%B~55%B; 4.0~4.5 min, 55%B~99%B; 4.5~5.0 min, 99%B。进样量10 μL。
质谱条件 电喷雾离子源(ESI);负离子模式扫描;MRM模式监测;气帘气(CUR)压力、雾化气(GS1)压力和辅助气(GS2)压力分别为172.4、310.3和310.3 kPa,离子源电压为-4.5 kV,离子源温度为550 ℃,射入电压(EP)为-10 V,碰撞室射出电压(CXP)为-20 V。
1.6 类二十烷酸混合标准溶液的配制
取适量类二十烷酸标准品配制为2.5 ng/μL类二十烷酸的混合标准储备液。取不同量混合标准储备液,加入不同体积无水乙醇稀释到60 μL,类二十烷酸质量梯度分别为0.005、0.015、0.025、0.035、0.05、0.15、0.25、0.35、0.5、1.5、2.5、3.5、5.0 ng,并分别加入10 μL 0.1 ng/μL的氘代类二十烷酸混合标准溶液作为内标。
1.7 定量分析方法
类二十烷酸定量分析方法采用内标法,并使用氘代类二十烷酸标准品作为内标。以类二十烷酸标准品与其对应的氘代内标的峰面积比值和类二十烷酸标准品含量进行线性回归,得到线性回归方程,用于后续样品中类二十烷酸浓度的计算。定量下限为标准曲线的最低点,在本研究建立的类二十烷酸定量分析方法中,定量下限应使信噪比(S/N)大于7[10]。
1.8 数据处理
将UPLC-MS/MS分析获得的原始数据通过Analyst 1.6.2软件进行峰识别和峰面积积分,并进行手动积分校正,得到类二十烷酸及其氘代内标的峰面积比值,再利用标准曲线计算得到不同药物浓度处理组、炎症组和正常组的RAW264.7细胞培养基中类二十烷酸的含量。
将新数据表导入SIMCA-P 13.0 (Umetrics, Sweden)进行多元统计变量分析。新数据进行主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)。在OPLS-DA分析中,花生四烯酸代谢产物含量的变异权重参数(VIP)>1的变量对不同实验组的分离有影响。此外,通过SPSS软件(版本IBM 20.0)的Kruskal-Wallis秩和检验来确定代谢物差异在单因素分析水平上是否存在显著性差异(P<0.05)。由VIP>1和P<0.05获得不同实验组类二十烷酸的代谢标记物。
2 结果与讨论
2.1 类二十烷酸的定量分析方法的建立
2.1.1 类二十烷酸
类二十烷酸可由omega-3多不饱和脂肪酸和omega-6多不饱和脂肪酸氧化生成。例如,多不饱和脂肪酸经环氧合酶(cyclooxygenase, COX)氧化可生成前列腺素(prostaglandins, PGs)和血栓烷素类(thromboxane, TXs),经LOX氧化可生成白三烯(leukotrienes, LTs),经细胞色素P450(cytochrome P450, CYP)氧化可生成羟基二十碳四烯酸类(hydroxyeicosatetraenoic acids, HETEs),经非酶途径氧化可生成异构的前列腺素(iso-PGs)。而以上类别的类二十烷酸在生命体内发挥着重要作用,是重要的炎症因子,在炎症发生时,参与多种抗炎和促炎反应。
为了全面完整地阐述水飞蓟素的抗炎机理,选择了不同氧化途经、不同类别的类二十烷酸共44种,以期覆盖较多的类二十烷酸代谢途径。44种类二十烷酸及15种氘代类二十烷酸标准品氧化途径等见表1。
2.1.2 内标的选择
本实验选择同位素稀释定量法[11]对类二十烷酸进行定量分析,选择氘代类二十烷酸作为内标是类二十烷酸分析方法建立的一个关键部分。氘代的类二十烷酸和其对应的类二十烷酸具有相似的结构,在色谱柱上保留时间相近,但其母离子和/或子离子质荷比并不相同,是内标的最佳选择。由于部分类二十烷酸并无商品化的氘代对照品,本研究选择与其具有相似结构的氘代类二十烷酸作为内标。例如,11-HETE目前没有商品化的氘代标准品,而(d8) 12-HETE的结构与11-HETE类似,因此选用(d8) 12-HETE作为11-HETE的内标。在本研究中,共选用15种氘代类二十烷酸作为44种类二十烷酸的内标。本研究所使用的类二十烷酸及其对应氘代内标见表1。
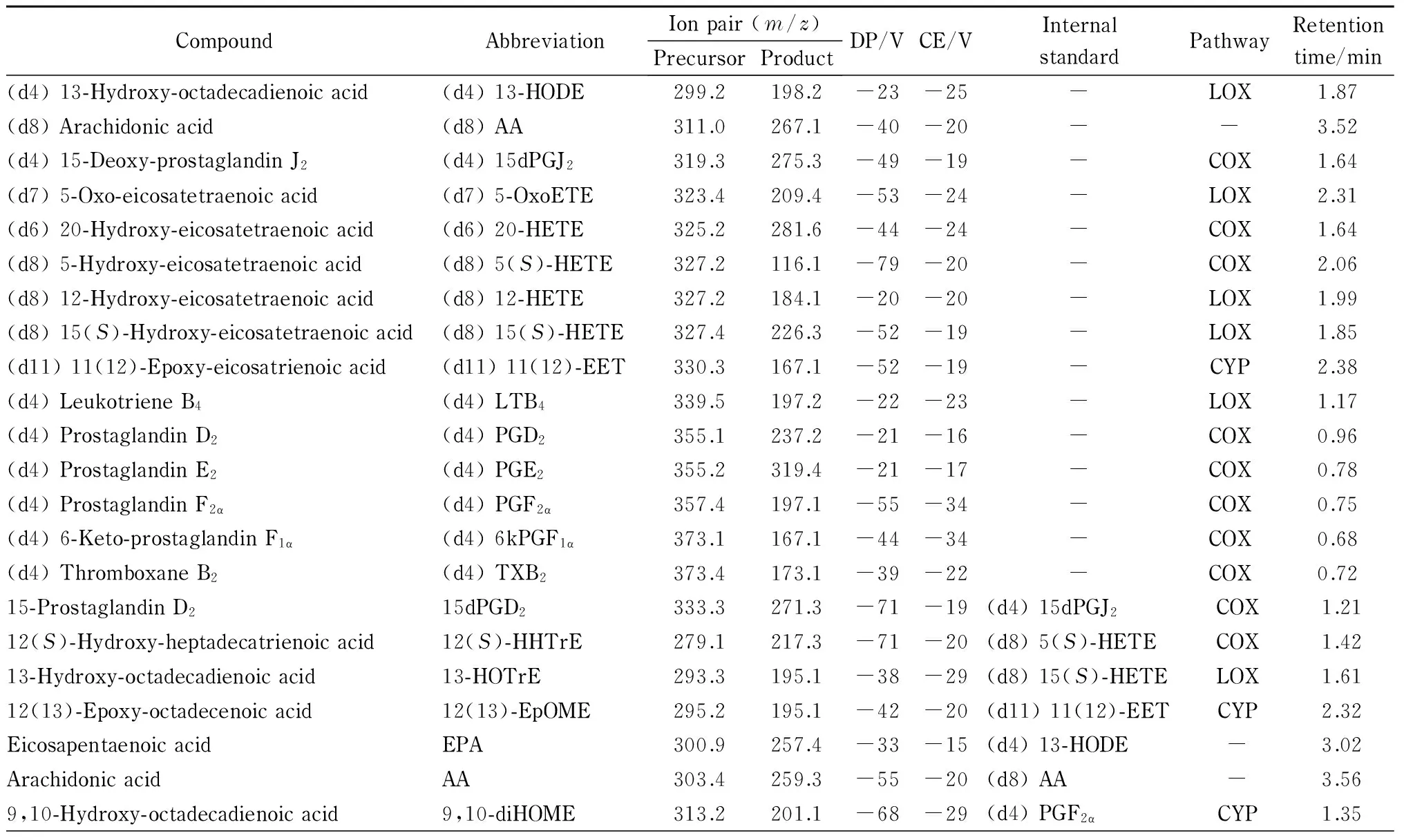
表 1 44种类二十烷酸及15种同位素内标的MRM离子对、优化参数、氧化途径及保留时间
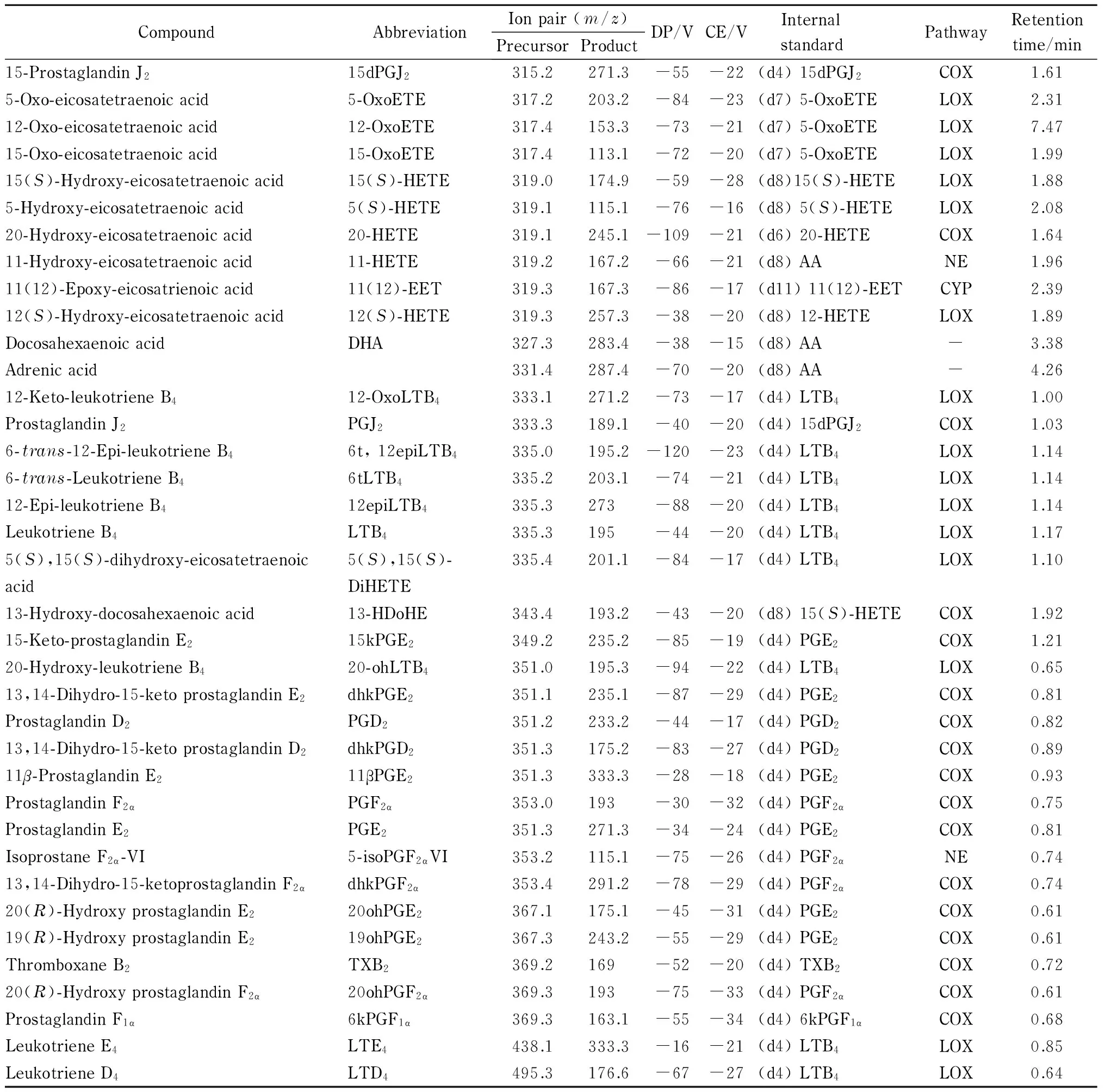
表 1 (续)
DP: declustering potential; CE: collision energy. LOX: lipoxygenase; COX: cyclooxygenase; CYP: cytochrome P450; NE: non-enzymatic; -: no pathway.
2.1.3 质谱参数的优化
精密吸取适量类二十烷酸标准溶液和氘代类二十烷酸标准溶液,在MS Q1 模式下选择母离子,在product MS2 模式下,选择合适的碎片离子作为特征子离子,并通过优化解簇电压(DP),碰撞能量(CE),使特征子离子和母离子的响应值比约为2:1,确定了44种类二十烷酸及15种氘代类二十烷酸的母离子,特征子离子及其优化后的DP、CE见表1。其中,一个类二十烷酸的母离子存在许多子离子,选择的特征子离子应该能与其他共流出的类二十烷酸区分且响应值至少是母离子响应值的2倍。
由于共流出的类二十烷酸的MRM离子对(母离子和特征子离子)并不相同,而MRM离子对相同的类二十烷酸的色谱保留时间不相同(59种类二十烷酸的保留时间见表1),因此,结合编程的多反应监测(scheduled multiple reaction monitoring, sMRM)的智能优化和UPLC的高分离度,可以提高类二十烷酸的选择性,可以较好地区分共流出的类二十烷酸和MRM离子对相同的类二十烷酸,实现类二十烷酸分析的高选择性和高灵敏度。在本研究中,每一种MRM离子对保留时间的驻留时间窗口设置为30 s。
在1.5节条件下,59种类二十烷酸在5 min内达到较好的分离,且具有较优的峰形(见图1)。
2.1.4 方法学验证
线性关系和定量下限 实验结果表明,39种类二十烷酸的线性相关系数(R2)均大于0.99,说明39种类二十烷酸在该浓度范围内的线性关系良好。除花生四烯酸和PGJ2外,类二十烷酸的定量下限均为5 pg,说明该方法具有较好的灵敏度。花生四烯酸和PGJ2的定量下限为15 pg。这可能与花生四烯酸和PGJ2的电离效率有关。类二十烷酸的线性范围均为0.005~5 ng,定量下限及相关系数见表2。

图 1 59种类二十烷酸标准品的提取离子流图Fig. 1 Extracted ion chromatograms of a mixture of 59 eicosanoid standards
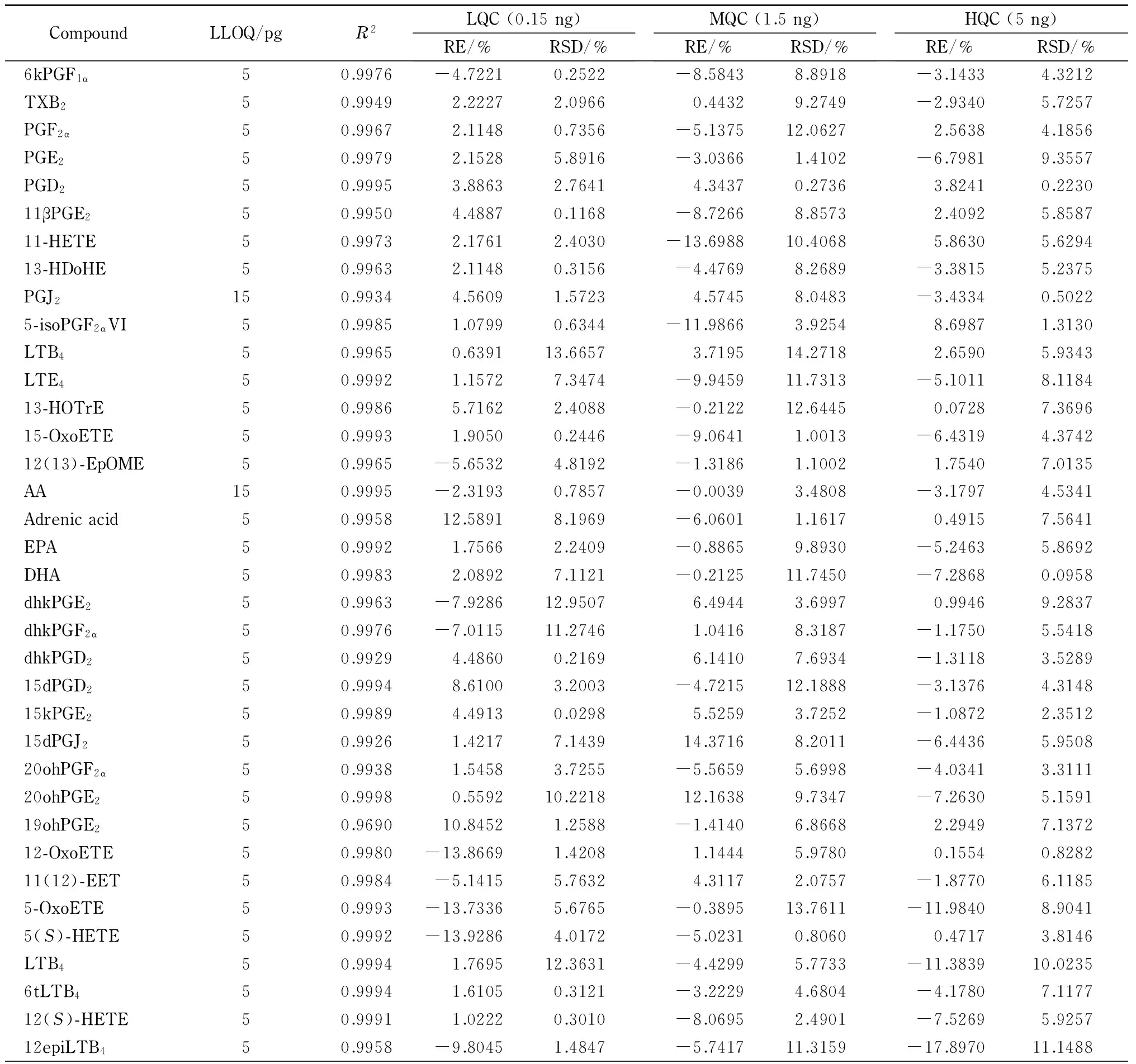
CompoundLLOQ/pgR2LQC(0.15ng)RE/%RSD/%MQC(1.5ng)RE/%RSD/%HQC(5ng)RE/%RSD/%6kPGF1α50.9976-4.72210.2522-8.58438.8918-3.14334.3212TXB250.99492.22272.09660.44329.2749-2.93405.7257PGF2α50.99672.11480.7356-5.137512.06272.56384.1856PGE250.99792.15285.8916-3.03661.4102-6.79819.3557PGD250.99953.88632.76414.34370.27363.82410.223011βPGE250.99504.48870.1168-8.72668.85732.40925.858711-HETE50.99732.17612.4030-13.698810.40685.86305.629413-HDoHE50.99632.11480.3156-4.47698.2689-3.38155.2375PGJ2150.99344.56091.57234.57458.0483-3.43340.50225-isoPGF2αVI50.99851.07990.6344-11.98663.92548.69871.3130LTB450.99650.639113.66573.719514.27182.65905.9343LTE450.99921.15727.3474-9.945911.7313-5.10118.118413-HOTrE50.99865.71622.4088-0.212212.64450.07287.369615-OxoETE50.99931.90500.2446-9.06411.0013-6.43194.374212(13)-EpOME50.9965-5.65324.8192-1.31861.10021.75407.0135AA150.9995-2.31930.7857-0.00393.4808-3.17974.5341Adrenicacid50.995812.58918.1969-6.06011.16170.49157.5641EPA50.99921.75662.2409-0.88659.8930-5.24635.8692DHA50.99832.08927.1121-0.212511.7450-7.28680.0958dhkPGE250.9963-7.928612.95076.49443.69970.99469.2837dhkPGF2α50.9976-7.011511.27461.04168.3187-1.17505.5418dhkPGD250.99294.48600.21696.14107.6934-1.31183.528915dPGD250.99948.61003.2003-4.721512.1888-3.13764.314815kPGE250.99894.49130.02985.52593.7252-1.08722.351215dPGJ250.99261.42177.143914.37168.2011-6.44365.950820ohPGF2α50.99381.54583.7255-5.56595.6998-4.03413.311120ohPGE250.99980.559210.221812.16389.7347-7.26305.159119ohPGE250.969010.84521.2588-1.41406.86682.29497.137212-OxoETE50.9980-13.86691.42081.14445.97800.15540.828211(12)-EET50.9984-5.14155.76324.31172.0757-1.87706.11855-OxoETE50.9993-13.73365.6765-0.389513.7611-11.98408.90415(S)-HETE50.9992-13.92864.0172-5.02310.80600.47173.8146LTB450.99941.769512.3631-4.42995.7733-11.383910.02356tLTB450.99941.61050.3121-3.22294.6804-4.17807.117712(S)-HETE50.99911.02220.3010-8.06952.4901-7.52695.925712epiLTB450.9958-9.80451.4847-5.741711.3159-17.897011.1488
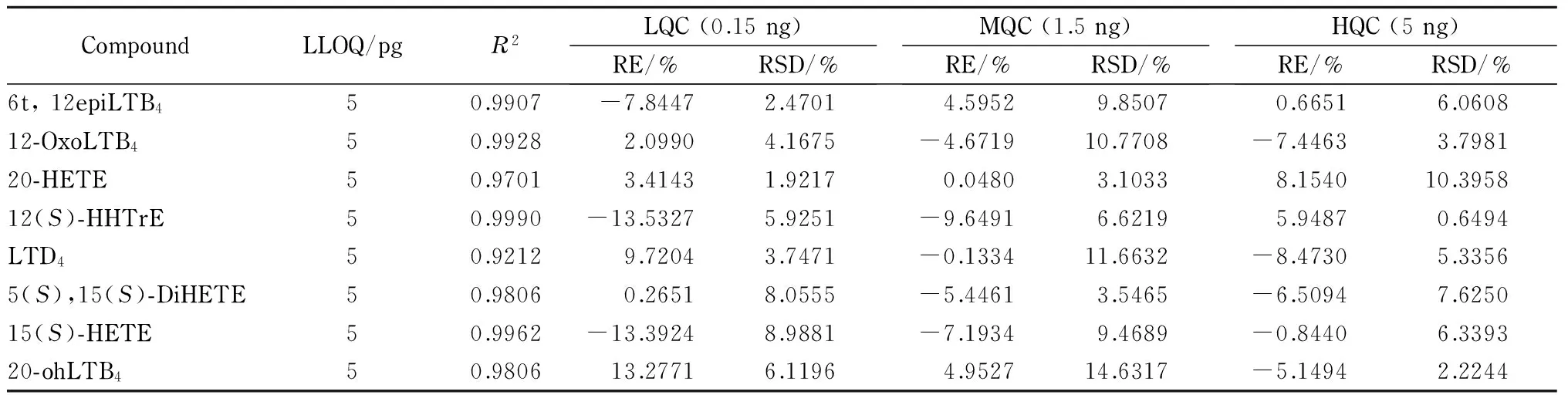
表 2 (续)
准确度和精密度 在1.5节条件下,对类二十烷酸高、中、低3个水平的质控样品进行精密度和准确度分析,结果见表2。对于低水平(0. 15 ng)和中水平(1.5 ng)质控样品,衡量准确度的相对偏差(RE)和衡量精密度的相对标准偏差(RSD)[10]均不超过±15%;对于高水平质控样品(5 ng),除5-OxoETE和12epiLTB4的RE外,其他类二十烷酸的RE和RSD均不超过±10%,均符合要求,这说明该方法具有良好的准确度和精密度。
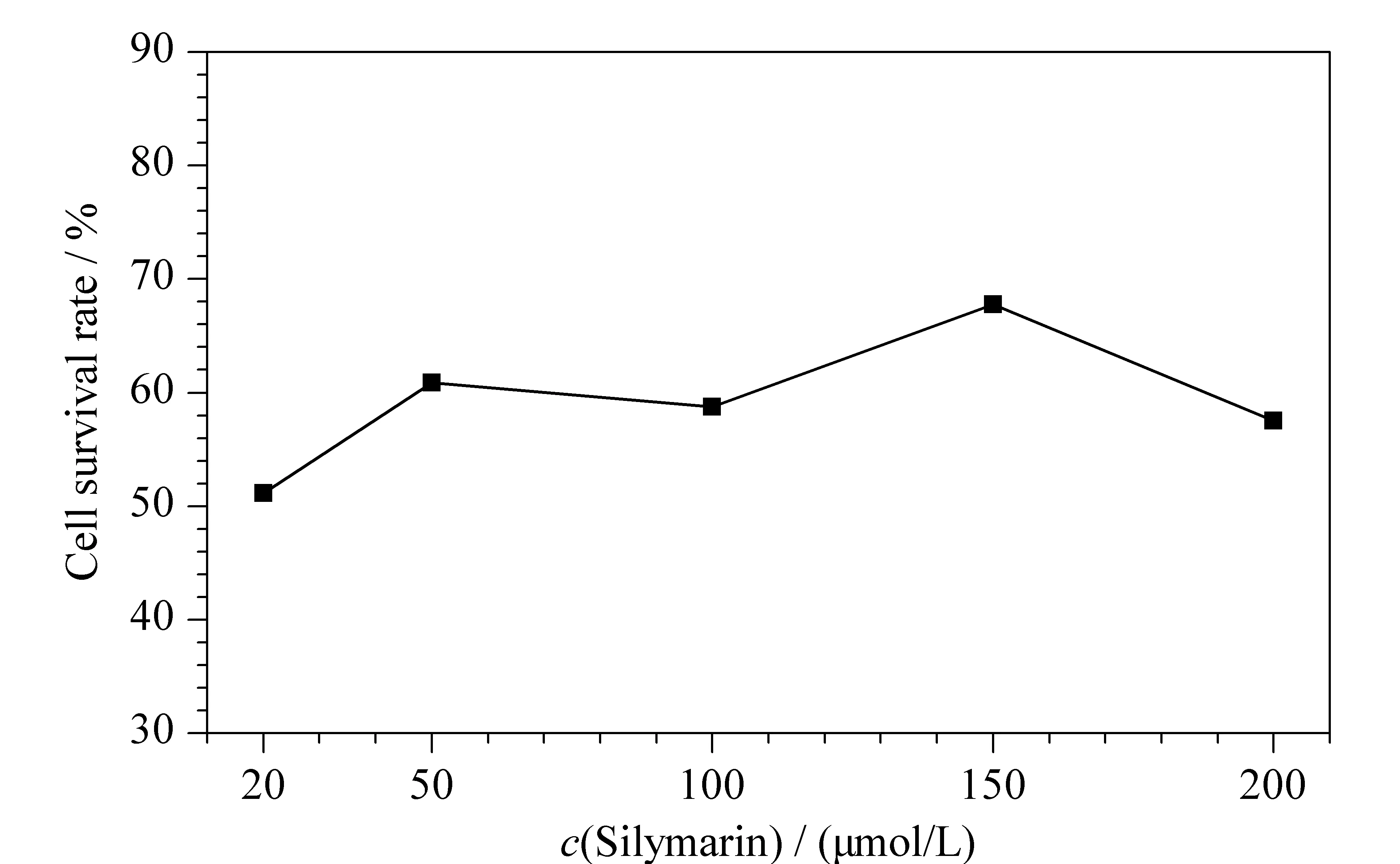
图 2 不同浓度的水飞蓟素对KLA诱导炎症细胞生存率的影响(n=5)Fig. 2 Effect of different concentrations of silymarin on KLA induced inflammation cell survival rate (n=5)
2.2 水飞蓟素作用KLA诱导RAW264.7炎症模型浓度范围的筛选
为寻找合适的抗炎活性成分对KLA诱导RAW264.7炎症模型作用的加药浓度,本研究采用MTT考察了不同浓度的水飞蓟素对RAW264.7细胞存活率的影响。图2为不同浓度水飞蓟素对KLA诱导炎症细胞生存率的影响,观察可知初选的5个浓度水平下细胞存活率曲线都处在高存活率范围且曲线平滑,故水飞蓟素后续实验所需的药物浓度范围可以直接从预实验设置的浓度中选择,最终确定水飞蓟素使细胞存活率为58%~80%的浓度为50、100和150 μmol/L。另外,根据MTT比色实验结果,也可推测水飞蓟素对炎症细胞作用温和,且具有一定的保护作用,所以即使其浓度升高,细胞存活率也没有明显下降,这也从侧面说明了水飞蓟素的抗炎活性。
2.3 不同浓度水飞蓟素干预下的KLA诱导RAW264.7细胞中类二十烷酸的代谢分析
因为本研究所测定的是KLA作用24 h后的RAW264.7细胞培养基中的类二十烷酸,PGs及其下游代谢产物是AA在炎症中的重要代谢物,根据Buczynski等[12]的研究,PGs及其下游代谢产物在KLA刺激24 h后的细胞内含量极低,绝大部分分泌至细胞培养基中,故本研究主要对RAW264.7细胞培养基中的类二十烷酸进行相关分析研究。
基于UPLC-MS/MS分析方法,得到水飞蓟素处理组、炎症组和正常组的RAW264.7细胞中类二十烷酸浓度的多元统计变量分析结果,图3a、3b为PCA-X及OPLS-DA的结果,200次响应排序检验结果(response permutation testing, RPT)图略。
图3a分别显示了水飞蓟素5组样本的UPLC-MS/MS数据经过PCA降维后的得分图。说明每类分组中组内样本的类二十烷酸的水平比较相近。为了进一步消除非疾病因素及其他潜在随机误差带来的影响,故对PCA-X得分图进行正交滤噪处理,获取OPLS-DA得分图(图3b),这样可对各个实验进行最优化区分,凸显其差异性,模型验证特异性与敏感性较高[13]。从图3中可以清楚地看到水飞蓟素的炎症组、低浓度药物处理组、中浓度药物处理组、高浓度药物处理组、正常组得到了更好的分离,并且可以观察到随着炎症组、低浓度药物处理组、中浓度药物处理组、高浓度药物处理组、正常组的变化,整体有向右迁移的趋势。另外,各个模型都具有较好的预测能力及总体变化解释能力。同时,200次排序响应的结果显示:R2(CUM)=(0.0,0.533),Q2(CUM)=(0.0,-0.192),均小于原始值,且Q2(CUM)回归直线与Y轴截距<0,进一步验证各模型是有效、可信的。
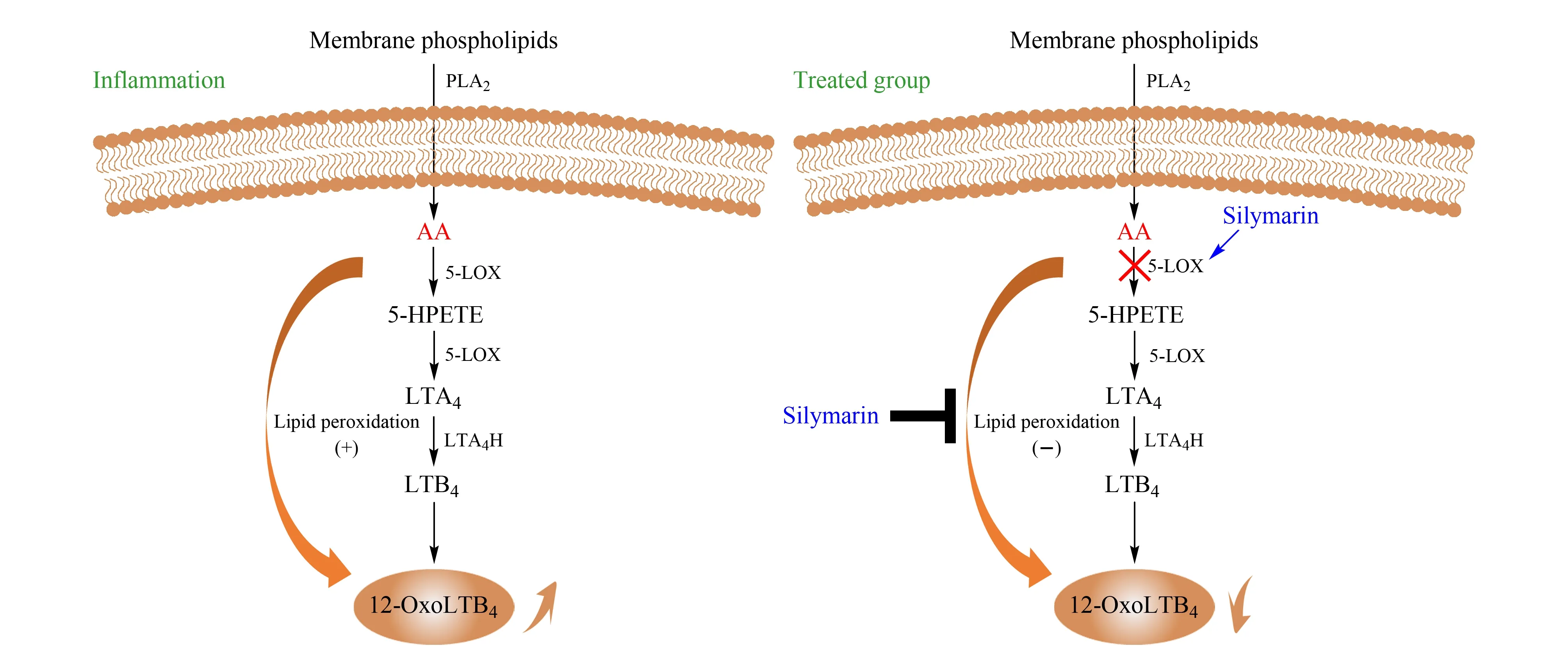
图 5 炎症状态以及水飞蓟素干预后AA的LOX代谢通路变化Fig. 5 Changes of arachidonic acid metabolic LOX pathways between inflammation and treated by silymarin 5-HPETE: 5-hydroperoxy-eicosatetraenoic acid.
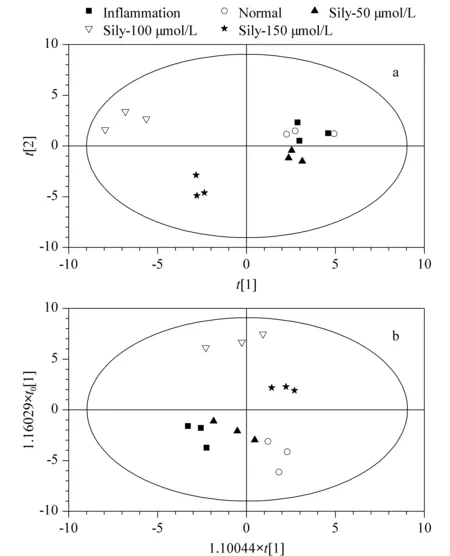
图 3 不同浓度水飞蓟素干预下的多元统计变量分析结果Fig. 3 Multivariate statistical variables analysis results under different concentrations of silymarin (Sily) intervention a. principle component analysis (PCA)-X model; b. orthogonal partial least squares-discriminant analysis (OPLS-DA) model.
选择OPLS-DA分析中VIP大于1的差异变量,并结合单维统计分析(秩和检验),将VIP>1且P< 0.05的代谢物作为炎症组、药物处理组、正常组的代谢标记物,得到一种类二十烷酸代谢标记物12-OxoLTB4。从花生四烯酸的代谢通路来看,代谢标记物12-OxoLTB4可以归于5-LOX通路,可以结合代谢通路及差异代谢物12-OxoLTB4解释水飞蓟素的抗炎机制。
2.4 水飞蓟素关键差异代谢物的生物学意义阐释
为了更加方便地表示代谢标记物的含量变化,水飞蓟素影响下代谢标记物12-OxoLTB4的柱状图见图4。代谢物12-OxoLTB4在炎症组的含量高于其他组,在加药组Silymarin-50 μmol/L组、Silymarin-100 μmol/L组和Silymarin-150 μmol/L组中的含量逐渐降低。
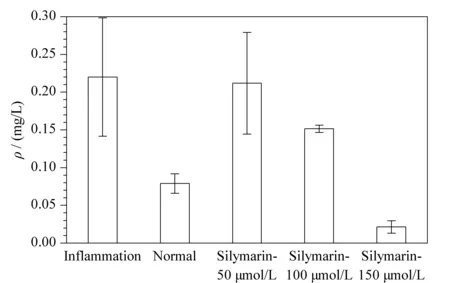
图 4 12-OxoLTB4在水飞蓟素干预下不同组别间的质量浓度变化(n=3)Fig. 4 Mass concentration changes of 12-OxoLTB4between different groups under silymarin intervention (n=3)
为了更直观地表现炎症状态下及水飞蓟素干预下LOX代谢通路的变化,绘制了水飞蓟素对LOX代谢通路的影响,见图5。从代谢差异物12-OxoLTB4的柱状图分析中得知,处于炎症状态时,代谢物12-OxoLTB4的含量升高。原因可从5-LOX代谢通路解释。首先,图5展示了AA在5-LOX通路上的代谢过程,在5-LOX的双加氧作用下,AA可被催化氧化为5-羟过氧化二十碳四烯酸(5-hydroperoxy-eicosatetraenoic acid, 5-HPETE),随后转化成5-HETE或进一步被氧化形成不稳定的环氧化物白三烯A4(leukotriene A4, LTA4),然后LTA4可以转化成LTB4, LTB4再转化为12-OxoLTB4。5-LOX在细胞静息状态时表达很少,而受到外部刺激时被活化[14], 从而促进环氧化物LTA4的合成,12-OxoLTB4为LTs的下游代谢产物,所以这可能是12-OxoLTB4的含量在炎症时升高的原因。
另外,在炎症发生时,会产生活性氧自由基,这些氧自由基不仅能增加血管的通透性,而且会攻击生物膜磷脂中的多聚不饱和脂肪酸,引起脂质过氧化,造成生物膜损伤[15]。AA在5-LOX的作用下,通过双加氧作用,产生性质较活泼的脂质过氧化自由基和脂质过氧化物。脂质过氧化物可进一步代谢为白三烯、羟基脂肪酸、脂氧素等具有生物活性的物质。这些物质在炎症过程中起重要作用[16]。
水飞蓟素为抗氧自由基活性物质,其抗脂质过氧化的作用已经被实验证实,故可以认为其抗炎作用源于抗氧自由基[17]。Gupta等[4]研究证实水飞蓟素可以通过抑制5-LOX的活性发挥抗炎及抗关节炎作用;文献[4]还提到Baumann等认为水飞蓟素可以在AA的LOX代谢通路的许多步骤中发挥清除自由基的功能,故可以总结如下:水飞蓟素通过抑制5-LOX酶的活性及阻断5-LOX代谢通路中产生氧自由基的脂质过氧化反应来减少氧自由基及过氧化物的形成,从而发挥抗炎作用,因此其抗炎作用源于其抗氧自由基性质。
3 结论
本实验建立了59种类二十烷酸在5 min内实现快速分离的LC-MS/MS方法,并利用该定量分析方法和多变量数据分析手段,研究了不同浓度水飞蓟素干预下KLA诱导的RAW264.7细胞炎症模型的代谢组学,得到一种类二十烷酸标记物12-OxoLTB4;通过柱状图分析,结合炎症信号通路,确定水飞蓟素借助其抗氧自由基特性发挥抗炎作用。本实验从组学角度对脂肪酸及其氧化代谢产物进行研究,能更准确地解释其在疾病中的作用机制,有助于疾病的诊断和治疗。
[1] Dong Y, Kong C Y. Chinese Traditional Patent Medicine, 2010, 32(7): 1225
董岩, 孔春燕. 中成药, 2010, 32(7): 1225
[2] Liu H L. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2008, 17(7): 23
刘洪玲. 中国民族民间医药, 2008, 17(7): 23
[3] Fiebrich F, Koch H. Experientia, 1979, 35(12): 1548
[4] Gupta O P, Sing S, Bani S, et al. Phytomedicine, 2000, 7(1): 21
[5] Yang C, Mai D T, Pan Z M, et al. Chinese Journal of Chromatography, 2016, 34(5): 449
杨婵, 麦旦提, 潘喆敏, 等. 色谱, 2016, 34(5): 449
[6] Masoodi M, Nicolaou A. Rapid Commun Mass Spectrom, 2006, 20(20): 3023
[7] Zehethofer N, Pinto D M. Anal Chim Acta, 2008, 627(1): 62
[8] Han X, Gross R W. J Lipid Res, 2003, 44(6): 1071
[9] US Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Veterinary Medicine (CVM). Federal Register, 2001, 66(4): 206
[10] Hang T J. Pharmaceutical Analysis. 8th ed. Beijing: People’s Medical Publishing House, 2011
杭太俊. 药物分析. 8版. 北京: 人民卫生出版社, 2011
[11] Dumlao D S, Buczynski M W, Norris P C, et al. Biochimica et Biophysica Acta, 2011, 1811(11): 724
[12] Buczynski M W, Stephens D L, Bowers-Gentry R C, et al. J Biol Chem, 2007, 282(31): 22834
[13] Yu Y, Cao Y, Chen Y M, et al. Chinese Journal of Chromatography, 2010, 28(7): 644
俞颖, 曹毅, 陈益民, 等. 色谱, 2010, 28(7): 644
[14] Lee J W, Mok H J, Lee D Y, et al. Int J Mol Sci, 2016, 17(4): 508
[15] Nie B, Yu C H, Wang F F, et al. Lishizhen Medicine and Materia Medica Research, 2008, 19(1): 65
聂犇, 余陈欢, 王芳芳, 等. 时珍国医国药, 2008, 19(1): 65
[16] Funk C D, Chen X S. Am J Respir Crit Care Med, 2000, 161: S120
[17] Wang F. [PhD Dissertation]. Hangzhou: Zhejiang University, 2006
汪峰. [博士学位论文]. 杭州: 浙江大学, 2006
Shanghai Science and Technology Commission Scientific Research Project (Nos. 15142200200, 16142200300); China Postdoctoral Science Fund (No. 2015M581628); Shanghai Introduction of Technology Absorption and Innovation (No. XC-ZXSJ-02-2016-11).
Investigation on silymarin impact on lipopolysaccharide induced inflammation model based on arachidonic acid metabolism pathway
MAI Danti, YANG Chan, XUE Yun, WANG Yan*, YAN Chao*
(SchoolofPharmacy,ShanghaiJiaoTongUniversity,Shanghai200210,China)
The objective of this research is to investigate the suppressive effect of silymarin on vitro cell culture model of inflammatory macrophage RAW264.7 induced by Kdo2-Lipid A, and explore its mechanism based on cell metabonomics. Ultra-high performance liquid chromatography coupled with tandem mass spectrometry (UPLC-MS/MS) method was used in the cell metabonomic assay to quantitative analysis of metabolites related to eicosanoids pathway. Then chemometric approaches such as principal component analysis were used to process the metabolic data. Within the established method, a total of 59 eicosanoids standards (containing 15 deuterated internal standards) were simultaneously separated in a single 5 min run, and the analytical method is proved to be rapid, sensitive and accurate. Whereafter, the metabolites with VIP>1 andPvalue<0.05 were considered as biomarkers. 12-OxoLeukotriene B4(12-OxoLTB4) was eventually identified as metabolic biomarkers of silymarin treatment group in this research, and according to the related inflammatory pathways, we speculated silymarin has anti-inflammatory activities by inhibiting the 5-lipoxygenase (5-LOX) activity and blocking lipid peroxidation in 5-LOX metabolic pathways to reduce the formation of peroxides and oxygen free radicals. This study provide a novel approach to the mechanism research on the silymarin treatment on RAW264.7 cells based on cell metabonomics.
ultra-high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); eicosanoids; deuterated internal standards; silymarin; metabonomics; inflammatory
10.3724/SP.J.1123.2017.01026
2017-01-20
上海市科委科研计划项目(15142200200,16142200300);中国博士后科学基金(2015M581628);上海市引进技术的吸收与创新专项(XC-ZXSJ-02-2016-11).
O658
A
1000-8713(2017)06-0578-09
* 通讯联系人.Tel:(021)34204833,E-mail:chaoyan@unimicrotech.com(阎超);Tel:(021)34205673,E-mail:wangyan11@sjtu.edu.cn(王彦).
