基于微流体脉冲驱动控制技术的电化学微流控芯片制备方法
2017-06-15杨利军朱丽陆宝春章维一
杨利军+朱丽+陆宝春+章维一

摘 要 基于微流体脉冲驱动控制技术搭建了电化学微流控芯片的制备系统。首先将纳米银墨水和甘油溶液分别微喷射到玻璃基底表面形成微电极图形和微流道液体阳模图形;然后分别进行烧结和聚二甲基硅氧烷(PDMS)模塑工艺制得微电极和微流道;最后将微电极和微流道键合形成电化学微流控芯片。研究了系统参量对液滴产生的影响以及液滴直径和重叠率对液滴成线的影响,制得的微电极最小线宽为45 μm、厚度为2.2 μm、电阻率为5.2 μΩ·cm,制得的微流道最小线宽为35 μm,流道表面光滑。采用制得的电化学微流控芯片进行了葡萄糖浓度的电化学流动检测。结果表明,葡萄糖溶液的浓度与响应电流具有较高的线性关系,可对一定浓度范围内的葡萄糖溶液进行定量检测。基于微流体脉冲驱动控制技术的电化学微流控芯片制备方法具有微喷射精度高、重复性好,制备系统结构简单、成本低廉等优点,可用于生化分析、生物传感器等领域的芯片制备。
关键词 电化学微流控芯片; 微电极; 微流道
1 引 言
近年来,随着微加工技术的发展,微流控芯片的集成化和微型化正成为越来越重要的研究方向[1~3]。电化学微流控芯片将微电极集成到芯片材料上,并将溶液中的待测组分转化为电信号,具有微型化、集成化、灵敏度高和消耗低等优点,在基础研究、疾病诊断、环境监测等领域有着广阔的应用前景[4~7]。
目前,电化学微流控芯片的制备方法主要是首先分别制备微电极芯片和微流道芯片,然后将两者通过键合工艺键合成电化学微流控芯片。其中,微电极芯片的制备方法主要有光刻腐蚀法、化学沉积法、印刷法等[8~11]。光刻腐蚀法在金属薄膜表面涂覆一层光刻胶,经光刻工艺去除微电极以外的光刻胶,并利用腐蚀工艺去除微电极以外的多余金属。然而光刻和腐蚀工艺成本较高、腐蚀一致性较差、边缘不够均匀。最早用于微流控芯片微流道加工的材料主要是各种玻璃和石英材料,近年来,PDMS等聚合物材料因其具有成本低、化学性质稳定等优点正逐渐成为制作微流道的主要材料。基于PDMS材料制备微流道的方法主要有精密机械加工法、掩模光刻法、激光直接成型法、脱蜡法等[12~15]。Koesdjojo等[15]采用精密机械加工法制作铝板凹槽,将高聚物材料浇铸于凹槽表面,将凹槽图样转化为凸起的阳模,再通过浇铸PDMS转印制得微流道。但这种方法需要精密加工设备,如机床刀具等。
微喷打印技术作为一种非接触的增材式制造技术,不仅可以实现微量流体的精确控制而提高制备精度,还能够减少工艺步骤和节约材料。Lee等[16]在PET薄膜表面打印制备了一层银薄膜,并利用脉冲激光器对烧结的区域进行照射,制得了线宽为20 μm的微电极。Kim等[17]采用压电式喷墨打印机在PDMS基底表面制备了尺寸为40~90 μm的微电极,并对微电极的制备性能进行了研究。Wu等[18]对PDMS表面进行改性以提高银的粘接性能,然后在PDMS材料表面采用喷墨打印法制备了微电极。Lu等[19]在硝酸纤维素膜(NC膜)上打印制作了石蜡图案,然后加热使石蜡渗入膜内形成亲疏水相间区域,通过提拉法制得了液体阳模,经倒模工艺制得PDMS微流道。上述制备微电极和微流道的方法结合了微喷打印、光刻、腐蚀和模塑等技术,制备过程较复杂,成本较高。制备过程中使用的商用打印机和激光器價格高昂,并且打印机的微喷嘴不易拆卸与维修,一旦喷嘴被堵,会造成较大的损失。
本研究基于微流体脉冲驱动控制技术[20],通过一种无内嵌微可动件、结构简单、以脉冲惯性力为主动力的微喷射系统,将纳米银墨水和甘油溶液分别微喷射到基底表面,形成微电极图形和液体阳模图形,分别经烧结和模塑、键合等工艺,制得电化学微流控芯片。本研究考察系统参量和制备参数对液滴成线的影响,制备了微电极和微流道,并利用制得的芯片对不同浓度的葡萄糖溶液进行了流动检测。
2 实验部分
2.1 实验材料与试剂
纳米银导电墨水(JET600C,昆山海斯电子有限公司,粘度30 cp);甘油溶液(70%, V/V, 粘度20 cp)、葡萄糖、壳聚糖、戊二醛、磷酸盐缓冲液(上海凌峰化学试剂有限公司);NaOH、HCl、乙烯基三乙氧基硅烷、甲醇(国药集团化学试剂有限公司); 葡萄糖氧化酶(上海金穗生物科技有限公司)。硼硅酸盐玻璃毛细管(600 μm × 100 mm)、石英毛细管(250 μm×50 mm,北京正天易科贸有限公司)。
2.2 实验方法
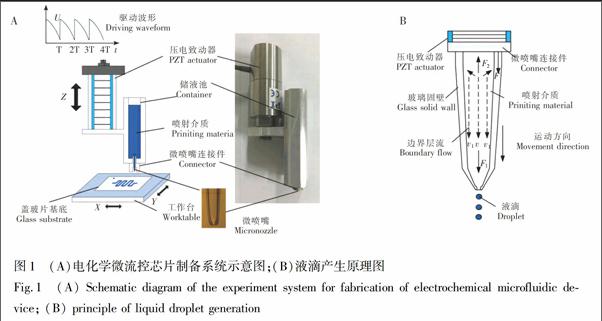
图1A为微流体脉冲驱动控制技术制备电化学微流控芯片的实验系统示意图,系统主要由压电驱动控制系统和三维运动工作台构成,其中,压电致动器和微喷嘴通过微喷嘴连接件和储液池连接在一起,储液池的容积远大于单个微喷嘴的容积,与单个微喷嘴构成的喷射结构相比,具有较高的稳定性,可以极大地提高系统的稳定喷射频率和制备效率,最大可提高到60 Hz[21]。微喷嘴由硼硅酸盐玻璃毛细管首先经拉针仪拉制,再由锻针仪截断并锻制至所需的出口内径。图1B为喷嘴内液滴产生的原理图,当施加图1A所示的驱动波形时,压电致动器周期性地伸长与收缩,并且变化量与电压幅值成正比。当压电致动器伸长时,玻璃固壁和喷嘴内的边界层流向前运动,微喷嘴内的液体在液体粘性力的作用下获得向前运动的速度v。当驱动电压迅速降至零时,压电致动器收缩,喷嘴内的液体获得脉冲惯性力F1,脉冲惯性力F1的大小随驱动电压的增大而增大,当脉冲惯性力F1>液体粘性力F2时,微喷嘴内的液滴沿着运动方向喷射出来。
电化学微流控芯片的制备过程如图2所示。将玻璃基底放入超声清洗仪中清洗10 min并烘干。将玻璃基底放在制备系统的工作台面,调节制备系统的制备参数,使纳米银墨水均匀稳定地喷射到基底表面, 形成相应的电极图形。将载有电极图形的基底进行烧结,制得具有较高导电性能的微电极,如图2A和图2B所示。将玻璃基底放在制备系统的工作台面,调节制备系统的制备参数,使甘油溶液均匀稳定地喷射到基底表面, 形成相应的液体阳模,放入80℃的恒温干燥箱内1 min, 将甘油溶液阳模中的水蒸干,形成甘油液体阳模[22], 将PDMS弹性体和固化剂以5∶1的比例均匀混合并抽真空,然后将PDMS液体通过注射泵以50 μL/s的速度缓慢均匀地沉积到用铝环包围的液体阳模表面,置于恒温干燥箱内, 60℃固化处理12 h,将固化后的PDMS负模从玻璃表面剥离,并切割打孔,如图2C~图2E所示。将载有微电极的玻璃基底和PDMS负模分别用无水乙醇和去离子水清洗,用氮气吹干,置于汞灯下进行表面改性,与微电极基底迅速对准贴合, 70℃保温30 min,完成键合,即可制得电化学微流控芯片(图2F)。
3 结果与讨论
影响电微流控芯片制备的主要因素有:微流体脉冲驱动控制系统的系统参量(微喷嘴内径d、驱动电压幅值U)、 液滴重叠率k、 微电极烧结条件等,其中系统参量和液滴重叠率对电化学微流控芯片的成型有显著影响,为提高制备效率,选择驱动电压频率为50 Hz。
3.1 系统参量对液滴直径的影响
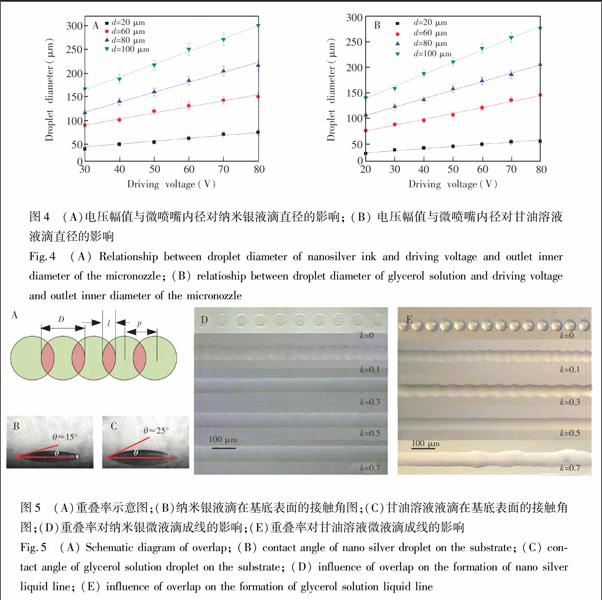
实验条件:微喷射介质为纳米银墨水和甘油溶液, U的范围为20~80 V, d的范围为20~100 μm。
分别在载玻片基底表面制备7×7的纳米银墨水液滴阵列和甘油溶液液滴阵列,如图3所示,其中,驱动电压幅值为50 V,微喷嘴内径为60 μm,液滴的中心距为180 μm。分别对图中49个液滴样点的直径进行测量,结果表明,纳米银墨水液滴的平均直径为120.4 μm,标准差为3.6 μm;甘油液滴的平均直径为101.4 μm,标准差为1.5 μm。采用相对标准偏差(RSD)表征液滴直径的一致性,计算公式为:RSD=(SD/MN)×100%,其中,SD为液滴直径的标准差,MN为液滴直径的平均值。采用上式计算液滴直径的相对标准偏差分别为3.0%和1.5%。由相对标准偏差结果可知,制得的液滴阵列具有较高的一致性,系统具有较好的喷射稳定性。
U和d对液滴直径的影响如图4所示,纳米银墨水的最小喷射电压为30 V,甘油溶液的最小喷射电压为20 V,这主要是由于纳米银墨水的粘度值高于甘油溶液,因而需要的驱动力较小。制备的纳米银微液滴的最小直径为40 μm,甘油溶液微液滴的最小直径为30 μm。液滴的直径可由U和d控制,当U增大时,微喷嘴内液体获得的脉冲惯性力增大,微喷射产生的液体量增多,在基底表面形成的液滴的直径增大;当d增大时,微喷射产生的液滴量也增多,使得基底表面形成的液滴的直径也增大。
3.2 制备参数对液滴成线的影响
如图5A所示,相邻的微液滴以一定的重叠率连接成微液线,其中,D为微液滴的直径,l为相邻液滴间重叠部分的宽度,p为相邻液滴的间距。重叠率k=l/D=1-p/D。此外,微液滴的铺展性能对液滴的成线有重要影响,实验采用测量液滴接触角的方法表征液滴的铺展性能。如图5B和5C所示,纳米银微液滴在基底表面的接触角为15°,甘油溶液液滴的接触角为25°,因此,纳米银微液滴比甘油溶液液滴具有更好的铺展性能。
实验条件:微喷射介质为纳米银墨水和甘油溶液, k的范围为0~85%, D的范围为40~250 μm。
图5D为纳米银液滴在基底表面的成线影响图,其中D=50 μm。当k=0时,液滴互相分离,无法形成液线。当k=0.1时,液滴互相连接成液线,但边缘呈锯齿状。继续提高重叠率时,液线的锯齿状边缘逐渐消失,并趋于直线。当k=0.5时,可以形成形貌较好的液线。继续提高重叠率后,液线依然可以维持较好的形貌,由于液滴量的增多和表面张力的影响,液线的宽度同时随着重叠率的增大而增大。重叠率对甘油溶液液滴在基底表面成线的影响如图5E所示,当k=0.5时,可以较好地形成甘油溶液液线,继续提高重叠率可以增大液线的宽度。但是当k=0.7时,液线边缘凸起,这主要是由于甘油溶液液滴的接触角较大,铺展扩散的能力弱于納米银微液滴,导致甘油液线单位距离内的液滴数较多,出现局部凸起现象。此外,当k=0.5时,纳米银液线的宽度大于甘油溶液液线的宽度,这主要是因为纳米银液线接触角较小,扩散性能较好,形成的液线宽度较大。
通过改变液滴的重叠率和直径,可以制得不同宽度的纳米银液线和甘油溶液液线,如图6A和图6B所示。其中,纳米银液线的宽度变化范围为60~130 μm,甘油溶液液线的宽度变化范围为40~120 μm。k和D对液线宽度的影响分别如图6C和图6D所示,纳米银液线的最小线宽为45 μm,甘油溶液液线的最小宽度为35 μm。液线的宽度由k和D控制,当k和D增大时,液线的宽度也增大。
3.3 微电极的制备与性能表征
将制备有纳米银液线图形的玻璃基底置于恒温干燥箱内以140℃进行烧结,持续30 min,即可制得具有较高导电性能的微电极图形。纳米银液线烧结前后的局部显微照片如图7A和7B所示,其中,微液线的制备参数为k=0.5, D=100 μm,微液线的线宽为135 μm。由图7可知,微液线经烧结后,线宽及边缘形貌均保持了较高的一致性。图7C和7D所示为微电极层厚和表面形貌的的SEM局部图,由图可见,制得的微电极的层厚约为2.2 μm,且层厚分布均匀;微电极的导电颗粒在烧结固化的过程中互相充分连接并长大, 密集分布于整个微电极区域内。微电极的导电性能是微电极的重要性能参数,实验采用精密直流电阻测试仪和四线法测量微电极的电阻率[23],测试结果表明,制得的微电极的电阻为5.2 μΩ·cm,约为金属银3倍,具有较高的导电性能。
3.4 微流道的制备与性能表征
实验采用白光干涉表面轮廓仪测定了微流道的三维轮廓形貌和表面粗糙度, 如图8所示,液体阳模经模塑工艺复制后得到的微流道保持了较好的形貌,微流道的边缘较直,流道的深度沿纵截面方向分布均匀,沿横截面方向先变深再变浅且基本对称。图8B和8C分别为微流道的横截面曲线图和微流道横截面的显微照片,微流道的宽度为169.7 μm,深度为16.3 μm,这表明制得的微流道深宽比为0.096。 图8D所示为微流道底部100 μm×325 μm范围内的表面粗糙度,测得微流道表面粗糙度的算术平均偏差Ra为125.1 nm,这表明实验制得的微流道表面粗糙度很小,表面光滑度较高, 有利于提高电化学检测的检测精度。
3.5 电化学微流控芯片的集成制备与测试
依据上述方法分别制备微电极和微流道,然后将制备有微电极的玻璃基底和含有微流道的PDMS负模采用可逆封装工艺进行键合,制得电化学微流控芯片。为增大芯片检测池中液体与电极的接触面积从而提高电化学反应效率和灵敏度,微电极采用并行排列并沿微流道分布的结构,制得的两排电极分别作为工作电极和对电极,对电极兼作参比电极,建立两电极电化学检测系统。本实验利用制得的两电极电化学检测系统,对葡萄糖溶液进行流动检测。将葡萄糖溶液流经固定有葡萄糖氧化酶的酶反应器,产生的过氧化氢在芯片的电极电压下发生电化学氧化反应,产生响应电流,从而测定出葡萄糖溶液的浓度。图9所示为电化学微流控芯片实验系统,主要包括电化学微流控芯片、电化学工作站、注射泵和待测溶液等,其中微流道的宽度为400 μm,微电极的宽度为70 μm。
首先依次用乙醇和去离子水冲洗石英毛细管内壁,去除通道内的有机物和杂质;然后将1 mol/L的NaOH溶液通入毛细管并静置12 h;接着依次用1 mol/L HCl溶液和去离子水冲洗毛细管内壁,随后将10%的乙烯基三乙氧基硅烷的甲醇溶液通入毛细管后, 将柱端封死,置于90℃加热2 h,进行硅烷化处理。将0.5%戊二醛溶液缓缓注入毛细管,持续2 h,然后通入蒸馏水冲洗干净。注入5 mg/mL 葡萄糖氧化酶和0.5%壳聚糖混合物,室温下孵育12 h,使酶固定在壳聚糖分子上。以磷酸盐缓冲液冲洗毛细管,即可制得固定有葡萄糖氧化酶的酶反应器[24]。
在注射泵上固定装有葡萄糖溶液的注射器,通过内径为300 μm的细塑料管将将固定有葡萄糖氧化酶的石英毛细管和注射器连接,接着再通过细塑料管将石英毛细管和微流道芯片微流道的入口连接,构成电化学检测装置。分别对pH=7.0的磷酸盐缓冲液和0.05 mol/L H2O2溶液进行循环伏安扫描,如图10A所示,磷酸盐缓冲液没有氧化峰,而H2O2出现了氧化峰,并且当工作点位为0.65 V时,氧化电流值最大。将酶反应器与微流控芯片连接,选择0.65 V工作电位,分别通入不同流速的葡萄糖溶液,响应电流与流速的关系如图10B所示,当流速在1~4 μL/min范围时,由于较大流速加强流体介质的传递,使反应效率更高,响应电流随浓度增大而增大,当流速大于4 μL/min时,由于过大的流速使得反应接触时间变短,反应不充分,响应电流随流速增大而下降。因此,实验选择4 μL/min为最佳流速。分别通入不同浓度的葡萄糖溶液,氧化电流的电流值(I)与葡萄样溶液的浓度(c)关系如图10C所示,当葡萄糖溶液的浓度在0.2~8.0 mmol/L的范围内时,萄糖溶液的浓度与响应电流具有较高的线性关系,线性方程为I=0.272c+0.721, r=0.997,检出限为0.15 mmol/L。结果表明,本实验中设计和制备的电化学微流控芯片两电极电化学检测系统可以对一定浓度范围内的葡萄糖溶液进行定量检测。
采用相同的制备方法制备10个电化学微流控芯片,分别构建检测系统,对5 mmol/L葡萄糖溶液进行检测。如图11所示,不同的电化学微流控芯片对于相同浓度葡萄糖溶液的检测结果没有明显差异, 表明采用相同的制备参数制得的不同批次的电化学微流控芯片具有较高的一致性。选择其中一个电化学微流控芯片,分别对0.5、1.0、1.5、3.0和6.0 mmol/L的葡萄溶液各进行10次测试,结果如表1所示。可见不同浓度葡萄糖溶液的10次测试结果,其响应电流的相对标准偏差较小,表明本方法制得的芯片具有较高的检测重复性。
4 结 论
研制了基于微流体脉冲驱动控制技术的电化学微流控芯片制备系统,考察了微喷嘴出口内径和电压幅值对液滴产生的影响,分析了液滴直径和重叠率对微电极和微流道液体阳模成线的影响,对制得的微电极和微流道进行了导电性能和表面形貌的检测。使用制备系统制得了电极宽度为70 μm、流道寬度为400 μm的电化学微流控芯片,进行了葡萄糖浓度的电化学流动检测,葡萄糖的浓度与响应电流具有良好的线性关系,可以对一定浓度范围内的葡萄糖溶液进行定量检测。本方法微喷射精度高、重复性好,制备系统结构简单、成本低廉,可用于不同喷射介质的微喷射成型,通过调整控制参数和进行基底的表面处理,可在不同的基底表面制备微电极等印制电子元件以及用于PDMS微流道倒模工艺的各种阳模,本方法有望用于生物芯片、生物传感器的制备以及微电化学分析等领域。
References
1 Li M, Li W H, Zhang J, Alici G, Wen W. J. Phys. D, 2014, 47(6): 063001
2 LIN BingCheng. Chinese J. Anal.Chem., 2016, (11): 1646-1651
林炳承. 分析化学, 2016, (11): 1646-1651
3 LIU WenWen, MA Yan, WEI Yan, PAN JianZhang, ZHU Ying, FANG Qun. Chinese J. Anal.Chem., 2016, 44(5): 698-706
刘雯雯, 马 妍, 魏 岩, 潘建章, 祝 莹, 方 群. 分析化学, 2016, 44(5): 698-706
4 Noiphung J, Songjaroen T, Dungchai W, Henry C S, Chailapakul O, Laiwattanapaisal W. Anal. Chim. Acta, 2013, 788: 39-45
5 ElMekawy A, Hegab H M, DominguezBenetton X, Pant D. Bioresource Technol., 2013, 142: 672-682
6 Jiang H, Jiang D L, Zhu P, Pi F W, Ji J, Sun C, Sun J D, Sun X L. Biosens. Bioelectron., 2016, 83: 126-133
7 GUO MengYuan, LI FengHua, BAO Yu, MA YuQin, NIU Li. Chinese J. Appl. Chem., 2016, 33(10): 1115-1125
郭梦园, 李风华, 包 宇, 马玉芹, 牛 利. 应用化学, 2016, 33(10): 1115-1125
8 WUZeXi, ZHANG WeiPing, CHEN JunJie, LI JinFeng, CHEN WenYuan, WU XiaoSheng, CUI Feng, LIU Wu, JIANG Chuan. Micronanoelectronic Technology., 2012, 49(1): 56-61
伍择希, 张卫平, 陈俊杰, 李金凤, 陈文元, 吴校生, 崔 峰, 刘 武, 姜 川. 微纳电子技术, 2012, 49(1): 56-61
9 Yan J L, Du Y, Liu J F, Cao W D, Sun X H, Zhou W H, Yang X R, Wang E K. Anal. Chem., 2003, 75(20): 5406-5412
10 Yoon Y J, Li K H H, Low Y Z, Yoon J, Ng S H. Sens. Actuator B, 2014, 198: 233-238
11 CHEN ZhiFeng, GAO YunHua, LI ChenWu, LIN JinMing. Chem. J. Chinese Universities, 2004, 25(12): 2253-2255
陈志锋, 高云华, 李成武, 林金明. 高等学校化学学报, 2004, 25(12): 2253-2255
12 Koesdjojo M T, Tennico Y H, Rundel J T, Remcho V T. Sens. Actuators B, 2008, 131(2): 692-697
13 Selvaraj H, Tan B, Venkatakrishnan K. J. Micomech. Microengi, 2011, 21(7): 075018
14 Yue W Q, Li C W, Xu T, Yang M S. Biosens. Bioelectron., 2013, 41: 675-683
15 Chung C, Chen Y J, Chen P C, Chen C Y. Inter. J. Precision Engineer. Manufacturing, 2015, 16(9): 2033-2039
16 Lee S H, Lee D J, Lee C K, Lee Y H, Wereley S T, Oh J H. Physica Status Solidi (a), 2012, 209(11): 2142-2146
17 Kim Y, Ren X, Kim J W, Noh, H. J. Micromechan. Microengineer., 2014, 24(11): 115010
18 Wu J W, Wang R D, Yu H X, Li G J, Xu K X, Tien N C, Roberts R C, Li D C. Lab Chip, 2015, 15(3): 690-695
19 Lu Y, Lin B C, Qin J H. Anal. Chem., 2011, 83(5): 1830-1835
20 ZHANG WeiYi, HOU LiYa. China. Patent, CN03152948. 8, 2004
章維一, 侯丽雅. 中国专利, CN03152948.8, 2004
21 Zhu X Y, Zhu L, Chen H J, Yang M, Zhang W Y. Optics Laser Technol., 2015, 66: 156-165
22 Zhu X Y, Li Z A, Chen H J, Yang L J, Zhang W Y. Appl. Surf. Sci., 2015, : 2015, 361: 80-89
23 WANG HongCheng, HOU LiYa, ZHANG Weiyi. Micronanoelectronic Technology, 2013, 50(4): 236-241
王洪成, 侯丽雅, 章维一. 微纳电子技术, 2013, 50(4): 236-241
24 Wu L, Cheng C M. Anal. Biochem., 2005, 346(2): 234-240
Abstract The fabrication system for the electrochemical microfluidic device was set up based on the pulse driving and controlling of microfluids technology. The nano silver ink and glycerol solution were jetted on the glass substrates to form the microelectrode pattern and the liquid mold pattern for the microchannel. Then the microelectrode and microchannel were obtained through a sintering process and a molding process, respectively. The electrochemical mircrofluidic device was Finally prepared through a bonding process with the microelectrode and the microchannel. The influences of the system parameters on the formation of the droplet were studied, as well as the influences of the droplets diameter and the overlap on the formation of the liquid lines. The minimal width, the thickness and the resistance of the prepared microelectrode were 45 μm, 2.2 μm and 5.2 μΩ cm, respectively. The minimal width of the microelectrode was 35 μm and the surface was smooth. The electrochemical flow detection of glucose concentration was carried out with the device, and the results showed that the glucose concentration had a high linear correlation with the response current, which could be used in the quantitative detection of glucose concentration. The fabrication of the electrochemical microfluidic device based on the pulse driving and controlling of micro fluids technology has many advantages such as simple system structure, lower cost and higher accuracy of the micro droplet and can be used in the preparation of the devices in the biochemical analysis and biosensor areas.
Keywords Electrochemical microfluidic device; Microelectrode; Microchannel
