激光扫描共聚焦表面等离子体共振系统实时监测单链DNA构象变化
2017-06-14朱嘉玮张洪艳杨卫平马倩
朱嘉玮+张洪艳+杨卫平+马倩

摘要:脱氧核糖核酸(DNA)是染色体的重要组成部分,是一种主要的遗传物质,很多实验方法与理论模型被用来研究DNA与一些重要生物物种相互作用引起的构象变化。采用激光扫描共聚焦表面等离子体共振(LSCISPR)系统研究了一种特定单链DNA(ssDNA)分别与其互补DNA(cDNA)和汞离子(Hg2+)作用后的构象变化。将一端有荧光分子的 ssDNA修饰在表面等离子体共振系统传感芯片上,通过观察荧光图像的变化来确定ssDNA与cDNA及Hg2+之间相互作用而导致的构象变化,并通过动力学曲线计算出二者的结合速率分别为3.33×10-5 s-1和1.42×10-4 s-1。对于ssDNAcDNA的相互作用,荧光图像没有变化。对于ssDNAHg2+的相互作用,在通入Hg2+后荧光发生猝灭。这些结果表明,激光扫描共聚焦表面等离子体共振系统在高灵敏实时监测ssDNA与其他特殊生物分子作用产生的构象变化和计算动力学参数方面有着广阔的应用前景。
关键词: 激光扫描共聚焦表面等离子体共振(LSCISPR); 构象变化; 实时监测
中图分类号: R 318.6 文献标志码: A doi: 10.3969/j.issn.1005-5630.2017.02.003
文章编号: 1005-5630(2017)02-00012-06
引 言
利用显微技术实现高分辨率的无损检测在材料研究、生物医学研究和半导体制造方面有着重要的作用。早在1957年,共聚焦显微镜被发明出来时,Minsky首次阐明共聚焦显微镜的工作原理[1]。作为一种先进的显微镜,激光扫描共聚焦显微镜为我们分析微观结构提供了很大的方便,在近几年也得到了很大的发展。激光扫描共聚焦显微镜可以对样品进行断层扫描和成像,进行无损观察和分析细胞的三维空间结构[2]。作为一种新型的高分辨率分析手段,激光扫描共聚焦显微镜被广泛应用于各个研究领域,比如生物学、材料科学、纳米技术等[3]。但是,激光扫描共聚焦显微镜一般用于定性分析,不易直接从荧光强度的变化来进行定量分析。
表面等离子体共振(SPR)传感器近几年被广泛应用于生物及化学检测。最早在1902年由Wood[4]发现SPR现象,并在1968年由Kretschmann等[5]利用衰减全反射棱镜耦合的方法激发出SPR现象,为后来SPR传感器发展奠定了基础。该传感检测技术具有灵敏度高、无需标记、实时等特点。因为SPR传感技术是根据高灵敏反射光的变化来检测,所以可以无标记地检测在水中或者空气中的污染物。SPR系统可以实时地检测并能够直观地看到生物分子间相互作用的过程[6-8],但是SPR信号的变化不能直接反应生物分子间相互作用之后发生的结构变化[9-13]。
本文采用激光掃描共聚焦表面等离子体共振(LSCISPR)系统,分别对ssDNAcDNA作用和ssDNAHg2+作用进行实时监测。该检测系统利用SPR的高灵敏度和激光扫描共聚焦显微成像的荧光可视化,把光学和生物学紧密结合,实现对生物分子间作用的检测。SPR检测灵敏度高,金膜表面发生的一切变化,包括生物分子的结合、分解以及结构变化都会引起SPR信号的改变,但是只有动力学曲线并不能直观地说明生物分子结构发生了何种改变,因此利用表面等离子体共振(LSCI)系统,通过对生物分子染色,可以很直观地观察被染色的生物分子与某种物质发生作用后结构发生了何种改变,比如是形成了双链螺旋结构还是馈折变化等。实验现象表明,通入cDNA后,SPR信号增强,随后通入缓冲液来证实该信号增强并不是折射率变化引起,而是生物分子间作用引起的变化,但荧光强度没有变化,说明ssDNA的构象变化并没有使荧光发生猝灭,而是遵循沃森克里克[14]当年提出来的DNA双螺旋结构模式,即cDNA能与ssDNA形成两条相互反平行盘绕成直径为2 nm的双螺旋结构。通入Hg2+后,SPR信号同样增强,荧光强度明显减弱,这是因为Hg2+的通入产生一种T-Hg2+T复杂结构使得ssDNA带有荧光一端发生折叠导致荧光发生猝灭[15]。LSCI-SPR在高灵敏实时监测ssDNA与其他特殊生物分子作用产生的构象变化和得到相应的动力学参数方面有着广阔的应用前景。
1 实 验
1.1 实验仪器与实验试剂
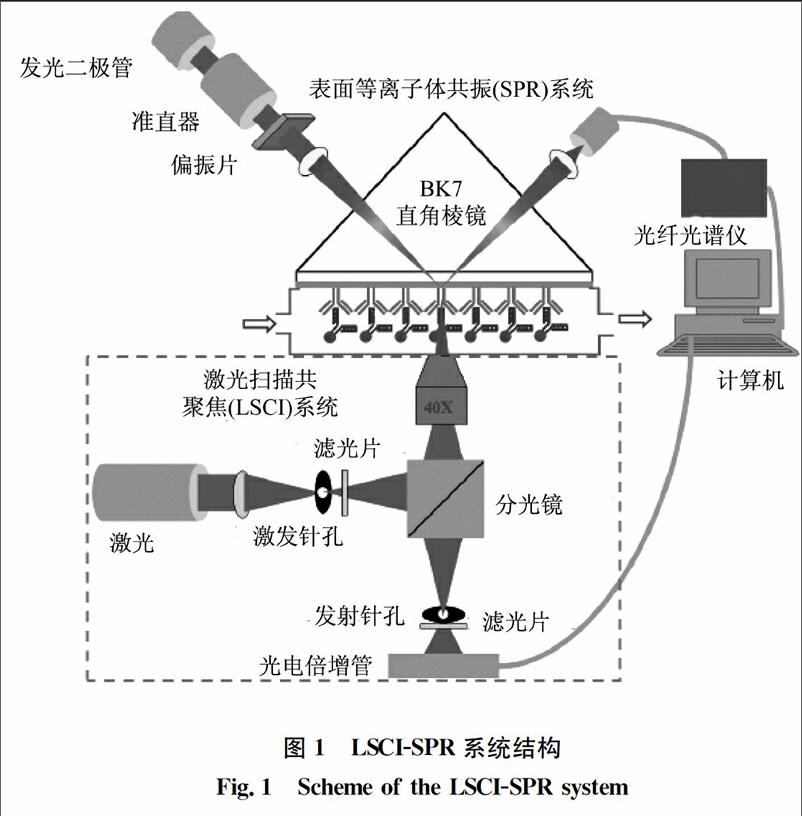
LSCI-SPR系统原理图如图1所示。波长型SPR传感系统是自主搭建的一套系统设备,白光光源由发光二极管发出平行光,经过偏振片产生P偏振光,再经过BK7直角棱镜,反射光由装有光电倍增管的光纤光谱仪采集。入射角可以通过平台上的两个旋转台随意调节来确定最佳的入射角度。生物传感基片的制备是用BK7玻璃片作为基底,在表面镀上4 nm的铬和50 nm的金。镀有金膜的一面与流通槽接触,另一面用匹配液与棱镜结合使其折射率和棱镜的折射率相同。棱镜、传感基片和流通槽与LSCI的倒置显微镜头相互固定。采用40倍物镜来采集ssDNA的荧光图像,荧光用波长为488 nm的多行氩激光器激发。焦平面设定在金膜面上,这样可以观察到ssDNA在与cDNA及Hg2+相互作用时的荧光图像。样品溶液通过注射泵注入流通池。
实验中所需溶剂为ssDNA溶液,物质的量浓度为3 μmol/L,TE缓冲液(呈弱碱性,对DNA的碱基具有保护作用)以及不同物质的量浓度的cDNA溶液与不同物质的量浓度Hg2+溶液,将cDNA溶液用TE缓冲液依次稀释成0.01 μmol/L、0.1 μmol/L、1 μmol/L、10 μmol/L。Hg2+溶液物质的量浓度为0.01 nmol/L、0.1 nmol/L、1 nmol/L、10 nmol/L。DNA在TE缓冲液中稳定性较好,不易破坏其完整性或产生开环及断裂。
1.2 实验过程
将金膜用乙醇溶液、乙醇和去离子水(各50%)混合溶液、去离子水各超声10 min,吹干后用Plasma仪器对金膜表面处理10 min,处理过后浸泡在0.3 μmol/L的ssDNA溶液中24 h,估算得到ssDNA的表面覆盖率为293 ng/cm2。所用的ssDNA分子结构中5端接有巯基(-SH)能够与使用的金膜相连接,3端接有红色染色剂罗丹明染料分子。取出浸泡后的金膜用TE缓冲液缓慢冲洗,洗掉没有接在金膜上的ssDNA。将修饰了ssDNA的金膜用匹配液与棱镜结合后固定在SPR仪器中,同时调节光路,光路调节好后开始实验,先通入TE缓冲液,基线平稳后,通入不同物质的量浓度的cDNA溶液。所有溶液通入的速率为1 μL/min。实验中DNA的相互作用过程都能被LSCI-SPR系统进行实时地监测,所有实验都在25 ℃下进行。
2 实验结果与分析
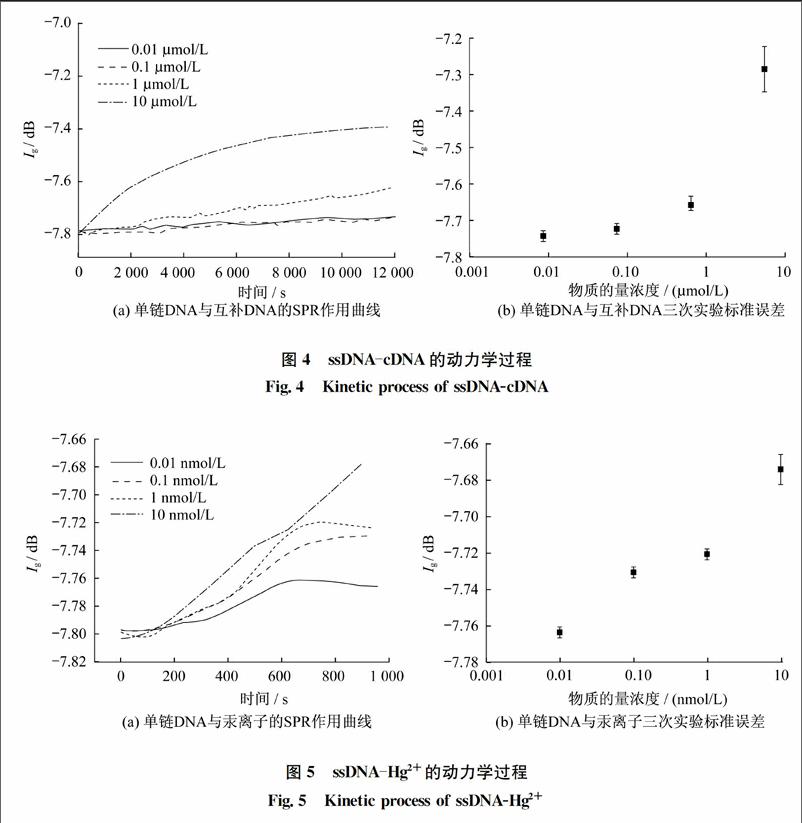
用LSCI-SPR系统实时监测ssDNA与cDNA及Hg2+相互作用时的SPR信号的变化以及荧光图像的变化,在ssDNA中通入cDNA的荧光图如图2所示,通入Hg2+的荧光图如图3所示,所有荧光图均在标尺为10 μm范围内拍摄。在基线平稳后分别通入事先稀释好的cDNA溶液和Hg2+溶液,cDNA的SPR曲线图如图4所示,Hg2+的SPR曲线图如图5所示。图4和图5纵坐标Ig表示IR与I0的比值,其中I0表示入射光强,IR表示反射光强。图4(a)与图5(a)的动力学曲线是通入溶液后反应的实时信号曲线,通入一段时间后,由于cDNA和Hg2+都能与ssDNA发生特异性作用,因此SPR信号上升,继续通入溶液后,基线趋于平稳,反应过程结束。图4(b)和图5(b)为三次平行实验的标准误差图,误差较小,说明在相同的实验条件下,有着良好的实验重复性。
通过实验反应前后的SPR信号可以估算出在物质的量浓度为10 μmol/L时的ssDNAcDNA反应的结合速率为3.33×10-5 s-1,物质的量浓度为10 nmol/L时的ssDNAHg2+反应的结合速率为1.42×10-4 s-1。由于是在室温25 ℃的条件下进行实验,其结合速率会比在37 ℃条件下的结合速率慢。从荧光图像可以看出,当通入不同物质的量浓度的cDNA溶液时,SPR信号增强明显而荧光几乎没有发生变化,这是由于ssDNAcDNA遵循沃森克里克机制形成双链DNA。但是在通入Hg2+后,SPR信号增强,荧光则有了明显减弱,随着Hg2+物质的量浓度的增加,荧光猝灭明显。这说明Hg2+不但与ssDNA发生了特异性作用,并且产生一种特殊的THg2+T复杂结构,使得带有荧光的ssDNA结构发生改变,接有罗丹明染色剂的一端发生折叠靠近金膜表面,表面等离子共振能在很短的距离使得荧光猝灭。通过LSCISPR系统实时地记录整个反应过程。
3 结 论
本文采用LSCI-SPR系统监测整个实验过程。实验证明,ssDNA与cDNA能够发生特异性作用,虽然改变了ssDNA的构象形成双链DNA,但不能使荧光发生猝灭,而Hg2+在与ssDNA发生特异性作用的同时也改变了ssDNA的构象使得荧光一端折叠,接近金膜表面让荧光猝灭。通过动力学曲线,计算出ssDNAcDNA以及ssDNAHg2+的结合速率分别为3.33×10-5 s-1、1.42×10-4 s-1。LSCISPR系统有着检测快速、实时、灵敏度高等优点,在监测生物分子间相互作用过程有着重要作用。不仅能够通过SPR信号的变化反映生物分子间特异性作用,还能通过荧光的变化来反映生物分子构象的改变。LSCISPR系统在高灵敏实时地监测ssDNA与其他特殊生物分子作用产生的构象变化,有着广阔的应用前景。
参考文献:
[1] MINSKY M.Memoir on inventing the confocal scanning microscope[J].Scanning,1988,10(4):128138.
[2] 杨子贤,王洪星,易小平.激光扫描共聚焦显微镜在生物科学研究中的应用[J].热带生物学报,2013,4(1):99104.
[3] 张旭,徐维奇.激光扫描共聚焦显微镜技术的发展及应用[J].现代科学仪器,2001(2):2123.
[4] WOOD R W.On a remarkable case of uneven distribution of light in a diffraction grating spectrum[J].Philosophical Magazine Series 6,1902,4(21):396402.
[5] KRETSCHMANN E,RAETHER H.Radiative decay of nonradiative surface plasmons excited by light[J].Zeitschrift Für Naturforschung A,2014,23(12):21352136.
[6] WITTMANN T,BOKOCH G M,WATERMAN STORER C M.Regulation of leading edge microtubule and actin dynamics downstream of Rac1[J].Journal of Cell Biology,2003,161(5):845851.
[7] 牟海維,王宏瑾,王强,等.表面等离子体共振理论仿真研究[J].光学仪器,2011,33(2):6770.
[8] CHAH S,YI J,ZARE R N.Surface plasmon resonance analysis of aqueous mercuricions[J].Sensors & Actuators B Chemical,2004,99(2/3):216222.
[9] MCDONNELL J M.Surface plasmon resonance:towards an understanding of the mechanisms of biological molecular recognition[J].Current Opinion in Chemical Biology,2001,5(5):572577.
[10] ZHANG H Y,YANG L Q,ZHOU B J,et al.Investigation of biological cell-protein interactions using SPR sensor through laser scanning confocal imaging-surface plasmon resonance system[J].Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy,2014,121:381386.
[11] ZHANG H Y,YANG L Q,MENG L,et al.Real time detection of antibody-antigen interaction using a laser scanning confocal imaging-surface plasmon resonance system[J].Chinese Physics B,2012,21(2):020601.
[12] ZHANG H Y,YANG L Q,ZHOU B J,et al.Ultrasensitive and selective gold film-based detection of mercury(II) in tap water using a laser scanning confocal imaging-surface plasmon resonance system in real time[J].Biosensors and Bioelectronics,2013,47:391395.
[13] LIU S,ZHANG H Y,LIU W M,et al.Investigation of biological cell-small molecule interactions with a gold surface plasmon resonance sensor using a laser scanning confocal imaging-surface plasmon resonance system[J].Rsc Advances,2016,6(70):6593065935.
[14] WATSON J D,CRICK F H C.Molecular structure of nucleic acids:a structure for deoxyribose nucleic acid[J].Nature,1974,248(5451):765.
[15] LU G W,SHEN H,CHENG B L,et al.How surface-enhanced chemiluminescence depends on the distance from a corrugated metal film[J].Applied Physics Letters,2006,89(22):223128.
(編辑:张磊)
