化脓链球菌磷酸化蛋白组的分析
2017-06-13曾观娣何姣姣孙雪松
曾观娣,何姣姣,孙雪松
(暨南大学 生命与健康工程研究院,广东 广州 510632)
化脓链球菌磷酸化蛋白组的分析
曾观娣,何姣姣,孙雪松*
(暨南大学 生命与健康工程研究院,广东 广州 510632)
化脓链球菌是一种革兰氏阳性致病菌,严重威胁人类及家禽健康。运用溶液酶解的方法将化脓链球菌中的全蛋白消化成肽段,利用TiO2富集化脓链球菌中的磷酸化肽段和 Finnigan Surveyor HPLC系统串联LTQ-Orbitrap质谱对富集的磷酸化肽段进行分析。鉴定到167个磷酸化肽段,对应57个磷酸化蛋白。生物信息学分析显示这些蛋白主要涉及到细胞生物合成、细胞有机物及其衍生物代谢、信号传递、基因转录、生物应激等生理过程。通过STRING软件对这57个磷酸化蛋白进行相互作用网络分析,发现7个磷酸化蛋白相互作用网络。化脓链球菌的磷酸化蛋白组为深入解析化脓链球菌的毒力、耐药的发生发展机制提供理论基础,为开发新的抗菌药物提供新视角。
磷酸化蛋白组;化脓链球菌;LTQ-Orbitrap;STRING
化脓链球菌(Streptococcuspyogenes)是致病性革兰氏阳性A族链球菌,广泛存在于自然界、人和动物粪便、健康人的鼻咽部,引起各种化脓性炎症、猩红热、败血症等疾病[1]。我国养殖业发达,猪、牛、羊、马和鸡感染链球菌,可呈现地方性爆发,具有高发病率和高致死率的特点,给养殖户造成巨大的经济损失。目前,还没有针对人的链球菌疫苗,针对猪的疫苗也只是仅有半年的有效期。
目前,针对化脓链球菌的研究集中于超级抗原(SAgs)的发现、生物功能与病症的相关性[2]、多价疫苗的开发[3]、临床样本中化脓链球菌的鉴定与识别[4]、化脓链球菌产生耐药及感染宿主的分子机制[5]。蛋白磷酸化是翻译后修饰至关重要的一步,几乎可以可逆地调节细菌所有的生物过程。但是,目前关于化脓链球菌磷酸化蛋白组却鲜有报道,已有的研究多是针对单一的磷酸化蛋白功能研究[6-8]。本文系统研究了化脓链球菌的磷酸化蛋白质组。该研究将会更深入地了解化脓链球菌的毒力来源、耐药性的发生发展以及为疫苗的研究奠定基础。
1 材料与方法
1.1 材料
试剂:氟化钠、2-甘油磷酸、钒酸钠、焦磷酸钠、氯化钠、氯化钾、磷酸二氢钠、磷酸二氢钾、尿素、硫尿、碳酸氢铵、二硫苏糖醇(DTT)、CHAPS、碘乙酰胺(IAA)、蛋白酶抑制剂(PMSF)、硫代硫酸钠、铁氰化钾、乙腈均购自Sigma公司,胰蛋白酶购自Promega公司,核酶购自GE公司。所有试剂均用超纯水配置。
材料:Michrom Bioresources公司的C18柱,Calbiochem的TiO2Enrichment kit,GE Healthcare 的PD-10脱盐柱,Michrom Bioresources公司的C18柱。
仪器:德国Thermo生产的linear ion trap (LTQ)-Orbitrap质谱仪、紫外分光光度计和真空冷冻离心机;宁波新芝生物仪器公司的超声波细胞破碎仪;江苏苏净安泰公司的超净工作台;美国GE公司的核酸蛋白测定仪;德国Eppendorf公司的小型冷冻离心机;美国Mollipore公司的MILLIPORE纯水系统。
1.2 菌株与培养
本实验采用StreptococcuspyogenesMGAS5005(S.pyogensMGAS5005)菌株(保存于本实验室),培养基是含0.5%酵母浸出液化的Tod-Hewit培养基(THY),在37 ℃、5%二氧化碳培养箱中培养细菌,当细菌长到半对数期(OD600 nm≈0.7),将样品低温离心(4 ℃,5000 r/min)10 min,收集细菌。
1.3 蛋白质样品的制备
继1.2操作离心后,去上清,加入预冷的1×PBS (10 mmol/L, pH 7.4),反复清洗细菌3次。向收集到的细菌中加入15 mmol/L Tris-HCl (pH 8.0), 7 mol/L尿素,2 mol/L硫脲,1% DTT,4% CHAPS 和5 mmol/L蛋白磷酸酶抑制剂 (氟化钠、2-甘油磷酸、钒酸钠、焦磷酸钠),混匀;反复冻融3次,再在冰上超声6次,30 s/次;裂解物在4 ℃,12000 r/min离心10 min,将上清转移到新的离心管中。用BCA法测定蛋白浓度。每10 mg总蛋白提取物加入10 mmol/L DTT, 37 ℃还原蛋白;之后加入20 mmol/L碘乙酰胺,在室温下避光处理45 min;将该混合物加入到PD-10 (GE Healthcare)脱盐柱上脱盐,将其蛋白缓冲液更换成25 mmol/L碳酸氢铵;加入胰蛋白酶(1∶100w/w), 37 ℃过夜酶解。
1.4 金属亲和层析富集磷酸化蛋白
按照TiO2Enrichment kit说明书,富集胰蛋白酶处理后的肽段中的磷酸化肽段,即在胰蛋白酶消化的肽段中加入200 mL TiO2Phosphobind缓冲液和50 g/L DHB,再加入50 mL TiO2树脂,混匀;孵育30 min,去上清,用清洗液清洗树脂3次;用Elution Buffer洗脱磷酸化肽段,共洗脱2次;洗脱液在真空冷冻离心机冷冻干燥,浓缩。
1.5 LTQ-Orbitrap质谱分析磷酸化肽段
小学生在进行阅读时,不按章法和技巧拿着书本就开始读,阅读效果不明显,这和他们年纪小,技能储备贫乏不无关系。因此在阅读教学中,老师要注重传授高效的阅读方法和技巧,让学生合理展开阅读,让阅读更加高效。老师的技巧使学生有章法的进行阅读,阅读效果达到预期,学生也能在阅读行为中获得成就感,从而产生阅读的兴趣。
将富集的磷酸化肽段溶解于5%乙腈和0.1%甲酸混合液中,并用Finnigan Surveyor HPLC系统串联linear ion trap (LTQ)-Orbitrap质谱仪处理样品[9-10]。经过孔径100 mm,长10 cm,粒径5 mm的C18柱分离肽段。洗脱梯度条件:在LTQ-Orbitrap的实时监控下,先用5.0%~36.5%乙腈和0.1%甲酸冲洗90 min[9,11]。质谱参数设置如下:spray voltage 为1.80 kV,sheath和auxiliary gas flow为0,ion transfer tube temperature 为200 ℃;MS2和MS3的ion selection threshold计数分别为1000和500;在MS2中,activation Q 设为0.25,activation time设为30 ms,isolation window 的m/z设为3,碰撞能为35%并进行串联质谱扫描;质谱的resolution R设为60000;动态清洗时间为90 s。质谱设置了阳离子模式及一级质谱与二级质谱间依赖于数据的自动采集模式的开关。每一个周期,在Orbitrap中一个完整的一级图谱在AGC靶位是1×106,最大离子积累时间为500 ms,在LTQ二级质谱后在AGC为5000的靶位前5位,最大离子积累时间是100 ms。为了检测磷酸化的肽段,如果在二级质谱中,肽段有-98.0、-49.0、-32.7、-24.5的峰,且这些峰是前5个最强峰之一,那么该肽段进入三级质谱[12]。
1.6 生物信息学分析
利用Blast2GO对50个磷酸化蛋白进行注释、获得细胞定位、细胞功能、参与的生物学过程和细胞通路分析。用STRING系统构建化脓链球菌磷酸化蛋白的相互作用图[13-16]。登录http://string-db.org/,进入multiple names模式,输入磷酸化蛋白相应的基因名,自动生成蛋白相互作用图。参数设置如下:物种为化脓链球菌,可信度为0.40,相互作用蛋白不超过20个。
2 结果与分析
2.1 化脓链球菌磷酸化蛋白的鉴定
利用质谱鉴定TiO2富集的磷酸化肽段,用SEQUEST软件检索NCBI中的化脓链球菌MGAS5005数据库。搜索数据库的结果显示,本实验共鉴定到167个磷酸化肽段,总共对应57个磷酸化的蛋白。表1显示了鉴定到的肽段序列、磷酸化位点、所属蛋白的详细信息。图1显示了磷酸化肽段[S(p)IEES(p)LDLGWELLS(p)ILPRTELK]的二级质谱图。
对57个磷酸化蛋白的磷酸化位点进行统计分析,结果显示:化脓链球菌的磷酸化56.8%位于丝氨酸残基、35.1%是苏氨酸残基、8.1%是酪氨酸残基。
2.2 磷酸化蛋白的分类
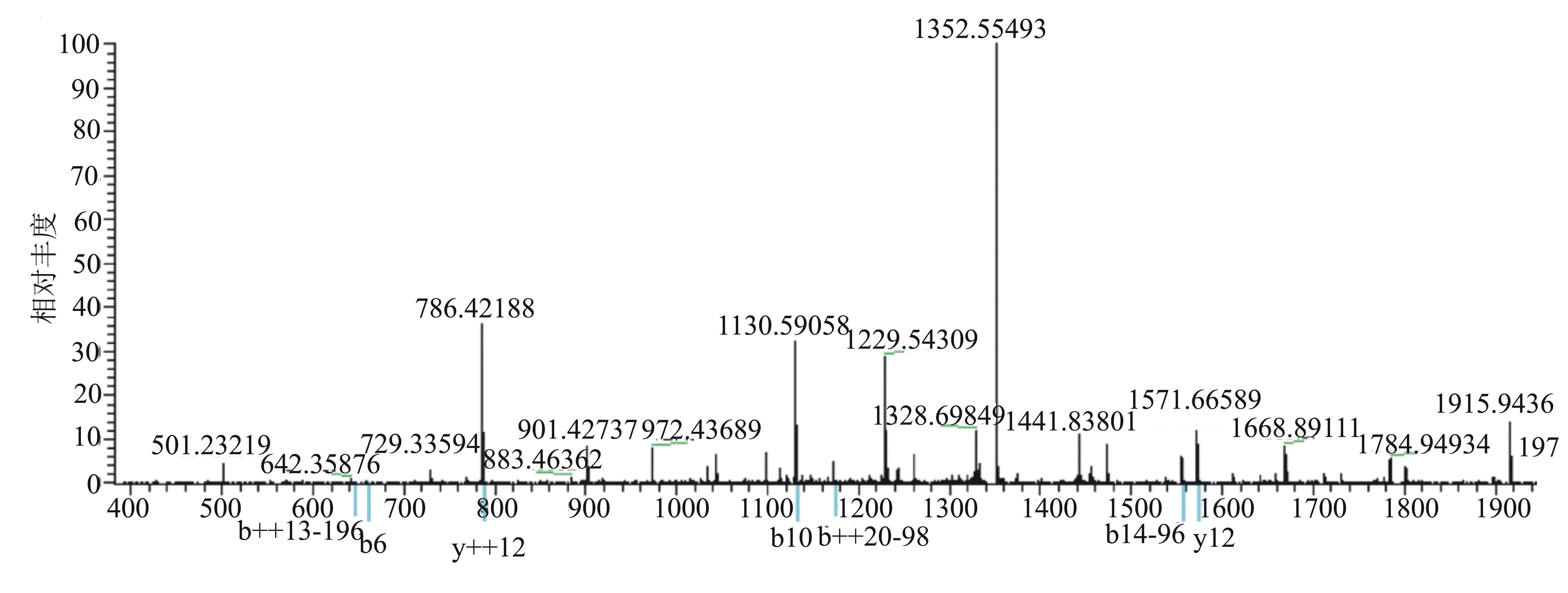
图1 用LTQ-Orbitrap质谱鉴定到的磷酸化蛋白肽段[S(p)IEES(p)LDLGWELLS(p)ILPRTELK]的二级图谱
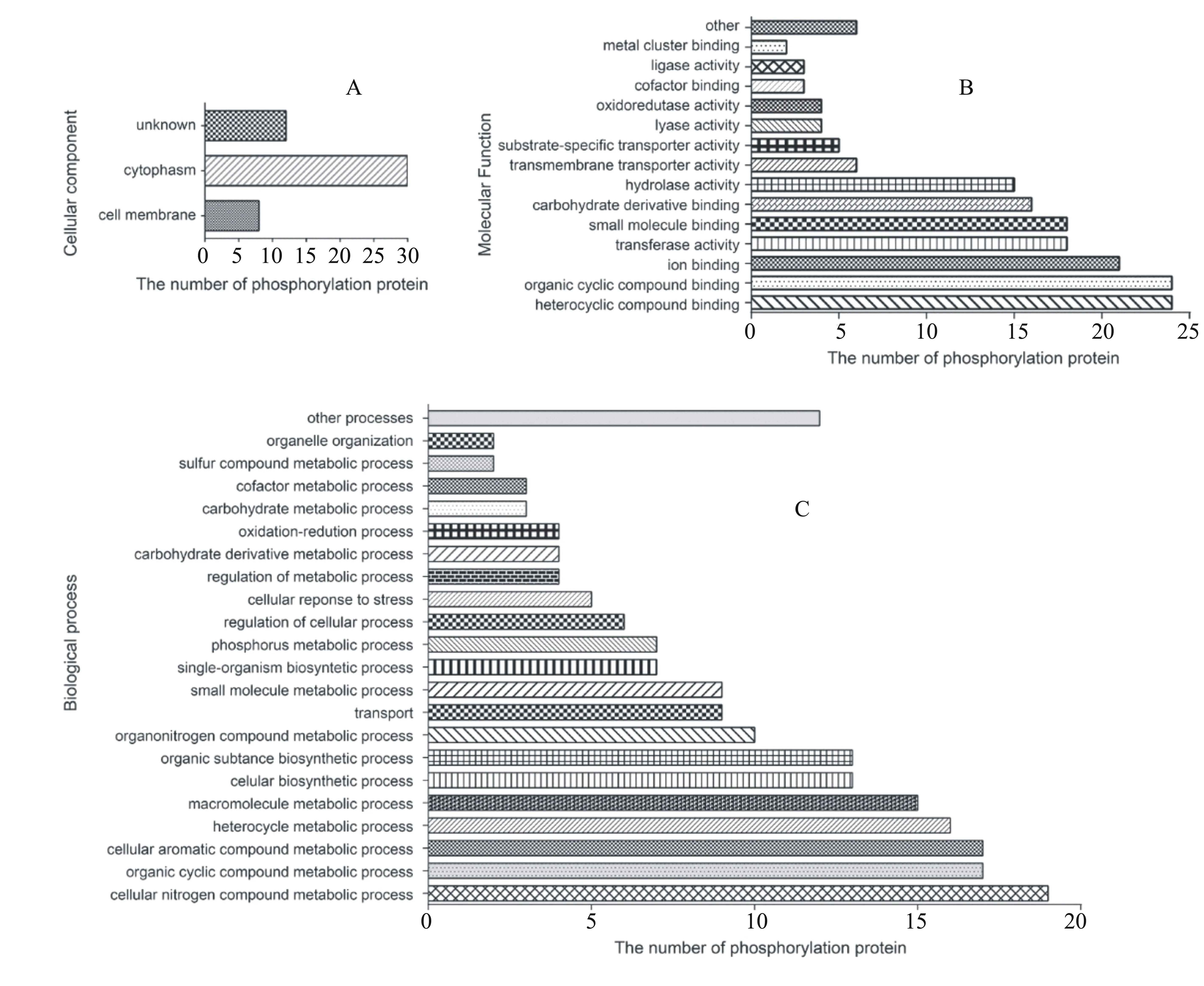
图2 磷酸化蛋白在细胞内的定位、功能分类及参与的生物学过程
2.3 磷酸化蛋白相互作用图
通过STRING系统构建化脓链球菌中鉴定到的磷酸化蛋白的相互作用图(图3)。在已鉴定的57个磷酸化蛋白中,形成1个大的和6个小的相互作用的网络。 其中大网络中主要是与转录翻译相关,包括很多核糖体蛋白,说明磷酸化对蛋白翻译有重要的调控功能。其他6个小网络分别是脂肪酸合成(Fab家族)、ATP合成(Ntp家族)、丙酮酸激酶的合成(Gpm、Pgk、Eno、TpiA家族)、磷酸盐转运系统(Pst家族)、四氢叶酸合成(Fhs家族)和ATP结合盒(Opp家族)。
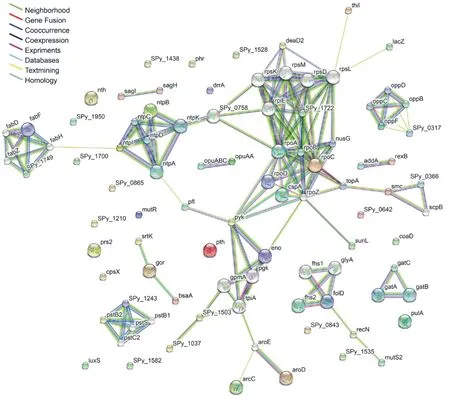
图3 化脓链球菌中磷酸化蛋白的相互作用图
表1 质谱鉴定到的磷酸化位点
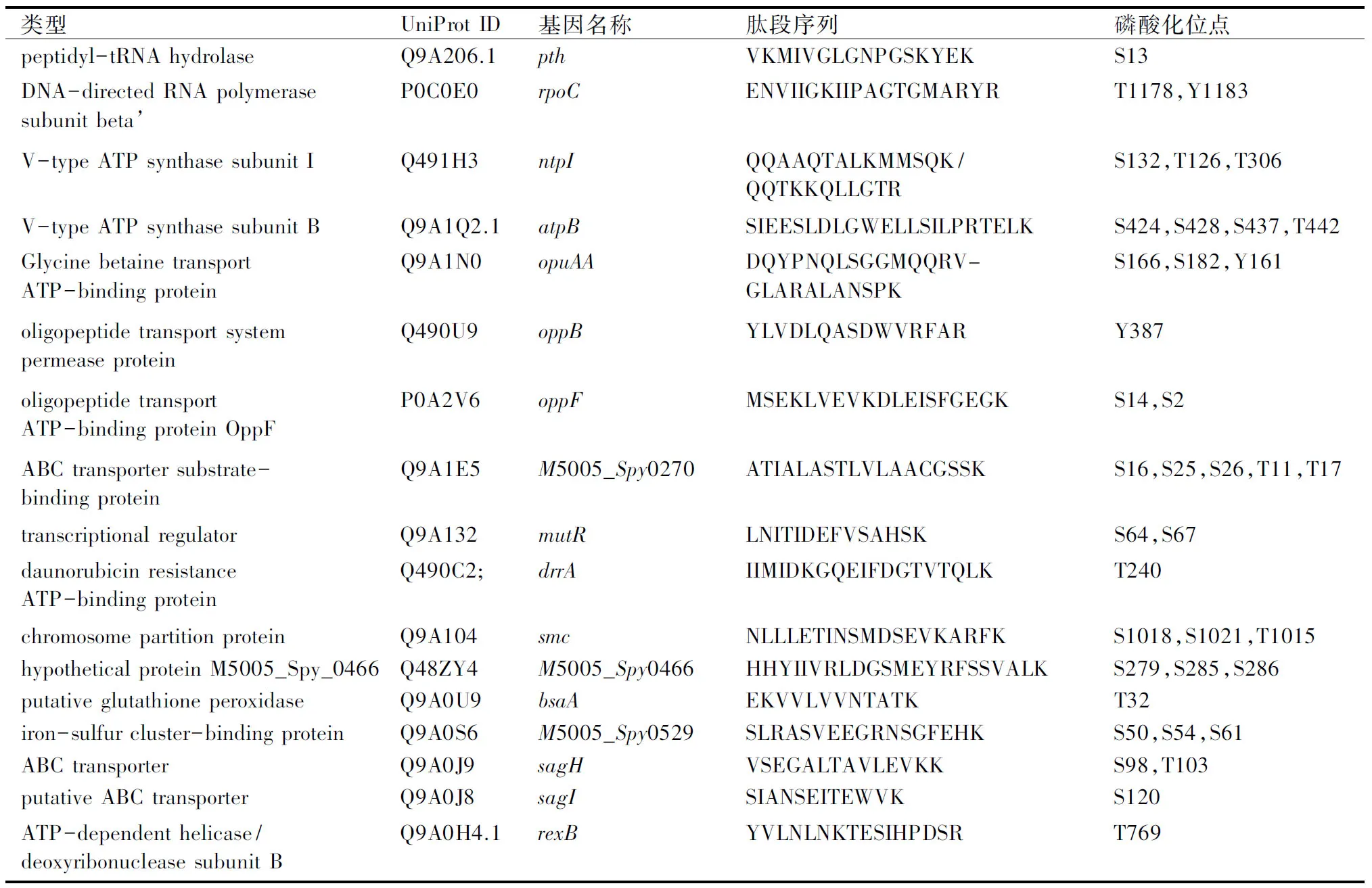
类型UniProtID基因名称肽段序列磷酸化位点peptidyl-tRNAhydrolaseQ9A206.1pthVKMIVGLGNPGSKYEKS13DNA-directedRNApolymerasesubunitbeta’P0C0E0rpoCENVIIGKIIPAGTGMARYRT1178,Y1183V-typeATPsynthasesubunitIQ491H3ntpIQQAAQTALKMMSQK/QQTKKQLLGTRS132,T126,T306V-typeATPsynthasesubunitBQ9A1Q2.1atpBSIEESLDLGWELLSILPRTELKS424,S428,S437,T442GlycinebetainetransportATP-bindingproteinQ9A1N0opuAADQYPNQLSGGMQQRV-GLARALANSPKS166,S182,Y161oligopeptidetransportsystempermeaseproteinQ490U9oppBYLVDLQASDWVRFARY387oligopeptidetransportATP-bindingproteinOppFP0A2V6oppFMSEKLVEVKDLEISFGEGKS14,S2ABCtransportersubstrate-bindingproteinQ9A1E5M5005_Spy0270ATIALASTLVLAACGSSKS16,S25,S26,T11,T17transcriptionalregulatorQ9A132mutRLNITIDEFVSAHSKS64,S67daunorubicinresistanceATP-bindingproteinQ490C2;drrAIIMIDKGQEIFDGTVTQLKT240chromosomepartitionproteinQ9A104smcNLLLETINSMDSEVKARFKS1018,S1021,T1015hypotheticalproteinM5005_Spy_0466Q48ZY4M5005_Spy0466HHYIIVRLDGSMEYRFSSVALKS279,S285,S286putativeglutathioneperoxidaseQ9A0U9bsaAEKVVLVVNTATKT32iron-sulfurcluster-bindingproteinQ9A0S6M5005_Spy0529SLRASVEEGRNSGFEHKS50,S54,S61ABCtransporterQ9A0J9sagHVSEGALTAVLEVKKS98,T103putativeABCtransporterQ9A0J8sagISIANSEITEWVKS120ATP-dependenthelicase/deoxyribonucleasesubunitBQ9A0H4.1rexBYVLNLNKTESIHPDSRT769
续表1:
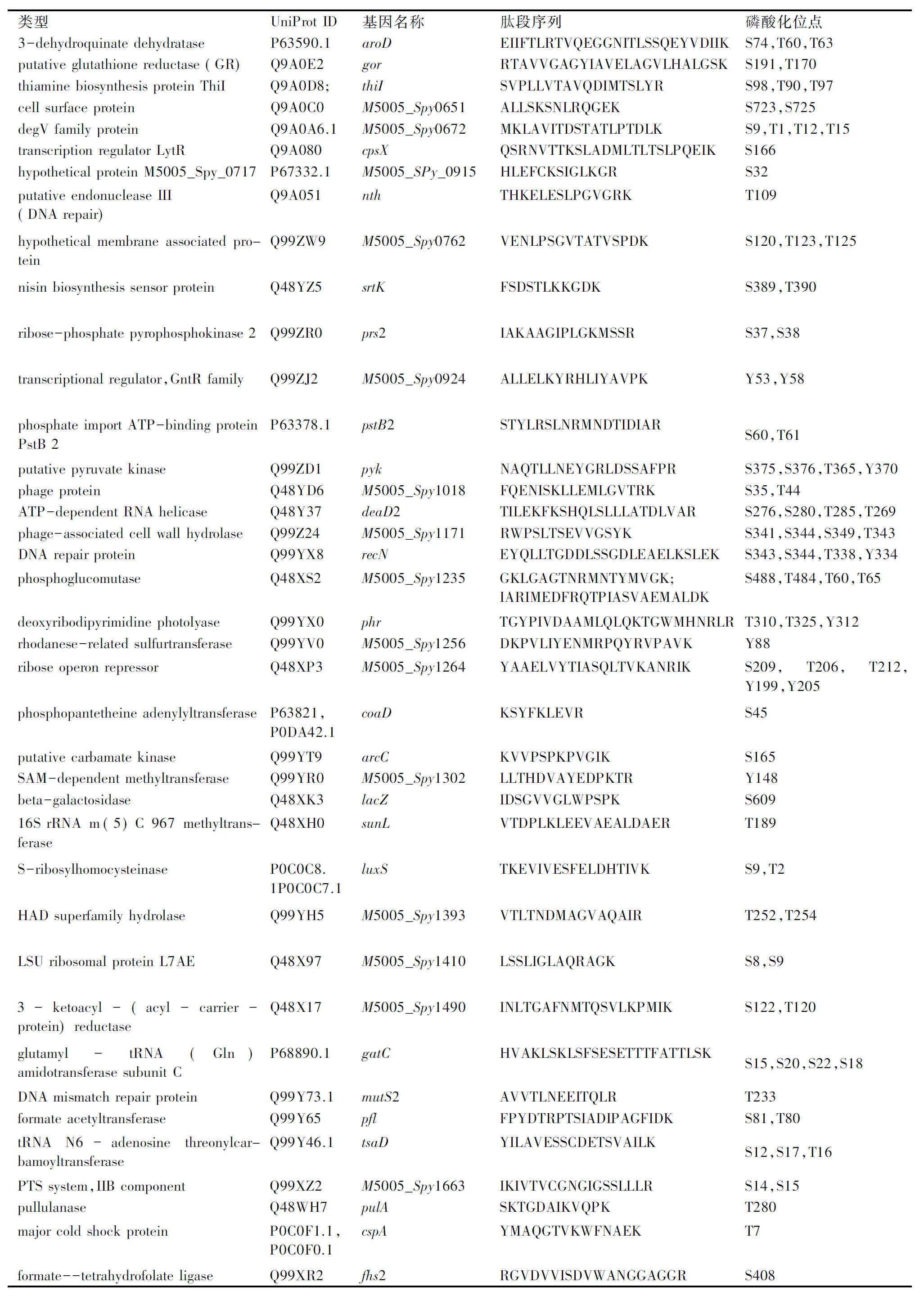
类型UniProtID基因名称肽段序列磷酸化位点3-dehydroquinatedehydrataseP63590.1aroDEIIFTLRTVQEGGNITLSSQEYV-DIIKS74,T60,T63putativeglutathionereductase(GR)Q9A0E2gorRTAVVGAGYIAVELAGVLHALG-SKS191,T170thiaminebiosynthesisproteinThiIQ9A0D8;thiISVPLLVTAVQDIMTSLYRS98,T90,T97cellsurfaceproteinQ9A0C0M5005_Spy0651ALLSKSNLRQGEKS723,S725degVfamilyproteinQ9A0A6.1M5005_Spy0672MKLAVITDSTATLPTDLKS9,T1,T12,T15transcriptionregulatorLytRQ9A080cpsXQSRNVTTKSLADM-LTLTSLPQEIKS166hypotheticalproteinM5005_Spy_0717P67332.1M5005_SPy_0915HLEFCKSIGLKGRS32putativeendonucleaseIII(DNArepair)Q9A051nthTHKELESLPGVGRKT109hypotheticalmembraneassociatedproteinQ99ZW9M5005_Spy0762VENLPSGVTATVSPDKS120,T123,T125nisinbiosynthesissensorproteinQ48YZ5srtKFSDSTLKKGDKS389,T390ribose-phosphatepyrophosphokinase2Q99ZR0prs2IAKAAGIPLGKMSSRS37,S38transcriptionalregulator,GntRfamilyQ99ZJ2M5005_Spy0924ALLELKYRHLIYAVPKY53,Y58phosphateimportATP-bindingpro-teinPstB2P63378.1pstB2STYLRSLNRMNDTIDIARS60,T61putativepyruvatekinaseQ99ZD1pykNAQTLLNEYGRLDSSAFPRS375,S376,T365,Y370phageproteinQ48YD6M5005_Spy1018FQENISKLLEMLGVTRKS35,T44ATP-dependentRNAhelicaseQ48Y37deaD2TILEKFKSHQLSLLLATDLVARS276,S280,T285,T269phage-associatedcellwallhydrolaseQ99Z24M5005_Spy1171RWPSLTSEVVGSYKS341,S344,S349,T343DNArepairproteinQ99YX8recNEYQLLTGDDLSSGDLEAELKSLEKS343,S344,T338,Y334phosphoglucomutaseQ48XS2M5005_Spy1235GKLGAGTNRMNTYMVGK;IARIMEDFRQTPIASVAEMALDKS488,T484,T60,T65deoxyribodipyrimidinephotolyaseQ99YX0phrTGYPIVDAAMLQLQKTGWMH-NRLRT310,T325,Y312rhodanese-relatedsulfurtransferaseQ99YV0M5005_Spy1256DKPVLIYENMRPQYRVPAVKY88riboseoperonrepressorQ48XP3M5005_Spy1264YAAELVYTIASQLTVKANRIKS209,T206,T212,Y199,Y205phosphopantetheineadenylyltrans-feraseP63821,P0DA42.1coaDKSYFKLEVRS45putativecarbamatekinaseQ99YT9arcCKVVPSPKPVGIKS165SAM-dependentmethyltransferaseQ99YR0M5005_Spy1302LLTHDVAYEDPKTRY148beta-galactosidaseQ48XK3lacZIDSGVVGLWPSPKS60916SrRNAm(5)C967methyltrans-feraseQ48XH0sunLVTDPLKLEEVAEALDAERT189S-ribosylhomocysteinaseP0C0C8.1P0C0C7.1luxSTKEVIVESFELDHTIVKS9,T2HADsuperfamilyhydrolaseQ99YH5M5005_Spy1393VTLTNDMAGVAQAIRT252,T254LSUribosomalproteinL7AEQ48X97M5005_Spy1410LSSLIGLAQRAGKS8,S93-ketoacyl-(acyl-carrier-pro-tein)reductaseQ48X17M5005_Spy1490INLTGAFNMTQSVLKPMIKS122,T120glutamyl-tRNA(Gln)amidotrans-ferasesubunitCP68890.1gatCHVAKLSKLSFSESETTTFATTLSKS15,S20,S22,S18DNAmismatchrepairproteinQ99Y73.1mutS2AVVTLNEEITQLRT233formateacetyltransferaseQ99Y65pflFPYDTRPTSIADIPAGFIDKS81,T80tRNAN6-adenosinethreonylcar-bamoyltransferaseQ99Y46.1tsaDYILAVESSCDETSVAILKS12,S17,T16PTSsystem,IIBcomponentQ99XZ2M5005_Spy1663IKIVTVCGNGIGSSLLLRS14,S15
2.4 蛋白磷酸化细胞代谢通路分析
对57个磷酸化蛋白进行细胞通路分析,鉴定到较多磷酸化蛋白的细胞通路:糖酵解途径、氨基酸代谢、叶酸代谢、嘌呤和嘧啶代谢。其中,糖酵解途径中的丙酮酸激酶是三羧酸循环(TCA)的限速酶,预示着蛋白磷酸化在TCA等重要代谢通路中发挥重要作用。
3 讨论
蛋白质磷酸化在细菌生命进程中发挥着重要作用。在生物体内,蛋白磷酸化的位点一般有丝氨酸、苏氨酸和酪氨酸[17]。由于丝氨酸和苏氨酸的结构末端的羟基比酪氨酸的活泼,且更易于与磷酸基团结合,所以丝氨酸和苏氨酸磷酸化比酪氨酸的磷酸化更常见[18]。本课题利用蛋白组学的方法鉴定了该细菌的磷酸化蛋白,在本研究中,化脓链球菌磷酸化蛋白的磷酸化位点大部分在于丝氨酸残基,其次是苏氨酸残基,最少的是酪氨酸残基,这个结果与在肺炎链球菌磷酸化蛋白组学的研究结果相似[18],也暗示着细菌蛋白保守的丝氨酸位点磷酸化的概率更高。
本研究鉴定到糖酵解过程中的主要限速酶[19]——丙酮酸激酶(pyruvate kinase),其能催化磷酸烯醇丙酮酸和ADP生成丙酮酸和ATP,除了能催动糖酵解的继续进行外,还可为细胞的生命活动提供能量。在本研究中,还鉴定到磷酸化的甲酸四氢叶酸连接酶(formate tetrahydrofolate ligase),它是叶酸甲酰化的关键,而叶酸的形成又与细菌内嘧啶、嘌呤核苷酸和S-甲硫氨酸的生物合成密切相关[20],而氨基酸代谢也与糖酵解存在相互转化的机制。因此,磷酸化蛋白组将细菌的各项生理功能紧密地联系在一起。
STRING的基本单元是功能的相关性,即特异的且有意义的两个相互作用的蛋白为同一个过程做出贡献[15]。研究中发现了7个磷酸化蛋白相互作用网络,覆盖了正常细胞生长繁殖的全过程,包括能量合成(Ntp、Gpm、Pgk、Eno、TpiA家族)、转运(Opp家族)、细胞DNA复制(Fhs家族)、蛋白合成(Rpo和Rps家族)、物质转运(Pst家族)。
综上所述,本文采用了TiO2Enrichment kit富集磷酸化蛋白,再利用Finnigan Surveyor HPLC系统串联LTQ-Orbitrap技术对化脓链球菌中磷酸化肽段进行组学研究,成功鉴定到167个磷酸化肽段,对应57个磷酸化蛋白,这些蛋白主要参与细胞生物合成与代谢、信息传递等生理过程,并且这些磷酸化蛋白组数据库的建立,为深入解析化脓链球菌的毒力、耐药性的发生发展机制提供理论基础,为开发新的抗菌药物提供新视角。
[1] Cole J N, Barnett T C, Nizet V, et al. Molecular insight into invasive group A streptococcal disease[J]. Nature Reviews Microbiology, 2011, 9(10): 724-736.
[2] Proft T, Fraser J D. Streptococcal superantigens: Biological properties and potential role in disease[M]// Ferretti J J, Stevens D L, Fischetti V A.Streptococcuspyogenes: Basic Biology to Clinical Manifestations, Oklahoma City, 2016.
[3] Mark R, Lynskey N N, Jung C Y, et al. Development of a multicomponent vaccine forStreptococcuspyogenesbased on the antigenic targets ofIVIG[J]. Journal of Infection, 2016, 72(4): 450.
[4] Spellerberg B, Brandt C. Laboratory diagnosis ofStreptococcuspyogenes(group A streptococci)//[M]. Ferretti J J, Stevens D L, Fischetti V A.Streptococcuspyogenes: Basic Biology to Clinical Manifestations, Oklahoma City, 2016.
[5] Golinska E, van der Linden M, Wiecek G, et al. Virulence factors ofStreptococcuspyogenesstrains from women in peri-labor with invasive infections[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2016, 35(5): 747-754.
[6] Kant S, Agarwal S, Pancholi P, et al. TheStreptococcuspyogenesorphan protein tyrosine phosphatase, SP-PTP, possesses dual specificity and essential virulence regulatory functions[J]. Molecular Microbiology, 2015, 97(3): 515-540.
[7] Sanson M, Makthal N, Gavagan M, et al. Phosphorylation events in the multiple gene regulator of group AStreptococcus(Mga) significantly influences global gene expression and virulence[J]. Infection & Immunity, 2015, 83(6): 2382-2395.
[8] Wang G X, Liszewski M K, Chan A C, et al. Membrane cofactor protein (MCP; CD46): Isoform-specific tyrosine phosphorylation[J]. Journal of Immunology, 2000, 164(4): 1839-1846 .
[9] Sun X S, Ge F, Xiao C L, et al. Phosphoproteomic analysis reveals the multiple roles of phosphorylation in pathogenic bacteriumStreptococcuspneumoniae[J]. Journal of Proteome Research, 2010, 9(1): 275-282.
[10] Ge R G, Sun X S, Xiao C L, et al. Phosphoproteome analysis of the pathogenic bacteriumHelicobacterpylorireveals over-representation of tyrosine phosphorylation and multiply phosphorylated proteins[J]. Proteomics, 2011, 11(8): 1449-1461.
[11] Haas W, Faherty B K, Gerber S A, et al. Optimization and use of peptide mass measurement accuracy in shotgun proteomics[J]. Molecular & Cellular Proteomics, 2006, 5(7): 1326-1337.
[12] Villen J, Beausoleil S A, Gygi S P. Evaluation of the utility of neutral-loss-dependent MS3 strategies in large-scale phosphorylation analysis[J]. Proteomics, 2008, 8(21): 4444-4452.
[13] Ge F, Lu X P, Zeng H L, et al. Proteomic and Functional analyses reveal a dual molecular mechanism underlying arsenic-induced apoptosis in Human Multiple Myeloma Cells[J]. Journal of Proteome Research, 2009, 8(6): 3006-3019.
[14] von Mering C, Jensen L J, Kuhn M, et al. STRING 7-recent developments in the integration and prediction of protein interactions[J]. Nucleic Acids Research, 2007, 35(Database issue): 358-362.
[15] Jensen L J, Kuhn M, Stark M, et al. STRING 8-a global view on proteins and their functional interactions in 630 organisms[J]. Nucleic Acids Research, 2009, 37(Database issue): D412-D416.
[16] Szklarczyk D, Franceschini A, Kuhn M, et al. The STRING database in 2011: functional interaction networks of proteins, globally integrated and scored[J]. Nucleic Acids Research, 2011, 39(Databaseissue): D561-D568.
[17] Calder B, Albeldas C, Blackburn J M, et al. Mass spectrometry offers insight into the role of Ser/Thr/Tyr phosphorylation in theMycobacteria[J]. Frontiers in Microbiology, 2016, 7(141): 141.
[18] Wu H Y, Tseng V S, Liao P C. Mining phosphopeptide signals in liquid chromatography-mass spectrometry data for protein phosphorylation analysis[J]. Journal of Proteome Research, 2007, 6(5): 1812-1821.
[19] Noy T, Vergnolle O, Hartman T E, et al. Central role of pyruvate kinase in carbon co-catabolism ofMycobacteriumtuberculosis[J]. Journal of Biological Chemistry, 2016, 291(13): 7060.
[20] Sah S, Aluri S, Rex K, et al. One-Carbon metabolic pathway rewiring inEscherichiacolireveals an evolutionary advantage of 10-formyltetrahydrofolate synthetase (Fhs) in survival under hypoxia[J]. Journal of Bacteriology, 2015, 197(4): 717-726.
(责任编辑:曾小军)
Analysis of Phosphoproteome ofStreptococcuspyogenes
ZENG Guan-di, HE Jiao-jiao, SUN Xue-song*
(Institute of Life and Health Engineering, Jinan University, Guangzhou 510632, China)
Streptococcuspyogenesis a Gram-positive pathogen, and it seriously threatens the health of human and fowls. The whole cell proteins inS.pyogeneswere digested into peptide fragments by using trypsin solution. The phosphopeptides inS.pyogeneswere enriched through using a TiO2enrichment kit, and the enriched phosphopeptides were analyzed by Finnigan Surveyor HPLC system and LTQ-Orbitrap mass spectrometer. A total of 167 phosphopeptides corresponding to 57 phosphorylated proteins were identified. The bioinformatics analysis revealed that these phosphoproteins mainly took part in the biosynthesis of cells, metabolism of cell organic matter and its derivatives, signal transduction, genetic transcription, biological stress and so on. The interactive networks of these 57 phosphorylated proteins were analyzed by using STRING software, and 7 interactive networks of phosphorylated proteins were found. The phosphoproteome ofS.pyogenescan provide the theoretical foundation for the deep study on the molecular mechanism of bacterial virulence and antibiotic resistance, and the new view for the development of novel anti-bacterial drugs.
Phosphoproteome;Streptococcuspyogenes; LTQ-Orbitrap; STRING
2016-09-01
国家自然科学基金(21571082)。
曾观娣(1988─),女,广东化州人,硕士研究生,从事细菌耐药研究。*通讯作者:孙雪松。
Q51
A
1001-8581(2017)05-0005-07
