产气荚膜梭菌α蛋白的高效可溶性表达与基因工程亚单位疫苗的制备
2017-06-09王传彬杨天意宋晓晖
孙 雨,杨 林,王传彬,董 浩,杨天意,宋晓晖
(中国动物疫病预防控制中心,北京 102600)
疾病防控
产气荚膜梭菌α蛋白的高效可溶性表达与基因工程亚单位疫苗的制备
孙 雨,杨 林,王传彬,董 浩,杨天意,宋晓晖
(中国动物疫病预防控制中心,北京 102600)
通过优化α蛋白的密码子、去除蛋白信号肽、选择亲水性与抗原性较好的序列、优化表达条件等方法,在大肠杆菌表达系统中获得了高效表达的产气荚膜梭菌可溶性重组α蛋白,用该蛋白免疫小鼠,再用间接ELISA方法测定血清抗体水平。结果表明:针对A型、B型、C型和D型产气荚膜梭菌的保护率分别为100%、90%、85%和90%,小鼠三免后7~14 d抗体效价达到峰值。该研究表达的α蛋白具有较好的免疫原性,可进一步用于研制预防产气荚膜梭菌的基因工程亚单位疫苗。
产气荚膜梭菌;α蛋白;可溶性表达与纯化;基因工程亚单位疫苗
产气荚膜梭菌(Clostridium perfringens)是临床上气性坏疽病原菌中最多见的一种梭菌,因能分解肌肉和结缔组织中的糖,产生大量气体,导致组织严重气肿,继而影响血液供应,造成动物机体组织大面积坏死,加之本菌在体内能形成荚膜,故名产气荚膜梭菌[1]。反刍动物的气性坏疽、肠毒血症、出血性肠炎、牛羊猝死症、羔羊痢疾均由产气荚膜梭菌引起[2]。α毒素是产气荚膜梭菌所有毒素基因中最重要的一种外毒素,A、B、C、D、E等5个型的细菌均可产生该毒素[3-5]。编码α毒素的基因plc位于染色体上,大小为1 194 bp,可以编码398个氨基酸,分子量为42.5 ku,其中成熟肽和信号肽分别由370个氨基酸和28个氨基酸组成。目前国内外学者对α毒素基因的功能及其致病机理研究较多。α毒素的致病机理就是依靠鞘磷脂酶和磷脂酶C两种酶活性,将细胞膜的膜磷脂进行水解,从而破坏细胞膜结构,导致细胞快速裂解死亡,同时该毒素对胰酶敏感,接触后容易丧失活性[6-8]。α毒素基因相对保守,虽然不同菌株之间平均有1.3%的核苷酸以及1.2%的氨基酸序列不同,但这些核苷酸与编码氨基酸的不同并不影响α毒素本身的活性[9-12]。α毒素基因的启动子能被大肠杆菌的RNA聚合酶所识别,因而α毒素在自身启动子下不仅可在产气荚膜梭菌本身高效表达,也可在大肠杆菌中得到高效表达。笔者等尝试在大肠杆菌表达系统中表达产气荚膜梭菌可溶性重组α蛋白,并用其制备预防产气荚膜梭菌的基因工程亚单位疫苗。
1 材料与方法
1.1 材料
载体:pET30a融合表达载体购自Novagen公司;感受态细胞:BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;酶和试剂:限制性内切酶BamHⅠ及XhoⅠ、T4DNA连接酶、2000 DNA Marker、SDS、IPTG、Taq PCR Master Mix均购自宝生物(大连)工程有限公司;琼脂糖、DNA Extraction Kit、DNA快速纯化回收试剂盒、质粒快速提取试剂盒均购自北京全式金生物技术有限公司;预染蛋白Marker购自Fermentas公司;蛋白纯化柱(镍柱5 mL)、分子筛(Superdex2000)购自GE公司;HRP标记羊抗鼠IgG、弗氏完全佐剂与不完全佐剂购自Sigma公司。基因合成:融合蛋白目的基因序的合成由华大基因生物科技有限公司完成。菌株:A型产气荚膜梭菌C57-10、B型产气荚膜梭菌C58-5、C型产气荚膜梭菌C59-4、D型产气荚膜梭菌C60-11均购自中国兽医药品监察所。
1.2 方法
1.2.1 α重组基因的合成与引物设计 通过去除蛋白信号肽、优化密码子序列设计了α重组基因。根据α重组基因的序列设计1对引物,并分别在引物5’端添加BamHⅠ和3’端添加XhoⅠ酶切位点,用于目的片段的扩增(下划线部分为酶切位点)。
上游引物F:5’-GGATCCATGTTTTGGGACCCGGACACCGAC-3’
下游引物R:5’-CTCGAGTTATTTGATGTTATAGGTGCTGT-3’
1.2.2 高效可溶性融合表达载体pET30a-α的构建及鉴定 将pET30a载体进行BamHⅠ和XhoⅠ双酶切,酶切体系为40 μL:10×酶切缓冲液4 μL,BamHⅠ和XhoⅠ各1 μL,载体24 μL,去离子水8 μL,酶切产物经过1%琼脂糖电泳后胶回收试剂盒回收。然后将酶切好的载体与扩增后的α编码基因序列进行连接,构建10 μL的连接体系。其中,α编码基因片段5.5 μL,pET30a载体1.5 μL,T4DNA连接酶1 μL,T4DNA连接缓冲液2 μL。轻敲管壁,上下颠倒混匀之后瞬离,放22℃连接仪中连接4h。将重组质粒进行双酶切鉴定及测序分析,将测序鉴定为阳性的质粒命名为pET30a-α。
1.2.3 连接产物的转化 将pET30a-α连接产物转化进BL21(DE3)细胞中。无菌条件下,取适量BL21菌液加到LB(Kan+)固体培养基平板上,将菌液涂布均匀,待菌液完全吸收后,做好标记,倒置于37℃恒温培养箱中,静置培养16 h。挑取单克隆菌落分别进行菌液鉴定、酶切鉴定、菌液测序,确定α片段转化进pET30a载体中。
1.2.4 重组蛋白可溶性诱导表达条件的建立 将上述鉴定的重组表达质粒转化至感受态菌E.coll BL21(DE3)中,挑取阳性克隆,37℃培养过夜。将菌液以1∶100接种于含卡那霉素(50 μg/mL)的液体LB培养基中,于37℃、200 r/min培养至OD值为0.4~0.6时,取出l mL未诱导的菌液作为对照,其余液体中加入异丙基硫代-B-D-半乳糖苷(IPTG)诱导蛋白的表达。经过对温度、时间、IPTG浓度等条件进行优化,最终确定蛋白高效可溶性诱导表达条件为:0.75 mmol/L的IPTG浓度,过夜诱导13 h大量表达后,于4℃、8 000 r/min离心30 min收集菌体。经高压大规模破碎菌体后,于4℃、16 000 r/min离心30 min收集上清。
1.2.5 重组蛋白表达形式的分析 取IPTG诱导表达13 h后的菌液用于蛋白表达形式分析。取1 mL诱导后的重组菌液置于1.5 mL离心管中,做好标记,4℃、8 000 r/min离心30 min,弃掉上清液,收集菌体沉淀。加入1 mL PBS重悬沉淀,8 000 r/min离心5 min,弃掉上清液。向洗涤好的菌体沉淀中加入200 μL PBS,高压破碎菌体,裂解至菌液不再粘稠。于4℃离心机中16 000 r/min离心30 min,将上清转移至新的1.5 mL离心管中,向剩余的沉淀中加入50 μL PBS重悬沉淀。向上清和沉淀中加入10 μL 5× SDS-PAGE loading Buffer,充分混匀后,置沸水浴中煮沸5 min,待样品冷却后,用掌式离心机瞬离。取10 μL用于SDS-PAGE电泳分析。
1.2.6 可溶性重组蛋白的AKTA系统高效纯化 菌液高压破菌后,于4℃、16 000 r/min离心30 min,弃沉淀,上清用 0.22 μm滤膜过滤,后上样至预先用20 mmol/L Tris、150 mmol/L NaCl的溶液(pH值8.0)平衡好的镍柱。将镍柱接入AKTA机上,分别用10个柱体积的20mmol/L Tris、150 mmol/L NaCl的溶液(pH值8.0)与20 mmol/L Tris、150 mmol/L NaCl、50 mmol/L咪唑的溶液(pH值8.0)清洗镍柱中的杂质蛋白,并在AKTA机上监测蛋白峰。用 20 mmol/L Tris、150 mmol/L NaCl、300 mmol/L咪唑的溶液(pH值8.0)冲洗镍柱上的目的蛋白,并使用AKTA收集出现目的蛋白峰的洗脱样品。
1.2.7 重组蛋白表达的鉴定 将纯化后的蛋白进行SDSPAGE电泳,并转移至NC膜上,用10%的BSA进行封闭,以产气荚膜梭菌阳性血清为一抗,兔抗鼠IgG-HRP(1∶20 000)为二抗,通过western-blot方法鉴定蛋白的特异性。
1.2.8 抗产气荚膜梭菌疫苗的制备 将使用分子筛纯化的α蛋白用无菌PBS溶解,得到浓度为1 000 μg/mL的α溶液,脱毒后用于免疫。将α溶液与弗氏佐剂按1∶1等体积混合,乳化制备油乳剂疫苗,将其命名为首免疫苗。将α溶液与不完全弗氏佐剂按1∶1等体积混合,乳化制备油乳剂疫苗并脱毒,将其命名为二免疫苗。
1.2.9 细菌对小鼠最小致死量的测定 取体重在18~22 g之间的雌性小鼠100只,随机将其分成4组(A组、B组、C组和D组),每组各25只。将每组再随机分成5个小组,每个小组各5只小鼠,第1小组腹腔注射浓度为1×1010CFU/mL的菌液1 mL,第2小组注射0.8 mL,第3小组注射0.6 mL,第4小组注射0.4 mL,第5小组注射0.2 mL,并设10只PBS对照组。A组接种A型产气荚膜梭菌(C57-10)菌液,B组接种B型产气荚膜梭菌(C58-5)菌液,C组接种C型产气荚膜梭菌(C59-4)菌液,D组接种D型产气荚膜梭菌C60-1株菌液。于接种后一周内观察并记录小鼠的存活情况。
1.2.10 产气荚膜梭菌攻毒试验 将80只体重在18~22 g的雌性昆明小鼠随机分成4组(攻毒剂量组20只,并另设20只小鼠的PBS对照组)。攻毒剂量组,首次免疫、第2次免疫与第3次免疫均采用皮下注射的方法,首次免疫用首免疫苗,第2次免疫与第3次免疫用二免疫苗,每次免疫剂量均为每只0.2 mL(重组蛋白免疫剂量为每只100 μg);PBS对照组中的每只小鼠首次免疫、第2次免疫与第3次免疫均皮下注射0.2 mL PBS。首次免疫之前,先对小鼠进行一次割尾采血,分离血清,用作阴性对照血清。首次免疫后,间隔14 d进行第2次免疫,二免后14 d进行第3次免疫。第3次免疫2周后每只攻毒剂量组小鼠和每只PBS对照组小鼠腹腔注射各型产气荚膜梭菌。根据1.2.9中确定的细菌最小致死量进行攻毒,具体的攻毒剂量为A型产气荚膜梭菌(编号:C57-10)1.5× 109CFU、B型产气荚膜梭菌(编号:C58-5)为2×109CFU、C型产气荚膜梭菌(编号:C59-4)为1.5×108CFU、D型产气荚膜梭菌(编号:C60-1)为1.8×109CFU。
1.2.11 疫苗免疫后小鼠体内抗体水平消长规律研究 对5只注射疫苗的对照组小鼠进行体内抗体水平消长规律检测,自一免后开始每周采血一次,分离血清,于-80℃冰箱保存,采用间接ELISA方法检测免疫动物抗体水平。具体步骤:用分子筛纯化的α蛋白包被ELISA板,采用棋盘方阵滴定法确定蛋白最适包被浓度和最佳血清稀释度,以不同浓度的BSA封闭酶标板确定最佳封闭液浓度,优化酶标二抗工作浓度、反应时间等条件,阳性血清与阴性血清的OD450比值(P/N)最大的孔所对应的反应条件为ELISA方法的最佳反应条件。按照上述间接ELISA方法检测试验小鼠初次免疫后0~12周的小鼠血清中抗体效价水平。
2 结果
2.1 重组质粒的鉴定
使用BamHⅠ和XhoⅠ内切酶对重组质粒pET30a-α进行双酶切鉴定,结果(见图1)表明,酶切产物于924 bp处出现一条明显的条带,说明目的片段成功克隆至pET30a载体中。
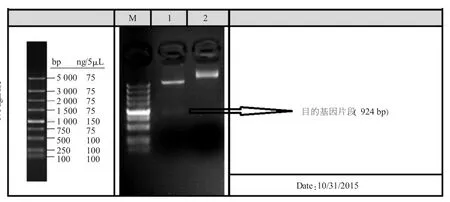
图1 重组质粒的酶切鉴定图谱
2.2 诱导表达产物的鉴定与表达形式分析
将诱导后的菌体制样后进行SDS-PAGE电泳,结果表明在41 kD处出现一条明显的条带,与预期结果相符,表明成功获得重组蛋白pET30a-α(见图2)。将重组蛋白α与产气荚膜梭菌阳性血清反应,结果显示该重组蛋白可被产气荚膜梭菌阳性血清所识别,具有良好的免疫反应性(见图3)。通过SDS-PAGE鉴定重组蛋白的表达形式,结果融合蛋白均为可溶性表达。本实验应用pET30a构建的pET30a-α载体,经过可溶性诱导表达条件的不断优化,表达的可溶性重组蛋白占总蛋白的比例非常高。通过NanoDrop 2000超微量分光光度计(ND 2000)对得到的蛋白纯度进行定量分析,并结合蛋白灰度分析软件分析蛋白含量,结果表明,大部分α融合蛋白以可溶性的形式存在于细菌破碎菌体的上清液中,可溶性蛋白目的条带表达明显,上清液中杂质较少(见图2)。

图2 纯化的目的蛋白的SDS-PAGE电泳图谱

图3 蛋白的Western-blotting鉴定
2.3 可溶性蛋白的AKTA系统高效纯化
将镍柱接入AKTA系统,分别用10个柱体积的20 mmol/L Tris、150 mmol/L NaCl的溶液(pH值8.0)与20 mmol/L Tris、150 mmol/L NaCl、50 mmol/L咪唑的溶液(pH值8.0)清洗镍柱中的杂质蛋白,并在AKTA机器上监测蛋白峰。用20 mmol/L Tris、150 mmol/L NaCl、300 mmol/L咪唑的溶液(pH值8.0)冲洗镍柱挂在镍柱上的目的蛋白,并使用AKTA收集出现目的蛋白峰的洗脱样品。通过紫外吸收可以发现,目的蛋白峰与杂质峰能够有效分离。使用分子筛对获得的目的蛋白进一步纯化,可得到纯度更高的目的蛋白,并发现该重组蛋白的结构为单体结构(见图4)。

图4 重组蛋白α-his的AKTA系统纯化鉴定结果
2.4 产气荚膜梭菌攻毒试验结果
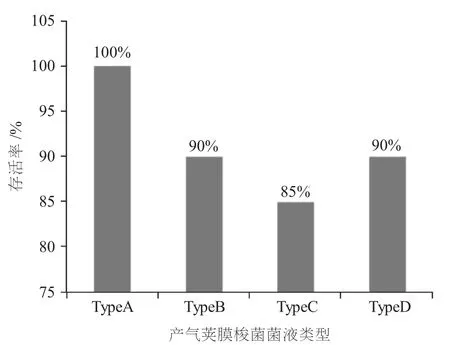
攻毒剂量组(免疫α-his)对各型产气荚膜梭菌的攻击均具有一定的免疫保护效果。攻毒剂量组(免疫α-his)抗A型产气荚膜梭菌攻击7 d内的免疫保护率为100%(20只全部存活),PBS对照组小鼠全部死亡;攻毒剂量组(免疫α-his)抗B型产气荚膜梭菌攻击的免疫保护率为 90%(18只存活,2只死亡),PBS对照组小鼠全部死亡;攻毒剂量组(免疫α-his)抗C型产气荚膜梭菌攻击的免疫保护率为 85%(17只存活,3只死亡),PBS对照组小鼠全部死亡;攻毒剂量组(免疫α-his)抗D型产气荚膜梭菌攻击的免疫保护率为90%(18只存活,2只死亡),而PBS对照组小鼠全部死亡。详见图5。
2.5 疫苗免疫后小鼠体内抗体水平消长规律
将纯化后的α蛋白作为诊断抗原包被酶标板检测小鼠免疫抗原或者攻毒后的血清抗体,发现α蛋白作为诊断抗原建立的检测方法均具有非常好的灵敏性与特异性。结果如表1所示,α蛋白质量浓度为5 μg/mL、血清稀释倍数为1∶200时,P/N值最大(P/N值≥2.1时样品判为阳性),因此确定抗原的最佳包被浓度为5 μg/mL,血清稀释倍数为1∶200。同时本实验确定HRP标记的羊抗鼠IgG按1∶20 000的比例稀释、37℃作用1 h、加入TMB显色液8 min后OD450值最佳。分别检测各实验组中小鼠首免后0~12周的血清中抗体效价水平,结果表明,α融合毒素蛋白免疫组抗体效价有明显升高,在二免后抗体效价快速上升,小鼠三免后7~14 d抗体效价达到峰值。详见图6。

表1 ELISA检测方法的反应条件优化结果

图6 小鼠免疫血清抗体消长曲线
3 讨论
产气荚膜梭菌主要的致病因素是其分泌的外毒素,种类多达13种,其中α毒素是最主要的外毒素,根据产生外毒素的种类不同,可将产气荚膜梭菌分为A、B、C、D、E五个主要血清型。产气荚膜梭菌的α毒素导致的动物传染病是当前动物疫病防控工作的主要难题之一。传统疫苗在治疗和预防动物产气荚膜梭菌疾病方面虽然取得了一定的效果。但这些疫苗易引起动物局部炎症以及毒性反应等。研发能表达α外毒素抗原蛋白,并且不破坏α外毒素抗原蛋白的免疫原性,对产气荚膜梭菌α外毒素引起的疫病起到防控作用的基因工程疫苗是急需解决的技术难题[13-16]。
α毒素是5种类型产气荚膜梭菌共有的毒素,也是A型产气荚膜梭菌的主要毒素,因其具有强启动子,所以该毒素不仅可在产气荚膜梭菌本身中高效表达,也可在大肠杆菌中得到高效表达。此外,也可将其置于其他启动子下,转化大肠杆菌后获得高效表达。这一点十分有利于α毒素作为基因工程疫苗的研究[17]。林明辉等[18]在成功构建重组高效表达工程菌株pBV220cpa408的基础上,实现了α基因在大肠杆菌中的部分可溶性表达,表达量达43.75%,用纯化可溶性蛋白免疫昆明小鼠,被免疫小鼠获得了较高的保护。许崇波等[19]克隆了第68位氨基酸残基后面的α毒素基因片段,并将其置于T7启动子下,转化入BL21(DE3)中表达。结果α毒素基因得到高效表达,其表达产物丧失了α毒素本身的活性,经IPTG诱导后,其表达量占菌体总蛋白的33.21%,而且保留了α毒素绝大部分的免疫原性。Zeng等[14]构建了产气荚膜梭菌α蛋白,并获得了一定的免疫保护性。Bai等[20]将产气荚膜梭菌α基因进行重组表达,表达产物具有良好的免疫原性。李娜[21]对羊源产气荚膜梭菌进行了分离鉴定并对α毒素的原核表达和免疫原性做了研究,并设计针对a毒素成熟肽序列的引物,采用PCR方法扩增α毒素成熟肽序列,将其插入质粒pET-28b构建重组表达载体pET-28b-cpa,用重组蛋白制备亚单位疫苗免疫小鼠,结果表明,重组α毒素可以刺激产生抗α毒素抗体免疫应答反应,免疫抗体在免疫后28 d达到最高水平(1∶6 400),并能够对免疫小鼠提供一定的免疫保护作用。但是该重组质粒表达出的蛋白为部分可溶性蛋白,可溶性蛋白表达量占菌体可溶性蛋白的34.6%。
现有技术中对产气荚膜梭菌主要外毒素蛋白的表达与纯化方法相对复杂,表达产物通常以不溶性的包涵体形式存在,可溶性蛋白表达的报道在国内外非常少。因为包涵体中的表达产物不具有生物学活性,因而需要进行变性与复性处理。蛋白的变性与复性是一个极其复杂的过程,不同蛋白的复性条件各异,复性率往往很难提高。这是限制其应用的主要制约因素。采用可溶性表达方式可克服这一问题。构建可溶性表达载体并优化可溶性蛋白的高效表达方法,是本领域长期以来一直研究的热点课题。
本研究通过优化密码子、切除蛋白信号肽、优化表达条件等多个环节进行反复探索,成功地在大肠杆菌中获得了可溶性高表达抗原。大肠杆菌表达水平高,生产成本低,利用大肠杆菌获得高表达的活性蛋白,为进一步开发基因工程亚单位疫苗奠定了良好的基础。本研究以高效表达的α重组蛋白为基础,研制出了抑制产气荚膜梭菌感染的融合蛋白疫苗。该疫苗免疫动物后可使动物产生较高的血清抗体水平,并且可抵抗产气荚膜梭菌的攻击。该疫苗在抵抗A型、B型、C型和D型产气荚膜梭菌攻击时的免疫保护率分别为100%、90%、85%和90%,最高抗体效价可达1∶128 000。综上所述,该研究构建的α重组蛋白可以作为预防动物产气荚膜梭菌感染疫苗研究的方向,为下一步研制产气荚膜梭菌毒素基因工程亚单位疫苗奠定了基础,该重组菌株有望作为产气荚膜梭菌基因工程疫苗的候选生产菌株。
[1] 田克恭.人与动物共患病[M].北京:中国农业出版社,2013.
[2] Mueller-Spitz S R,Stewart L B,Klump J V,et al.Freshwater suspended sediments and sewage are reservoirs for enterotoxin-positive Clostridium perfringens[J].Applied and Environmental Microbiology, 2010,76(16):5556-5562.
[3] Lebrun M,Mainil J G,Linden A.Cattle enterotoxaemia and Clostridium perfringens:description,diagnosis and prophylaxis[J].Veterinary Record:Journal of the British Veterinary Association,2010,167(1): 13-22.
[4] Glenn Songer J,Miskimins D W.Clostridial abomasitis in calves:Case report and review of the literature [J].Anaerobe,2005,11(5): 290-294.
[5] 张红英,杨霞,卢中华.魏氏梭菌肠毒素研究进展[J].中国畜牧兽医,2004,9(1):83-85.
[6] MorrisWE.ToxinsofClostridium perfringens[J].RevistaArgentinade Microbiologia,2009,41(4):251-260.
[7] Ewoldt J M,Anderson D E.Determination of the effect of single abomasal or jejunal inoculation of Clostridium perfringens type A in dairy cows[J].The Canadian VeterinaryJournal,2005,46(9):821-824.
[8] Kalender H,Kilic A,Atil E.Enterotoxemia in a cowdue to Clostridium perfringens type A[J].Turkish Journal ofVeterinaryand Animal Sciences,2009,31(1):83-84.
[9] Lebrun M.The expression ofClostridium perfringens consensus beta-2 toxin is associated with bovine enterotoxemia syndrome[J].Vet Microbiol,2007,120:151-157.
[10] Wang G,Zhou J,Zheng F,et al.Detection of different genotypes of Clostridium perfringens in feces of healthy dairy cattle from China using real-time duplex PCR assay[J].Pakistan Veterinary Journal, 2011,31(2):120-124.
[11] Savic B,Prodanovic R,Ivetic V,et al.Enteritis associated with Clostridium perfringens type A in 9 month old calves[J].The Canadian VeterinaryJournal,2012,53(2):174.
[12] Muylaert A,Lebrun M,Duprez J N,et al.Enterotoxaemia-like syndrome and Clostridium perfringens in veal calves[J].Veterinary record:Journal of the British Veterinary Association,2010,167(2): 64-65.
[13]Pilehchian Langroudi R,Shamsara M,Aghaiypour K.Expression of Clostridium perfringens epsilon-beta fusion toxin gene in E.coli and its immunologic studies in mouse[J].Vaccine,2013,31(32): 3295-3299.
[14]Zeng J,Deng G,Wang J,et al.Potential protective immunogenicity of recombinant Clostridium perfringens α-α-β1fusion toxin in mice,sows and cows[J].Vaccine,2011,29(33):5459-5466.
[15]Miyamoto K,Li J,Sayeed S,et al.Sequencing and diversity analyses reveal extensive similarities between some epsilon-toxin-encoding plasmids and the CPF5603 Clostridium perfringens enterotoxin plasmid[J].Journal ofBacteriology,2008,190(21):7178-7188.
[16]Chandran D,Naidu SS,Sugumar P,et al.Development ofa recombinant epsilon toxoid vaccine against enterotoxemia and its use as a combination vaccine with live attenuated sheep pox virus against enterotoxemia and sheep pox[J].Clinical and Vaccine Immunology,2010,17(6):1013-1016.
[17]LobatoF C F,Lima C G,Assis R A,et al.Potency against enterotoxemia of a recombinant Clostridium perfringens type D epsilon toxoid in ruminants[J].Vaccine,2010,28(38):6125-6127.
[18]林明辉,荫俊,邢洪光,等.重组A型产气荚膜梭菌毒素保护性抗原的制备及初步免疫保护作用研究[J].生物工程学报,2004,20(1):63-65.
[19]许崇波,朱平,姚湘燕,等.A型产气荚膜梭菌α毒素保护性抗原基因的高效表达[J].卫生研究,1998,27(S1):49-52.
[20]Bai J N,Zhang Y,Zhao B H.Cloning of alpha-beta fusion gene from Clostridium perfringens and its expression[J].World Journal of Gastroenterology,2006,12(8):1229-1234.
[21]李娜.羊源产气荚膜梭菌的分离鉴定与α毒素的原核表达和免疫原性研究[D].新疆石河子:石河子大学,2013.
Efficient and Soluble Expression of α Protein of Clostridium perfringens and the Preparation of Genetic Engineering Subunit Vaccine
Sun Yu,YangLin,SongXiaohui,et al
(China Animal Disease Control Center,Beijing102600,China)
According to optimization of codon,removal of the signal peptide,selection on better hydrophilicity and antigenic sequences,and optimization of the expression conditions in this study,the soluble α fusion protein was obtained in Escherichia coli expression system.The results showed that the serum antibody level increased obviously after immuning,and it could resist the attack of Clostridium perfringens.The vaccine could resist the attack of type A,B,C and D of Clostridium perfringens,and the immune protection rate in mouse were 100%,90%,85%and 90%,respectively.After the third immune,the antibody titer in mice reached a peak at 7 to 14 days.The vaccine can be used to control the disease caused by Clostridium perfringens infection,and it has a good application prospect.
Clostridium perfringens;α protein;soluble expression and purification;genetic engineeringsubunit vaccine
S851
A
2095-3887(2017)03-0040-06
10.3969/j.issn.2095-3887.2017.03.011
2017-04-01
十三五国家重点研发计划(2016YFD0500901)
孙雨(1983-),男,兽医师,博士,主要从事人畜共患病预防控制研究。
宋晓晖(1978-),女,高级兽医师,博士,主要从事草食动物与人畜共患病预防控制研究。
