投喂模式对吉富罗非鱼摄食和生长的影响
2017-06-07赵美娜赵早亚孙彩云李文笙
赵美娜,赵早亚,孙彩云,李文笙
(有害生物控制与资源利用国家重点实验室/广东省水生经济动物良种繁育重点实验室/中山大学深圳研究院/中山大学生命科学学院,广东 广州 510006)
投喂模式对吉富罗非鱼摄食和生长的影响
赵美娜,赵早亚,孙彩云,李文笙
(有害生物控制与资源利用国家重点实验室/广东省水生经济动物良种繁育重点实验室/中山大学深圳研究院/中山大学生命科学学院,广东 广州 510006)
以不同的投喂水平(100%、90%、80%、70%、60%、50%饱食投喂量)、每天投喂两次,不同的投喂频率(每天分别投喂1、2、3、4次)但日投喂总量(100%饱食投喂量)相同、分别投喂吉富罗非鱼幼鱼8周,分析不同投喂水平和投喂频率对吉富罗非鱼摄食生长性能、白肌生化组成及相关摄食因子mRNA转录水平的影响。结果表明,投喂水平较高或较低均会导致饲料系数和下丘脑NPY mRNA转录水平升高,特定生长率、饲料转化率和CCK1 mRNA转录水平降低,白肌生化成分中只有粗脂肪含量受投喂水平的影响达到显著性差异;投喂频率对罗非鱼生长各指标的影响均未达到显著性差异,但可观察到各指标的变化趋势,投喂频率过高或过低均会导致吉富罗非鱼的饲料转化率、特定生长率降低,饲料系数、下丘脑NPY mRNA转录水平升高,白肌各种生化成分含量随投喂频率的增加均有先升后降的趋势,全脑CCK1 mRNA转录水平则逐渐降低,全脑Orexin mRNA转录水平逐渐升高。综合分析各种指标,吉富罗非鱼的最适投喂水平为80%饱食投喂量,每天投喂两次。
吉富罗非鱼;投喂模式;生长摄食;生化成分;mRNA转录水平
罗非鱼(Oreochromis niloticus)具有繁殖力高、耐低氧、抗病力强、食杂性等特点,适宜进行集约化养殖,是国际养殖最广泛的鱼种之一[1]。但在集约化水产养殖中,饵料投喂多基于养殖者的经验,且大部分情况下为了获得更高的产量而过量投喂,从而导致饲料残饵过多、饲料系数升高、养殖成本增加、污染水质、引发鱼病,养殖品质与养殖效益不高,影响罗非鱼养殖的可持续发展。近年来,国内外对水产动物的研究主要集中在营养需求、原料替代等方面,而在投喂模式方面少有研究,如娄方瑞等[2]研究了不同投饲率对罗非鱼生长及养殖水质的影响,韩春艳等[3]研究了多重循环“饥饿-投喂”模式对奥尼罗非鱼生长及体内脂类代谢的影响,段国庆等[4]研究了投喂水平对黄鳝幼鱼生长的影响,李滑滑等[5]研究了摄食水平和投喂频率对大菱鲆幼鱼生长及生化成分的影响。此外,也有学者通过禁食-恢复投喂和脑室注射研究了NPY[6]、Orexin[7]、CCK[8]作为摄食因子对鱼类生长和摄食的影响。以上研究表明,最优的投喂水平和投喂频率可以促进鱼类的生长。然而,投喂水平和投喂频率对罗非鱼生长和摄食的研究却未见报道。鉴于此,本研究通过测定不同投喂水平和不同投喂频率下罗非鱼生长参数、白肌生化组成及摄食相关因子mRNA表达水平的变化,以期探索罗非鱼的最佳投喂模式,并为投喂模式对摄食生长的影响机制找到新的科学依据。
1 材料与方法
1.1 试验材料
投喂试验在透明塑料大棚内进行,光照为自然光照。吉富罗非鱼购自广东罗非鱼良种场同一批孵化鱼苗,且为当年鱼种。投喂水平试验鱼共270尾,初始体重14.35(±1.32) g;投喂频率试验鱼共180尾,初始体重12.27(±0.33) g。
试验用饲料为太阳鱼膨化颗粒配料饲料,其营养成分为:粗蛋白≥37%,粗灰分≤12%,粗纤维≤6%,水分≤12%,钙0.5%~3.5%,总磷≥0.8%,食盐0.5%~3.5%,赖氨酸≥1.2%。
待检基因的定量PCR引物:根据NCBI GenBank中各个物种的需检测基因的cDNA序列保守区域,设计简并引物用于扩增中间片段。引物序列见表1。

表1 目标基因的定量PCR引物
1.2 试验方法
挑选规格整齐、健康活泼的试验鱼,随机放入敞口尼龙网箱中,每个网箱15尾,每天9:00、15:00分别投喂相同量的饲料,驯化2周后进行试验。(1)投喂水平试验:每天投喂2次,设投喂饱食量的100%、90%、80%、70%、60%、50%共6个水平,3次重复。饱食投喂量水平(%)投喂1 h后,将剩余饲料捞出计数,根据每颗饲料的平均重量,计算剩余饲料重量。(2)投喂频率试验:设每天1、2、3、4次4种投喂频率,每次投喂量分别为1、1/2、1/3、1/4饱食投喂量。正式投喂试验持续56 d(2016年5月12日至7月10日),每隔4 d调整1次投喂量,每隔2周测鱼体全长、体重1次,每次测定前将鱼饥饿24 h。投喂试验结束后,将试验鱼饥饿1 d,然后测定鱼体全长、湿重,每个网箱分别随机取7尾鱼,取全脑、下丘脑、垂体,立即置于1.5 mL RNase free的EP管中,液氮速冻,转存于-80℃超低温冰箱中保存备用;将剩余8尾鱼去鱼皮,取背部白肌,贮存于-20℃冰箱中用于测定生化成分。
1.3 测定指标及方法
生化指标:从-20℃冰箱中取出罗非鱼背部白肌,采用凯氏定氮法、索氏抽提法、马弗炉灼烧法分别测定罗非鱼背部白肌粗蛋白、粗脂肪、粗灰分含量。
摄食相关因子:从-80℃冰箱中取出罗非鱼全脑和下丘脑,采用TRIzol(Invitrogen)法提取总RNA,并检测RNA纯度及完整度;按照Toyobo Rever Tra Ace-α-First strand cDNA Synthesis试剂盒进行反转录,采用Realtime PCR Master Mix (SYBR Green)试剂盒(Toyobo,日本)对罗非鱼全脑CCK1、下丘脑NPY、Orexin mRNA表达水平进行检测。
1.4 数据处理及统计
试验数据用SPSS17.0软件进行单因子方差分析,采用Duncan’s法进行多重比较分析。罗非鱼摄食相关指标计算公式如下:式中,Id为累计饲料消耗量,W0、Wt分别为试验鱼初始体重和终末体重,t为试验时间(d)。

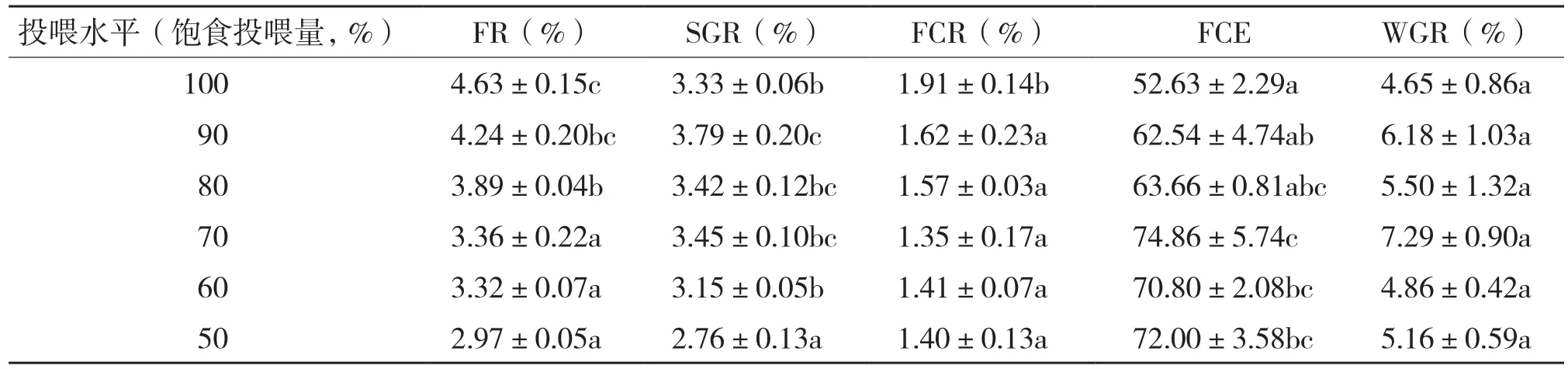
表2 投喂水平对吉富罗非鱼摄食生长的影响
2 结果与分析
2.1 投喂水平对吉富罗非鱼摄食生长和背部白肌生化成分的影响
2.1.1 摄食生长 在整个试验期间,不同投喂水平罗非鱼存活率均为100%。吉富罗非鱼的体重变化见图1,其中50%饱食投喂水平增重最小,90%、100%饱食投喂水平增重较大,其余投喂水平增重较小。

图1 不同投喂水平吉富罗非鱼体重的变化
从表2可以看出,不同投喂水平对吉富罗非鱼的摄食率(FR)、特定生长率(SGR)、饲料转化率(FCR)和饲料系数(FCE)的影响均达到显著水平,但对其末重变异系数(WGR)的影响不显著。其中,80%、90%饱食投喂水平的SGR均显著高于50%饱食投喂水平;70%饱食投喂量水平的FCE显著高于90%、100%饱食投喂水平,而与80%饱食投喂水平无显著差异;FR均随投喂水平的升高而缓慢升高。
2.1.2 背部白肌生化成分 不同投喂水平组鱼的背部白肌生化成分见表3。从表3可以看出,投喂水平只对背部白肌中粗脂肪的含量有显著影响,70%饱食投喂组粗脂肪含量显著高于50%饱食投喂组,而对粗蛋白和粗灰分含量的影响未达到显著水平。
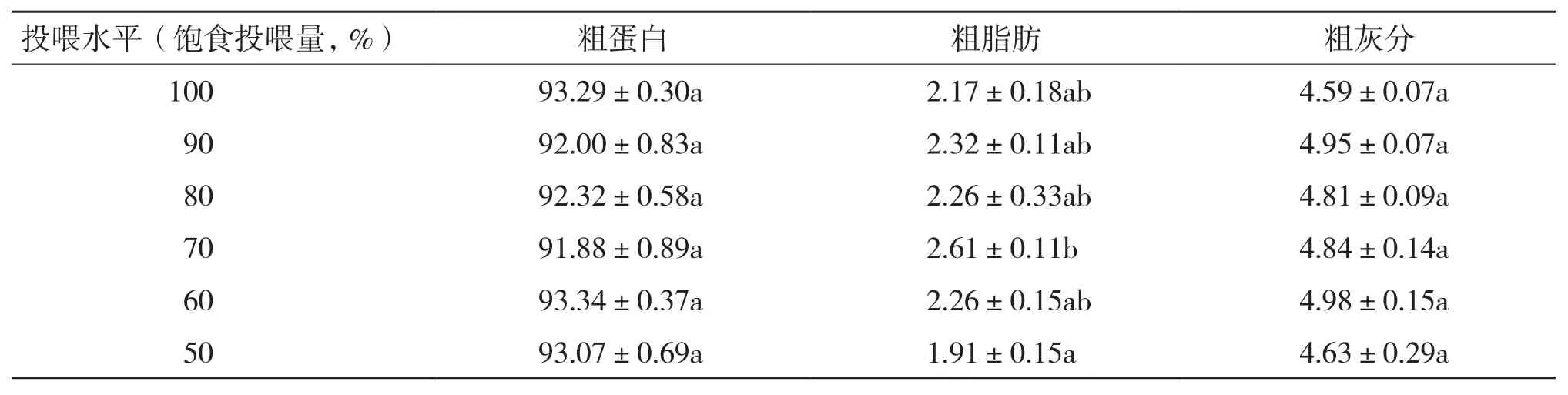
表3 投喂水平对吉富罗非鱼白肌生化成分的影响(%)
2.2 投喂频率对吉富罗非鱼摄食生长和背部白肌生化成分的影响
2.2.1 摄食生长 整个投喂试验期间,不同投喂频率的罗非鱼存活率均为100%,其FR、SGR、FCR和WGR见表4。从表4可以看出,随着投喂频率的增加,吉富罗非鱼的FR呈上升趋势,FCR先上升后降低,SGR先升高后降低,FCE呈先降低后升高的趋势,WGR先升高后降低,但各组间各指标的差异均未达到显著水平。

表4 投喂频率对吉富罗非鱼摄食生长的影响
2.2.2 背部白肌生化成分 从表5可以看出,不同投喂频率对罗非鱼白肌生化成分的影响均未达显著差异。
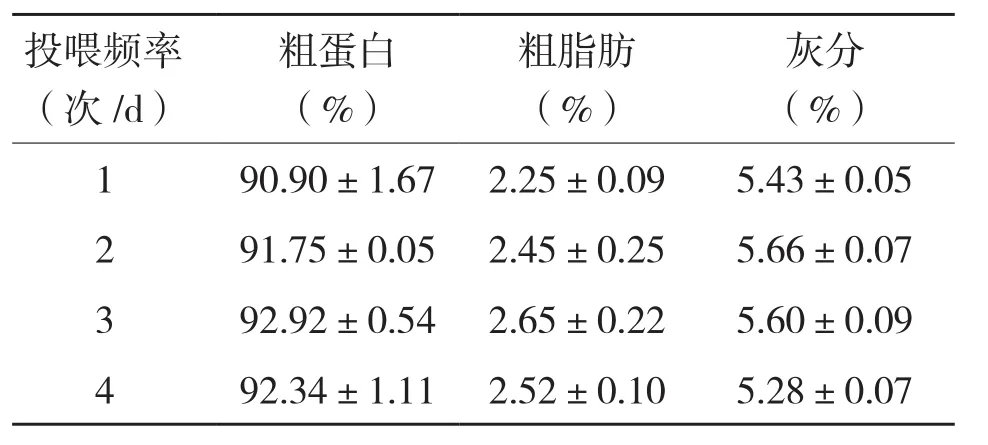
表5 投喂频率对吉富罗非鱼白肌生化成分的影响
2.3 投喂模式对吉富罗非鱼摄食因子表达的影响
2.3.1 投喂水平对吉富罗非鱼摄食因子表达的影响 不同投喂水平下,吉富罗非鱼摄食因子mRNA的表达水平差异见图2。由图2可知,100%、90%饱食投喂水平的鱼全脑CCK1 mRNA转录水平较低且显著低于80%、60%饱食投喂水平;随着投喂水平的降低,下丘脑NPY mRNA转录水平呈先降低后升高的趋势,其中80%饱食投喂水平的NPY mRNA转录水平显著低于100%、90%饱食投喂水平,但80%、70%、60%、50%饱食投喂水平间差异不显著;下丘脑Orexin mRNA转录水平以80%饱食投喂水平最低,显著低于100%、90%、70%、50%饱食投喂水平,而60%饱食投喂水平的罗非鱼下丘脑Orexin mRNA表达水平最高且显著高于其他投喂水平。
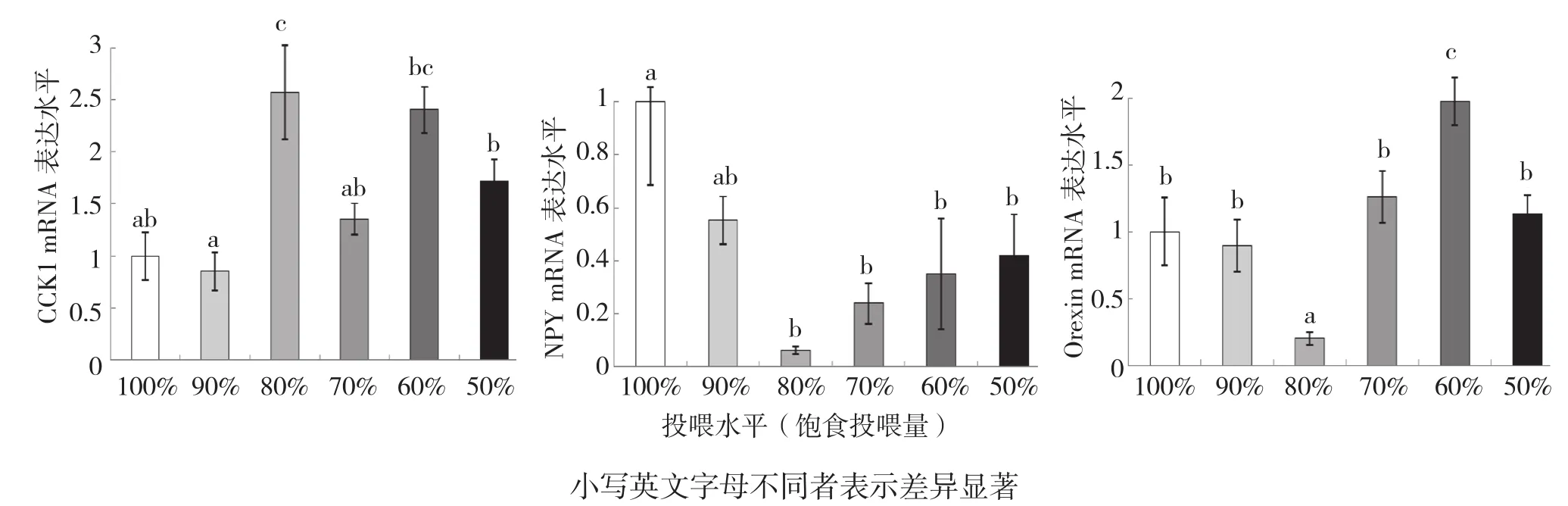
图2 投喂水平对吉富罗非鱼CCK1、NPY、Orexin mRNA转录水平的影响
2.3.2 投喂频率对吉富罗非鱼摄食因子表达的影响 当日投喂总量相同、投喂频率不同时,吉富罗非鱼摄食因子mRNA的表达水平差异见图3。由图3可知,投喂频率对罗非鱼全脑CCK1、下丘脑NPY、下丘脑Orexin mRNA转录水平的影响均未达到显著水平。
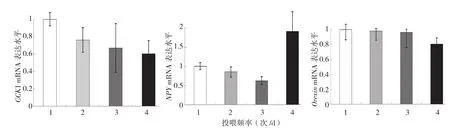
图3 投喂频率对吉富罗非鱼CCK1、NPY、Orexin mRNA转录水平的影响
3 结论与讨论
3.1 投喂模式对鱼体生长、摄食的影响
摄食生长关系模型受养殖鱼的种类、饵料组成和养殖环境的影响而表现不同,而大部分最优投喂模式的研究是建立在投喂模式和特定生长率或饲料转化效率的关系基础上[9]。本研究中,罗非鱼特定生长率(SGR)随投喂水平的增加呈先升后降的趋势,90%饱食投喂水平的SGR显著高于100%、50%饱食投喂水平,但与70%、80%饱食投喂水平无显著差异;摄食率(FR)随投喂水平的增加先升后平稳,在90%饱食投喂水平达到平稳期,与80%、100%饱食投喂水平无显著差异;饲料转化率(FCR)在70%饱食投喂水平最高,与80%饱食投喂水平没有显著差异。综上所述,80%饱食投喂水平是本试验得到的最适合投喂水平。这与张磊[10]“用SGR和FCR作为综合评价指标所得出的黄颡鱼幼鱼最佳投喂量为70%~80%饱食投喂量”的结果一致。此外,杨严鸥等[11]发现随着投喂水平的增加,黄颡鱼生长氮的比例显著提高,但在饱食2/3和饱食水平之间差异不显著。可见,摄食水平达到一定程度后,并不能增加鱼体的生长。
不同投喂频率对罗非鱼生长各指标的影响均无显著差异,而Biswas等[12]研究发现过高或过低的投喂频率均会引起武昌鱼生长缓慢、饲料转化率低、肠胃酶活性降低等。此外,不同投喂频率对点带石斑鱼[13]、大菱鲆[5]生长指标的影响与本试验结果一致。这可能是由于不同研究所针对鱼的种类不同,设计的投喂频率也不同,仅投喂频率不同引起的食欲变化不足以引起鱼体生长摄食的显著变化。
3.2 投喂模式对鱼体生化成分的影响
鱼体生化成分的含量常作为评价鱼肉品质的指标,而投喂水平和投喂频率是否影响鱼肉品质一直是学者关注的问题。鱼体生化成分受投喂水平和投喂频率的影响有不同的结论,李滑滑等[5]发现,投喂水平对大菱鲆幼鱼的粗蛋白含量影响差异不显著,但随着摄食水平的增加,鱼体水分降低,粗脂肪含量升高,粗灰分降低。本试验结果表明,70%饱食投喂水平的罗非鱼粗脂肪含量显著高于50%饱食投喂水平,但与其他投喂水平无显著差异,鱼体粗蛋白和粗灰分含量均不受投喂水平的影响;随投喂频率的增加,罗非鱼幼鱼水分、粗蛋白、粗脂肪和粗灰分含量无显著变化,说明投喂频率的提高并不能使罗非鱼幼鱼的主要营养组成发生改变,这与以牙鲆[5,14-15]和点带石斑鱼[13]为试材的研究结果一致。但也有研究表明,随着投喂频率的减少,瓦氏黄颡鱼幼鱼鱼体水分含量逐渐下降,蛋白质与脂肪含量逐渐上升[16]。这与本试验结果相悖,可能与本试验采取的投喂方法有关,说明以每天一次饱食投喂量作为总摄食量,可能还不足以满足鱼体生长所需的能量。
3.3 投喂模式对鱼体摄食因子表达的影响
在所有脊椎动物中,脑是调节摄食行为的中心,下丘脑分泌的NPY、黑皮质素、促黑激素、AgRP、CART、Orexin促进或抑制摄食行为,调节摄食的外周信号包括来自胃肠道及其相关器官的饱食信号,如CCK、SS、PYY等[17]。NPY被认为是一种促摄食神经肽,饥饿促进金鱼[6]、红鳍东方鲀[18]下丘脑NPY表达的增加,复投喂又使金鱼下丘脑NPY表达降低[6]。脑室注射哺乳动物和鱼类NPY均导致摄食呈剂量依存型增加,如斑马鱼[19]、虹鳟[20]等。NPY瞬时脑室注射能促进鱼类食欲的增加,说明NPY是一种短期饥饿信号。本试验中,投喂水平的差异导致罗非鱼下丘脑NPY mRNA的表达水平显著变化,100%饱食投喂水平的NPY mRNA表达量显著高于80%、70%、60%、50%饱食投喂水平,但与90%饱食投喂水平无显著差异,表明NPY可能参与罗非鱼的长期摄食调节,但具体的调节机制还有待进一步研究。
Orexin是一种最初在小鼠下丘脑中发现的神经肽,研究发现它对动物摄食有很强的调节作用,小鼠脑室注射Orexin的结果表明,Orexin能够促进摄食,饥饿条件下,肥胖和正常小鼠下丘脑Orexin mRNA的表达量增加[7]。在长期饥饿条件下墨西哥盲穴鱼Orexin[8]、金鱼[21]、比目鱼[22]下丘脑Orexin mRNA的表达水平显著升高,本研究也验证了这一结论,60%饱食投喂水平下丘脑Orexin mRNA的表达水平显著高于其他投喂水平。
CCK作为一种饱腹信号具有抑制摄食的功能,长期饥饿使武昌鱼脑和肠CCK mRNA水平升高,复投喂后增加[23]。但是在大西洋鲑鱼中,禁食6 d使脑CCK表达上调,肠CCK变化不显著[24]。禁食2周使鳐鱼肠CCK表达上调,但对下丘脑CCK的表达无显著差异[25],使比目鱼肠CCK表达下调[26]。而墨西哥盲穴鱼禁食10 d,未引起CCK在脑和肠中表达差异变化[8]。本研究中,低投喂水平罗非鱼全脑中CCK1表达量显著高于高投喂水平,这与CCK作为饱腹信号的功能相悖,可能是由于CCK对饥饿的反应具有种属、组织和时间特异性。本团队研究表明,罗非鱼中存在两种亚型的CCK(即CCK1和CCK2),其中CCK1在中枢组织中表达量较高、在胃肠道表达量很低,但其在中枢组织中的功能还不清楚,可能CCK对饥饿的反应还有亚型特异性(待发表)。
综上所述,采用适宜的投喂频率是保障网箱养殖吉富罗非鱼快速生长,提高饲料利用率和摄食率,改善鱼体生化成分的关键因素之一,体重为12~14 g的吉富罗非鱼投喂太阳鱼膨化颗粒配料饲料的适宜频率为每天投喂2次,最适投喂水平为80%饱食量。
[1]蔡云川,姜志勇,饶志新,等. 罗非鱼养殖关键环节潜在危害及其控制[J]. 中国水产,2014(6):64-6.
[2]娄方瑞,程光平,张紫皇,等. 不同投饲率对罗非鱼生长及养殖水质的影响[J]. 广东农业科学,2015,42(11):113-119.
[3]韩春艳,郑清梅,陈桂丹,等. 不同投喂模式对奥尼罗非鱼生长及体内脂类代谢的影响[J].广东农业科学,2014,41(16):120-123.
[4]段国庆,江河,胡王,等. 投喂水平对黄鳝幼鱼生长的影响[J]. 广东农业科学,2015,42(7):105-113.
[5]李滑滑,吴立新,姜志强,等. 摄食水平和投喂频率对大菱鲆幼鱼生长及生化成分的影响[J]. 生态学杂志,2013,32(7):1844-1852.
[6]Narnaware Y K,Peter R E. Effects of food deprivation and refeeding on neuropeptide Y(NPY)mRNA levels in goldfish[J]. Biochemistry and Molecular Biology,2001,129(2):633-639.
[7]Sakurai T,Amemiya A,Ishii M,et al. Orexins and orexin receptors:a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell,1998,92(4):573-585.
[8]Wall A,Volkoff H. Effects of fasting and feeding on the brain mRNA expressions of orexin,tyrosine hydroxylase (TH),PYY and CCK in the Mexican blind cavefish (Astyanax fasciatus Mexicanus)[J]. General and Comparative Endocrinology,2013,183:44-52.
[9]Sun L,Chen H,Huang L,et al. Growth and energy budget of juvenile cobia (Rachycentron canadum) relative to ration[J]. Aquaculture,2006,257(1):214-220.
[10]张磊. 黄颡鱼能量收支及生物能量学最适生长模型的研究[D]. 华中农业大学,2010.
[11]杨严鸥,姚峰. 摄食水平对黄颡鱼氮和能量收支的影响[J]. 湖北农业科学,2006,45(5):653-657.
[12]Biswas G,Thirunavukkarasu A,Sundaray J,et al. Optimization of feeding frequency of Asian seabass (Lates calcarifer) fry reared in net cages under brackishwater environment[J]. Aquaculture,2010,305(1):26-31.
[13]纪文秀,王岩,厉珀余. 不同投喂频率对网箱养殖点带石斑鱼生长、食物利用及氮磷排放的影响[J]. 浙江大学学报(农业与生命科学版),2011,37(4):432-439.
[14]Kim K D,Kim K M,Kang Y J. Influences of feeding frequency of extruded pellet and moist pellet on growth and body composition of juvenile Japanese flounder Paralichthys olivaceus in suboptimal water temperatures[J]. Fisheries Science,2007,73(4):745-753.
[15]陈晶,吴立新,吴玉波,等. 不同摄食水平对牙鲆幼鱼生长及能量收支的影响[J]. 水产科学,2012,31(1):1-6.
[16]覃志彪,赵海祥,赵华林,等. 投饲频率对瓦氏黄颡鱼 (Pelteobagrus vachelli) 幼鱼胃排空,生长效益及体组成影响[J]. 海洋与湖沼,2011(4):506-516.
[17]Strader A D,Woods S C. Gastrointestinal hormones and food intake[J]. Gastroenterology,2005,128(1):175-191.
[18]Kamijo M,Kojima K,Maruyama K,et al. Neuropeptide Y in tiger puffer(Takifugu rubripes):distribution,cloning,characterization,and mRNA expression responses to prandial condition[J]. Zoological Science,2011,28(12):882-890.
[19]Yokobori E,Azuma M,Nishiguchi R,et al. Neuropeptide Y stimulates food intake in the zebrafish,Danio rerio[J]. Journal of Neuroendocrinology,2012,24(5):766-773.
[20]Aldegunde M,Mancebo M. Effects of neuropeptide Y on food intake and brain biogenic amines in the rainbow trout(Oncorhynchus mykiss)[J]. Peptides,2006,27(4):719-727.[21]Abbott M,Volkoff H. Thyrotropin Releasing Hormone(TRH)in goldfish(Carassius auratus):role in the regulation of feeding and locomotor behaviors and interactions with the orexin system and cocaine-and amphetamine regulated transcript(CART)[J]. Hormones and Behavior,2011,59(2):236-245.
[22]Buckley C,Macdonald E E,Tuziak S M,et al.Molecular cloning and characterization of two putative appetite regulators in winter flounder(Pleuronectes americanus):Preprothyrotropinreleasing hormone(TRH)and preproorexin(OX)[J]. Peptides,2010,31(9):1737-1747.
[23]Ji W,Ping H C,Wei K J,et al. Ghrelin,neuropeptide Y(NPY)and cholecystokinin(CCK)in blunt snout bream(Megalobrama amblycephala):cDNA cloning,tissue distribution and mRNA expression changes responding to fasting and refeeding[J]. General and Comparative Endocrinology,2015,223:108-119.
[24]Murashita K,Kurokawa T,Nilsen T O,et al. Ghrelin,cholecystokinin,and peptide YY in Atlantic salmon(Salmo salar):molecular cloning and tissue expression[J]. General and Comparative Endocrinology,2009,160(3):223-235.
[25]Macdonald E,Volkoff H. Neuropeptide Y(NPY),cocaine-and amphetamine-regulated transcript(CART)and cholecystokinin(CCK)in winter skate(Raja ocellata):cDNA cloning,tissue distribution and mRNA expression responses to fasting[J]. General and Comparative Endocrinology,2009,161(2):252-261.
[26]Macdonald E,Volkoff H. Cloning,distribution and effects of season and nutritional status on the expression of neuropeptide Y(NPY),cocaine and amphetamine regulated transcript(CART)and cholecystokinin(CCK)in winter flounder (Pseudopleuronectes americanus)[J]. Hormones and Behavior,2009,56(1):58-65.
(责任编辑 邹移光)
Effects of feeding regime on food intake and growth of nile tilapia (Oreochromis niloticus)
ZHAO Mei-na,ZHAO Zao-ya,SUN Cai-yun,LI Wen-sheng
(State Key Laboratory of Biocontrol/Institute of Aquatic Economic Animals and Guangdong Provincial Key Laboratory for Aquatic Economic Animals/Research Institute of Sun Yat-Sen University in Shenzhen/ School of Life Sciences,Sun Yat-Sen University,Guangzhou 510006,China)
In order to investigate the effects of feeding regime on growth and food intake of genetic improvement of farmed tilapia (GITF tilapia),an 8-week experiment was conducted to determine the optimal feeding level and feeding frequency for the aquaculture of tilapia. The study investigated the effects of different feeding levels (100%,90%,80%,70%,60%,50% of satiation diet) and feeding frequencies (once,twice,thrice,four times a day) on food intake,growth performance,biochemical composition of white muscle and mRNA expression level of CCK1,NPY,and Orexin in tilapia. Results showed that higher or lower feeding level always enhanced feed coefficient (FCE)and mRNA expression level of NPY in hypothalamus. On the contrary,specific growth rate (SGR),feed conversion ratio (FCR) and mRNA expression level of CCK1 showed signs of decrease. Only crud fat content displayed a positive response to ration level. Moreover,feeding frequency showed no significant effects on all indices. Higher or lower feeding frequency led to lower FCR and SGR. Increased feeding frequency negatively affected crud protein and lipiddeposition in skeletal muscle. The mRNA expression level of CCK1 was lower by higher feeding frequency,while the mRNA expression level of Orexin was reversed. In summary,80% of satiation diet as optimal feeding level and feeding tilapia twice a day was proposed.
nile tilapia;feeding regime;growth and food intake;biochemical composition;mRNA expression
S965.125
A
1004-874X(2017)02-0120-08
2016-10-28
国家现代农业产业技术体系专项(CARS-49);国家现代农业人才支撑计划项目(2016-2020);广东省海洋与渔业局海港建设和渔业产业专项(A201601C02);深圳市战略性新兴产业发展专项资金 (NYSW 20140401010064)
赵美娜(1989-),女,硕士,E-mail:zhaomeina11@163.com
李文笙(1967-),女,博士,教授,E-mail:lsslws@mail.sysu.edu.cn
赵美娜,赵早亚,孙彩云,等.投喂模式对吉富罗非鱼摄食和生长的影响[J].广东农业科学,2017,44(3):120-127.
