大豆细胞悬浮培养及其大豆异黄酮和抗毒素诱导积累研究进展
2017-06-07王凯强徐小轻张宇微魏晨阳
王凯强,彭 晴,乔 宇,丁 慧,徐小轻,张宇微,魏晨阳,石 波
(中国农业科学院饲料研究所/农业部饲料生物技术重点实验室,北京 100081)
大豆细胞悬浮培养及其大豆异黄酮和抗毒素诱导积累研究进展
王凯强,彭 晴,乔 宇,丁 慧,徐小轻,张宇微,魏晨阳,石 波
(中国农业科学院饲料研究所/农业部饲料生物技术重点实验室,北京 100081)
大豆细胞悬浮培养是将大豆细胞及细胞团培养于液体培养基中的方法,应用于大豆多种研究领域。从不同的外植体包括子叶、子叶节、下胚轴、幼胚、茎培养大豆细胞的方法,外源诱导物及前体对细胞积累大豆异黄酮以及诱导物对细胞合成和积累大豆抗毒素诱导效果进行综述。大豆异黄酮和抗毒素是大豆产生的两类具有生物活性的次生代谢物。在此基础上,指出诱导中存在的问题及今后的研究方向,旨在通过增加诱导子的选择而促进大豆细胞合成更高水平抗毒素及异黄酮提供一些思路。
大豆;细胞悬浮培养;诱导子;诱导;大豆异黄酮;抗毒素
植物细胞悬浮培养始于20世纪30年代[1],该方法为植物学研究提供大量细胞材料,有助于在有关植物生理学、细胞学、组织学、形态学、生态学等领域开展试验。悬浮培养是植物细胞培养方法之一,特点是首先由固体培养基中诱导获得的愈伤分散在液体培养基释放细胞,细胞与营养物质接触充分,摇晃培养为细胞输送氧气,整体培养环境一致促进细胞状态保持同步。相比大田环境下生长的植物,室内容器培养的细胞合成生物活性物质有着诸多优势,其合成过程处于可控环境,能够降低不利生物活性物合成的生物干扰,如微生物、昆虫,还可筛选出生物活性物高产细胞系,提高目标物产量,可能实现细胞生长控制的自动化、代谢调节[2]。
早期的植物细胞获取来源于机械或酶分离处理的叶肉和根尖细胞的培养增殖。然而,直接分离于植物个体的细胞,分化程度不同步,生理一致性较差,难以培养获得均一性良好的细胞系。因此,现在建立的细胞悬浮培养体系,取用植物的外植体诱导愈伤,继代数次获得生长同步的愈伤组织,分散到液体培养基中悬浮培养,得到大量细胞,其操作主要包括外植体的选取、愈伤组织诱导培养基的优化筛选、悬浮系的继代培养以及细胞生长状态调控等[3]。
大豆是豆科大豆属一年生草本,是我国重要粮食作物之一,除含人体必需的微量元素外,还有多种特殊生物学功能的活性物质,如低聚糖、皂甙、异黄酮、多肽、蛋白以及磷脂[4]。其中,大豆异黄酮及其衍生物质抗毒素是本文综述的生物活性物。
大豆异黄酮及其异戊烯化物质抗毒素是属于大豆的两类生物活性的次生代谢物。有研究表明,它们具有益于人体健康的生物活性功能,表现为抗菌、抗氧化、抗癌、调节葡萄糖及能量代谢等。传统上,大豆异黄酮主要采用有机溶剂从种子中浸提[5],大豆抗毒素则来自硝酸银[6]、褐藻酸寡糖[7]等外源诱导物诱导处理过的种子合成。不同外源物对细胞合成大豆异黄酮及抗毒素量的诱导效果不同。此外,大豆异黄酮和抗毒素合成的前体添加量以及细胞系中的前体水平对诱导子诱导效果的影响都是决定其产量的因素[8]。
悬浮培养的大豆细胞已广泛应用于细胞生理学、细胞学、发育学、形态学、生物生化及分子生物学领域研究。其中主要涉及选择不同外植体诱导形成大豆细胞悬浮培养体系及外源诱导子诱导调控细胞合成异黄酮、抗毒素两个主要环节。
1 外植体选择
植物细胞的悬浮培养中,用于诱导愈伤组织的外植体的选择是一个重要环节。外植体类型、切割长度以及固体愈伤培养基上的放置方式都将影响愈伤的诱导效果[9-10]。大豆愈伤组织诱导常以子叶、子叶节、下胚轴、胚,少数采用茎作为外植体,置于固体培养基上诱导愈伤,然后将愈伤组织轻微碾碎,转移至含有一定营养成分以及适宜浓度和配比的植物激素的液体培养基中,在适宜的温度、转速、光照条件、继代周期下增殖培养。品种、外植体、培养基、温度、光照、转数、继代周期及初次接种愈伤量均为大豆细胞培养成功的影响因素。大豆细胞悬浮培养影响因素多样,本文以不同的外植体类型对其进行综述(表1)。
外植体的获得是愈伤组织诱导的前提,而愈伤组织是细胞悬浮培养的来源。由上述可见,不同的外植体在诱导愈伤组织以及细胞培养时的条件有所不同。品种选择多样化,表明品种不是影响细胞成功培养的决定性因素,合适的培养条件更为关键。培养基方面,MS是最常用培养基,也是初次培养大豆细胞的首选,其次可依据大豆细胞培养出现的问题选择改良过的MS培养基、B5培养基或改良过的B5培养基。温度是影响细胞生长的重要因素之一,通常培养温度为25℃,由于培养细胞采用的大豆品种不同,个别也选择21℃或28℃。光照方面主要采用暗培养及16 h/8 h的光照周期培养。此外,转数也决定细胞生长状态,转数高,细胞容易裂解死亡;转数低,细胞无法获得充足氧气供给,导致生长不良,120 r/min是最常用的培养转数,150 r/min应用很少。继代周期也会影响细胞生长速度,周期越长,生长进入稳定后期或衰亡期,此时细胞继代难适应新培养基环境,不利于生长;周期过短,生长处于对数期,生长快速,继代会减慢生长速度。因此,大豆细胞继代周期
一般采用7 d。初次接种愈伤可以通过愈伤块捏碎转移至液体培养基,接种量不能过低。

表1 以不同外植体综述大豆细胞悬浮培养方法
截至目前,大豆细胞培养研究已开展几十年,然而对影响大豆细胞培养的各个条件仍未有更为细致的研究,如光照,光照周期中光照时间与黑暗时间的比例优化未有过研究。再如对细胞培养转数选择未见详细报道,在生物反应器发展迅速的时代,影响大豆细胞培养的各条件的优化筛选决定着能否成功应用到生物反应器的关键,也是今后研究的一个方向。
2 诱导子调控细胞合成异黄酮抗毒素
诱导子是以低浓度加入活细胞系统以促进目标化合物合成的物质。诱导过程是指诱导子添加后增加代谢目标物生物合成的现象[21]。依据内在属性,诱导子可划分为生物诱导子、非生物诱导子。生物诱导子是来源于生物,如分离于植物细胞壁的果胶、纤维素,微生物细胞壁的几丁质、葡聚糖。非生物诱导子是非生命来源的物质,尤其是无机盐及物理因素,如铜、银、镉离子,pH值、超声、紫外线、高静水压[22]。根据来源,也将其分成内生诱导子、外生诱导子。内生诱导子是来源于胞内的物质,如海藻胶寡糖、β-葡萄糖苷;外生诱导子指源于胞外,如多糖、多肽、多胺等。研究表明,诱导子能够引起植物细胞生理及形态变化,此类常见的诱导子包括非生物性的金属离子、无机物及生物性的真菌、细菌、植物细胞壁成分以及细胞会产生一系列防御反应,如保护细胞的次生代谢物的合成积累[23]。大豆细胞是具有生物活性的植物化学物质的丰富来源,其富含的异黄酮及植保素大豆抗毒素均会在细胞受到外源物诱导刺激下产生变化,这也是诱导子诱导大豆细胞研究中关注的热点。
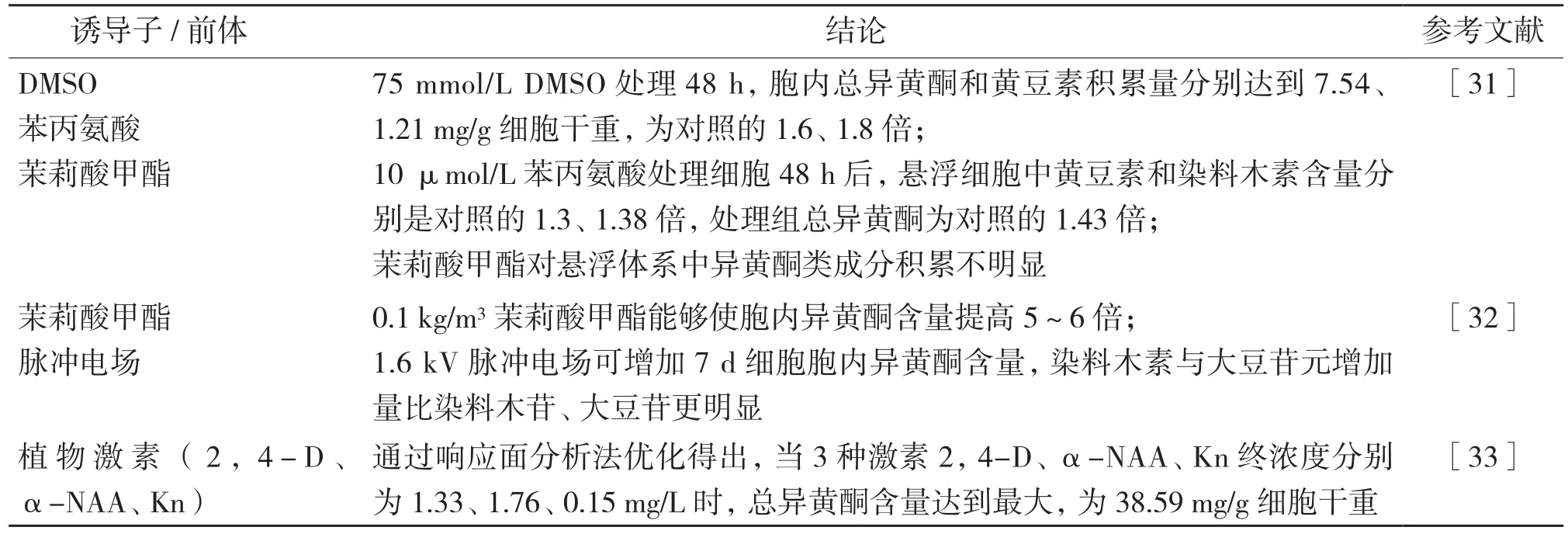
表2 不同前体和诱导子处理对大豆细胞积累大豆异黄酮的影响
2.1 大豆异黄酮
2.1.1 简介 大豆异黄酮(Soybean Isoflavones,SI)是大豆中一类多酚化合物的总称,也是一种次生代谢物,广泛存在于大豆及其制品如豆腐、豆浆、豆豉、腐乳等中。大豆异黄酮属于低分子量水溶性有机物,主要分布在成熟大豆种子的胚轴、子叶及种皮,胚轴中含量最高[24],主要由染料木素、大豆苷元、黄豆黄素为基本成分以及包括糖苷类、乙酰基类和丙二酰基类在内的12种物质组成[25]。大豆异黄酮结构与雌激素相似,且具有雌激素类似的作用,因此也称为植物雌激素[26]。研究表明,大豆异黄酮有多种对人体有益的生物学功能,具有雌激素样[27],抗氧化[28]、抗肿瘤[29]、降低胆固醇[30]等作用。
2.1.2 外源物诱导调控细胞合成大豆异黄酮 近几十年来,应用前体和外源物处理大豆悬浮培养细胞增加大豆异黄酮合成有诸多研究(表2)。研究表明,大豆细胞受到DMSO、茉莉酸甲酯等非生物诱导物,物理因素脉冲电场以及通过改变添加到培养基中激素的浓度配比时,大豆总异黄酮含量明显增加,这主要是由于外源诱导物以及培养环境中不同激素浓度对大豆异黄酮的代谢合成路径中有关酶合成或活性产生影响,导致某些异黄酮含量也相应发生改变。此外,苯丙氨酸作为大豆异黄酮的前体物质[34],给细胞系添加适量后,增加异黄酮代谢途径中的原料来源,有助于增加胞内异黄酮的积累量。
2.2 大豆抗毒素
2.2.1 简介 大豆抗毒素(Glyceollins,Gly)是植物受到外界环境压力后重新合成和积累的一类低分子量的植物抗毒素[35],也是一类可经诱导物诱导产生的异戊烯化的异黄酮和植物雌激素[34],具有益于人体健康的重要生物学特性[36],其主要以3种同分异构体的形式存在,即大豆抗毒素Ⅰ、Ⅱ、Ⅲ(图1),其他不常见的异构体包括大豆抗毒素Ⅳ、Ⅴ、Ⅵ和glyceofuran[37]。研究表明,大豆抗毒素是能与雌激素受体(ER)相结合的抗雌激素物质,抑制雌激素诱导的肿瘤进程,其中大豆抗毒素Ⅰ抗雌激素活性最强[38]。大量研究结果也显示,大豆抗毒素在促进人体健康方面发挥着重要作用,主要具有抗雌激素[39]、抗癌[40]、免疫抑制[41]、葡萄糖[42]和脂肪调节[43]、抗菌[44]、抗氧化[45]等多种临床前的特性。此外,大豆抗毒素在生物学特性上具体表现为抵抗雌激素依赖型的癌细胞的生长和增殖,调节葡萄糖、能量代谢、微生物生长和人体发病、炎症反应、氧化引发的细胞衰老等,还可用在皮肤美白[46]和血管健康维护[47]方面。

图1 大豆抗毒素Ⅰ、Ⅱ、Ⅲ结构
2.2.2 外源物诱导调控细胞合成大豆抗毒素 有研究表明,采用细菌、真菌以及其细胞壁提取物、寡糖及其他种类外源诱导物,在适当外界环境下,通过适宜的处理浓度能够诱导悬浮培养的大豆细胞合成大豆抗毒素,而诱导个别品种大豆细胞未合成大豆抗毒素(表3)。
大豆苷元是胞内大豆抗毒素合成的前体物质[53]。研究显示,Mandarin品种大豆细胞系Sb-1含低水平的大豆苷元,感染丁香假单胞菌A-29-2、2159以及致病疫霉真菌后,大豆苷元和染料木素含量均未有减少,仅合成极少量大豆抗毒素。这主要因为胞内低含量的前体物质大豆苷元限制其合成。含有高水平的异黄酮,尤其高含量大豆苷元的Mandarin Sb-2、Sb-4细胞暴露于致病疫霉真菌,胞内大豆苷元、染料木素含量显著降低,且合成大豆抗毒素[48]。该结果表明,诱导子处理前细胞系的前体物质大豆苷元含量影响大豆抗毒素合成。
还有研究报道,未被诱导处理的正常大豆细胞中的大豆抗毒素含量极其低[49],只有采用合适的外源诱导子对细胞产生刺激后,才可能促进细胞合成提高大豆抗毒素积累量。目前,调控大豆细胞合成异黄酮及抗毒素的诱导物以细菌、真菌培养滤液、微生物细胞壁提取物及重金属离子为主,而直接利用工业上生产的寡糖作为外源诱导子的研究还相对较少。细菌、真菌培养滤液及微生物细胞壁提取物的制备处理相对繁琐,耗费时间、人力、物力,容易降低诱导效率,且它们的制取方式容易对人体健康产生隐患。再者,菌培养滤液、细胞壁提取物成分复杂,用于诱导大豆细胞很大程度对细胞中生物活性物质的提取产生干扰。重金属离子诱导细胞的弊端在于离子吸附在大豆细胞表面,它们普遍存在生物活性物质的粗提液中,不易除去。尽管如此,上述诱导子仍可在一定条件下用于诱导大豆细胞。然而,采用寡糖诱导子诱导细胞的过程不会对人体健康产生任何危害,而且寡糖大多是一类功能性糖[54],因此用其处理大豆细胞合成异黄酮及抗毒素是今后值得期待的研究方向。
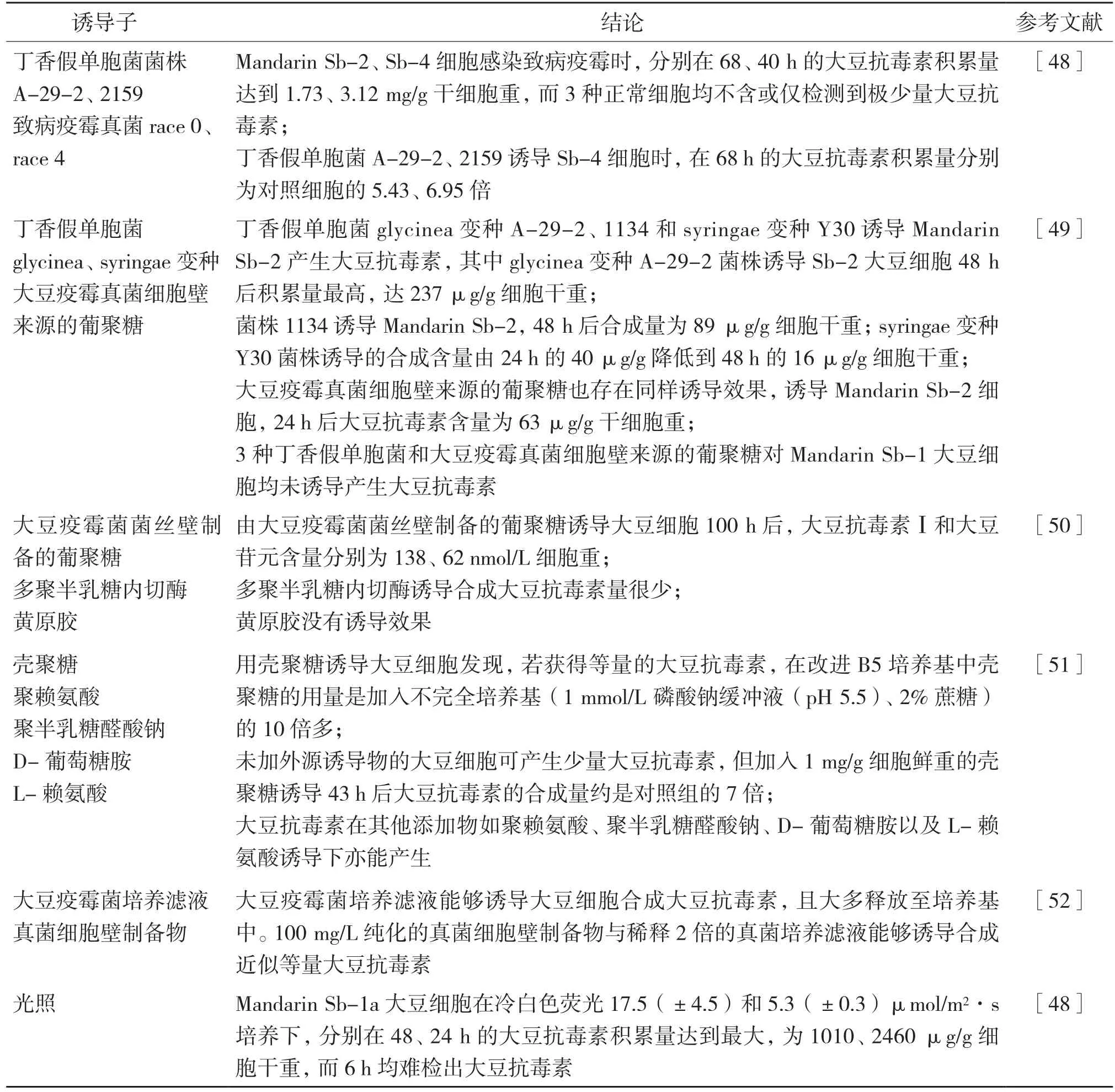
表3 不同诱导子处理对大豆细胞合成大豆抗毒素的影响
3 展望
传统的外源物诱导大豆细胞模式均采用单一诱导子,如真菌、细菌培养滤液、微生物细胞壁提取物、寡糖以及重金属离子等。然而,最新研究发现,采用复合诱导子诱导处理其他植物细胞时可以合成更高含量的生物活性物质,这可能得益于复合诱导子具有协同增效的作用,起到增强诱导能力的效果。Zhao等[55]指出,与单一诱导子相比,通过复合诱导子真菌制备物和四甲基溴化铵以及苹果酸和海藻酸钠分别处理细胞均可提高阿玛碱和长春碱积累量。另外,Almagro等[56]采用单一或复合诱导子诱导处理悬浮培养的亚麻细胞合成生育酚的研究发现,50 mmol/L羟丙基化β-环糊精分别与1 mg/L β-葡聚糖和40 μmol/L己烯醇复合诱导可产生174 μg/g生育酚和257 μg/g细胞干重,高于单一诱导子处理细胞后生育酚的积累量。然而,传统的诱导调控大豆细胞合成异黄酮及大豆抗毒素的诱导子均为单一诱导子,应用复合诱导子处理大豆细胞的研究至今尚无,其处理大豆细胞的诱导效果还处于未知阶段。因此,采用复合诱导子刺激大豆细胞调控合成异黄酮及抗毒素会是一个新的研究方向。
[1]White P R. Potentially unlimited growth of excised tomato root tips in a liquid medium[J]. Plant Physiol,1934,9(3):585-600.
[2]Mulabagal V,Tsay H S. Plant cell cultures an alternative and efficient source for the production of biologically important secondary metabolites[J]. Int J Appl Sci Eng,2004,2(1):29-48.
[3]谢从华,柳俊. 植物细胞工程[M]. 北京:高等教育出版社,2004.
[4]张蓓. 大豆的生物活性物质及生理功能[J]. 职业与健康,2003,19(11):77-78.
[5]孙玲,魏振承,徐志宏,等. 大豆异黄酮提取纯化及其抗衰老作用初探[J]. 食品科学,2002,23(8):267-270.
[6]冯东岳,石波. 硝酸银诱导青仁乌生成大豆抗毒素的机理[J]. 食品科学,2012,33(23):18-22.
[7]胡佳,石波,Ojokoh E,等. 褐藻酸寡糖诱导下大豆中大豆抗毒素的累积变化[J]. 中国农业科学,2012,45(8):1576-1586.
[8]肖春桥,张华香,高洪,等. 促进植物细胞培养生产次生代谢物的几种途径[J]. 武汉化工学院学报,2005,27(1):28-31.
[9]朱学艺,梁晓芳,李红芳. 激素对大豆悬浮细胞系愈伤组织诱导的影响[J]. 厦门大学学报(自然科学版),2008,47(4):562-566.
[10]方星,胡倩倩,王建国,等. 大豆悬浮细胞培养及作为外源基因转化受体的研究[J]. 大豆科学,2015,34(1):36-41.
[11]Ganapathi T R,Kumar G B S,Srinivas L,et al. Analysis of the limitations of hepatitis B surface antigen expression in soybean cell suspension cultures[J]. Plant Cell Rep,2007,26(9):1575-1584.
[12]陈锦清,胡张华,吕慧能,等. 辐射处理对大豆悬浮细胞超微结构的影响[J]. 浙江农业学报,1997,9(5):240-245.
[13]李军,郝贵霞,刘玲,等. 大豆胚性悬浮细胞培养系的建立研究[J]. 食品工业科技,2001(S):101-102.
[14]Finer J J,Nagasawa A. Development of an embryogenic suspension culture of soybean(Glycine max Merrill.)[J]. Plant Cell,Tiss Organ Cult,1988,15(2):125-136.
[15]Matthews B F,Widholm J M. Enzyme expression in soybean cotyledon,callus,and cell suspension culture[J]. Can J Bot,2011,57(4):299-304.
[16]Yang B,Wu J,Gao F,et al. Polyamineinduced nitric oxide generation and its potential requirement for peroxide in suspension cells of soybean cotyledon node callus[J]. Plant Physiol Biochem,2014,79(3):41-47.
[17]Sobkowiak R,Deckert J. Cadmium-induced changes in growth and cell cycle gene expression in suspension-culture cells of soybean[J]. Plant Physiol Biochem,2003,41(8):767-772.
[18]Young D H,Köhle H,Kauss H. Effect of chitosan on membrane permeability of suspensioncultured Glycine max and Phaseolus vulgaris cells[J]. Plant Physiol,1982,70(5):1449-1454.
[19]Aranha M M,Matos A R,Mendes A T,et al. Dinitro-o-cresol induces apoptosis-like cell death but not alternative oxidase expression in soybean cells[J]. J Plant Physiol,2007,164(6):675-684.
[20]Slaymaker D H,Hoppey C M. Reduced polysome levels and preferential recruitment of a defense gene transcript into polysomes in soybean cells treated with the syringolide elicitor[J]. Plant Sci,2006,170(1):54-60.
[21]Radman R,Saez T,Bucke C,et al. Elicitation of plants and microbial cell systems[J]. Biotechnol Appl Biochem,2003,37(1):91-102.
[22]Veersham C. In Elicitation:Medicinal PlantBiotechnology[M]. India:CBS Publisher,2004:270-293.
[23]Namdeo A G. Plant Cell Elicitation for Production of Secondary Metabolites:A review[J]. Pharmacogn Rev,2007,1(1):69-79.
[24]Oakey H J,Harty D W,Knox K W. Enzyme production by lactobacilli and the potential link with infective endocarditis[J]. J Appl Bact,1995,78(2):142-148.
[25]Moras B,Rey S,Vilarem G,et al. Pressurized water extraction of isoflavones by experimental design from soybean flour and soybean protein isolate[J]. Food Chem,2017,214:9-15.
[26]王建华. 大豆异黄酮研究进展[J]. 现代中药研究与实践,2013,27(1):85-88.
[27]Eason R R,Till S R,Velarde M C,et al. Uterine phenotype of young adult rats exposed to dietary soy or genistein during development[J]. J Nutr Biochem.,2005,16(10):625-632.
[28]Baiano A,Terracone C,Gambacorta G,et al. Evaluation of isoflavone content and antioxidant activity of soy-wheat pasta[J]. J Fd Technol,2009,44(44):1304-1313.
[29]Mahmoud A M,Yang W C,Bosland M C. Soy isoflavones and prostate cancer:A review of molecular mechanisms[J]. J Steroid Biochem Mol Biol,2014,140(3):116-132.
[30]Kawakami Y,Kiyosawa T,Nakamura S,et al. Effects of isoflavone supplementation on disturbances in lipid metabolism and antioxidant system due to exogenous cholesterol oxidation products in rats[J]. J Funct Foods,2014,7(2):212-218.
[31]梁晓芳,朱学艺,李红芳. 前体和诱导子对大豆悬浮细胞中异黄酮积累的影响[J]. 厦门大学学报(自然科学版),2009,48(1):113-118.
[32]Gueven A,Knorr D. Isoflavonoid production by soy plant callus suspension culture[J]. J Food Eng,2011,103(3):237-243.
[33]Akitha Devi M,Giridhar P. Isoflavone augmentation in soybean cell cultures is optimized using response surface methodology[J]. J Agric Food Chem,2014,62(14):3143-3149.
[34]Simons R,Vincken J P,Roidos N,et al. Increasing soy isoflavonoid content and diversity by simultaneous malting and challenging by a fungus to modulate estrogenicity[J]. J Agric Food Chem,2011,59(12):6748-6758.
[35]Burow M E,Boue S M,Collins-Burow B M,et al. Phytochemical glyceollins,isolated from soy,mediate antihormonal effects through estrogen receptor α and β[J]. J Clin Endocrinol Metab,2001,86(4):1750-1758.
[36]Sims J J,Keen N T,Ingham J L,et al. The occurrence of glyceollins in plants related to Glycine max(L.)Merr[J]. Biochem Syst Ecol,1989,17(5):395-398.
[37]Ng T B,Ye X J,Wong J H,et al. Glyceollin,a soybean phytoalexin with medicinal properties[J]. Appl Microbiol Biotechnol,2011,90(1):59-68.
[38]何怡. 激活的大豆中一新的抗雌激素植物抗毒素—— 大豆抗毒素I[J]. 现代药物与临床,2010,25(3):236-237.
[39]Zimmermann M C,Tilghman S L,Boué S M,et al. Glyceollin I,a novel antiestrogenic phytoalexin isolated from activated soy[J]. J Pharmacol Exp Ther,2010,332(1):35-45.
[40]Tilghman S L,Boué S M,Burow M E. Glyceollins,a novel class of antiestrogenic phytoalexins[J]. Mol Cell Pharm,2010,2(4):155-160.
[41]Kim H J,Cha B Y,Choi B,et al. Glyceollins inhibit platelet-derived growth factor-mediated human arterial smooth muscle cell proliferation and migration[J]. Br J Nutr,2012,107(1):24-35.
[42]Boué S M,Isakova I A,Burow M E,et al. Glyceollins,soy isoflavone phytoalexins,improve oral glucose disposal by stimulating glucose uptake[J]. J Agric Food Chem,2012,60(25):6376-6382.
[43]Wood C E,Boue S M,Collinsburow B M,et al. Glyceollin-elicited soy protein consumption induces distinct transcriptional effects as compared to standard soy protein[J]. J Agric Food Chem,2012,60(1):81-86.
[44]Kim H J,Suh H J,Lee C H,et al. Antifungal activity of glyceollins isolated from soybean elicited with Aspergillus sojae[J]. J Agric Food Chem,2010,58(17):9483-9487.
[45]Jung M H,Han S M,Lee S H,et al. Glyceollins protection against vascular endothelial cell death caused by a low-dose proton beam[J]. Korean J Phys Soc,2009,54(52):2129-2132.
[46]Parr A J. The production of secondary metabolites by plant cell cultures[J]. J Biotechnol,1989,10(1):1-26.
[47]Song M J,Baek I,Jeon S B,et al. Effects of glyceollin I on vascular contraction in rat aorta[J]. Naunyn–Schmiedeberg's arch pharmacol,2010,381(6):517-528.
[48]Zacharius R M,Kalan E B. Isoflavonoid changes in soybean cell suspensions when challenged with intact bacteria or fungal elicitors[J]. J Plant Physiol,1990,135(6):732-736.
[49]Fett W F,Zacharius R M. Bacterially-induced glyceollin production in soybean cell suspension cultures[J]. Plant Sci Lett,1982,24(3):303-309.
[50]Ebel J,Schmidt W E,Loyal R. Phytoalexin synthesis in soybean cells:Elicitor induction of phenylalanine ammonia-lyase and chalcone synthase mRNAs and correlation with phytoalexin accumulation[J]. Arch Biochem Biophys,1984,232(1):240-248.
[51]Köhle H,Young D H,Kauss H. Physiological changes in suspension-cultured soybean cells elicited by treatment with chitosan[J]. Plant Sci Lett,1984,33(2):221-230.
[52]Bhandal I S,Paxton J D,Widholm J M. Phytophthora megasperma culture filtrate and cell wall preparation stimulate glyceollin production and reduce cell viability in suspension cultures of soybean[J]. Phytochem,1987,26(10):2691-2694.
[53]Paytonstewart F,Schoene N W,Kim Y S,et al. Molecular Effects of Soy Phytoalexin Glyceollins in Human Prostate Cancer Cells LNCaP[J]. Mol Carcinogen,2009,48(9):862-871.
[54]闵力,刘立恒,许兰娇,等. 功能性寡糖的研究进展[J]. 饲料研究,2012(9):18-22.
[55]Zhao J,Zhu W H,Hu Q. Enhanced catharanthine production in catharanthus roseus cell cultures by combined elicitor treatment in shake flasks and bioreactors[J]. Enzyme Microb Technol,2001,28(7-8):673-681.
[56]Almagro L,García-Pérez P,Belchí-Navarro S,et al. New strategies for the use of Linum usitatissimum cell factories for the production of bioactive compounds[J]. Plant Physiol Biochem,2015,99:73-78.
(责任编辑 杨贤智)
Advances in suspension-cultured methods of soybean cell and accumulation on soybean isoflavones and glyceollins from cell exposed to elicitor
WANG Kai-qiang,PENG Qing,QIAO Yu,DING Hui,XU Xiao-qing,ZHANG Yu-wei,WEI Chen-yang,SHI Bo
(Feed Research Institute,Chinese Academy of Agricultural Sciences/Key Laboratory of Feed Biotechnology of Ministry of Agriculture,Beijing 100081,China)
Suspension-cultured cell technique which developed soybean cell and aggregates in liquid medium,has been extensively applied in numerous fields. The paper summarized the methods for suspension-cultured soybean cell employing different explants,including cotyledon,cotyledon node,hypocotyl,immature embryo and stem,inducible effect of exogenous elicitors and precursor treatment on accumulation of isoflavones and influence of elicitors exposure to soybean cell on synthesis and accumulation of glyceollins. Soybean isoflavones and glyceollins are two types of bioactive secondary metabolites produced from soybean. On the basis,the present problems were illustrated and prospective development directions were also recommended for the propose of providing ideas concerning higher level of isoflavones and glyceollins accumulation produced by cell in response to other optional elicitors.
soybean;cell suspension-cultured;elicitor;elicition;soybean isoflavones;glyceollins
S565.1
A
1004-874X(2017)03-0030-09
2016-12-25
国家自然科学基金(31171628)
王凯强(1988-),男,在读博士生,E-mail:1064645257@qq.com
石波(1964-),男,博士,研究员,E-mail:shibo@caas.cn
王凯强,彭晴,乔宇,等. 大豆细胞悬浮培养及其大豆异黄酮和抗毒素诱导积累研究进展[J].广东农业科学,2017,44(3):30-38.
