乌司他丁对脓毒症大鼠的肺保护作用
2017-06-05蒲光军蒲桂新四川省阿坝藏族羌族自治州人民医院药剂科四川马尔康64000四川省医学科学院四川省人民医院麻醉科四川成都6007
蒲光军,蒲桂新,邓 佳(.四川省阿坝藏族羌族自治州人民医院药剂科,四川 马尔康 64000;.四川省医学科学院·四川省人民医院麻醉科,四川 成都 6007)
乌司他丁对脓毒症大鼠的肺保护作用
蒲光军1,蒲桂新1,邓 佳2
(1.四川省阿坝藏族羌族自治州人民医院药剂科,四川 马尔康 624000;2.四川省医学科学院·四川省人民医院麻醉科,四川 成都 610072)
目的 建立大鼠脓毒症急性肺损伤模型,观察乌司他丁对大鼠急性肺损伤的保护作用及其机制。方法 SD大鼠120只,随机数字表法分为脓毒症组(CLP组)、乌司他丁组(UTI组)与假手术组(SHAM组)各40只;组内分6 h组、12 h组、24 h组、48 h组各10只。建立脓毒症模型,TUI组大鼠于手术30 min后经大鼠尾静脉注射乌司他丁100000 U/kg。光镜下观察肺组织病理改变及肺损伤Smith评分,透射电镜下观察大鼠肺组织超微结构变化,Western-Blot法测定大鼠肺组织高迁移率族蛋白B1(HMGB1)的表达。结果 CLP组大鼠肺损伤随时间呈逐渐加重趋势,术后48 h损伤达到高峰;UTI组大鼠肺损伤在24 h达到高峰;UTI组48 h时点肺损伤Smith评分明显低于CLP组(P< 0.05)。CLP组和UTI组大鼠各时点肺组织超微结构有不同程度损伤,UTI组损伤程度均较 CLP组对应时点减轻。UTI组大鼠各时点肺组织中HMGB1的表达均明显低于CLP组(P< 0.05)。结论 乌司他丁可以减轻脓毒症性急性肺损伤大鼠肺组织的损伤程度,HMGB1参与了脓毒症性急性肺损伤的发生发展,乌司他丁通过抑制HMGB1的表达减轻了急性肺损伤的严重程度。
脓毒症;急性肺损伤;高迁移率族蛋白B1;乌司他丁
脓毒症是由于抗炎反应综合征和促炎反应综合征平衡失调的结果[1],多种炎性因子介导的肺部失控性炎症反应是急性肺损伤/急性呼吸窘迫综合征发生发展的主要病理生理基础。乌司他丁是一种从健康成年男性新鲜尿液中分离的糖蛋白水解酶抑制剂,不仅能抑制蛋白酶、糖以及脂类的多种水解酶活性,还能抑制一些炎性介质的过度释放,稳定溶酶体膜,清除氧自由基以及抑制心肌抑制因子的产生[2~5]。研究发现乌司他丁能够使急性肺损伤/急性呼吸窘迫综合征患者的氧合改善,同时抑制病程的发生发展,降低疾病的死亡率[6],但其具体作用机制未完全明确。高迁移率族蛋白B1(HMGB1)是核内非组蛋白,研究表明HMGB1作为晚期炎症介质,与急性肺损伤/急性呼吸窘迫综合征的发生发展有密切关系[7~10]。本实验以大鼠为研究对象,建立脓毒症急性肺损伤模型,观察乌司他丁对急性肺损伤的保护作用及其机制。
1 材料与方法
1.1 实验动物 2015年9月至2016年3月,选择SPF级雄性SD大鼠120只(购于成都达硕实验动物有限公司),6~8周龄,体重180~200 g,随机数字表法分为脓毒症组(CLP组)、乌司他丁组(UTI组)和假手术组(SHAM组)各40只。
1.2 脓毒症模型的制备 CLP组大鼠:戊巴比妥钠60 mg/kg腹腔注射麻醉,麻醉后固定大鼠四肢,充分暴露腹部,剔除腹部毛发,消毒腹部手术区域,在腹壁正中处作一长约2 cm 的竖切口,进入腹腔后找到回盲部,分离出大鼠盲肠,采用中度脓毒症结扎方法即50%结扎盲肠,用注射针头于结扎端穿刺2次,挤出粪便少许,将回盲肠重新放回腹腔,逐层缝合腹部切口,手术结束后皮下注射生理盐水10 ml/kg抗休克。UTI组大鼠:建模方法同 CLP 组大鼠,造模后30 min于大鼠尾静脉注射乌司他丁100000 U/kg。假手术组大鼠:进入腹腔后回盲部不做盲肠结扎与穿刺,仅翻动腹腔内肠道,手术结束后不注射生理盐水。120只大鼠随机分入 CLP 组、UTI组、假手术组。每组40只,组内分6、12、24、48 h亚组各10只,在分别的时间点取材。UTI组大鼠手术30 min后由尾静脉注射乌司他丁100000 U/kg进行干预,CLP组及假手术组大鼠手术 30 min后注射等量生理盐水。
1.3 观察指标
1.3.1 大鼠肺组织病理改变及肺损伤Smith评分 取大鼠右中肺部分肺组织用10%中性甲醛固定、酒精逐级脱水、石蜡包埋、连续切片、HE染色,光学显微镜200倍视野下观察肺组织病理形态学变化并进行肺损伤Smith评分[11]。
1.3.2 透射电镜观察大鼠肺组织超微结构变化 取大鼠右下肺少许组织,生理盐水冲洗干净后用戊二醛溶液固定,经过漂洗、固定、脱水、渗透、包埋、切片,用透射电镜观察大鼠肺组织超微结构的变化。
1.3.3 Western-Blot法测定大鼠肺组织 HMGB1的表达 取大鼠右上肺部分肺组织制备组织匀浆,提取总蛋白、测定蛋白浓度,制备SDS-PAGE胶,蛋白样品变性、电泳,凝胶转膜后曝光洗片,将所得结果用Image J软件分析光密度值,将获得的平均光密度(AOD)值代表蛋白表达量。
1.4 统计学方法 采用SPSS 17.0 统计学软件对数据进行统计分析。计量资料用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD法。P< 0.05 为差异有统计学意义。
2 结果
2.1 大鼠肺组织病理学改变及肺损伤Smith 评分 假手术组大鼠肺组织无明显水肿。CLP组大鼠肺损伤呈逐渐加重趋势,术后 48 h损伤达到高峰,可见肺组织水肿明显,肺泡及肺间质出现炎症、出血,伴部分肺组织不张。UTI 组大鼠肺损伤在24 h达到高峰。UTI 组大鼠48 h时点肺损伤 Smith评分明显低于 CLP组(P< 0.05),见图1~3;表1。
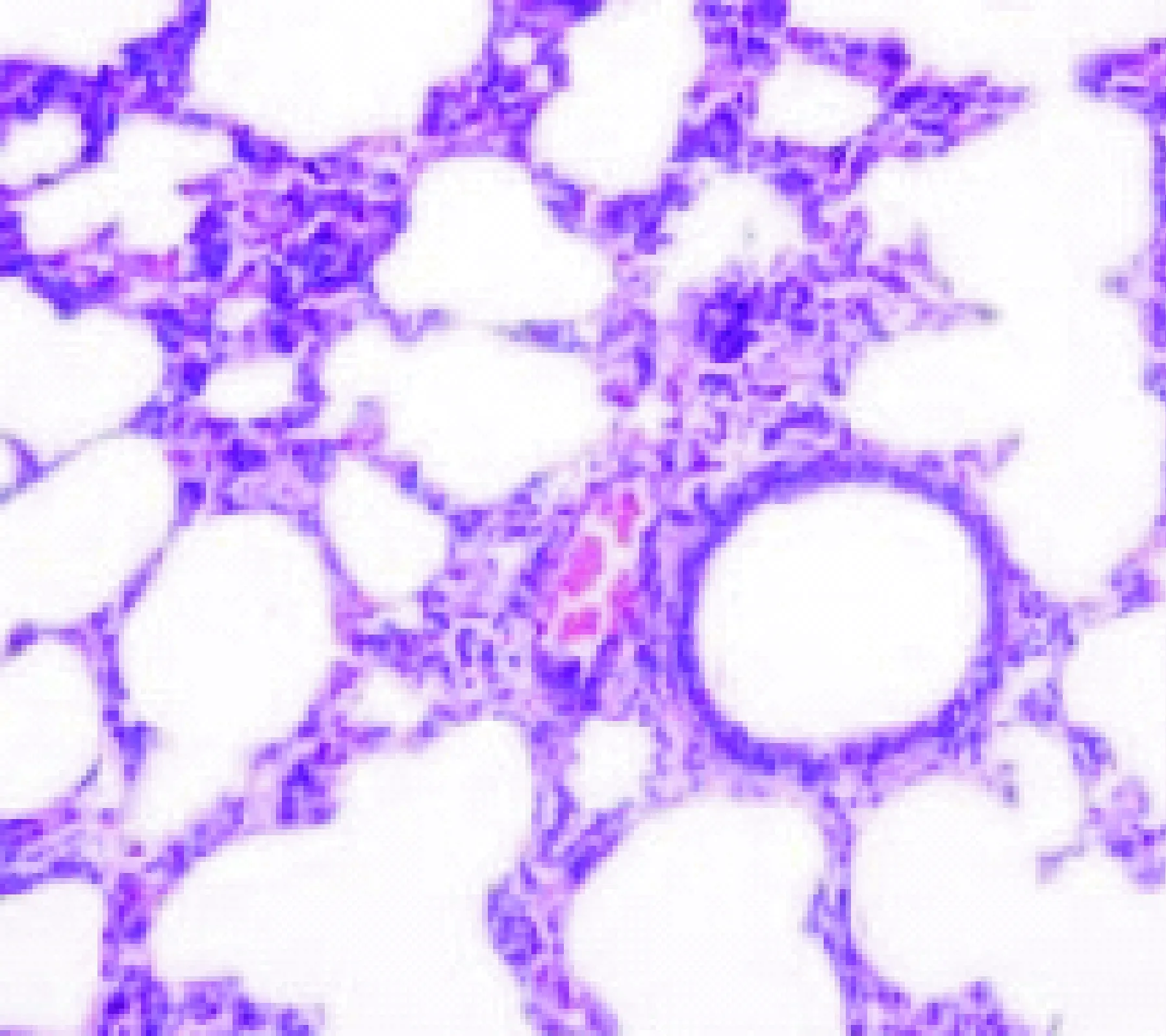
图1 假手术组大鼠肺组织病理学改变(HE×200)
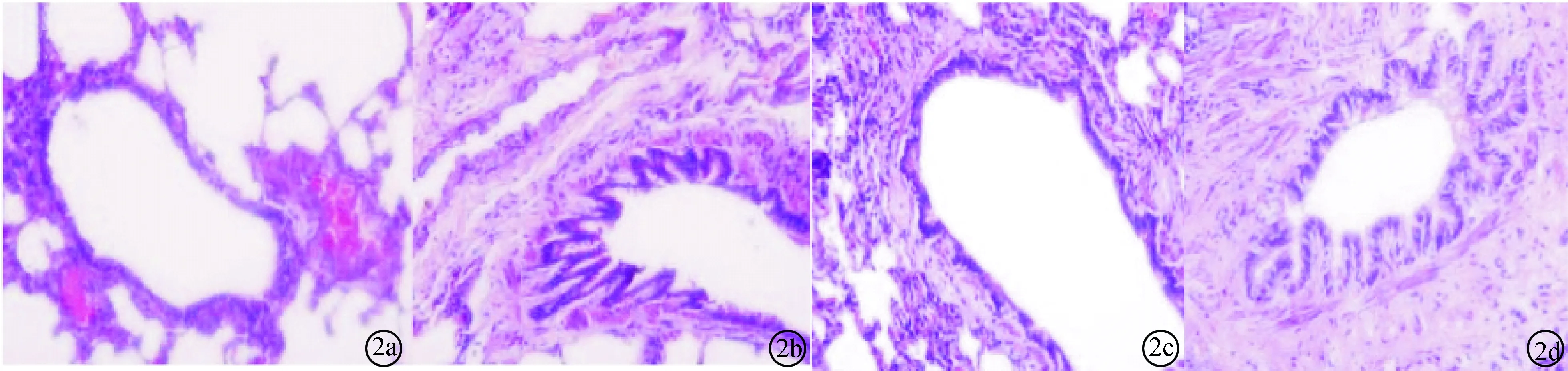
图2 CLP组大鼠肺组织病理学改变(HE ×200) a:6 h;b:12 h;c:24 h;d:48 h

表1 三组大鼠各时点肺损伤Smith评分 (分)
2.2 三组大鼠肺组织电镜超微结构改变 采用醋酸铀-柠檬酸铅双杂法,假手术组电镜下见肺泡细胞连接紧密,肺泡上皮细胞数量、形态基本正常,肺泡毛细血管膜结构基本正常。CLP组大鼠 6、12 h时点可见肺泡细胞连接欠紧密,细胞器减少,肺泡上皮细胞数目减少;24、48 h时点可见细胞连接疏松,胞浆浑浊,细胞数量减少,肺泡毛细血管内皮剥脱。UTI组大鼠各时点肺组织超微结构有不同程度损伤,但损伤程度均较 CLP组对应时点减轻,见图4~6。

图4 假手术组大鼠肺组织电镜超微结构(×10000)
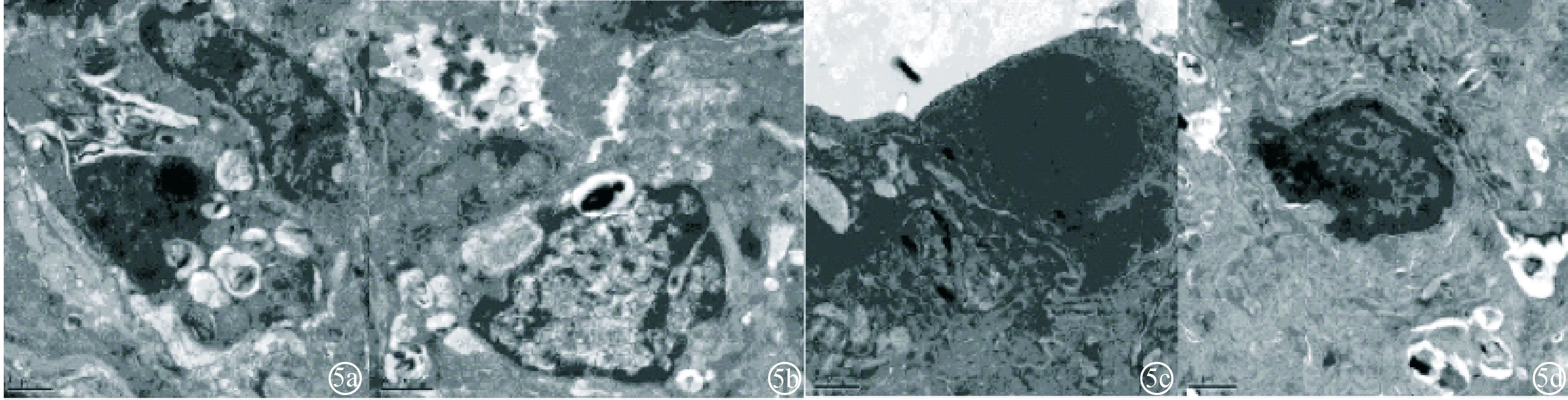
图5 CLP组大鼠肺组织电镜超微结构 a:6 h;b:12 h;c:24 h;d:48 h(×10000)
2.3 三组大鼠肺组织 HMGB1表达的比较 假手术组大鼠各时点肺组织 HMGB1的表达均明显低于CLP组(P< 0.05),UTI 组大鼠各时点肺组织中HMGB1的表达均明显低于CLP组(P< 0.05),见图7、表2。

图7 三组大鼠肺组织 HMGB1的表达
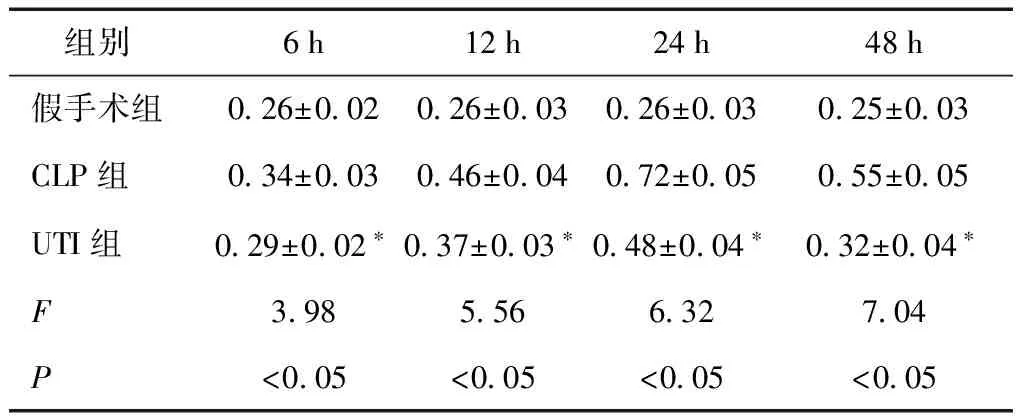
表2 三组大鼠肺组织 HMGB1的表达 (/β-actin)
*与CLP组比较,P< 0.05
3 讨论
本研究发现,CLP组大鼠肺组织病理证实了急性肺损伤的产生,Smith评分逐渐升高,在48 h达到高峰,肺组织水肿明显,肺泡及间质出现炎症、出血,伴部分肺组织不张;UTI组大鼠肺损伤Smith 评分在24 h时点达到高峰且峰值低于CLP组,在48 h时点肺损伤Smith评分明显低于CLP组。同时电镜超微结构的比较也表明乌司他丁可以减轻脓毒症性急性肺损伤大鼠肺组织的损伤程度。
HMGB1属于高迁移率族蛋白(HMG)家族中的HMGB亚家族,其生物学活性主要是通过与其相应受体的作用而实现的。多种炎性因子介导的肺部失控性炎症反应是急性肺损伤发生发展的主要病理生理基础,这些炎症因子通过一系列的级联反应参与急性肺损伤发生发展过程,HMGB1作为一种新的炎症介质,在急性肺损伤的发生发展中起着重要作用。本研究中发现,CLP组大鼠肺组织中HMGB1的表达明显高于假手术组,提示 HMGB1 可能在多个水平参与了脓毒症性急性肺损伤的发生发展。既往研究也发现,静脉给予重组人HMGB1后可以导致大鼠急性肺损伤的发生,同时肺组织里 TLR4 表达上调,支气管肺泡灌洗液中TNF-α、IL-1 含量增加[12];在肝脏缺血再灌注致急性肺损伤动物模型中,血浆中HMGB1表达上调,水平升高,同时在肺组织中 TLR4以及 HMGB1表达均上调[13]。
乌司他丁不仅能抑制蛋白酶、糖以及脂类的多种水解酶活性,还能抑制炎性介质的过度释放,稳定溶酶体膜,清除氧自由基以及抑制心肌抑制因子的产生[2~5]。本研究发现,UTI组大鼠肺组织 HMGB1的表达明显低于CLP组大鼠。既往研究发现乌司他丁可以抑制一些炎性因子(比如 TNF-α、IL-6、ICAM-1等)的过度表达,降低炎性反应程度,保护相关脏器功能[14,15]。
综上所述,本研究通过中度脓毒症结扎方法建立脓毒症急性肺损伤大鼠的模型,并通过乌司他丁对脓毒症急性肺损伤进行干预。结果发现乌司他丁可以减轻脓毒症急性肺损伤大鼠肺组织的损伤程度,HMGB1 参与了脓毒症急性肺损伤的发生发展,乌司他丁通过抑制HMGB1的表达减轻了急性肺损伤的严重程度。
[1] Kamisoglu K.Human metabolic response to systemic inflammation: assessment of the concordance between experimental endotoxemia and clinical cases of sepsis/SIRS[J].Critical Care,2015,19(1):71.
[2] Fang Y,Xu P,Gu C,et al.Ulinastatinimproves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory response[J].Journal of Trauma,2011,71(5):1297-1304.
[3] Gao C,Li R,Wang S.Ulinastatin protects pulmonary tissues from lipopolysaccharide-induced injury as an immunomodulator[J].Journal of Trauma & Acute Care Surgery,2012,72(1):169-176.
[4] 龙晓莉,邹凡文,冉茂娟,等.乌司他丁在大鼠慢性阻塞性肺疾病中对肺的保护作用及其机制[J].暨南大学学报自然科学与医学版,2015,36(6):496-502.
[5] Xiaoyun LI,Xiang LI,Chi X,et al.Ulinastatin ameliorates acute kidney injury following liver transplantation in rats and humans[J].Experimental & Therapeutic Medicine,2015,9(2):411-416.
[6] Gao C,Liu Y,Ma L,et al.Protective effects of ulinastatin on pulmonary damage in rats following scald injury[J].Burns Journal of the International Society for Burn Injuries,2012,38(7):1027-1034.
[7] Takahashi,Yusuke,Matsutani,et al.Therapeutic potential of recombinant thrombomodulin for lung injury after pneumonectomy via inhibition of high-mobility group box 1 in mice[J].Journal of Trauma & Acute Care Surgery,2016,81(5):868-875.
[8] Luo Y,Che W,Zhao M.Ulinastatin post-treatment attenuates lipopolysaccharide-induced acute lung injury in rats and human alveolar epithelial cells[J].Int J Mol Med,2017,39(2):297-306.
[9] Gil Minchan,Kim Yun Kyu,Hong Sang Bum,et al.Naringin Decreases TNF-α and HMGB1 Release from LPS-Stimulated Macrophages and Improves Survival in a CLP-Induced Sepsis Mice[J].Plos One,2016,11(10):e0164186.
[10] Kim J,Song J,Lee M.Combinational delivery of HMGB1 A box and heparin for acute lung injury.[J].J Control Release,2015,213(9):e57.
[11]Smith KM,Mrozek JD,Simonton S C,et al.Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques: gas exchange and lung pathology in an animal model of respiratory distress syndrome[J].Critical Care Medicine,1997,25(25):1888-1897.
[12]Deng Y,Yang Z,Gao Y,et al.Toll-like receptor 4 mediates acute lung injury induced by high mobility group box-1[J].Plos One,2013,8(5):e64375.
[13]Yang Z,Deng Y,Su D,et al.TLR4 as receptor for HMGB1-mediated acute lung injury after liver ischemia/reperfusion injury[J].Laboratory Investigation,2013,93(7):792-800.
[14]Feng M,Shu Y,Yang Y,et al.Ulinastatin attenuates experimental autoimmune encephalomyelitis by enhancing anti-inflammatory responses.[J].Neurochemistry International,2014,64(1):64-72.
[15]曾杰,陈宁波.乌司他丁联合血必净对重症急性胰腺炎患者免疫因子的调节作用[J].实用医院临床杂志,2013,10(5):119-122.
欢 迎 投 稿,欢 迎 订 阅
Protective effects of ulinastatin on lung injury in rats induced by sepsis
PUGuang-jun1,PUGui-xin1,DENGJia2
(1.DepartmentofPharmacy,People’sHospitalofAbaTibetanandQiangAutonomousPrefecture,Ma’erkang624000,China;2.DepartmentofAnesthesiology,SichuanAcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,China)
DENGJia
Objective To establish a model of acute lung injury induced by sepsis and investigate protective effects of ulinastatin on acute lung injury and its mechanism.Methods One hundred and twenty SD rats were randomly divided into the CLP group,UTI group or sham group,40 in each group.Each group was further divided into 6 h,12 h,24 h and 48 h subgroups,10 in each subgroup.A model of acute lung injury induced by sepsis was established.The rats in the TUI group
ulinastatin 100000 u/kg after the surgery.We observed pathology changes in the lung tissues and recorded Smith scores.We also observed ultrastructure changes in the lung tissues under transmission electron microscope.Moreover,we detected the expression of HMGB1 in the lung tissues by using Western Blot method.Results In the CLP group,lung injury gradually increased and reached the worst at 48 h.In the UTI group,the lung injury reached the worst at 24 h.Smith scores in the UTI group at 48 h were significantly lower than that in the CLP group (P< 0.05).Ultrastructure damage of the lung tissues under transmission electron microscope in the UTI group was reduced than that in the CLP group at the same time point.The expression of HMGB1 in the lung tissues in the UTI group was significantly lower than that in the CLP group (P< 0.05).Conclusion Ulinastatin can reduce acute lung injury induced by sepsis in rats by inhibiting the expression of HMGB1.
Sepsis;Acute lung injury;HMGB1;Ulinastatin
邓 佳
R631.2
A
1672-6170(2017)03-0024-04
2016-08-29;
2017-01-20)
