前后盘吸虫梅花鹿源分离株的种类鉴定及遗传进化分析
2017-06-05简永利涂宜强高永安宋军科
简永利,涂宜强,高永安,宋军科
(1.温州科技职业学院,浙江温州 325006; 2. 西北农林科技大学 动物医学院,陕西杨凌 712100)
前后盘吸虫梅花鹿源分离株的种类鉴定及遗传进化分析
简永利1,涂宜强1,高永安1,宋军科2
(1.温州科技职业学院,浙江温州 325006; 2. 西北农林科技大学 动物医学院,陕西杨凌 712100)
旨在研究温州地区的梅花鹿源前后盘吸虫的种类和遗传进化,利用形态学和分子生物学方法,对虫体样本进行染色显微镜观察及 pcox1和 pnad1序列的PCR扩增和序列分析。形态学鉴定结果表明,前后盘吸虫梅花鹿源分离株在外部形态、大小以及内部组织器官与鹿前后盘吸虫(Paramphistomumcervi)相近。序列比较分析结果表明,3株前后盘吸虫梅花鹿源分离株样本的 pcox1和 pnad1序列完全一致,扩增产物长度分别为446和505 bp,与GenBank中鹿前后盘吸虫(KT198987)同源性最高,分别为98.2%和97.7%。遗传进化分析表明,3株前后盘吸虫梅花鹿源分离株与鹿前后盘吸虫位于同一分支。表明,分离的虫株在形态学和遗传进化分析上均与鹿前后盘吸虫具有高度的一致性,提示获得的前后盘吸虫梅花鹿源分离株为鹿前后盘吸虫。
鹿前后盘吸虫;形态; pcox1; pnad1;遗传进化分析
前后盘吸虫病(Paramphistomosis)是由前后盘科(Paramphistomidae)吸虫所引起的寄生性吸虫病,是近年来被认为严重影响反刍动物生产性能的主要疾病之一[1]。前后盘吸虫种类繁多,呈世界性分布,以热带、亚热带地区流行率较高[2],不同地区感染的前后盘吸虫种类不同,其中以鹿前后盘吸虫(Paramphistomumcervi)最为常见[3]。鹿前后盘吸虫成虫寄生于牛、水牛、绵羊、山羊以及野生反刍动物的瘤胃和网胃中,引起的临床症状与寄生数量有密切关系;当大量的童虫在移行过程中寄生于皱胃、小肠、胆管时,可引起严重的胃肠炎,尤其是幼龄动物的感染率和死亡率都较高[4]。虽然目前还不清楚临床误诊和亚临床症状的动物数量,但感染的动物均出现饲料转化率降低、体质量减轻、泌乳量下降,据此估计该病所造成的经济损失远高于其他体内蠕虫[5-6]。
前后盘吸虫病的诊断主要依据病史和临床症状,确诊需要进行虫卵或虫体的形态学鉴定[2,7],而早期诊断可促使牧场及时采取防治措施从而减轻胆管、瘤胃的损伤。由于多数前后盘吸虫形态相近,目前尚缺乏可靠的区别鉴定方法。粪检时,鹿前后盘吸虫虫卵与其他吸虫卵相似,易出现误诊,且轻微感染和亚临床感染时检测更不敏感,因此,使用该诊断方法亦会延误病情。血清学诊断可用来弥补形态学鉴定的不足,部分虫体、分泌排泄抗原可被感染动物的血清识别,认为可将其作为诊断抗原用于临床疫情监测[8-9],但目前还尚未在临床推广使用。
随着分子生物学技术的快速发展,PCR、PCR-RFLP、DNA技术为寄生虫病诊断、病原分类、遗传变异研究提供有效手段。线粒体DNA(mtDNA)是独立于细胞核染色体的基因组,其结构简单、母系遗传、无重组、进化速率快,在种间、种内、群体间和群体内具有广泛的多态性,已被广泛用于寄生虫分类鉴定、群体遗传、系统进化研究中[10]。目前,用于吸虫发育分析的主要基因包括细胞色素c氧化酶第1亚基( cox1)基因、NADH脱氢酶( nad1)基因、内转录间隔区(ITS)等[11-14]。本研究以温州地区梅花鹿体内分离的前后盘吸虫虫体为研究对象,对其进行形态学种类鉴定和线粒体( cox1和 nad1)基因的扩增及序列分析,以期为鹿前后盘吸虫的分类鉴定提供理论基础。
1 材料与方法
1.1 试剂和虫体
加拿大树胶、DNA提取试剂盒TIAN Namp Genomic DNA Kit购自天根生化科技(北京)有限公司,TaqDNA聚合酶、琼脂糖、DL2000 DNA Marker购自宝生生物工程(大连)有限公司。苏木素染液,实验室配制保存。所用虫体均采自温州某鹿场急性死亡后的3只梅花鹿,剖检发现瘤胃内有大量虫体,采集虫体并保存于φ=75%的酒精中,备用。
1.2 虫体形态学鉴定
将固定于φ=75%酒精中的前后盘吸虫取出,置于乳酸透明液透明2 d;将配好的苏木素染液用蒸馏水稀释10倍,将透明的虫体标本投入染色液中染色过夜;虫体染色完毕后用蒸馏水洗去浮色,依次投入φ=30%、50%、70%的梯度酒精中各脱水30 min;将虫体标本置于2 个载玻片之间,载玻片两端用适当厚度的纸片垫衬以防止压片过薄损伤虫体组织,再用橡皮筋扎紧两端之后投入φ=70%的酒精固定24 h;次日用盐酸酒精混合液(φ=80%的酒精100 mL加入2 mL浓盐酸)分色30 min,使外部浓色退去,内部着色良好即可;分色后的虫体依次投入φ=80%、90%、95%、100%的梯度酒精中各脱水1 h;脱水完毕后将虫体投入二甲苯中30 min,虫体完全透明后取出;将透明后的虫体置于载玻片上,滴加适量的中性树胶后用盖玻片封片,干后置于显微镜下观察并采集图像,参照文献[15]的方法鉴定其种类。
1.3 虫体基因组DNA的提取
将保存于φ=75%酒精中的虫体用生理盐水洗涤3次,剪取1/2虫体置于1.5 mL离心管中,用研磨棒充分研磨20 min,加入200 μL 的GA溶液和20 μL 蛋白酶K,涡旋震荡使其彻底混匀,将其置于56 ℃水浴锅中消化过夜,期间颠倒混匀6次直至消化完全,次日按照DNA提取试剂盒说明书进行操作,提取的DNA样品保存于-20 ℃冰箱,备用。
1.4 cox1基因和 nad1基因的PCR扩增
参照Bowles等[16]报道的JB3、JB4.5、JB11、JB12引物用于扩增线粒体 cox1基因部分序列( pcox1)和 nad1基因部分序列( pnad1)。引物由上海生工生物工程技术服务有限公司合成,引物序列见表1。 pcox1和 pnad1预期扩增片段大小分别为450和500 bp。
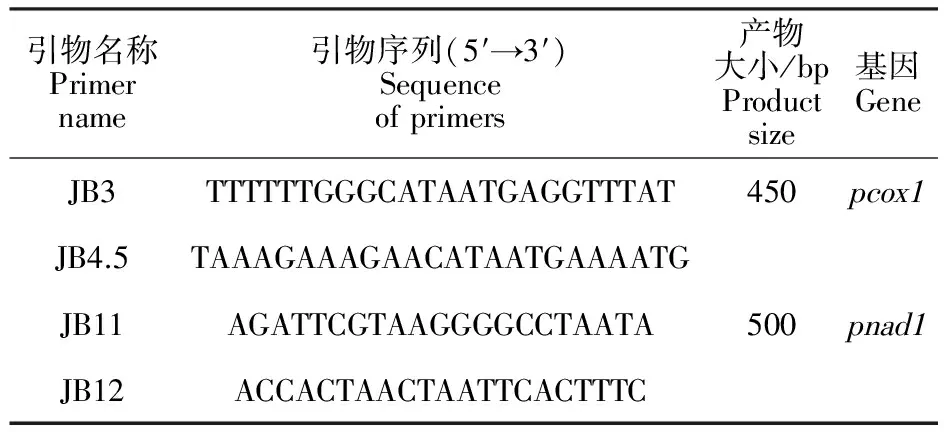
表1 扩增 pcox1和 pnad1基因片段的引物序列
PCR反应体系为25 μL:蒸馏水14.375 μL,10× PCR buffer 2.5 μL,MgCl23 μL,dNTP 2 μL,Primer(100 pmol/μL) 2 μL(上下游各1 μL),Taqpolymerase(5 U/μL) 0.125 μL,模板DNA 1 μL。反应条件:94 ℃预变性 5 min;94 ℃变性45 s,50 ℃(55 ℃)退火45 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。取5 μL的PCR产物经10 g/L的琼脂糖凝胶电泳,溴化乙锭(EB)染色,电泳结束后通过凝胶成像系统摄像并记录结果。
1.5 序列分析与种系发育分析
将PCR产物直接送上海生工生物工程技术服务有限公司进行测序。测序结果首先与GenBank中的序列进行Blast比对分析,确认数据可用性。使用ClustalX1.83软件、Chromas软件及图谱对正向、反向序列进行拼接和人工修正。从GenBank中检索现有前后盘吸虫 cox1和 nad1序列(登录号为KT198987、KP341657和KM397348),利用DNAstar 5.0 中的Megalign程序进行相似性分析并计算种间及种内差异。利用ClustalX 1.83及Mega 5.0软件对3个前后盘吸虫的鹿源分离株 pcox1和 pnad1序列与GenBank上收录的代表性吸虫的序列进行比对及计算遗传距离,然后用最大似然法(ML)进行遗传进化树状图分析。
2 结果与分析
2.1 形态学鉴定
新鲜虫体为鲜红色,呈圆锥形,虫体略向腹面弯曲,大小约为(5 ~8 )mm×(3 ~4)mm,寄生于梅花鹿瘤胃内。染色后虫体内部结构清晰可见(图1)。口吸盘位于虫体前端,腹吸盘则位于虫体亚末端,口、腹吸盘大小比例约为1∶4。缺咽,2条肠支较长,经3 ~ 4个弯曲,直达腹吸盘边缘。卵黄腺发达,滤泡状,位于肠支两侧。睾丸2个,呈横椭圆形,前后排列于虫体中后部。卵巢圆形,位于睾丸后侧缘。子宫在睾丸后缘经数个弯曲,沿睾丸背缘上升,至前睾前缘。子宫内充满虫卵。从虫体形态结构特征判断,该吸虫初步鉴定为鹿前后盘吸虫(P.cervi)。
2.2 PCR扩增
对 3株鹿前后盘吸虫样品的 pcox1基因和 pnad1基因片段进行PCR,成功扩增出约450和500 bp的片段,与预期的目的片段大小相符,且未出现非特异性条带,空白对照为阴性(图2)。
2.3 测 序
pcox1和 pnad1基因阳性样品经测序后,应用软件对正、反序列进行拼接并辅以人工核对。结果 pcox1和 pnad1核苷酸序列分别为446和505 bp。通过核苷酸序列比较,3个样品测序结果完全一致。经DNAStar 5.0中的Megalign软件分析表明, pcox1和 pnad1基因A、T含量分别为63%和63.5%。

a.前吸盘 Anterior sucker;b.肠支 Cecal bifurcation; c.卵黄腺 Vitelline gland; d.睾丸 Testis; e.腹吸盘 Posterior suker; f.卵巢 Ovary; g.子宫 Uterus

M. DNA Marker DL2000;1.阴性对照 Negative control;2~4.前后盘吸虫WZ1、WZ2、WZ3 Samples of P.cervi(WZ1, WZ2 and WZ3)
将样品的 pcox1和 pnad1基因序列与 GenBank收录的相应前后盘吸虫序列[鹿前后盘吸虫(KT198987)、雷登前后盘吸虫(KP341657)、长菲策吸虫(KM397348)]和其他吸虫序列[似锥低颈吸虫(KM111525)、肝片吸虫(AF216697)、大片吸虫(NC_024025)、土耳其斯坦血吸虫(HQ283100)]进行比对分析。序列经Clustal X 1.83软件比对和DNAStar 5.0中的Megalign 软件分析,鹿前后盘吸虫温州分离株 pcox1核苷酸序列与GenBank公布的鹿前后盘吸虫的种内差异为0~1.8%,序列相似性为98.2%;而与同科的雷登前后盘吸虫和长菲策吸虫种间存在较大的差异,种间差异为14.4%~15.2%,序列相似性小于87%。 pnad1核苷酸序列与GenBank收录的鹿前后盘吸虫的种内差异为0~2.3%,序列相似性为97.7%;与同科的其他2种吸虫种间差异为13.8%~18.1%,序列相似性小于87%。鹿前后盘吸虫 pcox1和 pnad1基因序列与其他所属吸虫相比,序列相似性均较低。
2.4 pcox1和 pnad1的种系发育分析
应用Mega 5.0软件,将扩增的 pcox1和 pnad1目的基因序列与GenBank上收录的鹿前后盘吸虫(KT198987)、雷登前后盘吸虫(KP341657)、长菲策吸虫(KM397348)及其他吸虫的线粒体基因组序列,并以土耳其斯坦血吸虫(HQ283100)作为外群共同构建系统遗传进化树。3个鹿前后盘吸虫温州分离株位于同一分支上,与P.cervi合为姐妹支。雷登同盘吸虫与长菲策吸虫聚类在另一分支,与鹿前后盘吸虫和鹿前后盘吸虫温州分离株合为一大支。结果表明,鹿前后盘吸虫温州分离株与其他2个前后盘科吸虫距离较远,与其他所属吸虫分离更远(图3)。

图3 基于 pcox1和 pnad1基因序列构建的进化树
3 讨 论
前后盘吸虫隶属于扁形动物门(Platyhelminthes)吸虫纲(Trematoda)复殖目(Digenea),包含6个科200多个种。调查发现,中国牛羊感染的前后盘吸虫种类达80多个[17]。前后盘吸虫种类的鉴定主要依据虫体形态大小、前后吸盘及生殖孔的位置、睾丸形状及位置、卵巢形态及位置、卵黄腺等特征。本试验前后盘吸虫温州分离株的虫体染色结构与Choudhary等[7]描述的虫体形态基本一致。但有研究[18]表明,前后盘吸虫不同发育阶段虫体的形态和内部器官差异较大,染色过程即费时又费力,且因该虫体较厚,染色后虫体内部结构不明显,同时需要熟练的寄生虫学专家才能区分鉴别其种类,因此,仅通过形态学方法准确鉴定前后盘吸虫种类还存在一定的困难。
PCR技术结合测序能精确区分生物种群的遗传进化程度,已广泛应用于病原的遗传变异、分子分类和种系发育分析中。线粒体DNA一般为双链闭环状,编码的蛋白为细胞内呼吸链中的酶复合体组分。相较于核糖体DNA,mtDNA进化速率快,能较好反映物种的群体内、群体间、种间和种内遗传变异情况,是研究进化的理想工具。其中,线粒体基因进化过程中编码蛋白质的核苷酸序列比较保守,因此, cox1和 nad1基因可作为分子标记应用于吸虫种类鉴定和系统发育分析。李利等[13]以 pcox1和 pnad1基因片段研究4种不同宿主来源土耳其斯坦东毕吸虫的遗传变异情况显示,线粒体基因存在差异。董世娟等[19]以 pcox1基因、黄维义等[20]以 pnad1基因片段研究中国片形吸虫的遗传变异情况显示, pcox1和 pnad1序列种内变异不明显,而种间变异显著,可作为片形吸虫分类鉴定的遗传标记。
本研究中所获得的3个前后盘吸虫梅花鹿源分离株样品mtDNA的 pcox1和 pnad1基因在碱基片段长度上无差异,表明这2个基因序列比较保守。前后盘吸虫梅花鹿源分离株与GenBank中的鹿前后盘吸虫P.cervi的相似度均在97%以上,而与其他种类吸虫相比,相似性低于87%。3个梅花鹿源分离株 pcox1基因序列的种间差异(14.4%~15.2%)远大于种内差异(0~1.8%); pnad1基因序列种间差异(13.8%~18.1%)比种内差异(0~2.3%)大,说明 pcox1和 pnad1可为种间差异提供遗传标记,适用于鹿前后盘吸虫的鉴定。这一结论与Ghatani对印度多种前后盘吸虫的 pcox1基因序列分析一致[12]。采用ML构建的进化树显示,前后盘吸虫温州分离株与P.cervi位于同一分支,同源性最高,其所属分支与其他吸虫所属分支较远,进一步说明 cox1和 nad1可作为理想的遗传标记用于寄生虫分类和进化研究中[21],为寄生虫的种类鉴定和分子流行病学研究提供有力工具。
Reference:
[1] PANYARACHUN S,SOBHON P,TINIKUL Y,etal.Paramphistomumcervi: surface topography of the tegument of adult fluke [J].ExperimentalParasitology,2010,125(2):95-99.
[2] RIEU E,RECCA A,BENET J J,etal.Reliability of coprological diagnosis ofParamphistomumsp.infection in cows [J].VeterinaryParasitology,2007,146(3/4):249-253.
[3] SAOWAKON N,LORSUWANNARAT N,CHANGKLUN GMOA N,etal.Paramphistomumcervi: The in vitro effect of plumbagin on motility,survival and tegument structure [J].ExperimentalParasitology,2013,133(2):179-186.
[4] ZAHIR A,RAHUMAN A,BAGAVAN A,etal.Evaluation of medicinal plant extracts and isolated compound epicatechin fromRicinuscommunisagainstParamphistomumcervi[J].ParasitologyResearch,2012,111(4):1629-1635.
[5] DORNY P,STOLIAROFF V,CHARLIER J,etal.Infections with gastrointestinal nematodesFasciolaandParamphistomumin cattle in Cambodia and their association with morbidity parameters [J].VeterinaryParasitology,2011,10(3/4):293-299.
[6] GONZALEZ M,LLADOSA S,CASTRO-HERMIDA J A,etal.Bovine paramphistomosis in Galicia (Spain): Prevalence,intensity,aetiology and geospatial distribution of the infection [J].VeterinaryParasitology,2013,191(3/4):252-263.
[7] CHOUDHARY V,HASNANI J J,KHYALIA M K,etal.Morphological and histological identification ofParamphistomumcervi(Trematoda:Paramiphistoma) in the rumen of infected sheep [J].VeterinaryWorld,2015,8(1):125-129.
[8] ANURACPREEDA P,WANICHANON C,SOBHON P,etal.Paramphistomumcervi: Antigenic profile of adults as recognized by infected cattle sera [J].ExperimentalParasitology,2008,118(2):203-208.
[9] ANURACPREEDA P,POLJAROEN J,CHOTWIWATTHANAKUN C,etal.Antigenic components,isolation and partial characterization of excretion-secretion fraction ofParamphistomumcervi[J].ExperimentalParasitology,2013,133(3):327-333.
[10] 贾万忠,闫鸿斌,倪兴维,等.蠕虫线粒体基因组研究及其应用进展[J].科学通报,2011,56(28/29):2358-2372.
JIA W ZH,YAN H B,NI X W,etal.Advances in the study of helminth mitochondrial genomes and their associated applications [J].ChineseScienceBulletin,2011,56(28/29):2358-2372(in Chinese).
[11] SANABRIA R,MORE G,ROMERO J.Molecular characterization of the ITS-2 fragment ofParamphistomumleydeni(Trematoda:Paramphistomidae) [J].VeterinaryParasitology,2011,177(1/2):182-185.
[12] GHATANI S,SHYLLA J A,ROY B,etal.Multilocus sequence evaluation for differentiating species of the trematode Family Gastrothylacidae,with a note on the utility of mitochondrial COI motifs in species identification [J].Gene,2014,548(2):277-284.
[13] 李 利,邢继兰,王春仁,等.4种终末宿主土耳其斯坦东毕吸虫 cox1和 nad1基因的序列分析[J].中国兽医科学,2008,38(4):303-307.
LI L,XING J L,WANG CH R,etal.Sequence analysis of cox1 and nad1 gene ofOrientobilharziaturkestanicumfrom 4 definitive hosts [J].ChineseVeterinaryScience,2008,38(4):303-307(in Chinese with English abstract).
[14] 伍慧兰,庄远红,黄 文.湖南省华支睾吸虫线粒体 cox1和 nad1基因的克隆及进化分析[J].中国兽医科学,2012,42(1):8-12.
WU H L,ZHUANG Y H,HUANG W.Cloning and phylogenetic analysis of mitochondrial cox1 and nad1 genes ofClonorchissinensisisolates from Hunan province[J].ChineseVeterinaryScience,2012,42(1):8-12(in Chinese with English abstract).
[15] 汪 明.兽医寄生虫学 [M].第三版.北京:中国农业出版社2007:124.
WANG M.Veterinary Parasitology[M].3rd ed.Beijing:China Agricutrural Press,2007:124(in Chinese).
[16] BOWLES J,BLAIR D,MCMANUS D P.Genetic variants within the genusEchimococcusidentified by mitochondrial DNA sequencing[J].MolecularandBiochemicalParasitology,1992,54(2):165-174.
[17] 王华东,廖党金.奶牛前后盘吸虫虫种调查与感染动态分析[J].中国兽医学报,2008,28(1):90-93.
WANG H D,LIAO D J.Species investigation ofParamphistomumspp.and analysis of its infection trends in dairy cattle at Hongya[J].ChineseJournalofVeterinaryScience,2008,28(1):90-93(in Chinese with English abstract).
[18] LOTFY W M,BRANT S V,ASHMAWY K I,etal.A molecular approach for identification ofParamphistomesfrom Africa and Asia[J].VeterinaryParasitology,2010,174(3/4):234-240.
[19] 董世娟,黄维义,林瑞庆,等.我国片形吸虫(Fasciola)线粒体细胞色素c氧化酶亚基Ⅰ基因( coxⅠ)部分序列的多态性[J].中国兽医学报,2005,25(4):378-381.
DONG SH J,HUANG W Y,LIN R Q,etal.DNA polymophism of the mitochondrial cytochrome oxidase subunit 1 gene ( coxⅠ) ofFasciolafrom Mainland China[J].ChineseJournalofVeterinaryScience,2005,25(4):378-381(in Chinese with English abstract).
[20] 黄维义,董世娟,杨晓野,等.我国片形吸虫线粒体NADH脱氢酶亚单位A 基因( nad1)多态性的研究[J].中国预防兽医学报,2005,27(4):273-276.
HUANG W Y,DONG SH J,YANG X Y,etal.DNA polymophism of the mitochondrial NADH dehydrogenase subunit 1 gene ( nad1) ofFasciolafrom China[J].ChineseJournalPreventiveVeterinaryMedicine,2005,27(4):273-276(in Chinese with English abstract).
[21] AMER S,DAR Y,ICHIKAWA M,etal.Identification ofFasciolaspecies isolated from egypt based on sequence analysis of genomic ( ITS1 and ITS2 ) and mitochondrial (NDIandCOI) gene markers [J].ParasitologyInternational,2011,60(1):5-12.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Identification and Phylogenetic Analysis ofParamphistomumcervifromCervusnippon
JIAN Yongli1, TU Yiqiang1, GAO Yong’an1and SONG Junke2
(1. Wenzhou Vocational College of Science and Technology, Wenzhou Zhejiang 325006, China; 2. College of Veterinary Medicine, Northwest A&F University, Yangling Shaanxi 712100, China)
The aim of the present study was to identify and genetically analyzeParamphistomumsp. collected from Cervus nippon around Wenzhou region of Zhejiang province in China. Adult worms were identified based on morphological observation under microscopy after staining, and then the pcox1 and pnad1 genes were analyzed by PCR and sequencing. Morphological identification results showed thatParamphistomumsp. fromC.nipponwere close toP.cerviin external shape, size and internal organs. Comparative sequence analysis demonstrated that the pcox1 and pnad1 sequences from threeC.nippon-derivedParamphistomumsp. were 446 bp and 505 bp in length and entirely consistent in similarity. Moreover, the homologies were the highest between isolates fromC.nipponandP.cervi(KT198987) in GenBank, reached 98.2% and 97.7%, respectively. Phylogenetic analysis revealed that the threeParamphistomumsamples fromC.nipponand theP.cervi(KT198987) locate in the same branch. These results indicated that theParamphistomumsp. has high consistency withP.cerviin morphology and phylogenetic analysis, suggesting theParamphistomumsp. sampled from theC.nipponin Wenzhou area isP.cervi.
Paramphistomumcervi;Morphology; pcox1; pnad1; Phylogenetic analysis
JIAN Yongli, female, lecture.Research area: prevention and control of the zoonotic parasitic diseases. E-mail:wkyjianyl@163.com
SONG Junke, male, lecture. Research area: research and teaching work of animal parasitic diseases. E-mail:sjk7998@163.com
日期:2017-05-22
2016-06-28
2016-09-06
浙江省教育厅科研项目(Y201432069)。
简永利,女,讲师,从事人兽共患寄生虫病防控研究。E-mail:wkyjianyl@163.com
宋军科,男,讲师,主要从事动物寄生虫病的研究。E-mail: sjk7998@163.com
S852.73
A
1004-1389(2017)05-0665-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170522.0856.006.html
Received 2016-06-28 Returned 2016-09-06
Foundation item Education Department Scientific Research Item of Zhejiang Province(No.Y201432069).
