大脑胶质瘤交叉性小脑神经机能联系不能的MR 动脉自旋标记灌注成像
2017-06-05刘宵雪张志强李建瑞翁艺菲卢光明1
刘宵雪,张志强,李建瑞,许 强,翁艺菲,卢光明1,*
(1.徐州医科大学医学影像学院,江苏 徐州 221004;2.南京总医院医学影像科,江苏 南京 210002)
中枢神经影像学
大脑胶质瘤交叉性小脑神经机能联系不能的MR 动脉自旋标记灌注成像
刘宵雪1,2,张志强2,李建瑞2,许 强2,翁艺菲2,卢光明1,2*
(1.徐州医科大学医学影像学院,江苏 徐州 221004;2.南京总医院医学影像科,江苏 南京 210002)
目的 采用MR三维动脉自旋标记(3D ASL)灌注成像技术探讨大脑胶质瘤患者交叉性小脑神经机能联系不能(CCD)现象。方法 回顾性分析31名大脑胶质瘤患者和31名正常人的MR资料,采用3D ASL灌注成像技术测量脑组织的脑血流量(CBF),计算并比较患者小脑半球CBF值不对称指数(AI)改变。分析小脑半球AI与大脑半球肿瘤区域AI、肿瘤级别、病变体积的关系。结果 大脑胶质瘤患者肿瘤对侧小脑半球CBF值较同侧小脑半球降低(t=5.04,P<0.01),胶质瘤患者小脑半球AI(AI小脑)较正常人增高(t=4.13,P<0.01),高级别与低级别胶质瘤间AI小脑的差异无统计学意义 (t=1.31,P>0.05)。患者AI小脑与大脑肿瘤区域AI(AI肿瘤:r=-0.28;AI肿瘤实质:r=-0.24;AI肿瘤加水肿:r=-0.19)、病变体积(r=0.18)均无相关性(P均>0.05)。结论 大脑胶质瘤可出现CCD现象,3D ASL灌注成像可无创定量评估小脑半球低灌注程度,但CCD现象与肿瘤的级别、病变范围及大脑半球AI无明显相关。
交叉性小脑神经机能联系不能;动脉自旋标记;磁共振成像;胶质瘤
交叉性小脑神经机能联系不能(crossed cerebellar diaschisis, CCD)是指各种原因造成幕上脑组织损伤后,引起对侧小脑血流减少和代谢减低的继发性改变[1-2]。在脑梗死[2]、脑出血[3]、颅内肿瘤[4]、癫痫[5]、脑炎[6]等疾病中均已发现这一改变,尤其是缺血性脑梗死后CCD有较多的报道[2],认为该现象的产生可能与皮质—桥脑—小脑通路(cortical-pons-cerebellar pathway, CPC)损伤有关,但该现象通常不会造成明显的额外临床神经功能缺损。Otte等[7]观察脑肿瘤相关的CCD现象,其通过PET或SPECT技术测量对侧小脑血流量和代谢改变,但未对脑肿瘤CCD与临床及病理间的关系进行研究。近年来,随着MR灌注成像技术的快速发展,三维动脉自旋标记(3-dimensional arterial spin labeling, 3D ASL)灌注成像因其无创、可定量分析全脑的脑血流量(cerebral blood flow, CBF)及可重复性好等获得广泛应用。本研究采用MR3D ASL灌注成像技术观察大脑胶质瘤患者CCD现象,并分析CCD与大脑半球不对称指数(asymmetry index, AI)、肿瘤级别、病变范围的关系。
1 资料与方法
1.1 一般资料 收集2014年9月—2016年4月南京总医院经病理证实为大脑胶质瘤的患者31例(胶质瘤组)和性别、年龄相匹配的正常人31名(对照组)。回顾性分析正常人和大脑胶质瘤患者术前的MR影像资料。大脑胶质瘤组男17例,女14例,年龄22~68岁,中位年龄51岁;高级别胶质瘤(WHO Ⅲ~Ⅳ级)16例,其中胶质母细胞瘤10例,间变性星形细胞瘤 4例,间变性少突胶质细胞瘤1例,胶质肉瘤1例;低级别胶质瘤(WHO Ⅰ~Ⅱ级)15例,其中弥漫性星形细胞瘤10例,少突胶质细胞瘤3例,节细胞胶质瘤1例,胚胎发育不良性神经上皮肿瘤1例。对照组中男15名,女16名,年龄25~60岁,中位年龄52岁。本研究经医院伦理委员会批准,所有受检者均知情同意。
1.2 仪器与方法 采用GE Discovery MR750 3.0T MR成像仪,8通道头颅相控阵线圈,检查范围覆盖全脑。受试者均接受常规序列扫描,包括轴位T1WI平扫及增强、轴位T2WI、冠状位T2 FLAIR序列,以及
3D ASL和3D T1WI增强扫描。3D ASL采用三维伪连续动脉自旋标记序列,TR 5 310 ms,TE 10.1 ms,标记延迟时间2.5 s,arms 6,NEX 3,层厚4 mm,层数36层。3D T1WI增强扫描TR 8.2 ms,TE 3.2 ms,NEX 1,层厚为1 mm。
1.3
图像分析 由2名放射科医师在不知病理结果的情况下分别阅片,意见有分歧时经协商达成一致。采用GE AW 4.6工作站中的Functool软件,获得CBF伪彩图像,结合3D T1WI增强图像,在胶质瘤患者及正常人的小脑半球灌注差异最大层面及其上下两个层面分别选取2个ROI,每层的ROI分别为小脑半球低灌注区及镜像区,ROI面积均为689 mm2。在胶质瘤患者的大脑半球病变范围最大的层面及其上下两个层面分别手动勾画6个ROI,每层的ROI分别为整个肿瘤区、肿瘤实质区、肿瘤加水肿区及其镜像区,其中勾画整个肿瘤区域ROI时,应沿肿瘤的边界,包括肿瘤内部的囊变、坏死区,肿瘤实质区的勾画应尽量避免囊变、坏死区,所有ROI的勾画均应尽量避免血管、脑沟、脑池、脑室(图1)。分别获得以上所有ROI相应的脑血流灌注值,所有区域的灌注值均取ROI的平均值。
胶质瘤组:AI小脑=(肿瘤同侧小脑半球CBF-肿瘤对侧小脑半球CBF)/肿瘤同侧小脑半球CBF[8];AI大脑(AI肿瘤、AI肿瘤实质、AI肿瘤加水肿)=(肿瘤镜像区CBF-肿瘤区CBF)/肿瘤镜像区CBF。对照组: AI小脑=(右侧小脑半球CBF-左侧小脑半球CBF)/右侧小脑半球CBF。于3D T1WI图像的每个层面勾画胶质瘤的病变范围,即幕上肿瘤加水肿区(图1),并采用Matlab软件计算肿瘤病变范围的体积。
1.4 统计学分析 采用SPSS 16.0统计分析软件,计量资料以±s表示。胶质瘤组两侧小脑半球间CBF值的比较采用配对t检验。胶质瘤组与对照组、不同级别肿瘤间的AI小脑比较采用两样本独立t检验。胶质瘤组AI小脑与AI大脑(AI肿瘤、AI肿瘤实质、AI肿瘤加水肿)、病变范围体积的相关性采用双变量相关分析。P<0.05为差异有统计学意义。
2 结果
两组性别和年龄差异均无统计学意义(χ2=0.40,P=0.53;t=0.66,P=0.52)。
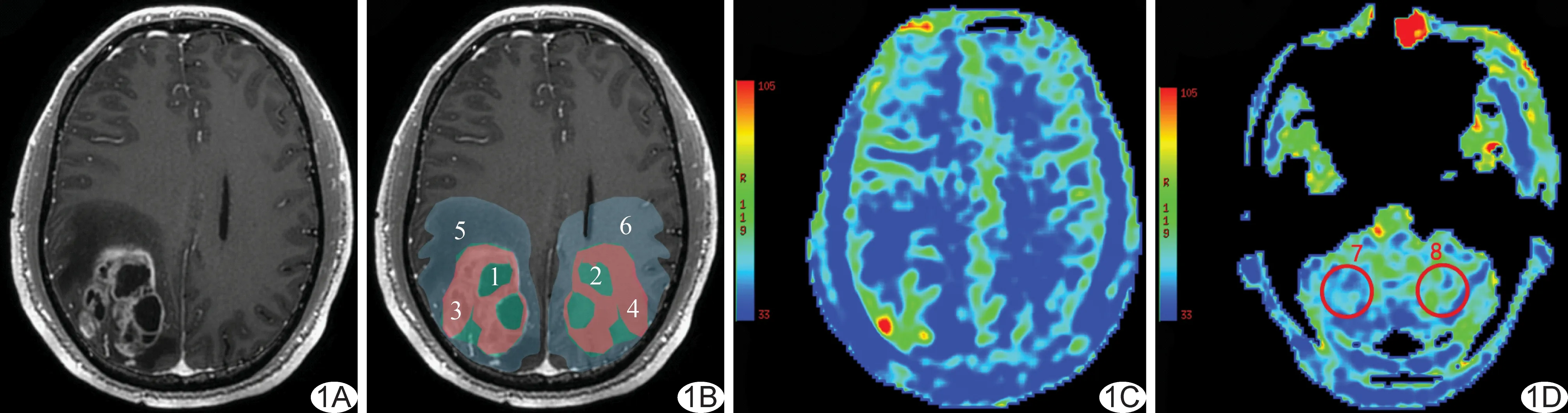
图1 ROI勾画示意图
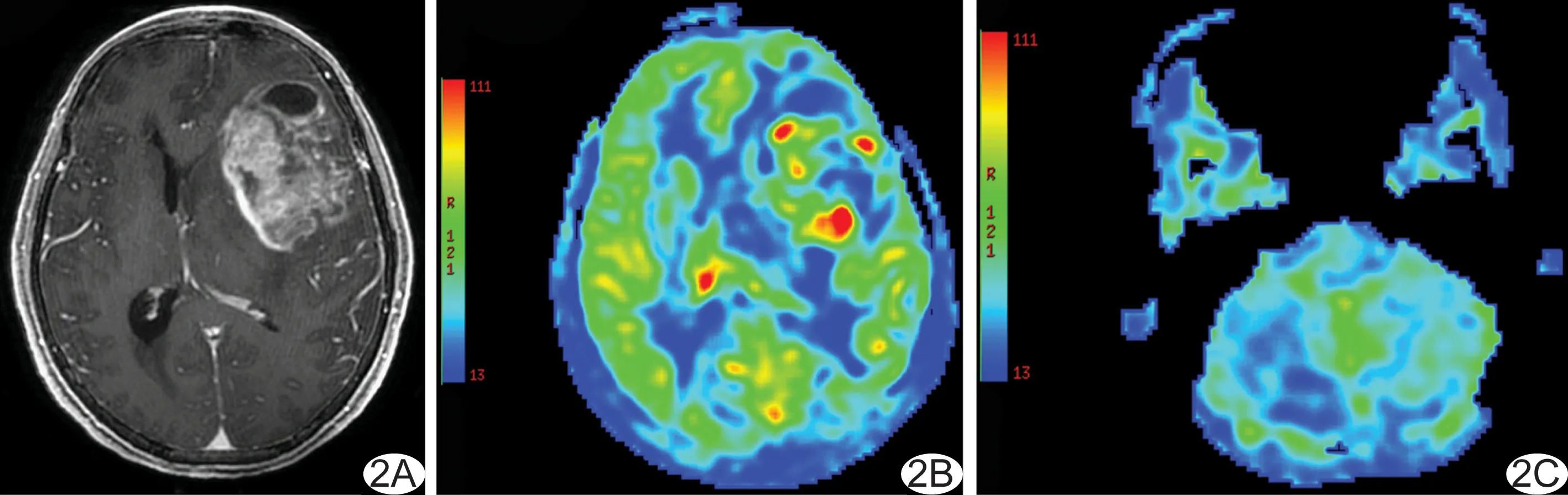
图2 患者女,61岁,左额叶胶质瘤母细胞瘤(WHO Ⅳ级)
胶质瘤组病变同侧小脑半球的CBF值为 (54.81±8.11)ml/(100 g·min);病变对侧小脑半球的CBF值为(51.44±7.79)ml/(100 g·min),病变对侧小脑CBF值较同侧明显降低(t=5.04,P<0.01;图2);对照组右侧小脑半球的CBF值为(53.00±7.31)ml/(100 g·min);左侧小脑的CBF值为(53.16±6.65)ml/(100 g·min)。胶质瘤组AI小脑值为0.06±0.07,对照组AI小脑值为-0.01±0.05,差异有统计学意义(t=4.13,P<0.01)。高级别胶质瘤患者的AI小脑值为0.07±0.09,低级别胶质瘤患者为0.05±0.06,差异无统计学意义(t=1.31,P>0.05)。
胶质瘤患者病变体积为5.27~299.12 cm3,中位体积60.78 cm3。AI小脑与胶质瘤的病变体积无相关性(r=0.18,P>0.05);AI小脑与AI大脑(AI肿瘤、AI肿瘤实质、AI肿瘤加水肿)间无相关性(r=-0.28、-0.24、-0.19,P均>0.05)。
3 讨论
本研究通过MR 3D ASL灌注成像发现:①肿瘤对侧小脑半球CBF值降低;②相比正常人,胶质瘤患者的AI小脑明显增高;③患者AI小脑与其AI大脑(AI肿瘤、AI肿瘤实质、AI肿瘤加水肿)、病变体积无明显相关性;不同级别患者的AI小脑也无明显差异。3D ASL灌注成像可较敏感地发现全脑灌注异常的区域,并通过AI定量评估小脑半球低灌注的程度。
在本组胶质瘤患者中,肿瘤对侧小脑半球CBF值较同侧小脑半球明显减低,且与正常人相比,胶质瘤患者的AI小脑明显增加,提示大脑胶质瘤患者存在CCD现象。关于CCD的发生机制至今尚不明确,既往研究[9-10]认为可能与以下3个因素有关:①血流动力学的改变;②神经传导通路的抑制;③迟发性神经元的死亡。目前多数学者[11]认为CCD的出现可能是由于幕上病变损伤CPC通路,导致神经信号的传输障碍,使皮质兴奋性冲动不能传至对侧小脑,从而导致对侧小脑出现功能抑制。也有学者[12]认为当幕上传入到对侧小脑的神经冲动减少时,CCD现象也会发生。Kim等[13]对22例慢性脑梗死的患者进行DTI研究,认为CCD现象是由于神经传导通路抑制而导致对侧小脑糖代谢减低。本研究提示胶质瘤患者CCD现象的发生机制与血流动力学的改变关系并不密切,推测该现象可能由于肿瘤对周围神经元的破坏并沿白质纤维束浸润,导致CPC通路局部的损害。
本研究发现高级别胶质瘤患者的AI小脑高于低级别患者,但差异无统计学意义,可能与本研究样本量较小有关。Otte等[7]研究证实与低级别相比,高级别胶质瘤的小脑葡萄糖代谢AI值较高,且两组差异有统计学意义。肿瘤病理分级越高,其侵袭性越强,对周围组织的破坏越大,导致CCD发生的概率也越大,但肿瘤级别并非是导致CCD的决定性因素,可能还受发病部位、病变大小等因素的影响。另外,本研究发现胶质瘤病变体积与AI小脑无明显相关性。Otte等[7]的研究也表明胶质瘤的大小与小脑的葡萄糖代谢AI无明显相关性。Sommer等[14]对156例单侧大脑中动脉供血区的血流灌注不足的患者进行研究,发现幕上梗死灶的体积与CCD的发生关系并不密切,提示对CCD的影响并不在于病灶的大小,而是取决于原发损害对CPC通路的影响程度。本研究结果发现胶质瘤患者的AI大脑(AI肿瘤、AI肿瘤实质、AI肿瘤加水肿)与AI小脑无相关性。但Nocuń等[15]采用SPECT分析发现,慢性期卒中患者AI大脑与AI小脑有相关性。Kamouchi等[16-17]对超急性期缺血性脑卒中的患者进行SPECT研究,发现AI小脑与大脑前额叶和前颞叶的AI有相关性,但并非在梗死区域。笔者认为卒中患者脑梗死区的灌注值减低,而脑胶质瘤患者肿瘤区的灌注值受肿瘤细胞侵袭程度、瘤内囊变、坏死区的影响,可表现为高灌注或低灌注,从而对AI大脑造成的影响并不确定,笔者分析可能与肿瘤患者与脑梗死患者AI变化并不完全相同有关。
本研究的不足:①样本量较少;②未对不同病理类型和不同发病部位的胶质瘤患者的CCD现象进行分层研究;③数据分析时采用手动勾画ROI的方法,ROI位置的选取在一定程度上受观察者的主观影响,对结果可能会造成一定的偏差;④仅运用ASL观察胶质瘤患者脑血流灌注,缺乏其他技术的比较和相互验证;⑤未对肿瘤引起的神经纤维束的破坏进行研究。今后笔者将联合DTI进一步探讨CCD的发生机制,并对患者的体征和其他临床指标进行相关分析。
综上所述,大脑胶质瘤可导致CCD的发生,3D ASL灌注成像可无创定量评估小脑半球低灌注程度。患者的AI小脑与肿瘤的级别、病变体积及大脑半球灌注的不对称性未发现明显相关关系,其CCD现象的产生机制还有待进一步研究。
[1] Lin DD, Kleinman JT, Wityk RJ, et al. Crossed cerebellar diaschisis in acute stroke detected by dynamic susceptibility contrast MR perfusion imaging. AJNR Am J Neuroradiol, 2009,30(4):710-715.
[2] Jeon YW, Kim SH, Lee JY, et al.Dynamic CT perfusion imaging for the detection of crossed cerebellar diaschisis in acute ischemic stroke. Korean J Radiol, 2012,13(1):12-19.
[3] Noguchi T, Nishihara M, Egashira Y, et al. Arterial spin-labeling MR imaging of cerebral hemorrhages. Neuroradiology, 2015,57(11):1135-1144.
[4] Teoh EJ, Green AL, Bradley KM. Crossed cerebellar diaschisis due to cerebral diffuse large B cell lymphoma on18F-FDG PET/CT. Int J Hematol, 2014,100(5):415-416.
[5] Zaidi SA, Haq MA, Bindman D, et al. Crossed cerebellar diaschisis: A radiological finding in status epilepticus not to miss. BMJ Case Rep, 2013,2013. pii:bcr2013200478.
[6] Mahale R, Mehta A, Rangasetty S. Crossed cerebellar diaschisis due to Rasmussen encephalitis. Pediatr Neurol, 2015,53(3):272-273.
[7] Otte A, Roelcke U, Von Ammon K, et al. Crossed cerebellar diaschisis and brain tumor biochemistry studied with positron emission tomography, [18F] fluorodeoxyglucose and [11C] methionine. J Neurol Sci, 1998,156(1):73-77.
[8] 何洁,翟勇,李则,等.脑缺血患者交叉性小脑神经机能联系不能的影响分析.中国医学影像技术,2006,22(27):1100-1103.
[9] Lim JS, Ryu YH, Kim BM, et al. Hematoma in basal ganglia or thalamus. J Nucl Med, 1998,39(12):2044-2047.
[10] Nagasawa H, Kogure K. Exo-focal postischemic neuronal death in the rat brain. Brain Res, 1990,524(2):196-202.
[11] Rubin G, Levy EI, Scarrow AM, et al. Remote effects of acute ischemic stroke: A xenon CT cerebral blood flow study. Cerebrovasc Dis, 2000,10(3):221-228.
[12] Gold L, Lauritzen M. Neuronal deactivation explains decreased cerebellar blood flow in response to focal cerebral ischemia or suppressed neocortical function. Proc Natl Acad Sci U S A, 2002,99(11):7699-7704.
[13] Kim J, Lee SK, Lee JD, et al. Decreased fractional anisotropy of middle cerebellar peduncle in crossed cerebellar diaschisis: Diffusion-tensor imaging-positron-emission tomography correlation study. AJNR Am J Neuroradiol, 2005,26(9):2224-2228.
[14] Sommer WH, Bollwein C, Thierfelder KM, et al. Crossed cerebellar diaschisis in patients with acute middle cerebral artery infarction: Occurrence and perfusion characteristics. J Cereb Blood Flow Metab, 2016,36(4):743-754.
[15] Nocuń A, Wojczal J, Szczepańska-Szerej H, et al. Quantitative evaluation of crossed cerebellar diaschisis, using voxel-based analysis of Tc-99m ECD brain SPECT. Nucl Med Rev Cent East Eur, 2013,16(1):31-34.
[16] Kamouchi M, Fujishima M, Saku Y, et al. Crossed cerebellar hypoperfusion in hyperacute ischemic stroke. J Neurol Sci, 2004,225(1-2):65-69.
[17] 赵珊珊,程敬亮,白洁,等.磁共振脑灌注加权成像评估脑梗死后交叉性小脑机能联系不能的发生因素及机制.中国医学影像技术,2012,28(7):1268-1271.
MR arterial-spin-labeling perfusion imaging in crossed cerebellar diaschisis in cerebral gliomas
LIUXiaoxue1,2,ZHANGZhiqiang2,LIJianrui2,XUQiang2,WENGYifei2,LUGuangming1,2*
(1.SchoolofMedicalImaging,XuzhouMedicalUniversity,Xuzhou221004,China; 2.DeptartmentofRadiology,JinlingHospital,Nanjing210002,China)
Objective To explore crossed cerebellar diaschisis (CCD) in cerebral gliomas with three-dimensional arterial-spin-labeling (3D ASL) perfusion MRI. Methods The images of 31 patients with cerebral gliomas and 31 normal subjects were retrospectively analyzed. The cerebral blood flow (CBF) were measured with 3D ASL technology, and the asymmetry index (AI) of cerebellar hemispheric CBF value changes were calculated and compared in patients. And the relationship between the AI values of cerebellar hemispheric and the AI values of tumor region in cerebral hemispheric, tumor histological grade and size were investigated. Results Compared with tumor ipsilateral cerebellar hemisphere of supratentorial glioma, the CBF value of contralateral cerebellar hemisphere significantly reduced (t=5.04,P<0.01), and the AI values of cerebellar hemispheric in patients obviously increased compared to normal subjects (t=4.13,P<0.01). But there was no significant difference in the AI values of cerebellum between high grade and low grade gliomas (t=1.31,P>0.05). In cerebral gliomas patients, there was no significant correlation between the AI values of cerebellar hemispheres and the AI values of cerebral hemisphere (tumor:r=-0.28; tumor parenchyma:r=-0.24; tumor plus edema:r=-0.19, allP>0.05), and tumor size (r=0.18,P>0.05). Conclusion Cerebral glioma can cause CCD phenomenon, and 3D ASL is able to quantitatively assess the degree of cerebellar hypoperfusion noninvasively. This phenomenon may not be associated with tumor histological grade, size and the AI values of cerebral hemispheric.
Crossed cerebellar diaschisis; Arterial spin labeling; Magnetic resonance imaging; Glioma
国家自然科学基金(81530054)。
刘宵雪(1991—),女,江苏响水人,在读硕士。研究方向:脑胶质瘤灌注成像。E-mail: fmriliuxx@163.com
卢光明,南京总医院医学影像科,210002。E-mail: cjr.luguangming@vip.163.com
2016-08-18
2017-01-18
10.13929/j.1003-3289.201608083
R739.41; R445.2
A
1003-3289(2017)04-0510-04
