神经鞘磷脂合成酶2缺乏对小鼠学习记忆能力的影响*
2017-06-05赵志欣李腊梅蒋恩社
赵志欣, 李腊梅, 蒋恩社
(河南大学公共卫生研究所, 开封 475004)
神经鞘磷脂合成酶2缺乏对小鼠学习记忆能力的影响*
赵志欣, 李腊梅, 蒋恩社△
(河南大学公共卫生研究所, 开封 475004)
目的:探讨神经鞘磷脂合成酶2缺乏对小鼠学习记忆能力的影响,方法:实验采用雄性的野生型小鼠(WT)和神经鞘磷脂酶合成酶2缺乏小鼠(KO),每组10只,采用Morris水迷宫实验进行7 d的定位航行试验检测,之后进行空间探索试验,以检测小鼠的学习记忆能力。结果:定位航行试验检测结果显示,两组小鼠找到平台的潜伏期、游泳距离均无显著性差异(P>0.05);空间探索试验检测结果显示,两组小鼠的目标象限滞留时间占总时间的百分比和小鼠穿越平台区的次数也无显著性差异(P>0.05);但野生型小鼠的搜索策略优于神经鞘磷脂合成酶2缺乏小鼠(P<0.05)。结论:神经鞘磷脂合成酶2缺乏影响小鼠的搜索策略,但不影响小鼠的空间学习记忆能力。
神经酰胺;神经鞘磷脂合成酶2;学习记忆;搜索策略
ceramide; sphingomyelin synthase 2; learning and memory; search strategy
【DOI】 10.12047/j.cjap.5470.2017.039
鞘脂类化合物在人体内广泛存在并且是各种生物膜结构的重要组成成分,特别是其中的神经酰胺(ceramide)和神经鞘磷脂(sphingomyelin, SM)在维持细胞膜功能的完整性方面具有重要的作用。神经酰胺作为细胞膜的组成成分,参与了细胞凋亡(包括自噬)和应激等生理功能[1]。神经酰胺主要的代谢途径是在细胞内经神经鞘磷脂合成酶(sphingomyelin synthases, SMSs)的作用转化成SM。在哺乳动物中,SMS有两种同工酶即神经鞘磷脂合成酶1(sphingomyelin synthase 1, SMS1)和神经鞘磷脂合成酶2(sphingomyelin synthase 2, SMS2)。SMS1主要存在于细胞高尔基体,而SMS2则主要存在于细胞膜上[2]。细胞膜上除了富含SMS2外,还富含神经鞘磷脂酶(sphingomyelinases,SMases)它可以将SM水解为神经酰胺。细胞膜上的神经酰胺和SM都可以通过外
泌作用进入血浆中,因此SMS2和神经鞘磷脂酶在维持细胞和血浆中神经酰胺和SM水平的平衡中起着重要作用[3]。有研究表明,SMS2的缺失或失活可使神经酰胺转化合成SM的途径受阻,进而血浆中SM的水平降低,神经酰胺水平升高[4,5]。血浆中神经酰胺水平升高还与2型糖尿病肥胖患者胰岛素抵抗严重程度之间有着很强的相关性[6]。另有研究表明,鞘脂类化合物还参与应激及死亡配体诱导的肝细胞凋亡[7]。另外在许多中枢神经系统疾病的病理变化中也观察到有细胞内SMSs和SMases两种酶活动的失调[8]。在阿尔茨海默病(Alzheimer disease,AD)患者额颞区灰质中发现有神经酰胺水平的升高和SM浓度的下降[9]。AD病人最典型的症状就是学习记忆能力的下降。Morris水迷宫(Morris water maze, MWM)实验是一种强迫实验动物游泳,学习寻找隐藏在水中平台的一种实验,可用于测试实验动物学习记忆能力之一的空间学习记忆能力。在MWM实验中,搜索策略是动物寻找平台所采用的游泳方式,在训练早期动物可能采用非空间策略发现平台,而在随后的训练中动物会逐渐采用空间策略,因为采用这种搜索策略寻找平台最为有效。这种搜索策略的改变是需要动物海马和前额皮质参与的高级神经活动。因此我们猜测SMS2缺乏导致神经酰胺在学习与记忆相关脑区内的堆积,可能会进一步对动物的学习记忆能力造成一定的影响。本研究利用SMS2基因敲除模型,采用MWM测试方法,分析神经酰胺和SM对小鼠学习记忆以及高级神经活动的影响,为人们认识神经酰胺及SM的生理作用提供进一步的理论依据。
1 材料与方法
1.1 实验动物及分组
本实验所用实验动物是由美国纽约州立大学动物实验中心引进的SMS2基因敲除杂合子小鼠(SMS+/-)经过杂交、回交和互交等方法进行繁殖获得。通过提取小鼠的DNA,经过PCR扩增和琼脂糖凝胶电泳鉴定小鼠的基因型,获得SMS2+/+和SMS2-/-基因型小鼠。小鼠分笼饲养,自由进食水和食物。饲养室温度控制在20~25℃,采光控制为12 h光照,12 h黑暗。测试前依据基因型(SMS2+/+, SMS2-/-)分别分组为野生型小鼠(Wild type, WT)和SMS2基因敲除小鼠(Knockout, KO)。每组小鼠各10只,均为黑色成年雄性小鼠。
1.2 Morris水迷宫行为学测试
本实验使用成都泰盟科技有限公司制造的MT-200 Morris水迷宫视频跟踪分析系统,圆形反应水箱直径为80 cm,逃逸平台直径为5 cm,箱内盛水,水温为室温摄氏25℃左右,平台置于水面下1 cm。在水中加入白色颜料以避免动物看清水下平台。摄像机位于水池中央上方200 cm,用于记录动物的位置、时间、游泳距离和以及游泳路径等。
实验分为定位航行试验(place navigation)和空间探索试验(spatial probe)两个阶段。定位航行试验历时7 d,首先将小鼠置于水迷宫测试所在房间30 min以适应环境。将水池分为4个象限,平台置于第三象限,每天将小鼠面向池壁分别从4个象限之一轻轻放入水中。每天每只小鼠训练2次, 时间间隔大于30 min。实验时设定小鼠游泳时间为60 s,若小鼠在60 s内未找到平台,人为地引导小鼠找到平台,潜伏期记为60 s。小鼠登上平台后,让其在平台上停留10 s。记录每天每组小鼠潜伏期、游泳距离、游泳速度和游泳轨迹。依据记录的小鼠游泳轨迹可将小鼠对平台的搜索分为空间搜索策略和非空间搜索策略。如图1所示,空间搜索策略是指小鼠采用直接游向目标象限或者最多用一圈路程便游向平台的模式。非空间搜索策略包括系统搜索策略和重复环绕策略。系统搜索策略是指小鼠系统地搜索水池而对目标象限没有清晰的空间定位,属于一种“地毯式”搜索;而重复环绕策略是指小鼠不停地以环状轨迹沿着水池边游泳的模式来搜索平台。由于空间搜索策略对目标象限有较清晰的定位,该策略优于非空间搜索策略。
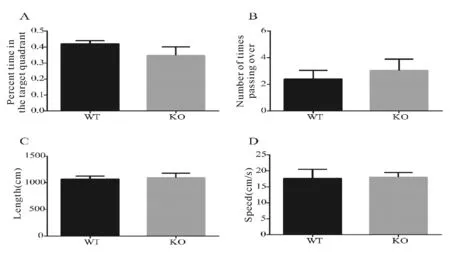
空间探索试验(spatial probe)于第8天进行,将平台撤除,将动物由原先平台象限的对侧放入水中,游泳60 s。记录和小鼠穿越原平台所在位置的次数、游泳距离、平均游泳速度及目标象限滞留时间占总时间的百分比。
1.3 统计学处理
每只小鼠每天两次测量结果的算术平均值作为小鼠当天的实验数据,每组10只小鼠每天的实验数据采用平均值±标准误(mean±SEM)表示。定位航行试验重复测量数据采用重复测量方差分析,空间探索试验数据采用t检验。数据分析采用SPSS 19.0统计软件。
2 结果
2.1 定位航行试验
两组小鼠7 d定位航行试验训练结果分析见表1。WT小鼠和KO小鼠寻找平台的潜伏期和游泳距离随着时间的延长均明显缩短,双因素重复测量数据的方差分析显示,时间因素(day) 主效应明显(P<0.001),表明两组小鼠的空间学习记忆能力随着时间的延长而逐渐提高。分组因素的检验结果显示分组因素无统计学意义(P>0.05),表明两组小鼠的空间学习记忆能力没有差异。对两组小鼠的平均游泳速度进行方差分析表明两组小鼠之间每天的平均游泳速度并无显著性差异(P>0.05),表明两组小鼠在体力上不存在显著性差异。
2.2 两组小鼠对平台搜索策略的比较
对小鼠游泳轨迹进行平台搜索策略分类,两组小鼠每天定位航行试验训练中搜索策略占总策略的百分比分布图分别见图2A和图2B。对定位航行试验训练中7 d内两种小鼠三种搜索策略平均百分比进行分析(图3),结果表明WT小鼠采用空间策略百分比明显高于KO小鼠(P<0.05),而KO小鼠采用重复环绕策略百分比明显高于WT小鼠(P<0.05)。在搜索策略的选择上,WT小鼠的搜索策略以更有效的空间搜索策略为主,优于KO小鼠。

Tab. 1 The performance of the WT and KO mice during the place navigation trials over 7-day training (mean±SEM)
WT: Wild type; KO: Knockout
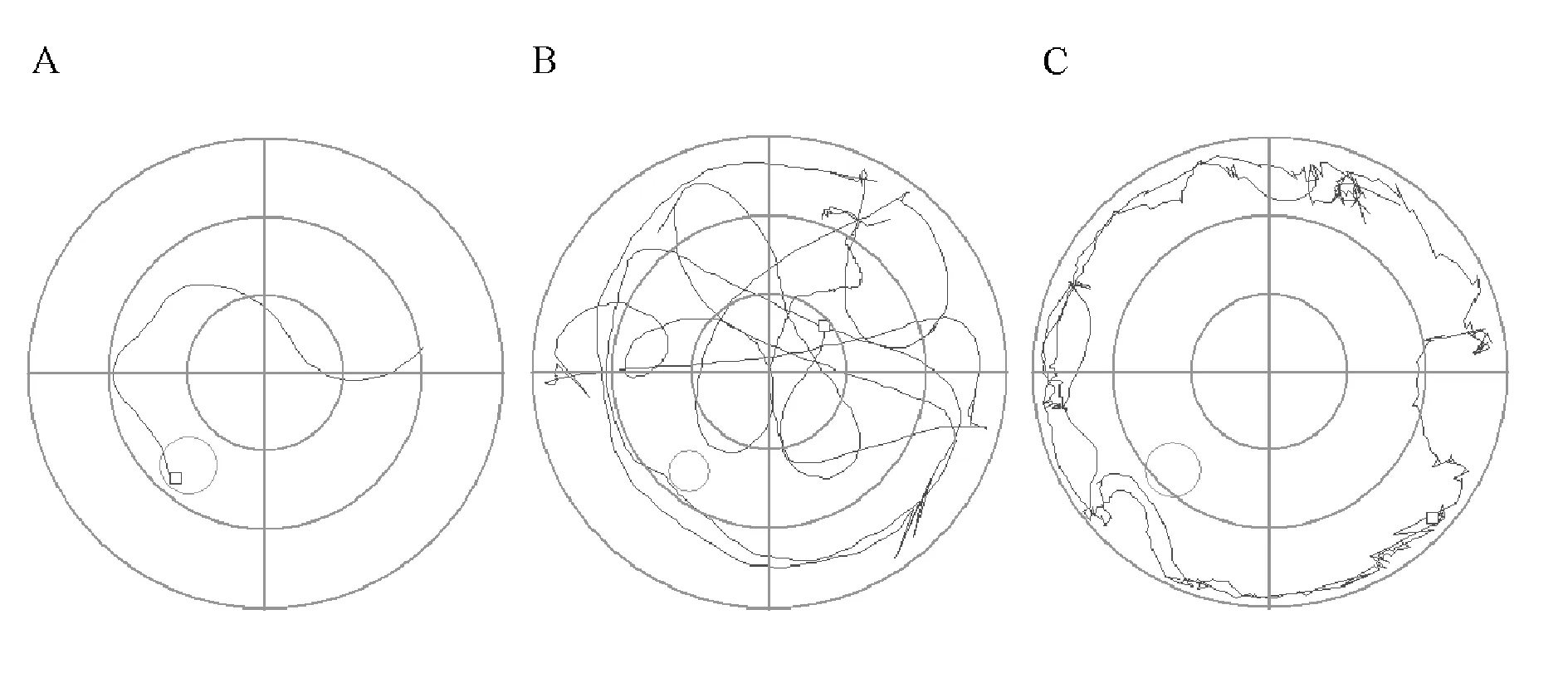
Fig. 1 Three typical swim-tracking paths used by the mice during the place navigation training phase A: Spatial search; B: Systematic search; C: Repetitive loop
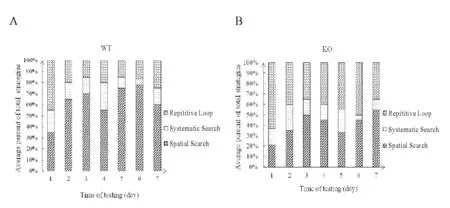
Fig. 2 Distribution of search strategies used by mice over 7-day trials A: Search strategies used by wild type mice; B: Search strategies used by knockout mice


2.3 空间探索试验
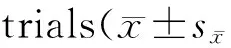
3 讨论
神经酰胺和SM是构成各种生物膜结构的两种重要的鞘脂类化合物,他们通过SMS2和神经鞘磷脂酶在细胞膜内进行神经酰胺/SM循环,进而调节两种鞘脂类化合物在细胞膜和血浆中的平衡状态。本研究观察SMS2酶缺乏对成年小鼠中枢神经系统的高级活动-学习记忆能力的影响。结果发现,SMS2酶缺乏对小鼠在水迷宫中的空间学习记忆能力没有影响,但却影响小鼠的平台搜索策略,SMS2缺乏小鼠采用空间搜索策略的比例下降。
神经酰胺和SM作为两种重要的鞘脂参与应激和细胞凋亡等多种生理和病理过程[1]。在肝豆状核变性疾病中,高浓度的Cu2+可以激活酸性神经鞘磷脂酶和升高血浆中神经酰胺水平,导致肝细胞和红细胞凋亡的发生[10]。而肝细胞和红细胞的功能正常对于中枢神经系统的营养和氧气来源具有重要作用,肝豆状核变性疾病中的神经和精神症状表现也可能和血浆中升高的神经酰胺水平有关。对一组健康妇女9年的跟踪研究表明,志愿者血清中神经酰胺水平升高与AD发生风险之间存在着强烈的相关性[11]。我们猜想SMS2缺乏可能会对高级神经系统的活动学习记忆产生影响。然而本研究并没有发现SMS2缺乏对小鼠的学习记忆能力有显著的影响。推测其原因可能有以下几个方面:首先,对于鼠类来说,空间记忆是依赖于海马的陈述性记忆,内侧颞叶包括海马、嗅皮层和旁海马皮层在这一过程中起着重要作用。SMS2缺乏虽然会影响血浆中神经酰胺和SM的平衡,但是并没有显著改变细胞内神经酰胺和SM水平[3]。因而有可能这些脑区的的功能没有受到较大的影响。SMS2缺乏小鼠潜伏期随着时间的延长明显下降表明小鼠可以对平台位置形成良好的记忆。由于两组小鼠在游泳速度上并无差异,因此两组小鼠学习记忆能力并没有受到体力改变等外界因素的影响。其次,有研究表明SMS2酶缺乏对动脉粥样硬化也有有利的一面,SMS2酶缺乏可以降低小鼠动脉粥样硬化的发生[12-14],也可以增加胰岛素的敏感性和减缓高脂饮食诱发的肥胖[15],因此SMS2缺乏导致的血浆中神经酰胺和SM平衡的改变是否会对中枢神经系统产生显著的影响还需要更多的实验研究。最后需要指出的是,本研究采用Morris水迷宫实验来评价实验动物的学习记忆能力,但是水迷宫实验也易受到多种因素的影响。有研究表明,老年小鼠空间学习记忆能力下降,慢性应激对老年小鼠的空间学习记忆能力的影响较青年小鼠更为显著[16]。本实验只针对成年雄性小鼠进行研究,那么随着年龄的增加SMS2缺乏是否会对小鼠的学习记忆能力有显著性影响还有待进一步研究。
本研究发现SMS2缺乏对小鼠的更高级的神经活动有一定的影响,在搜索策略方面,野生小鼠主要以空间搜索策略搜寻平台,而SMS2缺乏小鼠主要采用空间搜索和重复环绕策略来搜寻平台,从搜索策略优越上来看,SMS2缺乏小鼠搜索策略不如野生型小鼠。搜索策略的改变反应小鼠行为认知能力的变化,表明SMS2缺乏诱发的血浆中神经酰胺和SM平衡的改变对大脑的更高级的神经活动产生了影响。已知AD是一种与年龄相关的学习、记忆和认知能力受损的疾病,有研究表明在AD发病的早期额叶皮层内与脂筏相结合的SM水平显著降低[17]。这些脑区的轻度受损都有可能影响到动物的行为认知能力。具体SMS2缺乏会影响到哪一个或者哪些脑区? 都还有待于进一步的研究。
总之,SMS2缺乏虽不能影响小鼠的学习记忆能力,但却影响到小鼠对搜索策略的选择,SMS2缺乏对动物各个系统的影响是复杂的。在临床实践中,理解循环系统或者细胞内神经酰胺和SM水平改变对中枢神经系统的作用、作用部位及其潜在的影响,对于早期发现血液中两种物质水平的异常,以及预防和治疗与记忆认知有关的老年性疾病具有重要意义。
[1] Gulbins E, Li PL. Physiological and pathophysiological aspects of ceramide [J].AmJPhysiolRegulIntegrCompPhysiol, 2006, 290(1): R11-26.
[2] Huitema K, van den Dikkenberg J, Brouwers JF,etal. Identification of a family of animal sphingomyelin synthases [J].EMBOJ, 2004, 23(1): 33-44.
[3] Hussain MM, Jin W, Jiang XC. Mechanisms involved in cellular ceramide homeostasis [J].NutrMetab(Lond), 2012, 9(1): 71-77.
[4] Liu J, Zhang H, Li Z,etal. Sphingomyelin synthase 2 is one of the determinants for plasma and liver sphingomyelin levels in mice[J].ArteriosclerThrombVascBiol, 2009, 29(6): 850-856.
[5] Li Z, Fan Y, Liu J,etal. Impact of sphingomyelin synthase 1 deficiency on sphingolipid metabolism and atherosclerosis in mice[J].ArteriosclerThrombVascBiol, 2012, 32(7): 1577-1584.
[6] Haus JM, Kashyap SR, Kasumov T,etal. Plasma ceramides are elevated in obese subjects with type 2 diabetes and correlate with the severity of insulin resistance[J].Diabetes, 2009, 58(2): 337-343.
[7] Mari M, Fernandez-Checa JC. Sphingolipid signalling and liver diseases [J].LiverInt, 2007, 27(4): 440-450.
[8] Bienias K, Fiedorowicz A, Sadowska A,etal. Regulation of sphingomyelin metabolism [J].PharmacolRep, 2016, 68(3): 570-581.
[9] He X, Huang Y, Li B,etal. Deregulation of sphingolipid metabolism in Alzheimer's disease [J].NeurobiolAging, 2010, 31(3): 398-408.
[10]Lang PA, Schenck M, Nicolay JP,etal. Liver cell death and anemia in Wilson disease involve acid sphingomyelinase and ceramide [J].NatMed, 2007, 13(2): 164-170.
[11]Mielke MM, Bandaru VV, Haughey NJ,etal. Serum ceramides increase the risk of Alzheimer disease: the Women's Health and Aging Study II [J].Neurology, 2012, 79(7): 633-641.
[12]Liu J, Huan C, Chakraborty M,etal. Macrophage sphingomyelin synthase 2 deficiency decreases atherosclerosis in mice[J].CircRes, 2009, 105(3): 295-303.
[13]Fan Y, Shi F, Liu J,etal. Selective reduction in the sphingomyelin content of atherogenic lipoproteins inhibits their retention in murine aortas and the subsequent development of atherosclerosis[J].ArteriosclerThrombVascBiol, 2010, 30(11): 2114-2120.
[14]Jiang XC, Liu J. Sphingolipid metabolism and atherosclerosis [J].HandbExpPharmacol, 2013(216): 133-146.
[15]Li Z, Zhang H, Liu J,etal. Reducing plasma membrane sphingomyelin increases insulin sensitivity [J].MolCellBiol, 2011, 31(20): 4205-4218.
[16]李 亚, 张亚楠, 陈亚静, 等. GDNF在慢性应激和老化致小鼠行为与认知损伤中的作用 [J]. 中国应用生理学杂志, 2013, 29(1): 52-56.
[17]Fabelo N, Martin V, Marin R,etal. Altered lipid composition in cortical lipid rafts occurs at early stages of sporadic Alzheimer's disease and facilitates APP/BACE1 interactions [J].NeurobiolAging, 2014, 35(8): 1801-1812.
2016-06-30
2016-12-15
R338.2
A
1000-6834(2017)02-155-04
△【通讯作者】Tel: 0371-23880199, E-mail: esjiang@gmail.com
