氧化应激对原代培养乳鼠心房肌细胞中内质网应激及凋亡因子的影响*
2017-06-05刘晓翠王伊林
龙 杰, 王 羽+, 刘晓翠, 于 淼, 王伊林, 黄 侠, 赵 明
(1. 内蒙古民族大学, 通辽 028000; 2. 内蒙古民族大学附属医院, 通辽 028000)
氧化应激对原代培养乳鼠心房肌细胞中内质网应激及凋亡因子的影响*
龙 杰1, 王 羽1+, 刘晓翠1, 于 淼1, 王伊林1, 黄 侠1, 赵 明2△
(1. 内蒙古民族大学, 通辽 028000; 2. 内蒙古民族大学附属医院, 通辽 028000)
目的:研究氧化应激对原代培养乳鼠心房肌细胞凋亡、内质网应激及凋亡因子的影响。方法:实验分2组:对照组、氧化应激组。原代培养乳鼠心房肌细胞,氧化应激组在培养的原代心房肌细胞中加入终浓度为100 μmol /L 的H2O2培养2 h,检测氧化和抗氧化指标超氧化物歧化酶(SOD) 活力、丙二醛(MDA)及还原型谷胱甘肽(GSH) 含量;检测细胞凋亡、细胞GRP78、GRP94及chop、bax、bcl-2 mRNA表达。结果:与对照组相比较,氧化应激组心房肌细胞SOD活力和 GSH 含量下降、MDA含量增加(P<0.01),细胞凋亡增加(P<0.01),细胞GRP78、GRP94、chop、bax mRNA表达增加、bcl-2 mRNA表达减少(P<0.01)。结论:氧化应激反应可能介导内质网应激反应并激活促凋亡因子表达,抑制抗凋亡因子表达,引起心房肌细胞凋亡增加。这可能与心房纤颤的发生有一定关联性。
氧化应激;内质网应激;凋亡;心房纤颤
【DOI】 10.12047/j.cjap.5381.2017.047
心房颤动(简称房颤) 是临床上最常见的持续性心律失常,房颤可以增加血栓栓塞风险,增加总死亡率[1]。心房颤动(简称房颤)具有自身进展性, 主要由于房颤时心房发生电、结构和功能重构, 而心房结构重构又在促进房颤发作并持续中发挥更重要作用。研究证实, 房颤时心房肌的氧化应激产物增加、氧化还原基因表达失衡以及线粒体DNA 存在氧化损伤, 表明了房颤时心房肌存在氧化应激[2]。氧化应激可能在房颤时心房结构重构过程中发挥重要作用[3]。心肌细胞凋亡是心肌重构的重要机制,Aimé-Sempé等[4]研究发现心房肌细胞凋亡与心房组织重构有明确的联系。凋亡的产生机制复杂,近年发现内质网应激反应介导的细胞凋亡是一条新的细胞凋亡信号转导通路[5]。 然而,氧化应激与内质网应激及心房肌细胞凋亡是否关联还未见报道,本实验拟观察氧化应激与内质网应激及心房肌细胞凋亡是否具有关联性,以探讨心房纤颤的发病机制。
1 材料与方法
1.1 动物药品与仪器
1~3 d,Balb/c新生乳鼠购置吉林大学基础医学院动物中心,许可证号:scxk(吉)2011-0004; cTnI,α-SCA抗体购于santa公司,Super M-MLV 反转录酶(BioTeke)公司, RNA simple Total RNA Kit试剂盒(TIANGEN)公司,引物由生工生物工程(上海)有限公司合成。SOD、MDA、GSH 试剂盒(Sigma 公司)。
1.2 乳鼠心房肌细胞的分离与培养
经下列实验步骤:(1)将实验室提供的无菌乳鼠心脏10个放于工作台内,准备分离细胞。(2)将乳鼠心脏放入培养皿中,用PBS反复清洗。(3)将清洗后的心脏组织剪碎至1~3 mm3小块。(4)加入0.1%Ⅱ型胶原酶以及0.1%胰蛋白酶混合液,37℃消化25 min。消化好后将其移入15 ml离心管1500 r/min离心7 min去上清。(5)用PBS重悬沉淀,用吸管反复吹打1 000 r/min离心5 min,用培养基重悬细胞,过200目筛网去除大块组织。(6)PBS清洗细胞两次,1 000 r/min离心10 min,去上清,留沉淀。(7)加入1 ml的培养基重悬细胞,进行细胞计数后放置到培养板中。(8)成纤维细胞贴壁较快,2 h差速贴壁法可去除大量的成纤维细胞,上清悬液中为较纯的心房肌细胞。细胞放置在培养板后24 h不用动,随后每两天换一次液。
1.3 免疫组织化学方法鉴定乳鼠培养心房肌细胞
为明确培养细胞为心房肌细胞,对各组乳鼠培养心肌细胞进行免疫组化鉴定。按常规方法,将细胞用0.1%TritonX-100孵育,然后加入3%过氧化氢以破坏内源性过氧化物酶,室温作用5 min。经PBS洗涤后,加入血清封闭非特异结合位点。用1∶1 000的抗体ɑ-SCA作用,4℃作用过夜,经PBS洗涤后二抗室温孵育1 h。DAB显色,苏木素复染,最后封片观察。
1.4 实验分组及氧化应激模型制备
实验分为对照组及氧化应激模型组,乳鼠心肌细胞按照细胞浓度为5×104/ml接种于6孔板,并将其置于37℃,5%CO2的培养箱内培养过夜,次日,对照组不做任何处理,正常培养基培养。氧化应激组在培养的原代心房肌细胞中加入终浓度为100 μmol /L 的H2O2培养2 h,检测氧化和抗氧化指标的变化。
采用ELISA法检测两组心房肌细胞超氧化物歧化酶(superoxide dismutase, SOD) 活力、丙二醛(malondialdehyde,MDA)及还原型谷胱甘肽(glutathione,GSH) 含量。具体按照试剂盒说明书进行。SOD 活性单位定义:每毫克组织蛋白在1 ml反应液中SOD抑制率达50%时所对应的 SOD量为一个SOD活性单位(U)。GSH 活性单位定义:每毫克蛋白质,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 μmol/L为一个活力单位(U)。MDA含量定义:每毫克组织蛋白丙二醛的含量。所有指标吸光值均用紫外可见分光光度计测定
1.5 TUNEL检测两组心房肌细胞凋亡
两组心房肌细胞应用Tunel法,经过下列步骤检测凋亡(1)透化: 滴加0.1 % Triton X-100(0.1 %柠檬酸钠盐配置) 50 μl,室温放置8 min。(2)PBS漂洗,3×5 min。(3)封闭:滴加3 % H2O2以覆盖爬片,室温放置10 min。(4)PBS漂洗,3×5 min。(5)Labeling:配制TUNEL reaction mixture:Enzyme solution与Label Solution按1∶9配制(即用即配,冰上操作)。(6)滴加TUNEL反应液至完全覆盖玻片。(7)保湿、避光、37℃孵育60 min。(8)PBS漂洗,3×5 min。(9)滴加Converter-POD 至完全覆盖玻片,37℃孵育30 min。(10) PBS漂洗,3×5 min。(11) 加DAB底物直至完全覆盖玻片,待颜色刚刚变深时迅速置于水中终止反应。(12) PBS漂洗,3×5 min。(13) 滴加苏木素,复染3 min后,用蒸馏水清洗,滴加1%盐酸乙醇中分化3 s,立即用自来水清洗,流水反蓝20 min。(14) 滴加甘油乙醇封片。最后进行显微镜检测。
1.6 real time PCR 检测两组心房肌细胞GRP78、GRP94及chop、bax、bcl-2 mRNA表达
引物信息:GRP78-F CAGCCAACTGTAACAATC AA;GRP78-R CTGTCACTCGGAGAATACCA;GRP94-F GGTGTTGTGGATTCCGATGA;GRP94-R AAGTTTAGCAAGCCGTGT;Bcl-2-F CTCTGGTTGGGATTCCT ACGG;Bcl-2-R CGGCATGATCTTCTGTCAAGTTTA;Bax-F CCAGGATGCGTCCACCAAGAA;Bax-R AGCAAAGTAGAAGAGGGCAACCAC;Chop-F CAGCGACAGAGCCAGAATAAC;Chop-R TGTTGCAGATGATGAGAGCC;β-actin-F CTGTGCCCATCTACGAGGG CTAT;β-actin-R TTTGATGTCACGCACGATTTCC
经下列实验步骤:(1)样本总RNA提取(2)RNA浓度检测(3)反转录(4)荧光定量PCR检测。每种样本每个基因进行4个复孔平行实验,实验重复3次(n=3),实验数据的选取,是舍去误差较大的数值,取剩余数值的平均值作为最终实验保留数据,利用2-△△CT方法分析数据。
1.7 统计学处理
2 结果
2.1 各组乳鼠培养心肌细胞免疫组化
各组乳鼠培养心肌细胞经免疫组化实验,检测出心肌细胞特有的ɑ-SCA蛋白,确定为心房肌细胞(图1)。
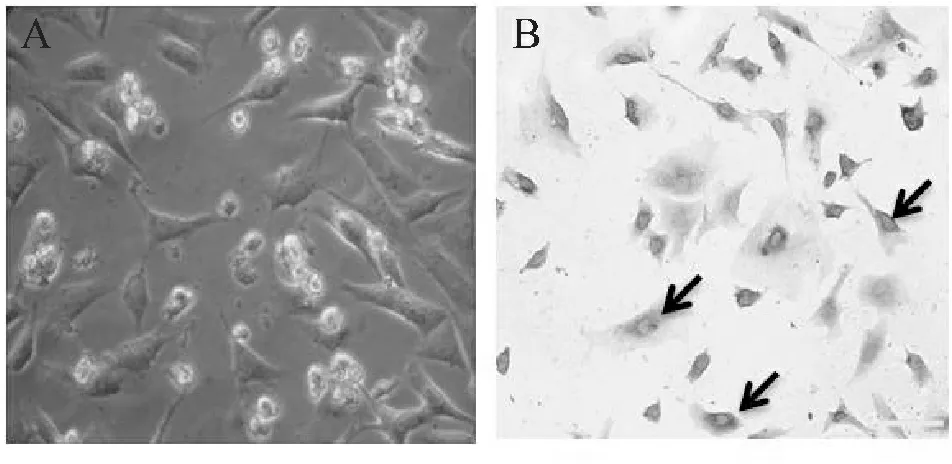
Fig. 1 Atrial myocytes were analyzed by immunocytochemistry (bar=75 μm) A: Culturing atrial myocytes cell (×400); B: Immunocytochemistry of culturing atrial myocytes cell α-SCA (×400)
2.2 ELISA法检测两组心房肌细胞 SOD活力、 MDA及GSH含量
与对照组心房肌细胞SOD活力相比较,氧化应激组心房肌细胞SOD活力下降;与对照组心房肌细胞 GSH 含量相比较,氧化应激组心房肌细胞GSH 含量下降(P<0.01);与对照组心房肌细胞MDA含量相比较, 氧化应激组心房肌细胞MDA含量增加(P<0.01,表1)。
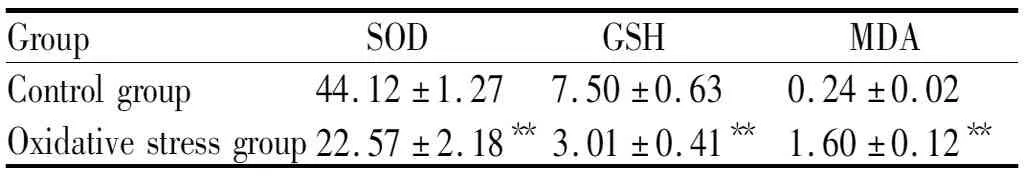
Tab. 1 SOD, MDA and GSH were analyzed by ELISA
SOD: Superoxide dismutase; GSH: Glutathione; MDA: Malondialdehyde
**P<0.01vscontrol group
2.3 TUNEL检测两组心房肌细胞凋亡
与对照组相比较,氧化应激组心房肌细胞凋亡率增加(P<0.01,图2)。
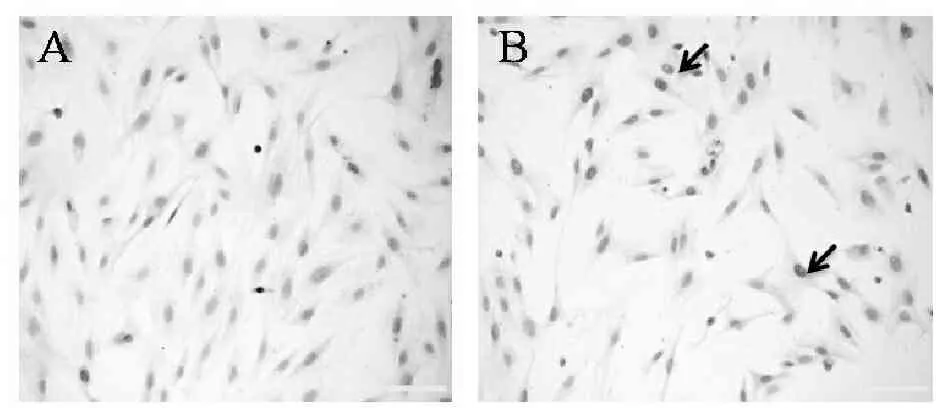
Fig. 2 The apoptosis of cultured atrial myocytes (bar=75 μm) A: Control group; B: Oxidative stress group
2.4 real time PCR 检测两组心房肌细胞GRP78、GRP94及chop、bax、bcl-2 mRNA表达
与对照组相比较,氧化应激组心房肌细胞GRP78、GRP94、chop、bax mRNA表达增加(P<0.01),bcl-2 mRNA表达减少(P<0.01, 表2)。
3 讨论
内质网稳态失衡时,内质网正确折叠蛋白质功能异常,可能致误折叠蛋白在内质网内异常聚集及内质网应激性蛋白分泌增加,并且识别错误折叠蛋白,并通过蛋白酶体将其降解,上述一系列反应过程即内质网应激反应(endoplasmic reticulum stress,ERS)[6]。ERS发生后,内质网通过上调分子伴侣蛋白GRP78及GRP94 表达[7]、抑制蛋白质合成、加速错误折叠和未折叠蛋白质降解等方式缓解ERS。然而持续或较严重的ERS 则触发凋亡信号,诱导CHOP、caspase-12、bax 等促凋亡因子的表达及活化[8],导致细胞凋亡[9-11]。大量文献报道氧化应激与心房重构及心房纤颤发生密切相关,并且无论是AF动物模型还是AF患者均发现内质网分子伴侣蛋白GRP94 表达增高[12],新近研究发现起搏诱导AF细胞模型可通过内质网应激介导HL-1细胞凋亡[13]。众所周知,心房肌细胞凋亡可以引起心房发生结构重构及产生房颤,但氧化应激是否引起内质网应激及心房肌细胞凋亡,还不得而知[14]。本研究发现氧化应激组心房肌细胞凋亡率明显增加,以及内质网应激伴侣蛋白GRP78,GRP94 mRNA表达均

Tab. 2 The expressions of GRP78, GRP94, chop, bax, bcl-2 mRNA in the cultured atrial myocytes
GRP78: Glucose-regulated protein 78; GRP94: Glucose-regulated protein 94; CHOP: C/EBP homologous protein; Bax: Bcl-2 associated x protein; Bcl-2: B-cell leukemia 2 protein
**P<0.01vscontrol group
明显高于对照组心房肌细胞,并且伴随着促凋亡因子chop, bax mRNA表达增高,抗凋亡因子bcl-2 mRNA表达减少。从实验结果我们可以得出结论:氧化应激反应可能介导内质网应激反应并激活促凋亡因子表达,抑制抗凋亡因子表达,引起心房肌细胞凋亡增加。这一结果可能引起心房发生重构并与心房纤颤的发生有一定关联性。但是氧化应激是如何介导内质网应激发生,以及通过哪一条内质网应激凋亡信号传导通路引起心房肌细胞凋亡的,还需在以后的实验中进一步阐明。
[1] 刘 彤, 张承宗, 李广平. 关注心房颤动的抗氧化治疗[J/OL]. 中华临床医师杂志(电子版), 2012, 6 (24): 7947-7948.
[2] Lozano HF, Conde CA, Florin T,etal. Treatment and prevention of atrial fibrillation with non-antiarrhythmic pharmacologic therapy[J].HeartRhythm, 2005, 2(9): 1000-1007.
[3] 田 苗, 单兆亮. 氧化应激在心房颤动发生维持中的作用[J]. 心血管病学进展, 2010, 31(3): 380-383.
[4] Aimé-Sempé C, Folliguet T, Rücker-Martin C,etal. Myocardial cell death in fibrillating and dilated human right atria[J].JAmCollCardiol, 1999, 34(5): 1577-1586.
[5] Xin W, Li X, Lu X,etal. Involvement of endoplasmic reticulum stress-associated apoptosis in a heart failure model induced by chronic myocardial ischemia[J].IntJMolMed, 2011, 27(4): 503-509.
[6] 罗梓垠, 郭长满, 项冰倩, 等. 右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子Caspase-12表达的影响[J]. 中国应用生理学杂志, 2016, 32(2): 164-168.[7] 崔飞飞, 潘莹莹, 张 龙, 等. 内质网分子伴侣蛋白在压疮局部缺血性损伤中的表达[J]. 中国应用生理学杂志, 2013, 29(3): 196-198.
[8] 曹延萍, 郝咏梅, 刘青娟, 等. 内质网应激及其特有凋亡途径Caspase-12与糖尿病大鼠肾组织固有细胞凋亡之间的关系[J]. 中国应用生理学杂志, 2011, 27(2): 236-240.
[9]刘 磊, 王洪军, 辛 晴, 等. 病毒性心肌炎所致小鼠心力衰竭心肌组织内质网应激相关的凋亡关系的研究[J]. 中国应用生理学杂志, 2014, 30(5): 461-464.
[10]赵雅君, 王伊林, 陶谢鑫, 等. 阿霉素致心肌细胞凋亡时网腔钙结合蛋白的变化[J]. 临床心血管病杂志, 2015, 31(8): 895-898.
[11]王伊林, 赵雅君, 杨 洋, 等. 磷酸肌酸钠对慢病毒介导calumenin蛋白沉默阿霉素损伤心肌细胞内质网应激信号通路的作用[J]. 临床心血管病杂志, 2015, 31(10): 1119-1122.
[12]Vitadello M, Ausma J, Borgers M,etal. Increased myocardial GRP94 amounts during sustained atrial fibrillation: a protective response [J].Circulation, 2001, 103(17): 2201-2206.[13]Shi J, Jiang Q, Ding X,etal. The ER stress-mediated mitochondrial apoptotic pathway and MAPKs modulate tachypacing-induced apoptosis in HL-1 atrial myocytes[J].PLoSOne, 2015, 10(2): e0117567.
[14]杨 锐, 贾 强, 刘小粉, 等. 硫化氢对大鼠糖尿病心肌病氧化应激及内质网应激的影响[J]. 中国应用生理学杂志, 2016, 32(1): 8-12.
Effect of oxidative stress on myocardial apoptosis, endoplasmic reticulum stress and apoptosis factor in suckling mouse atria myocardium
LONG Jie1, WANG Yu1+, LIU Xiao-cui1, YU Miao1, WANG Yi-lin1, HUANG Xia1, ZHAO Ming2△
(1. The Inner-Mongolia National University, Tongliao 028000; . The Inner-Mongolia National University Affiliated Hospital, Tongliao 028000, China)
Objective: To investigate the relationship between oxidative stress and myocardial apoptosis, endoplasmic reticulum stress, apoptosis-inducing factors in the process of by researching the effect of oxidative stress on myocardial apoptosis, endoplasmic reticulum stress and apoptosis factor--chop, bax, bcl-2 in suckling mouse atria myocardium. Methods: The primary cultured suckling mouse myocardium were randomly divided into control group and oxidative stress group. Firstly, the suckling mouse atria cardiomyocytes were treated with H2O2at the concentration of 100 mμmol/L for 2 hours. Then, the index of oxidative stress and anti-oxidative stress superoxide dismutase (SOD), the contents of malondialdehyde (MDA) and glutathione (GSH) of this two groups were detected by ELISA. Myocardial apoptosis of the two groups was detected by TUNEL. The expressions of glucose-regulated protein 78 (GRP78), glucose-regulated protein 94 (GRP94), C/EBP homologous protein (chop), Bcl-2 associated X protein (bax), B-cell leukemia 2 protein (bcl-2) mRNA were detected by real time PCR. Results: Compared with the control group, the viability of SOD and the contents of MDA in oxidative stress group were reduced, the contents of MDA was increased (P<0.01). Compared with the control group, the expression of myocardial apoptosis in oxidative stress group was increased(P<0.01); the expressions of GRP78, GRP94, chop and bax mRNA were increased, while the expression of bcl-2 mRNA was reduced in oxidative stress group. Conclusion: Oxidative stress may induce the endoplasmic reticulum stress, activate the expressions of apoptosis factors, and finally increase the myocardial apoptosis of atria cardiomyocytes. This may connected to the incident of atrial fibrillation.
oxidative stress; endoplasmic reticulum stress; apoptosis; atrial fibrillation
2015-11-19
2016-11-22
R331.3;R-332
A
1000-6834(2017)02-185-04
△【通讯作者】Tel: 13474859991; E-mail: langzhe73@163.com;+: 为共同第一作者
