HPLC—ELSD法测定不同储存时间党参药材中果糖、葡萄糖和蔗糖的含量
2017-06-03刘和平周光雄许彦尚强
刘和平+++周光雄++许彦+++尚强+++高进++陆文岐


[摘要] 目的 建立党参药材中果糖、葡萄糖和蔗糖高效液相色谱-蒸发光散射检测法(HPLC-ELSD)含量测定的方法,并测定不同储存时间的党参果糖、葡萄糖和蔗糖的含量。方法 采用80%甲醇超声提取,通过HPLC-ELSD法测定不同储存时间的党参中果糖、葡萄糖和蔗糖的含量。色谱条件:Shodex Asahipak NH2P-50 4E(250 mm × 4.6 mm,5 μm)色谱柱,以乙腈-水(77∶23)为流动相,柱温25 ℃,流速1.0 mL/min,ELSD检测器。结果 通过实验,不同储存时间的党参中果糖、葡萄糖和蔗糖均能很好分离,线性范围和相关系数分别为2.409~24.09 μg(r = 0.9999)、1.456~14.56 μg(r = 0.9995)、1.15~11.50 μg(r = 0.9999),平均回收率分别为103.73%(RSD = 0.26%)、97.85%(RSD = 1.98%)、99.08%(RSD = 1.09%)。结论 表明该方法简便,稳定性、重复性、分离度好,可用于党参中果糖、葡萄糖和蔗糖含量分析,储存0、3、6、12个月的不同时间党参中果糖、葡萄糖和蔗糖含量差异明显。
[关键词] 党参;果糖;葡萄糖;蔗糖;HPLC-ELSD;含量测定
[中图分类号] R931.4 [文献标识码] A [文章编号] 1673-7210(2017)04(c)-0138-04
[Abstract] Objective To establish a HPLC-ELSD determination method of fructose, glucose and sucrose in Codonopsis pilosula, and to determine the content of fructose, glucose and sucrose of Codonopsis pilosula in different storage times. Methods The sample solutions made by ultrasonic extraction of 80% methanol solution were used to determine the contents of fructose, glucose and sucrose of Codonopsis pilosula in different storage times by HPLC-ELSD. The analysis was performed on a Shodex Asahipak NH2P-50 4E column (250 mm × 4.6 mm, 5 μm) with a gradient elution of acetonitrile-water (77∶23) at the flow rate of 1.0 mL/min. The column temperature was 25℃. It was determined by ELSD detector. Results The methodological studies showed that fructose, glucose and sucrose of Codonopsis pilosula in different storage times were in good linearity from 2.409 to 24.09 μg (r = 0.9999), 1.456 to 14.56 μg(r = 0.9995), 1.15 to 11.50 μg (r = 0.9999) respectively. The average recoveries of the three components were 103.73% (RSD = 0.26%), 97.85% (RSD = 1.98%) and 99.08% (RSD = 1.09%), respectively. Conclusion The results show that the method is convenient, stable, reproducible and well separated. It can be used to determine fructose, glucose and sucrose in Codonopsis pilosula. The content of fructose, glucose and sucrose in Codonopsis pilosula of different storage times(0, 3, 6, 12 months) are different obviously.
[Key words] Codonopsis Radix; Fructose; Glucose; Sucrose; HPLC-ELSD; Assay
黨参来源于桔梗科植物党参Codonopsis Pilosula (Franch.)Nannf.、素花党参Codonopsis pilosula Nannf. var. modesta(Nannf.)L. T. Shen 或川党参Codonopsis tangshen Oliv. 的干燥根[1]。党参根据产地分为西党参、东党参和潞党参等[2]。党参所含主要化学成分有苷类、糖类、甾醇、胆碱、生物碱、木质素、三萜等[3-9]。文献报道[10-16],党参糖类成分为党参具有滋补功效的有效成分之一,具有调节血液系统、抗癌、抗炎、抗病毒、抗衰老、抗细胞毒性等免疫增强的功效。由于党参药材中果糖、葡萄糖、蔗糖含量很高,在储存过程中容易发生糖的转化与降解以及容易发生霉变等过程中造成糖的损失。有文献报道了党参不同储存时间的质量考察研究,但该研究只考察了气味、颜色、霉变等指标,没有考察指标性成分和糖类成分的含量变化[17]。《中国药典》2015年版党参项下未建立含量测定项,也未见有文献报道同时测定党参药材中果糖、葡萄糖、蔗糖的含量。本文首次建立了HPLC-ELSD法测定果糖、葡萄糖、蔗糖含量的一针同时测定3个指标成分的方法,可用于党参药材的质量评价,研究的不同储存时间党参中果糖、葡萄糖、蔗糖含量差异明显,为党参药材的储存期提数据支持。
1 仪器与试药
Agilent 1260快速高效液相色谱仪(美国安捷伦),KQ-500VDE超声清洗器,CPA225D电子天平(德国赛多利斯)。甲醇、乙腈为Merck色谱纯,水为自制超纯水,其他试剂均为分析纯。果糖、葡萄糖、蔗糖化学对照品(中国食品药品检定研究院,批号:100231-201305、110833-200904、111507-201303)。3批党参药材收集于道地产区甘肃省陇西县种植基地,经国家中药现代化工程技术研究中心主任曹晖研究员鉴定为桔梗科植物党参Codonopsis Pilosula(Franch.) Nannf.,俗称白条党参,凭证标本存于本中心生药标本室。根据党参药材储存特性,将3批党参药材储存于20℃左右的阴凉库中,分别在第0、3、6、12个月取样测定。
2 方法与结果
2.1 色谱条件与系统适用性试验
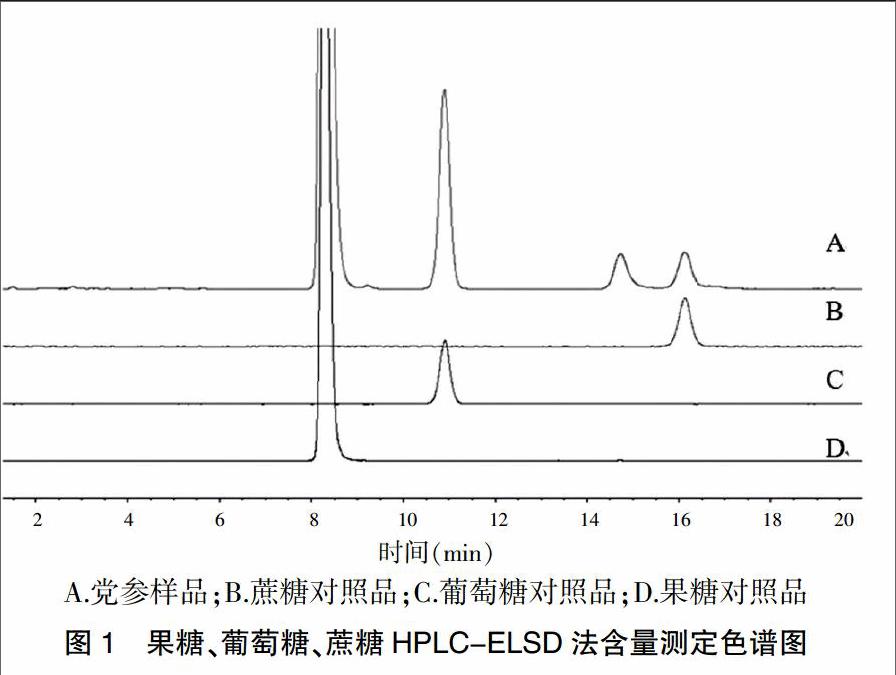
色谱柱:Shodex Asahipak NH2P-50 4E (250 mm × 4.6 mm,5 μm);流动相:乙腈-水(77∶23);柱温:25℃;流速:1.0 mL/min; ELSD检测器:温度45℃,载气为空气,压力0.5 kPa,分离度不低于1.5,理论塔板数以果糖计不低于6000(图1), 测定法:照高效液相色谱法(《中国药典》2015年版通则0512)测定,精密吸取对照品溶液2.5、10 μL,供试品溶液5 μL,注入液相色谱仪,测定,以外标两点法对数方程计算,即得。
2.2 对照品溶液制备
取果糖、D-无水葡萄糖、蔗糖化学对照品适量,精密称定,加水适量溶解置20 mL容量瓶中,再加水至刻度,分别制成每1 mL含2.3 mg的果糖溶液、每1 mL含0.7 mg的D-无水葡萄糖溶液、每1 mL含0.5 mg的蔗糖溶液,作为对照品溶液。
2.3 供试品溶液制备
取党参药材切厚片后粉碎成粗粉,取粉末2 g,精密称定,置250 mL锥形瓶内, 精密加50 mL 80%乙醇,称重,超声(45 kHz,600 W)提取30 min,放至室温,用80%乙醇补足减失的重量,摇匀,过滤,精密移取续滤液5 mL至25 mL容量瓶内,加80%乙醇至刻度,摇匀,过微孔滤膜(0.45 μm),即得。
2.4 供试液制备方法考察
2.4.1 提取方式考察 取同一党参药材粉末2 g,精密称定,平行2份,精密加50 mL 80%乙醇,一份超声提取30 min,另一份回流提1 h,按“2.3”项下方法制备样品溶液,并按“2.1”项下色谱条件测定,结果超声提取与回流提取无显著性差异,超声提取操作简便,故选超声提取。
2.4.2 提取溶剂考察 取同一党参药材粉末2 g,精密称定,平行3份,分别精密加50 mL 60%乙醇、80%乙醇和95%乙醇,按“2.3”项下方法分别制备样品溶液,并按“2.1”项下色谱条件测定,结果三种提取溶剂无显著性差异,80%乙醇提取率略高,故选80%乙醇。
2.4.3 提取时间考察 取同一党参药材粉末2 g,精密称定,平行3份,按“2.3”项下方法分别超声15、30、60 min制备样品溶液,并按“2.1”项下色谱条件测定,结果表明超声处理30 min,基本可以提取完全,故选用超声30 min。
2.4.4 提取溶剂用量考察 取同一党参药材粉末2 g,精密称定,平行3份,按“2.3”项下方法分别加25、50、75 mL的溶剂,制备样品溶液,并按“2.1”项下色谱条件测定,结果表明,用50 mL提取溶剂基本可以提取完全,故选用50 mL溶剂。
2.4.5 提取次数考察 取同一党参药材粉末2 g,按“2.3”项下方法超声1次后,药渣再加溶剂超声第2次,分别制备溶液,并按“2.1”项下色谱条件测定,第二次提取液测得的峰面积为两次结果之和的1.28%,表明超声1次,基本可以提取完全,故选用超声1次。
2.5 色谱条件的优化及方法学考察
2.5.1 柱温 相同条件下分别比较了不同柱温15、20、25、30、35℃,结果表明,25℃时主要色谱峰分离度及响应值最佳。
2.5.2 流速 相同条件下分别比較了0.8、1.0、1.2 mL/min的流速,结果表明,流速为1.0 mL/min时主要色谱峰分离度较佳。
2.5.3 流动相耐受性 相同条件下改变流动相比例 ±5%,试验结果表明流动相耐受性良好。
2.5.4仪器精密度 取同一份供试品溶液,按“2.1”项下色谱条件测定,连续进样6次,测得果糖、D-无水葡萄糖、蔗糖峰面积RSD分别为1.48%、2.83%、3.33%,结果表明仪器精密度良好。
2.5.5稳定性试验 取同一供试品溶液和对照品溶液,分别在0、1、3、6、12、24、48 h不同时间按“2.1”项下色谱条件测定,测得样品48 h内的果糖、D-无水葡萄糖、蔗糖峰面积RSD分别为2.39%、2.60%、3.69%,对照品RSD分别为1.58%、1.96%、2.63%,表明供试品溶液和对照品溶液在48 h内基本稳定。
2.5.6重复性试验 取同一党参药材粉末2 g,平行6份,按“2.3”项下方法制成供试品溶液,按“2.1”项下色谱条件测定,测得果糖、D-无水葡萄糖、蔗糖含量的RSD分别为1.63%、0.87%、1.06%,结果表明本法重复性良好。
2.5.7线性关系考察 分别精密吸取浓度为2.4090 mg/mL的果糖、浓度为1.4560 mg/mL的葡萄糖以及浓度为1.1500 mg/mL的蔗糖对照品溶液各1、2、4、6、8、10 μL,注入液相色谱仪中测定。以进样量(μg)的对数对峰面积的对数进行线性回归,分别得到线性方程,果糖:Y = 1.5054 X + 2.1198,r = 0.9999;葡萄糖:Y = 1.4865 X + 2.1383,r = 0.9995;蔗糖:Y = 1.6410 X + 2.0971,r = 0.9999。结果表明,果糖在2.409 ~ 24.09 μg范围内,葡萄糖在1.456 ~ 14.56 μg范围内,蔗糖在1.15 ~ 11.50 μg范围内,均呈良好的线性关系,定量限度分别为1.2045、0.72、0.575 μg。
2.5.8 准确度试验 取同一党参药材粉末1 g,平行6份,以100%水平分别加样果糖、D-无水葡萄糖、蔗糖,按“2.3”项下方法制备样品溶液,并按“2.1”項下条件测定,果糖、D-无水葡萄糖、蔗糖的加样平均回收率均在97%~103%之间,RSD均<2%,结果表明方法准确度良好(表1)。
2.6 样品测定
将3批党参药材储存于20℃左右的阴凉库中,分别在第0、3、6、12个月取样,按“2.3”项下方法制备样品溶液,同时按“2.1”项下色谱条件进行测定,不同储存时间的样品测定结果见表 2。不同储存时间的样本中果糖、葡萄糖和蔗糖含量差异明显,葡萄糖随着储存时间的延长,逐步下降,并达到一个平衡值;蔗糖随着储存时间的延长,逐步下降,储存12个月后在“2.1”项色谱条件下基本检测不出;果糖随着储存时间的延长,先下降后上升,储存12个月后含量最高。
3 讨论
党参药材中的多糖随着存放时间的延长,可以部分转化为单糖,同时,随着党参药材的储存时间的延长,单糖的含量也会因破坏随之下降,党参药材中单糖的含量实际上是这两种转化的动态平衡结果。从单糖含量-时间变化趋势可知:果糖储存3个月含量逐步下降,6个月之后含量再逐步增加,12个月达到最高,含量呈先下降后升高的趋势,表明果糖随着储存时间的增加,多糖转化成果糖的量多于破坏的量,果糖含量逐步增加;葡萄糖储存3~6个月后葡萄糖平均下降了70%,6个月之后到葡萄糖含量基本不再下降,达到一个转化与破坏的动态平衡;蔗糖的含量随着储存时间的增加而逐步下降,6个月后蔗糖平均下降了60%,12个月后基本检不出蔗糖,表明蔗糖储存6个月后逐步转化为果糖和葡萄糖。党参药材中多糖转化为蔗糖、果糖和葡萄糖存在着复杂的过程,我们将进一步探讨其转化的机制。
文献报道[18-20],党参糖类的检测方法主要有薄层色谱-扫描法(TLC)、紫外分光光度法(UV)、滴定法来测定党参多糖总含量和单糖总含量,方法准确性差。也有文献报道采用高效液相色谱峰紫外末端吸收(200 nm)和高效液相示差检测器(HPLC-RID)测定单糖的含量[21],虽然单糖及双糖有末端吸收,也可采用HPLC-UV法测定,但响应值低,准确度差;示差折光检测法受温度等外界条件影响较大,方法稳定性差、基线噪声大。本文建立的ELSD检测法,作为一种通用型质量检测器,对温度变化不敏感,基线稳定,方法重复性好。
[参考文献]
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2015:281-282.
[2] 南换杰,秦雪梅,武滨,等.潞党参多糖的超声提取和含量测定[J].山西医科大学学报,2008,39(7):641-643.
[3] 贺庆,朱恩员,王峥涛,等.党参化学成分的研究[J].中国药学杂志,2006,41(1):10-12.
[4] 戚欢阳,王瑞,刘勇,等.白条党参化学成分研究[J].中药材,2011,34(4):546-548.
[5] 孙政华,邵晶,郭玫,等.党参化学成分及药理作用研究进展[J].安徽农业科学,2015,43(33):174-176.
[6] 蒋跃平,刘玉凤,郭庆兰,等.党参水提取物中的木脂素类化学成分[J].药学学报,2016,51(4):616-625.
[7] 谢海燕,黄文华,宋艳刚,等.参芪扶正注射液中党参成分UHPLC-MS分析[J].中药材,2014,37(8):1471-1474.
[8] 邹元锋,曹朝生,刘江,等.党参质量评价研究进展[J].中草药,2010,41(3):附3-6.
[9] 李黎星,康杰芳.中药党参的研究进展[J].现代生物医学进展,2009,12(9):2371-2373.
[10] 陈克克,王豁之.党参多糖的研究进展[J].现代生物医学进展,2007,7(4):635-637.
[11] 张雅君,梁忠岩,张丽霞.党参粗多糖的组成及其免疫活性研究[J].西北农林科技大学学报,2012,40(7):199-202.
[12] 宁理文,赵红新.党参的药理作用及临床应用[J].临床合理用药,2014,7(10):66-67.
[13] 靳贵林,侯嘉,崔治家.党参的本草考证及药理作用和质量控制的研究进展[J].世界中医药,2016,11(8):1635-1639.
[14] 元艺兰.党参的药理作用及临床应用[J].中国中医药现代远程教育,2012,10(19):113-114.
[15] 张培,郑晓萍,马玉玲,等.党参多糖单糖组成与其对HepG2细胞毒活性的相关分析[J].中草药,2016,47(15):2684-2692.
[16] 李艳,孙萍,刘霞,等.新疆党参多糖的提取、含量分析及免疫功能的初步研究[J].中成药,2005,27(7):839-840.
[17] 尹顺明,陈永康.不同现代养护技术贮藏党参的对比研究[J].健康之路,2016,15(6):247-248.
[18] 陈军,舒翔,余南才,等.中药党参的质量控制研究[J].中国中医药现代远程教育,2012,10(14):154-155.
[19] 王新杰,时培.党参属五种药材单糖含量的研究[J].河南中医药学刊,2001,16(5):23-24.
[20] 宋英,周小初,宋崎,等,党参中多糖的含量测定方法研究[J].药物研究,2008,17(23):9-10.
[21] 魏锋,吴朝阳,马玲云,等.RP-HPLC-RID测定中药和保健食品中低聚果糖的含量[J].亚太传统医药,2009,9(5):20-22.
(收稿日期:2017-01-15 本文编辑:王 丽)
