COX-2介导肿瘤相关成纤维细胞在乳腺癌进展中的作用研究
2017-06-01曹清程波聂静樊洪徐梦鑫李玉玲
曹清,程波,聂静,樊洪,徐梦鑫,李玉玲
(九江市第三人民医院,江西 九江 332000)
COX-2介导肿瘤相关成纤维细胞在乳腺癌进展中的作用研究
曹清,程波,聂静,樊洪,徐梦鑫,李玉玲
(九江市第三人民医院,江西 九江 332000)
目的 探讨COX-2介导肿瘤相关成纤维细胞在乳腺癌进展中的作用,以提高乳腺癌的诊治水平。方法 随机选取2005年12月~2015 年12月乳腺病变微创手术或者外科手术标本:癌旁正常乳腺组织50例,标本均取自乳腺癌术后标本,同时距肿物5cm外的正常乳腺组织;良性病变组织80例,导管原位癌54例及浸润性导管癌135例,标本均取自于乳腺病变微创手术及外科手术术后标本,检测标本α-SMA和COX-2在乳腺各病变组织中的表达。结果 与癌旁正常乳腺组织、良性病变组织相比,导管原位癌组织α-SMA阳性30例(阳性率55.55%)、浸润性导管癌组织α-SMA阳性70例(阳性率51.85%),肿瘤相关成纤维细胞阳性率相对较高,表明肿瘤相关成纤维细胞在后两者中活化、累积。与癌旁正常乳腺组织、良性病变组织相比,导管原位癌组织COX-2阳性28例(阳性率51.85%)、浸润性导管癌组织中COX-2阳性73例(阳性率54.07%),COX-2阳性率相对较高,表明COX-2在后两者中过表达。COX-2在乳腺癌过表达与肿瘤相关成纤维细胞活化、累积相关。结论COX-2介导肿瘤相关成纤维细胞的过表达能够提示乳腺癌进展情况,在未来研究诊断和治疗乳腺癌具有十分重要的临床价值
环氧化酶-2;乳腺癌;肿瘤相关成纤维细胞
目前,乳腺癌已逐渐成为全球女性最常见的恶性肿瘤,其导致的女性死亡率位居第二[1]。可知乳腺癌已经严重威胁到全球女性的身体健康。乳腺癌的发病机理主要是肿瘤细胞与肿瘤周围微环境相互作用的结果[2]。肿瘤相关成纤维细胞(CAFs)作为肿瘤微环境中的主要成分之一,在被活化之后,会释放一部分肿瘤相关细胞因子(比如PDGF、EGF、MMP-2),进而促进癌细胞的增殖和转移[3]。环氧化酶(COX-2)在前列腺素合成中作为一个诱导酶。在乳腺癌的组织中COX-2被检测到有高表达,可以促进线性胶原纤维的产生,也可以促进DCIS向着浸润性癌的发展[4]。本文中旨在探讨COX-2介导肿瘤相关成纤维细胞在乳腺癌进展中的作用及两者的相关联系。
1 资料与方法
1.1 临床资料 随机选取2005年12月~2015年12月乳腺病变微创手术或者外科手术标本:癌旁正常乳腺组织50例,标本均取自乳腺癌术后标本,同时距肿物5cm外的正常乳腺组织;良性病变组织80例,导管原位癌54例及浸润性导管癌135例,标本均取自于乳腺病变微创手术及外科手术术后标本。
1.2 方法
1.2.1 检测α-SMA在乳腺各病变周围组织中的表达,初步评定成纤维细胞在各病变组织中的活化、累计情况;检测COX-2在乳腺各病变组织中的表达。
1.2.2 统计分析成纤维细胞活化和COX-2两者在乳腺癌进展中分子之间的联系;COX-2的表达与临床病理参数之间的关系。
1.3 观察指标 α-SMA以及COX-2在镜下的胞浆呈现出棕黄色时为阳性细胞,由两名经验丰富的病理医生在镜下观察并判定结果。通过Q550CW图像采集[5]分析系统把切片上的阳性染色信号转化成灰度并进行分析,把组织切片空白处射入值作为定标,每张切片的测定至少要5个高倍镜视野,取其平均值作为测定值,最后用净灰度值作为最终的统计数据,并统计分析。
1.4 统计学方法 本研究数据均用SPSS17.0统计软件处理,计量资料采用“±s”表示,组间比较采用t检验;计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
与癌旁正常乳腺组织、良性病变组织相比,肿瘤相关成纤维细胞在导管原位癌、浸润性导管癌组织中阳性率相对较高,表明肿瘤相关成纤维细胞在后两者中活化、累积。与癌旁正常乳腺组织、良性病变组织相比,COX-2在导管原位癌、浸润性导管癌组织中 阳性率相对较高,表明COX-2在后两者中过表达。见表1。
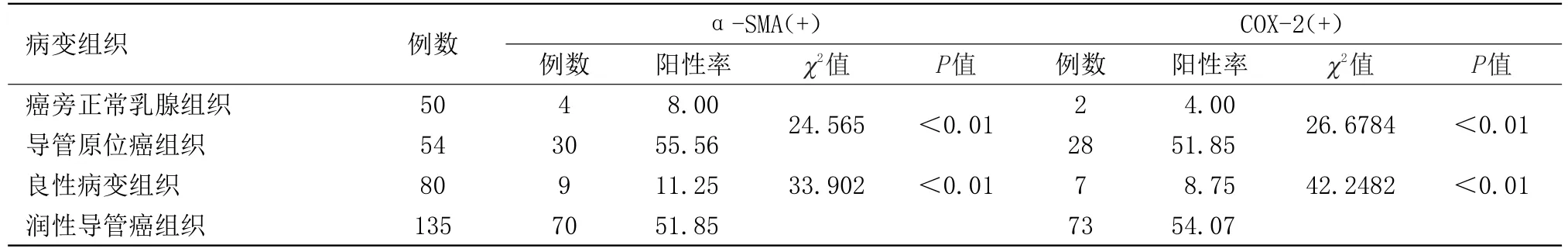
表1 成纤维细胞在各病变组织中的活化和累积情况Table1 Activation and accumulation of fibroblasts in various pathological changes
3 讨论
乳腺癌的发展是一个多因素、多步骤累积的过程,之前的研究一直认为乳腺导管癌是从扁平上皮不典型增生开始的,进一步演变为不典型的导管增生,之后发展成导管原位癌,最后成为可致命性的浸润性导管癌[6]。其发展过程也给了我们一个更加直观的认识过程,在之前的研究中,科研人员以及相关学者主要将目光集中在乳腺上皮细胞本身的分子遗传学上,找寻乳腺癌细胞本身的分子基因的改变[7]。但是,随着研究的进行,更多的证据证明乳腺癌的发生发展不只是癌细胞本身。肿瘤微环境也扮演着不可忽视的重要作用,其本身就是一种复杂的概念,它主要包括炎症因素、基底膜、血管微环境、成纤维细胞等,他们释放的相关细胞因子和乳腺癌上皮细胞本身构成了一个分子相互作用网络。因此,在分子水平上,揭示癌细胞与肿瘤微环境之间的联系给乳腺癌的研究者们提供了一种新的研究方向和思路。
乳腺密度的增加也被认为是患乳腺癌的风险因素,其相关检测也经常用于预测患乳腺癌的风险[8]。乳腺密度和乳腺组织中成纤维细胞有密切的联系。肿瘤相关成纤维细胞(CAFs)作为肿瘤微环境中的主要成份,与正常乳腺组织中的成纤维细胞(Fs)相比,具有自身特有的生物特征,肿瘤中的CAFs被活化后,α-SMA会呈阳性。在之前的研究中,被活化的基质可以为乳腺肿瘤细胞提供结构及营养,使组织重组,在自身基因改变和相关活化基质的双重影响下,乳腺上皮细胞被激活,从而转变成恶性肿瘤细胞。随之出现无限增殖、浸润及转移[9]。
环氧化酶(COX-2)可以参与多种肿瘤的发生过程,比如有结肠癌、胃癌、肝癌、膀胱癌等的癌组织中,其可呈现高表达。在乳腺癌的组织中,研究人员也可以检测出COX-2的高表达,它的表达的程度和不良的预后有关。动物的研究发现,COX-2的过表达可以促进血管再生、肿瘤细胞的增殖和侵袭,促进了肿瘤的发展和转移[10]。它的表达会随着肿瘤发展和转移阶段的增强而表达增强。COX-2的过表达和乳腺密度升高有关,基因表达分析表明,PTGS2在高密度的胶原基质乳腺上皮细胞中表达上升。COX-2的过表达可以促使线性胶原纤维产生,与此同时推动了DCIS向着浸润性癌的方向发展。这一观点也得到了近期研究[11-12]中的证实。
本研究中发现COX-2在乳腺癌过表达与肿瘤相关成纤维细胞活化、累积相关。COX-2过表达可以促进血管再生、肿瘤细胞的增殖和侵袭,促进肿瘤的发生、发展和转移。COX-2介导肿瘤相关成纤维细胞,对于治疗乳腺癌见效快,成功率高。
综上所述,COX-2介导肿瘤相关成纤维细胞的过表达能够提示乳腺癌进展情况,在未来研究诊断和治疗乳腺癌具有十分重要的临床价值。
[1] 吕丽,李文通,杨灵,等.COX-2表达与乳腺癌EMT发生关系的研究[J].中国妇幼保健,2013,28(28):4728-4730.
[2] Ana Valdehita,María J,Carmena,et al.RNA interference-directed silencing of VPAC 1 receptor inhibits VIP effects on both EGFR and HER2 transactivation and VEGF secretion in human breast cancer cells[J]. Molecular and Cellular Endocrinology,2011,348(1):241-246.
[3] 胡纲.miRNA-26a下调COX-2的表达对乳腺癌细胞增殖和侵袭的影响[J].肿瘤防治研究,2015,12(42):1183-1187.
[4] Alpna Tyagi,Chapla Agarwal,Lori D.Dwyer-Nield, etc.Silibinin modulates TNF-α and IFN-γ mediated signaling to regulate COX2 and iNOS expression in tumorigenic mouse lung epithelial LM2 cells[J]. Mol Carcinog,2011,51(10):135-137.
[5] 陈伟贤,赵建华,唐金海.乳腺癌微环境中巨噬细胞相关因子与环氧化酶-2的调节[J].中国肿瘤临床,2013,13(40):811-814.
[6] 高忠诚,张莲芳,刘夫芸.COX-2和TGF-β1表达与乳腺癌发生发展相关性的研究[J].中华肿瘤防治杂志,2013,14(20):1057-1060.
[7] Ming-Xu Da,Xiao-Ting Wu,Jie Wang,et al.Expression of Cyclooxygenase-2 and Vascular Endothelial Growth Factor-C Correlates with Lymphangiogenesis and Lymphatic Invasion in Human Gastric Cancer[J].Archives of Medical Research,2008,39(1):92-99.
[8] Li Sun,Da-hai Yu,San-Yuan Sun,et al.Expressions of ER,PR,HER-2,COX-2,and VEGF in Primary and Relapsed/Metastatic Breast Cancers[J].Cell Biochemistry and Biophysics,2014,68(3):511-516.
[9] 王丽,柳雅玲,李亚鲁.乳腺导管内癌、浸润性导管癌中PPAR-γ和COX-2的联合检测及临床意义[J].中国妇幼保健,2015, 14(30):2264-2267.
[10] Demetrios Kalaitzidis,Thomas D.Gilmore.Transcription factor cross-talk:the estrogen receptor and NF-κB[J].Trends in Endocrinology & Metabolism, 2005,16(2):46-52.
[11] 王永霞,李永真,崔静,等.人乳腺癌细胞中HPV16 E6/E7与COX-2表达的关系[J].中国老年学杂志,2013,8(33):1843-1845.
[12] Mariagrazia Rita Scuderi,Carmelina Daniela Anfuso, Gabriella Lupo,et al.Expression of Ca2+-independent and Ca2+-dependent phospholipases A2 and cyclooxygenases in human melanocytes and malignant melanoma celllines[J].BBA-MolecularandCellBiologyof Lipids,2008,1781(10):635-642.
COX-2 mediated tumor associated fibroblasts in the progression of breast cancer
Cao Qing,Cheng Bo,Nie Jing,Fan HongXu Meng-xin,Li Yu-ling
(Jiujiang Third People's Hospital,Jiujiang,Jiangxi,332000,China)
Objective To investigate the role of COX-2 in the progression of breast cancer,and to improve the level of diagnosis and treatment of breast cancer.Methods Randomly selectedsurgical specimens from the minimally invasive breast lesions surgery orbreast surgery from December 2005 to December2015.Including 50 cases of adjacent normal breast tissue specimens,which were taken from patients with breast cancerand normal breast tissue from the tumor outside 5cm,80 cases of benign lesions,54 cases of ductal carcinoma in situ and 135 cases of invasive ductal carcinoma.Samples were all taken from postoperative minimally invasive breast lesionsand breast surgery.Tested the expression of a-SMA and COX-2 in breast lesions.Results Compared with normal breast tissues and benign disease tissues,the positiveexpression ofa-SMA in ductal carcinoma in situwas 30 cases(positive rate 55.55%)and positiveexpression ofa-SMA in infiltrating ductal carcinomawas 70 cases(positive rate 51.85%),tumor associated fibroblasts showed high positive rate,which showed tumor associated fibroblasts cells activation and accumulation in the latter two groups. Compared with benign disease tissues and normal breast tissues,COX-2 positivecases number in ductal carcinoma in situ was28(positive rate 51.85%)and in invasive ductal carcinoma was 73(positive rate 54.07%),the positive rate of COX-2 is relatively high in the latter two groups,which showed that over expression of COX-2 in the latter two groups.Overexpression of COX-2 in breast cancer was associated with activation and accumulation of tumor associated fibroblasts.Conclusion The overexpression of COX-2 mediated tumor associated fibroblasts can prompt the development of breast cancer.It is importance to diagnose and treat breast cancer in the future.
Cox-2;Breast cancer;Tumor associated fibroblasts
10.3969/j.issn.1009-4393.2017.06.006
