交联聚乙二醇二丙烯酸酯固定化漆酶的性质1)
2017-06-01孙明慧孟庆辉赵敏王炎
孙明慧 孟庆辉 赵敏 王炎
(东北林业大学,哈尔滨,150040) (哈尔滨工业大学) (东北林业大学) (哈尔滨工业大学)
交联聚乙二醇二丙烯酸酯固定化漆酶的性质1)
孙明慧 孟庆辉 赵敏 王炎
(东北林业大学,哈尔滨,150040) (哈尔滨工业大学) (东北林业大学) (哈尔滨工业大学)
为探究交联聚乙二醇二丙烯酸酯为载体的固定化漆酶的优势,采用单因素分析法,在不同条件下对固定化漆酶和游离漆酶的酶学性质进行了研究。结果表明:与游离漆酶相比,固定化漆酶与底物2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)的亲和力下降,但稳定性明显提高,最适pH值也发生了变化。固定化漆酶的最适温度为60 ℃,比游离漆酶升高了5 ℃;固定化操作pH为3.5时,固定化漆酶的酶活力最高。固定化漆酶对2,4-二氯苯酚降解时间为24 h时,降解率达到了85%,酶活力保持80%以上,漆酶的使用效率和稳定性明显提高。
交联聚乙二醇二丙烯酸酯;漆酶;固定化漆酶;游离漆酶
The experiment was conducted to study the advantage of laccase immobilization with the carrier being cross-linked polyglycol diacrylate. The control variate method was used to investigate the activity between laccase immobilization and free laccase from different conditions. Comparing with free laccase, appetency between immobilized laccase and 2,2’-azinobis (3-ethylbenzthiazoline-6-sulfonate) (ABTS) descends, but the stability was improved and the optimum pH changed. The pH effect in the immobilization process was conducted simultaneously. The proper temperature of immobilized laccase was 60 ℃ and 5 ℃ higher than that of free laccase. The activity of immobilized laccase got the highest level when pH was 3.5. At last, the immobilized laccase was used in the biocatalysis of 2,4-dichloro-phenol. Results indicate that the degradation ratio achieved 85% in 24 h, and the kept activity was more than 80% with better use efficiency and stability of laccase.
漆酶属于氧化型酶,能够催化多种酚型和非酚型化合物分解,底物主要包括单酚、甲基替代单酚、多酚、聚甲氧基苯、苯硫醇、芳香胺等易氧化的化合物[1]。在工业染料脱色[2]、工业污水处理等领域,具有重要应用价值[3]。游离酶虽然活性高,但却因其易流失、易变性失活、回收利用困难、损失量大等缺点,在工业化使用中存在困难[4]。因此,实现漆酶的固定化,是推行漆酶在工业化应用的关键。
本文探究了一种较为新颖的固定化材料,即交联聚乙二醇二丙烯酸酯,将它作为载体包裹漆酶,并以此进行研究。孟庆辉[5]研究证明,最佳固定化条件为0.075 mol/L磷酸盐缓冲液(PBS)缓冲液稀释103倍的漆酶溶液,以酶液量30 mL∶载体0.1 g的比例,在pH为3.5的偏酸性环境中固定4 h后取出,4 ℃下静置15 h,在此条件下载体上漆酶的负载量为0.792 mg/g。本文在此基础上研究了固定化漆酶的稳定性、酶学性质及其对2,4-二氯苯酚(DCP)的降解特性。
1 材料与方法
1.1 主要试剂、仪器
漆酶,是由诺维信(中国)公司赠送,未作进一步纯化处理;交联聚乙二醇二丙烯酸酯,自合成;标准蛋白溶液,南京森贝伽生物科技有限公司生产;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),SIGMA公司产品;考马斯亮蓝G-250、4-氨基安替比林、磷酸氢二钠、柠檬酸、铁氰化钾,均为分析纯;2,4-二氯苯酚,为化学纯。
pHS-3C型精密pH计,上海雷磁仪器厂;离心机,Eppendorf公司生产。
1.2 漆酶的固定化方法
称取一定质量交联聚乙二醇二丙烯酸酯,放入烧杯,在烧杯中加入适量稀释后的漆酶溶液,封口,放入摇床,摇床温度设置为25 ℃,固定化4 h,然后放在4 ℃条件下静置15 h。将固液分离开,弃掉液体;得到的固定化漆酶颗粒,将其用蒸馏水冲洗多次并检测洗涤液蛋白含量,需洗到洗涤液中无蛋白检出。随后,对固定化漆酶颗粒进行低温烘干,得到干燥的固定化漆酶。
1.3 酶活力的测定
(1)游离漆酶的活性测定[6]:以ABTS为底物,在比色皿中加入磷酸氢二钠-柠檬酸缓冲溶液、稀释104倍的漆酶溶液和1 mmol/L的ABTS溶液各1 mL;测定25 ℃条件下,反应体系在光照420 nm处,反应初始以及反应3 min时的吸光度值,计算漆酶活力。
(2)固定化漆酶的活性测试[7]:以ABTS为底物,在25 ℃条件下,测定初始时ABTS和缓冲液混合液在420 nm处的吸光度值;然后用固定化漆酶催化ABTS分解反应3 min后,立即进行冰浴(时间为9 min),迅速终止反应,离心取上清液,测定其在420 nm处的吸光度。
(3)酶活力的计算方法:在一定条件下,单位时间内,催化1 μmol的底物转化为产物所需要的酶量,定义为1个U[8]。漆酶的活力计算公式为:
PV=((AV/εt)×1 000)/V0;
(1)
PM=((AV/εt)×1 000)/M0。
(2)
式中:PV为游离漆酶的酶活力;PM为固定化漆酶的酶活力;A为反应时间t内的吸光度变化值(A<0.5);V为比色皿中溶液的体积(3 mL);M0为固定化漆酶的质量(g);V0为反应体系中游离漆酶溶液体积(mL);ε为底物ABTS在420 nm处的消光系数(360 mmol-1·cm-1)[7]。
固定化漆酶的酶活力单位是“U/(g·min)”,在默认时间为1 min时也记作U/g,表示每克固定化漆酶所对应的酶活力。
(4)检测固定化漆酶活力指标有2个,分别是固定化效率和负载量[9],计算公式如下:
固定化效率=((加入总酶活力-上清液总酶活力)/加入总酶活力)×100%;
负载量(T)=((加入总酶蛋白含量-上清液蛋白含量)/载体质量)×100%。
1.4 固定化漆酶处理2,4-二氯苯酚
在锥形瓶中加入100 mL一定浓度的2,4-二氯苯酚的溶液,实验组加入定量的固定化漆酶,对照组只加入载体不加入固定化漆酶。分别封口放入摇床中慢速(50 r/min)振荡,使反应物与反应底物充分接触。每间隔一段时间取0.5 mL上清液,测定其在510 nm处的紫外分光光度值(方法为4-氨基安替比林法),得到催化动力学曲线。探究在不同条件下,如底物浓度、pH、酶量等条件不同时,会对固定化漆酶分解2,4-二氯苯酚产生何种影响。
2 试验结果
2.1 漆酶最佳固定化条件
2.1.1 漆酶固定化时间的选择
取7份各0.2 g的交联聚乙二醇二丙烯酸酯,在固定化时间不同、其他都相同的条件下固定,固定化时间为1~7 h,每隔1 h取1个时间点,而静置时间都为12 h,然后测定固定化漆酶的活力。结果显示,固定化漆酶活力最高时,固定化时间为4 h(见图1)。

图1 固定化时间对固定化漆酶活力的影响
2.1.2 静置时间的选择
如上,取9份0.2 g载体,同条件下进行固定(静置时间不同);上一步实验得出结果,取固定化时间4 h;而静置时间为变量每隔3 h取1个时间点,分别为0、3、5、7、13、15、17、20、24 h。结果显示,固定化漆酶的活力最高时,静置时间为15 h(见图2)。

图2 静置时间对固定化漆酶活力的影响
2.1.3 漆酶给酶量的选择
酶液稀释倍数的选择:酶液的稀释倍数,是漆酶固定化过程中的关键因素之一。本实验分别选择稀释倍数为1.0×102、2.5×102、5.0×102、1.0×103、2.5×103、5.0×103的酶液10 mL,分别用0.2 g等量载体进行固定化,固定化时间和静置时间都相同。由图3可见:初始阶段,漆酶溶液稀释倍数与固定化后的活力呈负相关,在稀释倍数为1.0×103时,酶活力达到最高值,随后随着漆酶溶液稀释倍数的增加又与酶活力呈负相关,即随着酶液稀释倍数升高,固定化后的酶活力反而下降。

图3 稀释倍数对固定化漆酶活力的影响
给酶量的选择:固定化酶在载体中含量的多少对固定化酶酶活力有很大影响。在1.0×103稀释倍数前提下,控制固定化过程中加入的酶液量,分别在5~25 mL之间平均取5个数值,各用0.2 g载体进行固定化。其中加酶量为15 mL酶活最高(见图4)。

图4 酶液量对固定化漆酶活力的影响
2.1.4 固定化pH值的选择
分别用pH值为3.0~7.0(每隔0.5取1个值)的磷酸缓冲液代替蒸馏水,对原酶液进行1.0×103倍稀释。然后,分别用0.2 g等质量的载体,在其他条件相同、但不同的pH环境下,进行固定化、活力测试。结果显示,在缓冲液pH为3.5时,固定化漆酶的活力最好(见图5)。

图5 固定化pH对固定化漆酶活力的影响
2.1.5 离子浓度选择
等质量同条件的固定化漆酶,在离子浓度不同,但pH相同的缓冲溶液中,进行固定化漆酶的活性测试。研究表明,当离子浓度为0.075 mol/L时,固定化漆酶的活力最高(见图6)。

图6 离子浓度对固定化漆酶活力的影响
2.2 固定化漆酶的酶学性质
2.2.1 最适反应pH值
取固定化漆酶9份(每份0.03 g),分别进行不同pH值环境下的活性测试。同样对游离漆酶进行了最适pH值测定(见图7)。结果表明,当pH=3.5时,固定化漆酶的活性最好;游离漆酶的最适pH值相对高些,为4.2。说明固定以后,漆酶的最适pH值稍微向偏酸性方向移动,此时固定化漆酶比游离漆酶的耐酸性得到提高。

图7 pH值对漆酶活力的影响
2.2.2 最适反应温度
对固定化漆酶和游离漆酶进行最适反应温度测试(见图8)。结果表明,游离漆酶在55 ℃时活性最高;固定化漆酶的酶活力,随着温度的上升而不断地升高,在60 ℃时达到最高值。说明经过固定化后的漆酶,比游离漆酶耐高温性得到了提高。

图8 漆酶活力与温度的关系
2.2.3 米氏常数
在不同底物浓度下,分别测定同样稀释了104倍的游离漆酶和固定化漆酶反应动力学,计算酶反应的初速度。通过双倒数做图可计算米氏常数(Km,见图9)。其中:游离漆酶的Km为7×10-5mol/L,固定化漆酶的Km为3.37×10-4mol/L,说明固定化漆酶与底物ABTS的结合能力降低。
2.2.4 固定化漆酶的稳定性
pH值稳定性:将干燥的固定化漆酶在酸性条件的微环境中(pH=3~5)保存1 h,其相对活力仍然很高,基本保持在80%左右;而游离漆酶在微环境中相对活力较高的pH范围在4~6之间(见图10)。总体看,与游离漆酶相比,固定化漆酶的pH稳定性更偏向酸性,而在工业化应用中,环境多偏酸性,这为固定化漆酶在工业化的应用奠定了基础。
热稳定性:将游离漆酶和干燥固定化漆酶置于70 ℃的水浴锅中封闭加热,每1 h进行1次测试(见图11)。加热的时间越长,固定化漆酶和游离漆酶的活性降低越明显,尤其在1 h之内活性急剧下降,固定化漆酶的活性随着加热时间的延长先升高后降低,慢慢下降速率变小,但固定化漆酶活力仍然略高于游离漆酶。因此,与游离漆酶相比,固定化漆酶更加稳定,热稳定性能更好。

图9 游离漆酶和固定化漆酶的反应速度与底物浓度关系的双倒数曲线图

图10 固定化漆酶和游离漆酶的pH稳定性

图11 70 ℃下加热时间对酶活力的影响
使用稳定性:衡量固定化漆酶性能的另一个重要指标,是它的使用稳定性。研究结果(见图12)表明,经过2~3次使用后,固定化漆酶的酶活力均为初始酶活力的90%以上,且在使用了6次之后,活性仍为初始酶活力的60%以上。证明了固定化漆酶具有较好的使用稳定性。

图12 使用次数对固定化漆酶酶活力的影响
放置稳定性:将游离漆酶和固定化漆酶同时放置于室温下封闭保存,定时(24 h)测定1次活性(见图13)。研究表明,固定化漆酶在放置过程中活性变化不大;而游离漆酶的活性,随着时间的延长不断的降低,但由于游离漆酶的初始酶活力较高,在12 d左右才与固定化漆酶活力相近。虽然固定化漆酶的活性远低于游离漆酶,但在存放过程中固定化漆酶更稳定,更适合工业化生产的应用。

图13 游离漆酶和固定化漆酶的放置稳定性
2.2.5 固定化漆酶的活性
用最优固定化条件下制得固定化漆酶,并对其进行活性测定。根据公式(1)、(2)计算得到固定化漆酶的最高活性为54.63 U/(g·min)(比活性为68.91 U/(mg·min)),远低于游离漆酶的活性(2 656.09 U/(mg·min));漆酶的固定化效率为54.4%;负载量达到了0.793 mg/g载体。
2.3 固定化漆酶对2,4-二氯苯酚的降解
2.3.1 固定化漆酶与游离漆酶降解2,4-二氯苯酚(DCP)的比较
载体和周围环境对DCP无任何的降解作用(见图14),而固定化漆酶可对DCP降解,因此说明是载体上的漆酶分子对其的降解作用;且时间越长降解率越大。游离漆酶,因初始没有损耗,因此降解速率会高于固定化漆酶;随着时间的延长,二者的变化速率减慢,最终固定化漆酶降解率为84.5%,而游离漆酶的降解率为89%左右。但是,在相同单位质量蛋白的情况下降解二氯苯酚,所用固定化漆酶体积与游离漆酶体积比为13∶1。说明固定化漆酶降解DCP的效果更好。
pH值对催化降解效果的影响:由于微环境对酶的催化活性影响很大,因此本文研究了固定化漆酶降解DCP过程中pH值的影响(见图15)。固定化漆酶对DCP降解的最适pH值在6~7之间,而游离漆酶在4~6之间。固定化漆酶在降解过程中最适pH值变大,说明可以克服漆酶仅在偏酸条件下才能使用的缺点,使用范围也因此扩大。

图14 降解率-时间变化曲线

图15 pH值对游离漆酶和固定化漆酶降解2,4-二氯苯酚的影响
底物质量浓度对降解效果的影响:影响固定化漆酶降解DCP的因素有很多,例如,底物的质量浓度不同也会影响固定化漆酶对DCP的降解能力(见图16)。当底物质量浓度为20 mg/L时,降解效果最好。
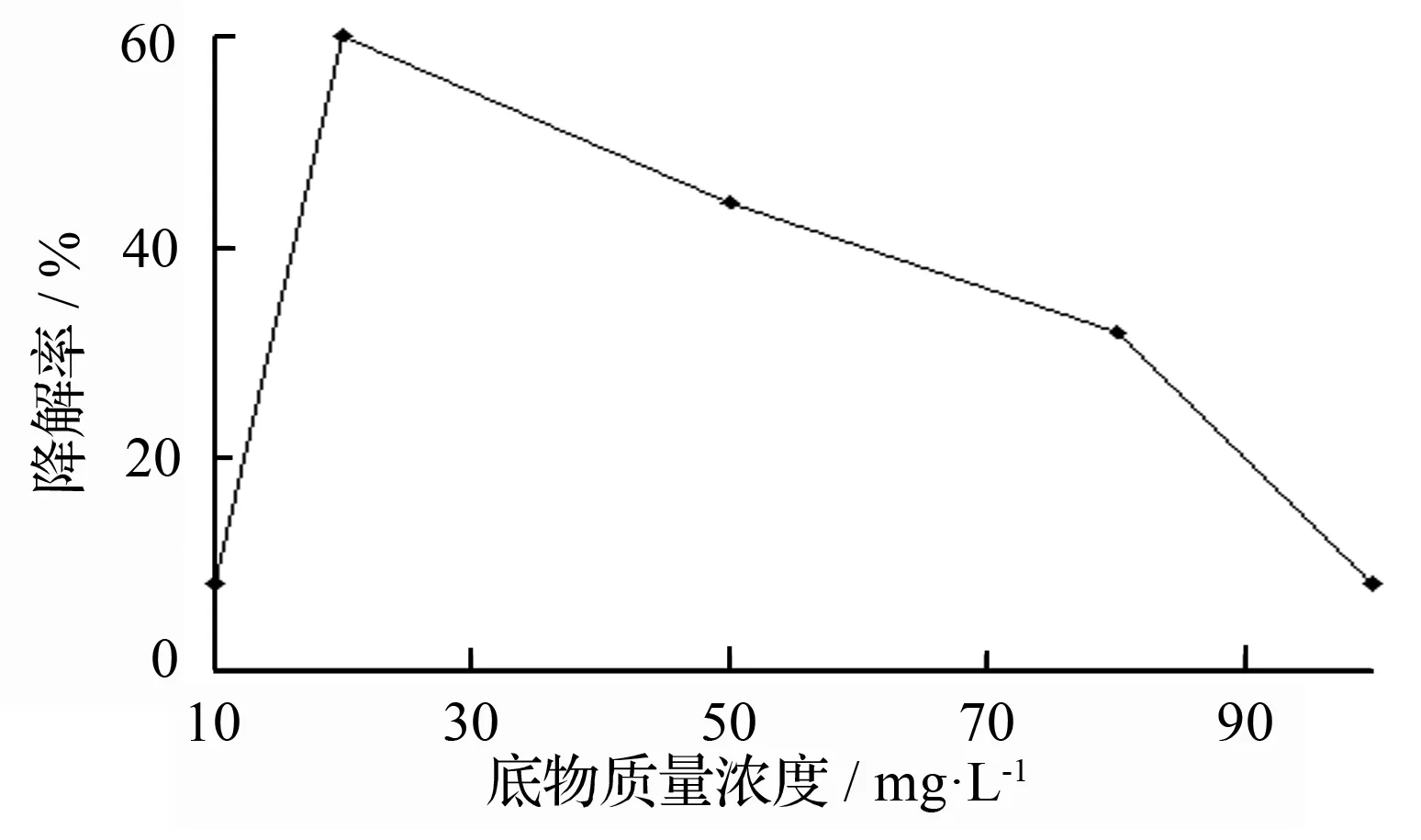
图16 底物质量浓度对降解的影响
固定化漆酶量对降解的影响:对于相同质量浓度的DCP溶液,酶量不同降解能力也不同(见图17)。当m(固定化漆酶量)∶m(酚量)=143∶1时,降解率最高,达到了85%。
降解时间对降解率的影响:实验表明,当降解时间变更为30 h时,游离漆酶和固定化漆酶的降解能力均有提升,但提升的范围很小(见图14)。反应时间变为48 h时,两者对DCP降解率达到稳定。
2.3.2 固定化漆酶使用批次
取一定的固定化漆酶对2,4-二氯苯酚进行降解,进行了5批次实验。研究发现,对比游离漆酶,固定化漆酶在使用稳定性方面有很大优势,酶活力达到初始值的80%以上,且在6.0h左右的降解率最高,到达到了40.6%,基本维持在32.9%以上。

图17 固定化漆酶对DCP的降解批次
3 讨论
漆酶在载体上的吸附,不仅受到固定化时间、静置吸附时间以及给酶量的影响。而漆酶在载体上吸附的状态并不是静止的,整个过程是漆酶分子和载体间的动态平衡,因此,载体对漆酶分子吸附量的大小,对固定化后漆酶颗粒活性的发挥起着十分重要作用。由图1、图2可见,固定化漆酶的活性,先是随着固定化时间和静置时间延长而增大的,经过一段时间之后降低。原因是,开始时载体可吸附的蛋白量低于动态平衡点,时间越长吸附的蛋白分子量越大,因此酶活力会上升。但随着时间的延长,吸附的蛋白分子越来越多,底物接近酶活力中心的概率越小,因此会有活性降低的现象[9]。图3中的原液稀释倍数对活性也有很大影响,在稀释倍数为103时活性最高,两端都呈下降状态。原因是,当稀释倍数小,酶浓度高时,载体吸附蛋白量大,载体上的蛋白单位空间更小,因此与底物亲和力下降。而当稀释倍数过大,酶浓度低,酶分子撞击载体分子的概率小,因此载体上酶蛋白的吸附量小,导致酶活力降低。图4中显示,pH对固定化漆酶的活性影响也很大,原因是,H+参与了固定化的过程,首先当H+遇到了CO后会攻击碳原子,将电子云引到O周围,因此CO变得不稳定,碳原子亲电性增加。酶蛋白分子上的NH2—亲和有亲电性C原子,使载体和酶蛋白分子更亲和,两者偶联量增加。因此稳定性更好,活性更高。卢磊等[10]实验证明,离子强度大会引起酶的变性失活,因此酶学活性降低,本文研究结果与之相似。
固定化漆酶能进行工业应用,关键在于酶是否有稳定的理化性质。本文研究了固定化漆酶和游离漆酶的pH值、温度、稳定性等问题,以及固定化漆酶的米氏常数(Km)。研究表明,固定化漆酶的最适pH值较游离漆酶向酸性方向移动,这是由于载体在结合蛋白分子时,需要消耗微环境中H+,使最适pH发生了改变,pH稳定性也发生了变化。通常,游离漆酶的pH稳定性范围在4~6,被固定化后pH稳定性范围变成了3~5。Tisher et al[11]认为,产生这种变化的原因,载体在反应过程中产生质子,由于CO中的O可以吸引电子云,使得NH2—中的H+解离出来,因此载体的微环境的H+增多,pH减小,整个体系pH稳定性范围发生偏移。固定化漆酶的最适温度比游离漆酶升高了5 ℃,是由于载体特有的包埋结构保护了酶蛋白分子,加上酶分子间的作用力以及载体与蛋白分子间的作用力相互所用,使得固定化漆酶的结构更稳定,因此抗变性能力和热稳定性都有所提高。而游离漆酶由于较为离散,容易变性失活[11](见图11)。衡量固定化漆酶性能的另一个重要指标是使用稳定性[12],研究表明(见图12),固定化漆酶循环使用7次后,活性降低明显,仅为原来的50%,但继续使用后活性变化并不明显,说明一部分蛋白为游离蛋白,并没有完全结合在载体上,导致固定化漆酶稳定性降低。固定化漆酶载体对漆酶分子的有效保护,主要体现在放置稳定性。从图13可见,固定化漆酶每日活性几乎无变化,但游离漆酶的活性却逐日降低,是因为载体特有的网格结构和溶胀性质对漆酶的分子结构的保持起到了保护的作用。
固定化漆酶活力远低于游离漆酶的活性,是由于漆酶在固定化过程中,摇床振荡导致混合物体系整体温度上升,温度越高,酶蛋白分子的结构越可能发生变化,因此固定化过程中酶量损失较大。酶活力降低的另一个原因,是载体和环境中的杂质,杂质过多会影响酶与底物的亲和力,从而导致酶活力降低[13-14]。
与游离漆酶相比,固定化漆酶对2,4-二氯苯酚的降解效果更好(见图14)。在底物浓度13倍于游离漆酶体系的降解过程中,固定化漆酶最终达到了与游离漆酶几乎一样的降解效果。其中,载体对2,4-二氯苯酚完全没有降解作用[15]。固定化漆酶的使用稳定性特点,在这得到了完美的体现。降解的过程中,酶分子周围的微环境对降解率有很大影响。例如,当pH=6.5时,固定化漆酶降解效率最高,而游离漆酶的最适pH却为5.5。原因,2,4-二氯苯酚本身就偏酸性,且固定化载体中CO具有的吸电子作用,使得—OH离解出H+,从而微环境pH降低,使固定化漆酶降解DCP最适pH发生偏移[16]。而底物的质量浓度越大,降解效率越低,是因为较高质量浓度的2,4-二氯苯酚具有毒性,使得部分漆酶分子结构发生变化而失去活力,因此降解率降低;若底物质量浓度较低,对于少量的固定化漆酶而言,漆酶分子进攻氯原子的几率下降,也会因此导致降解率低。当体系中固定化漆酶量(g)∶2,4-二氯苯酚(g)=143∶1时,达到了最好的降解效果,也是由于在此浓度时底物进攻酶分子几率增加,而此时底物对酶分子的毒性较弱,所以能得到最佳降解效果。
4 结论
漆酶最佳的固定化条件:酶液量30 mL∶载体(交联聚乙二醇二丙烯酸酯)0.1 g,酶液浓度为稀释103倍的漆酶液,固定化操作时,PBS溶液浓度为0.075 mol/L,pH=3.5,固定时间4 h,之后4 ℃条件下静置15 h。
固定化漆酶在60 ℃时体现了最佳活性,比游离漆酶的最适温度55 ℃升高5 ℃;70 ℃下,固定化漆酶比游离漆酶更不易失活;固定化漆酶的最适pH=3.5,比游离漆酶的最适pH向偏酸方向移动;固定化漆酶的pH稳定范围3~5,游离漆酶在pH为4~6之间的微环境中相对活力保持较高;固定化漆酶的Km为3.37×10-4mol/L,固定化漆酶对底物的降解能力小于游离漆酶;固定化漆酶使用6次后,酶活力保留仍为60%以上;固定化漆酶活力日变化不大,游离漆酶的活性逐日降低,稳定性得到提高。
固定化效率为54.4%;固定化漆酶活力为54.63 U/(g·min),载体负载量为0.793 mg/g载体;远低于游离漆酶的活性2 656.09 U/(mg·min)。
实验中采用固定化漆酶对2,4-二氯苯酚(DCP)进行了降解,并对降解过程中的各个条件因素,如底物质量浓度、pH、给酶量等进行了研究。结果表明:底物质量浓度为0.02 g/L时,固定化漆酶对相应底物的降解效果最好;固定化漆酶降解时,最适pH范围在6~7之间,而游离漆酶降解的最适pH范围在4~6之间,最适pH范围向碱性方向移动。当固定化漆酶量(mg)∶2,4-二氯苯酚量(mg)=143∶1时,24 h后降解效率高达85%;与游离漆酶相比,固定化漆酶对2,4-二氯苯酚的降解能力提高,当降解时间延长,降解率变化速率减小并逐渐趋近于0;在固定化漆酶降解2,4-二氯苯酚5次实验中,酶活力的保留能力均达80%以上。
[1] LU L, ZHAO M, ZHANG B B, et al. Purification and characterization of laccase fromPycnoporussanguineusand decolorization of an anthraquinone dye by the enzyme[J]. Appl Microbiol Biotechnol,2007,74(6):1232-1239.
[2] 王天女,李国富,赵敏,等.重组血红密孔菌漆酶在染料脱色中的应用[J].南京林业大学学报(自然科学版),2016,40(1):92-96.
[3] ABADULIA E, TZANOV T, COSTA S, et al. Decolorization and detoxification of textile dyes with a laccase fromTrameteshirsuta[J]. Applied and Environmental Microbiology,2000,66(8):3357-3362.
[4] HUBLIK G, SCHINNER F. Characterization and immobilization of the laccase fromPleurotusostreatusand its use for the continuous elimination of phenolic pollutants[J]. Enzyme and Microbial Technology,2000,27(3/4/5):330-336.
[5] 孟庆辉.漆酶在交联聚乙二醇二丙烯酸酯上的固定化及性能研究[D].哈尔滨:哈尔滨工业大学,2006.
[6] 徐莉,侯红萍. 酶的固定化方法的研究进展[J].酿酒科技,2010,18(1):86-94.
[7] 历娜,栗君,卢磊,等.固定化漆酶在染料脱色中的应用[J].南京林业大学学报(自然科学版),2014,38(5):129-133.
[8] 郑文爽.漆酶的固定化及其对偶氮染料的脱色降解[D].哈尔滨:东北林业大学,2012.
[9] 王新,刘丽,陆佳靓,等.固定化漆酶载体研究进展[J].生态学杂志,2013,32(10):2823-2829.
[10] 卢磊,赵敏,赵丽艳,等.重组血红密孔菌漆酶的纯化、酶学性质及染料脱色研究[J].北京林业大学学报,2010,32(6):125-129.
[11] TISHER W, KASCHE V. Immobilized enzymes: crystal or carriers[J]. Trends in Biotechnology,1999,17(8):326-335.
[12] MOZHAEV V V, MARTINEK K. Structure-stability relationships in proteins: a guide to approaches to stabilizing enzymes[J]. Advanced Drug Delivery Reviews,1990,4(3):387-419.
[13] 杨波,张丽媛,冯利东. 固定化漆酶对水中邻苯二胺的去除研究[J].安全与环境学报,2012,12(2):32-36.
[14] 栗君,李国富,卢磊,等.解淀粉芽孢杆菌芽孢漆酶在染料脱色中的应用[ J ].北京林业大学学报,2013,35(2):125-129.
[15] 董科利,马晓建,鲁锋.酶在环境保护方面的应用[J].化学与生物工程,2007,24(2):63-65.
[16] CHAIRIN T, NITHERANONT T, WATANABE A, et al. Biodegradation of bisphenol A and decolorization of synthetic dyes by laccase fromWhite-rotFungus, Trametes polyzona[J]. Applied Biochemistry and Biotechnology,2013,169(2):539-545.
更 正
2017年第45卷第2期文章《秦岭火地塘林区不同海拔森林土壤NO通量》一文中,作者侯琳和陈书军的单位由陕西秦岭森林生态系统国家野外科学观测研究站,改为西北农林科技大学,特此更正。
Immobilization of Laccase on Cross-linked Polyglycol Diacrylate//
Sun Minghui(Northeast Forestry University, Harbin 150040, P. R. China); Meng Qinghui(Harbin Institute of Technology); Zhao Min(Northeast Forestry University); Wang Yan(Harbin Institute of Technology)//
Journal of Northeast Forestry University,2017,45(4):99-105.
Cross-linked polyglycol diacrylate; Laccase; Immobilized laccase; Free laccase
1)国家自然科学基金项目(51678120)。
孙明慧,女,1992年6月生,东北林业大学生命科学学院,硕士研究生。E-mail:503023421@qq.com。
赵敏,东北林业大学生命科学学院,教授。E-mail:82191513@163.com。
2017年1月5日。
Q554
责任编辑:张 玉。
