基于对比实验和创新实验的化学教学
2017-05-24伍强黄晶杜金铃
伍强+黄晶+杜金铃
摘要:分析了教材中碳酸钠和碳酸氢钠相关的内容,认为应设计对比实验来探究碳酸钠和碳酸氢钠的性质。分析了相关实验的设计,认为实验设计还有创新的空间。指出学生在学习中存在的困惑问题及教师在教学时遇到的困扰问题,认为教学环节的设计和相关实验的创新必须解决教与学的问题。通过对比实验教学,学生能较好地领悟物质化学反应原理、了解科学探究方法。通过学生实验探究和教师创新实验演示并进的多种实验探究活动,培养学生的创新思维能力。
关键词:碳酸钠;碳酸氢钠;对比实验;创新实验;实验教学
文章编号:1005–6629(2017)4–0059–05 中图分类号:G633.8 文献标识码:B
《化学教学》期刊设置了“实验创新设计”的栏目,展示了丰硕的实验创新成果。但从目前教学期刊上发表的“碳酸钠和碳酸氢钠”教学课例来看,将实验创新成果融入课堂教学的现状并不乐观。如比较Na2CO3和NaHCO3的热稳定性选用套管实验,二者与酸反应仍用等质量的Na2CO3和NaHCO3粉末与稀盐酸反应的实验,CO2气体与Na2CO3溶液反应采用CO2气体通入饱和Na2CO3溶液实验的剪辑视频。目前部分教师还存在一种错误的认识,认为按照教科书上的实验方案做了实验探究,就能很好地完成了实验教学。殊不知教科书编写的意图是“要有助于发挥化学教师的创造性,应留给教师较大的创造空间,使教师在实践中充分发挥教学的主动性和创造性”[1]。为此,笔者尝试将实验创新成果融入课堂教学,试图培养学生的创新思维能力。
1 课程标准和教材内容分析
课程标准指出:根据生产、生活中的应用实例或通过实验探究,了解钠等金属及其重要化合物的主要性质[2]。Na2CO3和NaHCO3的性质是人教版《化学1》“科学探究”的内容,就二者的外观、水溶性、溶解热效应、溶液酸碱性和热稳定性进行了实验探究,二者与稀盐酸的反应只要求写出反应的离子方程式[3]。人教版强调对比实验的设计,却忽视了二者与稀盐酸反应的实验探究。同样,苏教版《化学1》“活动与探究”的内容,对澄清石灰水和CaCl2溶液分别与Na2CO3溶液反应、浓盐酸与Na2CO3溶液反应、用pH试纸测定Na2CO3溶液pH和Na2CO3溶液去油污性能进行了实验探究,同时教材提供了Na2CO3和NaHCO3的性质比较信息,要求设计实验方案区别Na2CO3和NaHCO3的固体[4]。苏教版强调Na2CO3性质的实验探究,却忽视了NaHCO3性质的实验探究。从两个版本的教材内容分析,在实施教学过程中,应增加设计对比实验来探究Na2CO3和NaHCO3的性质。
2 相关实验设计的分析
2.1 Na2CO3、NaHCO3的固体热稳定性实验
人教版方案是将Na2CO3和NaHCO3的固体分别装在两支试管中,用酒精灯加热,将可能生成的气体通入澄清石灰水中,实验现象明显。缺点是分别做两次实验,需两次加热,实验加热环境不同,因此实验对比性差。为使实验对比性强,已有套管实验设计。实验装置如图1所示,实验现象明显,且只需一次加热。但此实验把不易分解的Na2CO3固体放在温度较高的外管,把易分解的NaHCO3固体放在温度较低的内管。这是在NaHCO3比Na2CO3容易分解的前提下设计的,实验预设性太强,缺乏探究性。
2.2 Na2CO3、NaHCO3与稀盐酸反应的实验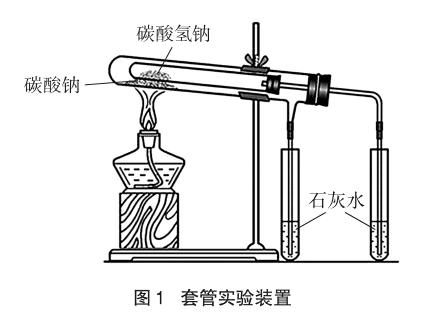
人教版全日制普通高级中学教科书设计了Na2CO3和NaHCO3粉末与稀盐酸反应的对比实验。实验如下:“在两支试管中分别加入3mL稀盐酸,将两个各装0.3g Na2CO3或NaHCO3粉末的小气球分别套在两支试管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。[5]”通常观察到NaHCO3固体与稀盐酸反应速率比Na2CO3固体与稀盐酸反应速率大。事实上,两个反应速率大小与如下三个因素有关:一是Na2CO3与盐酸发生分步反应;二是颗粒大小,无水Na2CO3固体颗粒较大,NaHCO3晶体颗粒较小;三是热效应,Na2CO3固體溶解以及与盐酸反应均是放热,NaHCO3晶体溶解以及与盐酸反应均是吸热。两个反应速率大小除了Na2CO3与盐酸发生分步反应的影响因素外还有两个影响因素,而对比实验中只考虑一个影响因素,因此不符合对比实验基本要求。现行人教版删除了这个实验,要求学生写出Na2CO3、NaHCO3与稀盐酸反应的离子方程式。苏教版设计了Na2CO3溶液与浓盐酸反应实验,仍不能解决Na2CO3溶液和稀盐酸发生分步反应的机理。
2.3 饱和Na2CO3溶液与CO2气体反应的实验
有教师认为,向饱和Na2CO3溶液中通入CO2气体没有什么好研究的,NaHCO3溶解度比Na2CO3小,通入CO2气体后很快会析出白色晶体,教材没有要求做此实验就不做了。笔者用启普发生器快速生成CO2气体,通入饱和Na2CO3溶液中,20几分钟后才有微量晶体析出[6],做过此实验的教师都认为不适宜作课堂演示实验。有教师在课堂中演示了如下实验:用大理石与稀盐酸反应生成的CO2气体和用雪碧(饮料)产生的CO2气体,分别通入饱和Na2CO3溶液中,约3min均出现白色沉淀[7]。该教师将CO2气体通入过饱和Na2CO3溶液中,析出的是碳酸钠晶体。
从以上三个实验设计分析可知,实验设计还有创新的空间。
3 学生学习困惑和教师教学困扰
3.1 Na2CO3溶液与稀盐酸分步反应
向Na2CO3溶液中滴加稀盐酸发生分步反应的机理(Na2CO3+HCl=NaHCO3+NaCl;NaHCO3+HCl=H2O+CO2↑+NaCl)在高考和会考中时有出现。学生的困惑:受“盐和酸反应生成新盐和新酸”的定向思维影响,总认为向Na2CO3溶液中滴加稀盐酸就会生成NaCl和CO2气体。教师的困扰:向盛有Na2CO3溶液的试管中滴加稀盐酸至过量,起初产生少量微小气泡,随后产生气泡似乎增多,实验现象不直观,不能断定是否生成了NaHCO3,只能在理论层面上给学生讲述分步反应机理。
3.2 Na2CO3溶液与CO2气体反应
用大理石与稀盐酸反应生成的CO2气体中含有HCl气体,教师强调因CO2气体会与Na2CO3溶液反应生成NaHCO3,則通过饱和NaHCO3溶液洗气来除去HCl气体,不能通过Na2CO3溶液洗气。学生的困惑:教师没有做过CO2气体与Na2CO3溶液反应实验,只是作了类比推理。教师的困扰:CO2气体通入饱和Na2CO3溶液实验不适宜作课堂演示实验,只能作类比推理。CO2气体能与CaCO3悬浊液反应生成Ca(HCO3)2溶液,则CO2气体也能与Na2CO3溶液反应生成NaHCO3。
学生在学习中存在困惑问题,教师在教学时遇到的困扰问题,教学环节的设计和相关实验的创新必须解决教与学的问题。
4 教学过程的设计
本节课设计了五个环节,一环扣一环,有效集中学生的注意力。
4.1 钙化合物的转化关系
[问题] Ca(OH)2微溶于水,澄清石灰水浓度小。向澄清石灰水中不断通入CO2气体将会出现什么现象?
[学生]澄清石灰水变浑浊。
[追问]后来呢?不知道(学生)。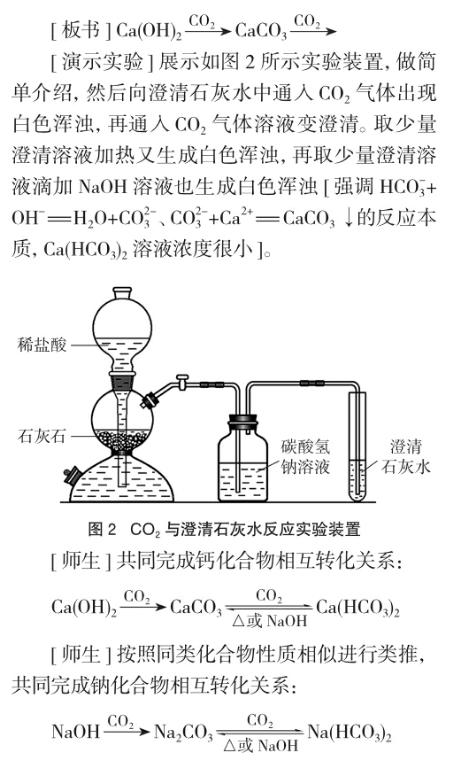
设计意图:通过实验再现钙化合物性质,构建钙化合物转化关系,以此类推钠化合物转化关系。
4.2 溶解度、溶液酸碱性、热稳定性
4.2.1 溶解度
[讲述]固体物质在水中的溶解性分易溶(大于10g)、可溶(10~1g)、微溶(1~0.01g)、难溶(小于0.01g),在20℃时Na2CO3溶解度为21.5g、NaHCO3溶解度为9.6g。
[学生] Na2CO3属易溶、NaHCO3属可溶。
4.2.2 溶液酸碱性
[过渡] Na2CO3属于盐类,为什么俗称纯碱?
[学生] Na2CO3溶液可能呈碱性。
[学生实验]取两支试管分别加入少量1mol·L-1 Na2CO3、NaHCO3的溶液,请用pH试纸测定溶液pH,然后滴加酚酞溶液观察颜色变化。
[实验结果] Na2CO3、NaHCO3溶液pH分别为 12和8,滴加酚酞溶液分别呈现红色和粉红色。
4.2.3 热稳定性
[过渡] CaCO3高温分解,Ca(HCO3)2加热分解,Na2CO3、NaHCO3固体热稳定性如何?
[问题]请同学设计实验,比较Na2CO3、NaHCO3固体的热稳定性。
[学生实验]取少量NaHCO3固体于试管中,并加热,将可能产生的气体通入澄清的石灰水中,以同样的方法加热Na2CO3固体实验。
[实验结果] NaHCO3固体易分解。
[演示实验]展示如图3所示的油浴法实验装置,做简单的介绍,然后点燃酒精灯加热约2分钟,食用油温度升高至130~140℃时,右侧的澄清石灰水无明显现象,左侧的澄清石灰水变浑浊[8]。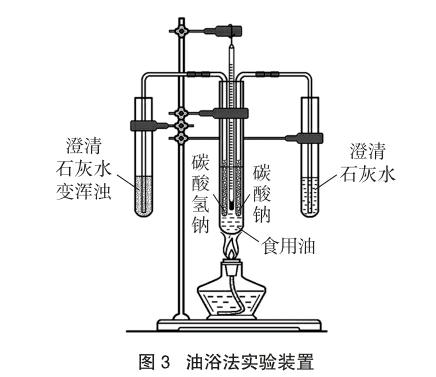
[实验结果]NaHCO3固体易分解,Na2CO3难分解。
[学生] 2NaHCO3△=Na2CO3+CO2↑+H2O
设计意图:掌握Na2CO3、NaHCO3溶解性和溶液酸碱性为以下实验探究奠定基础。油浴法实验具有很好的对比性、探究性、直观性和简约性,可以粗略地测定NaHCO3分解的温度,学生对其热的不稳定性印象深刻。能拓展学生的知识面,培养学生的创新能力。
4.3 与酸反应
4.3.1 与稀盐酸反应
[学生实验]取两支试管分别加入少量1mol·L-1 Na2CO3、NaHCO3的溶液,然后分别滴加1mol·L-1 盐酸。
[实验现象]向Na2CO3溶液中滴加稀盐酸至过量,起初产生少量微小气泡,随后产生气泡逐渐增多。向NaHCO3溶液中滴加稀盐酸,立刻产生大量气泡。
[教师]请写出反应的化学方程式。
[学生] Na2CO3+2HCl(过量)=2NaCl+H2O+ CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑。
[设疑]向Na2CO3溶液中滴加稀盐酸至过量,起初产生少量微小气泡,随后产生气泡逐渐增多,可能还发生其他反应。
[教师]展示如图4所示的恒压式实验装置[9],作简单介绍。
实验1 向Na2CO3溶液中滴加稀盐酸至过量
[演示实验]如图4装置。在广口瓶中加入1mol·L-1 Na2CO3溶液20mL,再滴入几滴酚酞溶液,在分液漏斗中加入1mol·L-1盐酸40mL。打开磁力搅拌器,搅拌待反应溶液。然后打开分液漏斗活塞,滴入约20mL稀盐酸,关闭活塞。溶液由红色变成粉红色,反应没有气泡产生,气球没有增大。
[问题]反应没有气体生成,溶液变成粉红色,反应生成了什么物质?
[学生]生成了NaHCO3。
[师生] Na2CO3+HCl(少量)=NaHCO3+NaCl。
[演示实验]再次打开分液漏斗活塞,滴入剩余约20mL稀盐酸。溶液由粉红色变成无色,反应产生气泡,气球逐渐增大。
[教师] NaHCO3+HCl=NaCl+H2O+CO2↑(已写出)。
实验2 向稀盐酸中滴加Na2CO3溶液至过量
[演示实验]如图4装置。在广口瓶中加入1mol·L-1盐酸40mL,再滴入几滴酚酞。在分液漏斗中加入1mol·L-1 Na2CO3溶液40mL。打開磁力搅拌器,搅拌待反应溶液。然后打开分液漏斗活塞,滴入Na2CO3溶液约20mL,关闭活塞。溶液保持无色,反应产生气泡,气球逐渐增大。
[教师] Na2CO3+2HCl(过量)=2NaCl+H2O+ CO2↑(已写出)。
[演示实验]再次打开分液漏斗活塞,滴入剩余约20mL Na2CO3溶液。溶液由无色变成红色,气球缓慢变小。Na2CO3溶液与CO2气体反应速率很慢。
设计意图:用恒压式实验装置探究Na2CO3溶液与稀盐酸互滴反应,实验现象明显、直观,解决了向Na2CO3溶液中滴加稀盐酸至过量发生分步反应的实验教学难点问题。通过实验探究,有助于学生更好地领悟Na2CO3溶液与稀盐酸互滴反应的化学反应原理,理解Na2CO3与盐酸分步反应的机理,领会化学反应中量变到质变的辩证思想,也让学生了解某些化学反应的可控性。
4.3.2 饱和Na2CO3溶液与CO2气体反应
[过渡] Na2CO3溶液能与稀盐酸反应,Na2CO3溶液能不能与CO2气体反应呢?
[师生实验]取盛有CO2气体的500mL普通矿泉水瓶,注入20mL饱和Na2CO3溶液,旋紧瓶盖,剧烈振荡矿泉水瓶1~2分钟,矿泉水瓶变瘪,再放置(或振荡或将矿泉水瓶与桌面敲打几下)1~3分钟析出较多白色晶体并出现白色浑浊现象[10]。
[问题]白色晶体是什么物质?
[学生] NaHCO3晶体。
[师生] Na2CO3+CO2+H2O=2NaHCO3。
[教师]反应时水的量几乎不变,为什么能析出NaHCO3晶体。
[学生]NaHCO3溶解度比Na2CO3小。
设计意图:通过实验探究,能让学生深刻领悟Na2CO3溶液和CO2气体反应的原理,NaHCO3溶解度比Na2CO3溶解度小的物理性质。说明:寒冷天气实验时,剧烈振荡矿泉水瓶1~2分钟,矿泉水瓶变瘪,说明发生了反应,然后用温水浸泡矿泉水瓶后再振荡析出晶体;或者放置较长时间后自然析出晶体。

5.3 师生实验探究并进,培养创新思维能力
对同一个化学反应,通过学生实验探究和教师创新实验演示并进的多种实验探究活动,会引发学生认知的冲突,营造问题情境,激发学生探究的欲望。用油浴法实验装置探究Na2CO3、NaHCO3固体的热稳定性,使学生感受到设计的实验应具有科学性、可行性和简约性。用恒压式实验装置探究Na2CO3溶液与稀盐酸互滴反应,使学生感受到某些化学反应的可控性。师生实验探究并进,使学生体验实验探究的过程,激发学习化学的兴趣,强化科学探究的意识,培养了学生的创新思维能力。
参考文献:
[1][2]中华人民共和国教育部制定.普通高中化学课程标准(实验)[S].北京:人民教育出版社,2003:40,11.
[3]宋心琦主编.普通高中课程标准实验教科书·化学1(第3版)[M].北京:人民教育出版社,2007:56~57.
[4]王祖浩主编.普通高中课程标准实验教科书·化学1(第6版)[M].南京:江苏教育出版社,2014:50~52.
[5]人民教育出版社化学室.全日制普通高级中学教科书·化学(必修)(第一册)[M].北京:人民教育出版社,2003:32.
[6][10]伍强.饱和碳酸钠溶液和二氧化碳气体反应实验的研究[J].化学教学,2014,(11):56~57.
[7]游梅.一个大胆的猜想赢来的成功[J].中学化学教学参考,2014,(7):37.
[8][11]伍强.碳酸钠和碳酸氢钠性质对比实验的研究[J].化学教学,2015,(12):48~50.
[9]伍强.碳酸钠和碳酸氢钠与稀盐酸反应实验的创新设计[J].化学教学2016,(8):64.
